不同除草剂对苜蓿苗期光合特性的影响
蔡鹏元,赵桂琴
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
不同除草剂对苜蓿苗期光合特性的影响
蔡鹏元,赵桂琴
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
为明确除草剂对苜蓿苗期安全性和光合特性的影响,采用5种除草剂设低、中、高3个浓度对苗期苜蓿的叶绿素相对含量(SPAD)、净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔导度(Gs)、气孔限制值(Ls)等指标进行了测定。结果表明:5种除草剂中,乙氧氟草醚药害严重,不适合苗期使用。苯达松、高效盖草能、拿捕净和苜草净均显著降低了苜蓿的SPAD、Pn、Gs、Tr和Ls值,并随着除草剂浓度的增加而进一步降低。Ci随除草剂浓度的增加而显著升高。除草剂胁迫下苜蓿的水分利用效率提高。苯达松在苜蓿苗期安全施用的剂量为1 500mL/hm2;高效盖草能对苜蓿幼苗安全的剂量为300~450mL/hm2;拿捕净的安全剂量为1 200~1 400mL/hm2;苜草净的安全施用量为1 300~2 300mL/hm2。
除草剂;苜蓿;光合特性
紫花苜蓿(Medicago sativa) 作为优质豆科牧草,已成为我国农村产业结构调整主要选择的作物品种[1]。苜蓿在我国北方地区广泛分布,甘肃、宁夏等西北省区已成为苜蓿商业化种植的大省,栽培面积逐年扩大。但苜蓿苗期生长缓慢,杂草危害比较严重,大面积人工除草成本高,因此,使用化学除草剂来进行田间杂草的防除是目前行之有效的手段,但控制杂草的同时也会对作物造成不良影响[2]。作物对不同种类的除草剂响应不同,绝大部分除草剂会降低作物的光合作用,使叶片同化物输出受阻,生长受到抑制[3]。除草剂主要是通过抑制光合电子传递链、光合磷酸化、色素的合成和水的光解等生理生化过程来影响植物的光合进程[4]。
目前,有关除草剂在苜蓿田间的应用主要集中在除草剂的筛选(包括苜蓿安全性研究、药剂浓度的筛选)[5-7]、杂草防除[8-10]、喷药时间[11]、助剂添加[12]等方面,而有关除草剂对苜蓿光合特性影响的研究并不多见,通过喷施不同浓度梯度的5种除草剂,研究其对苜蓿安全性及光合特性变化的影响,以期从生理角度为苜蓿田科学施用除草剂提供理论依据。
1 材料和方法
1.1 供试材料和药剂
供试苜蓿品种为甘农3号,来自甘肃农业大学草业学院,供试药剂见表1。
1.2 试验设计
试验在甘肃农业大学温室进行,清水做对照,设置高、中、低3个浓度梯度,每个处理10次重复,进行盆栽试验。盆栽试验用直径25cm、高15cm塑料花盆,每盆装土约1.5kg,浇透水,水渗下后播种苜蓿种子20粒,播种后覆土1.5~2.0cm,轻微镇压,播种后定期浇水且每盆浇水量一致,出苗后每盆定苗10株,于3叶期用小喷壶施药(表1)。
1.3 测定指标与方法
1.3.1 安全性观测 施药后每天观察苜蓿的生长状况,观察有无植株萎蔫,茎叶扭曲、变色、长斑等现象。随时调查记录,根据表2的药害分级标准进行安全性的调查。

表1 供试除草剂特性及用量Table 1 Herbicide treatments and dosage

表2 药害分级标准Table 2 The phytotoxicity classification standard
1.3.2 叶绿素相对含量的测定 用SPAD-502型(日本Konica Minolta Sensing公司生产)叶绿素仪进行叶绿素相对含量(SPAD)的测定。
1.3.3 光合生理的测定 在天气晴好时采用GFS-3000光合仪测定,每处理选取3株长势相近的植株,每株选取1个生长良好分枝的完全展开叶,于施药后7、14、21、28、35、42 d上午9∶00~12∶00测定,测定指标分别为苜蓿叶片的净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔导度(Gs)等。测定时气流设定为750 μmol/s,光强为800 μmol/(m2·s),CO2绝对浓度为750 μmol/mol。
气孔限制值(Ls)按文献[13]的方法进行。
Ls= 1-Ci/Ca
式中 :Ci为胞间CO2浓度,Ca为大气CO2浓度。
水分利用效率(WUE)按文献[14]的计算方法:
WUE=Pn/Tr
式中 :Pn为净光合速率,Tr为蒸腾速率。
1.4 数据分析
数据统计利用Excel 2003及SPSS 17.0进行。
2 结果与分析
2.1 除草剂对苜蓿安全性的影响
5种药剂中,苯达松的中、高浓度对苜蓿产生药害。中浓度处理的苜蓿叶片有药斑出现,高浓度症状明显,叶边缘枯黄。高效盖草能、拿捕净、苜草净3种除草剂经高、中、低3个浓度处理后,苜蓿叶片的状态与对照相无明显差异,高浓度下有零星药害斑点出现,但随着时间的推移,症状逐渐消失。20%乙氧氟草醚的3个浓度下均出严重的药害现象,叶片发黄枯萎,在短时间内整株植株全部死亡,试验数据终断(表3)。
2.2 除草剂对苜蓿叶绿素相对含量的影响
叶绿素是绿色植物光合作用的基础物质,是植物叶片的主要光合色素,也是反映植物生长特性、生理变化和营养状况的重要指标[15],它捕获光能进行光能转换,其含量的多少与植物捕获光能的能力有正相关,可以反映出作物光合能力的大小及同化产物积累的多少[16]。结果表明,经除草剂处理后,苜蓿苗期叶片的叶绿素相对含量(SPAD)均受到不同程度抑制,其SPAD值随着浓度的增大而减小;高、中、低浓度下苜蓿叶片的叶绿素相对含量随着施药时间的推移均呈现出上升的趋势。药后7 d,各处理下的SPAD值均表现下降趋势,其中苯达松中、高浓度下SPAD值最低,较对照分别下降了17.7%和26.7%。药后14 d各处理的SPAD值仍较对照低,以苯达松中、高浓度和拿捕净中、高浓度下为最低。药后28 d各处理的SPAD值与对照的差距与药后7,14 和21 d 相比逐渐减小;到药后35 d和42 d,这种差距进一步减小,除草剂的胁迫减弱,苜蓿逐渐恢复(表4)。

表3 不同除草剂处理下苜蓿安全性Table 3 The safty of different herbicides for alfalfa

表4 不同除草剂处理下苜蓿叶绿素相对含量Table 4 Effect of different herbicides on SPAD of alfalfa
注:同列不同小写字母表示差异显著(P<0.05),下同
2.3 除草剂对苜蓿光合特性的影响
2.3.1 除草剂对苜蓿Pn的影响 光合速率是反映植物光合作用暗反应阶段CO2同化水平的一个重要的生理指标。光合速率越大,植物光合作用的水平越高[17]。喷施药剂后,苜蓿叶片的净光合速率随着浓度的增大而减小,随着时间的推移而增大。苯达松T3处理的Pn值最低,显著低于对照,降幅在38%~57%,说明苯达松高浓度处理对苜蓿光合作用抑制最强。苜草净T10处理和T11处理下的Pn与对照相比,降幅较低(14%~31%),说明苜草净的中、低浓度处理对苜蓿光合作用抑制较弱。处理期内,推荐剂量处理(中浓度)下,苯达松对Pn的抑制最强,高效盖草能和拿捕净对Pn的抑制作用相当,苜草净的抑制作用最小(表5)。
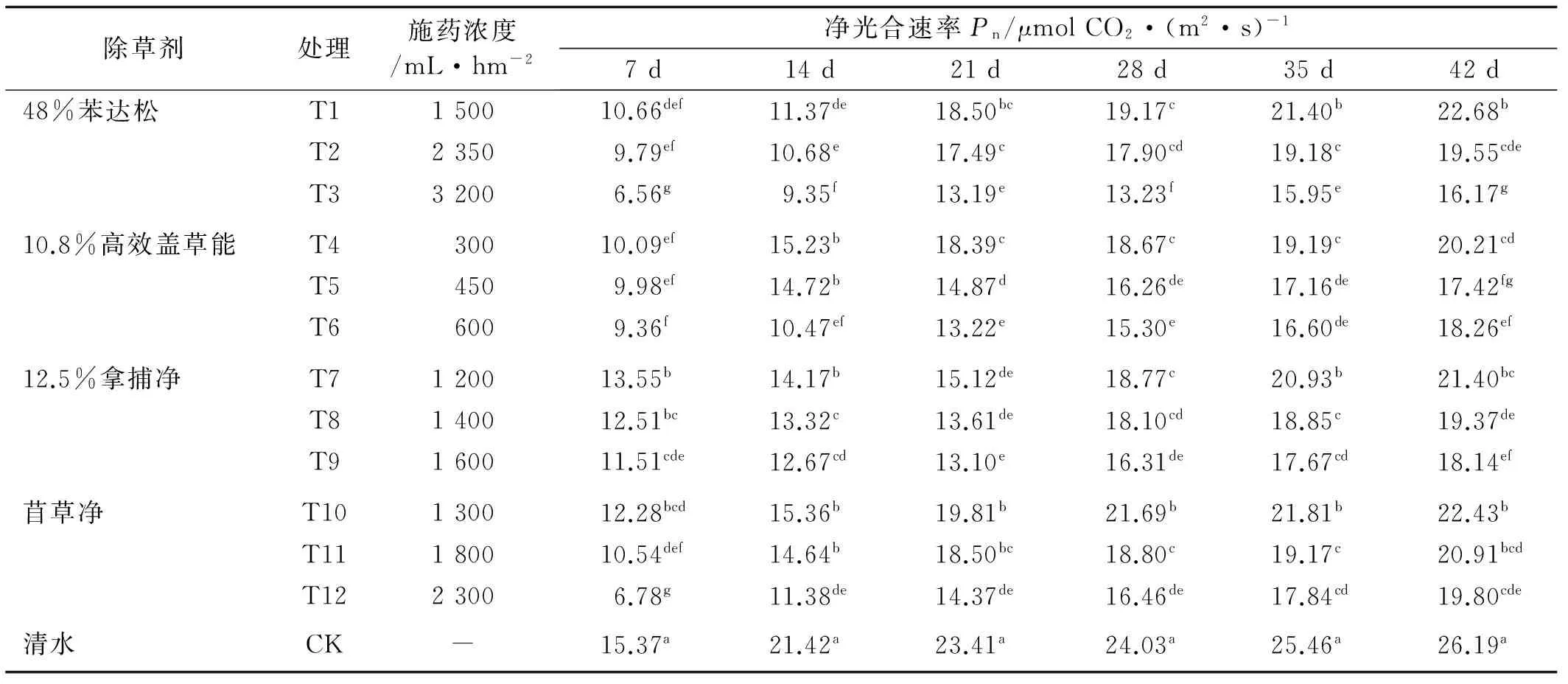
表5 不同除草剂处理下苜蓿的PnTable 5 Effect of different herbicides on Pn of alfalfa
2.3.2 除草剂对苜蓿Gs的影响 气孔是水分和CO2气体交换的重要通道,通过气孔,空气中的CO2扩散进入叶片光合组织的细胞间隙,并溶解于液相中,在光能的作用下发生光合作用[18]。与对照相比,各除草剂处理均造成了苜蓿Gs不同程度的降低,随着施药浓度的增加,Gs减小;随着药后时间的推移,Gs逐渐升高,这与Pn的变化趋势相一致。药后7 d和药后14 d,T3处理具有较低的Gs,说明此时T3对Gs的抑制作用最强;药后14 d,以苯达松和高效盖草能的高浓度下Gs最低,分别较对照下降了54.9%和52.9%;药后21 d和28 d,高效盖草能高浓度下的Gs仍然最低,显著低于其他处理。药后42 d,除草剂对Gs的抑制逐渐减弱,各处理下的Gs与对照的差距较前几个时段减小(表6)。

表6 不同除草剂处理下苜蓿的GsTable 6 Effect of different herbicides on Gs of alfalfa
2.3.3 除草剂对苜蓿Ci及Ls的影响 胞间CO2浓度是外界CO2气体进入叶肉细胞过程中所受各种驱动力和阻力以及叶片内部光合作用和呼吸作用最终平衡的结果[19]。经4种除草剂不同浓度处理后的苜蓿,其Ci普遍增加,表现为随着除草剂浓度的增大而增大,随着时间的推移而减小。与对照相比,同时期各处理的Ci都有所增加,而Ls则呈现出相反的趋势,各处理与对照相比有不同程度的降低(表7,8),表明除草剂处理后苜蓿叶片对CO2的固定能力有不同程度的减弱。药后7 d,4种药剂的12个处理下,苜草净低、中浓度下(T10、T11)苜蓿Ci值最低,但仍然显著高于对照;相应地,其Ls值最大,仅次于对照。药后14~28 d,除T10外,高效盖草能低浓度下(T4)的Ci值也显著降低。药后35 d,T4和T10下苜蓿的Ci值仍然最低,分别比相应的高浓度处理T6和T12下降10.3%和12.2%。 药后42 d,处理间差异逐渐缩小。气孔限制值的变化趋势与胞间CO2浓度恰恰相反,除草剂处理下苜蓿的Ls值显著下降(表7)。
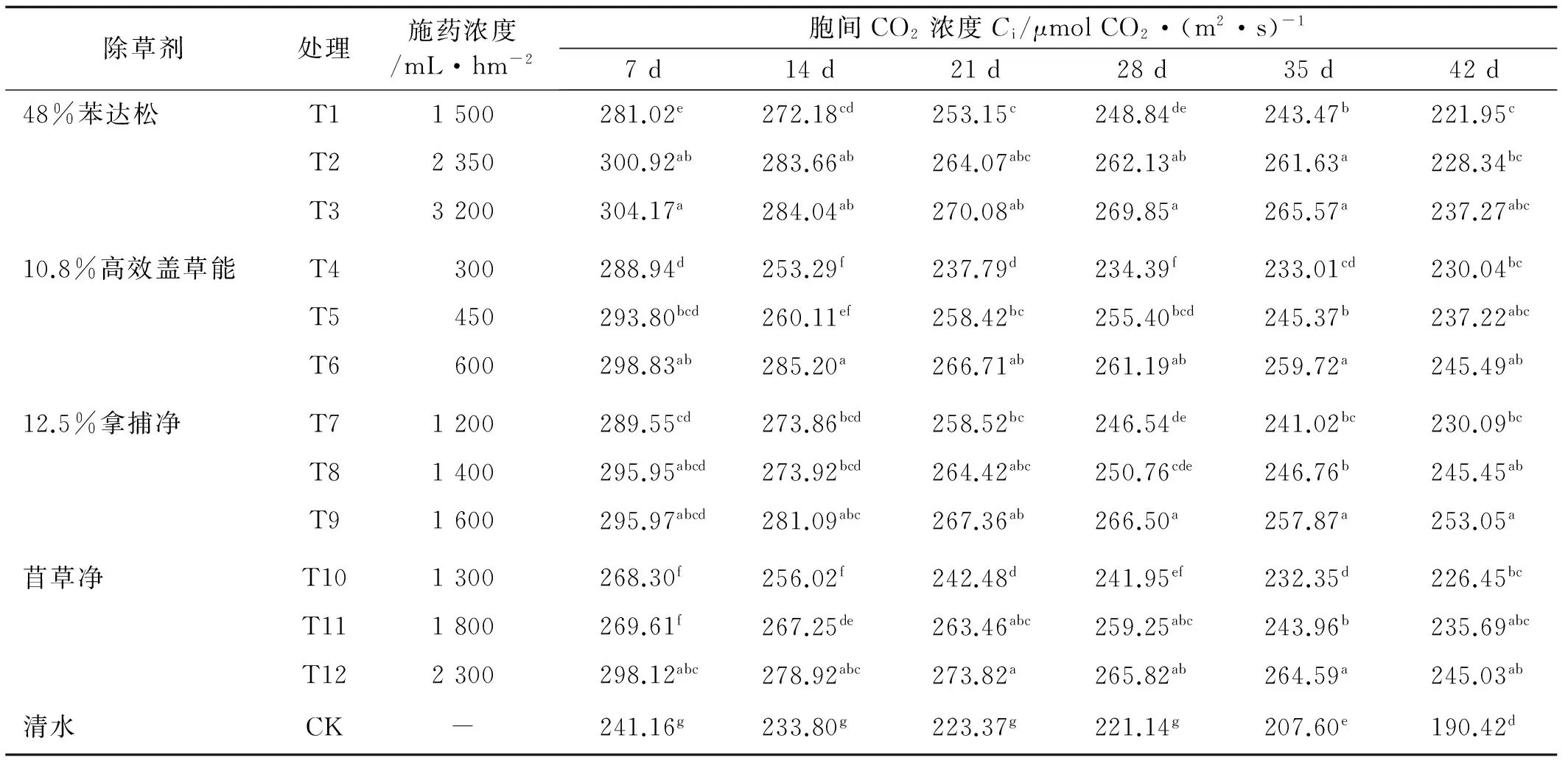
表7 不同除草剂处理下苜蓿的CiTable 7 Effect of different herbicides on Ci of alfalfa
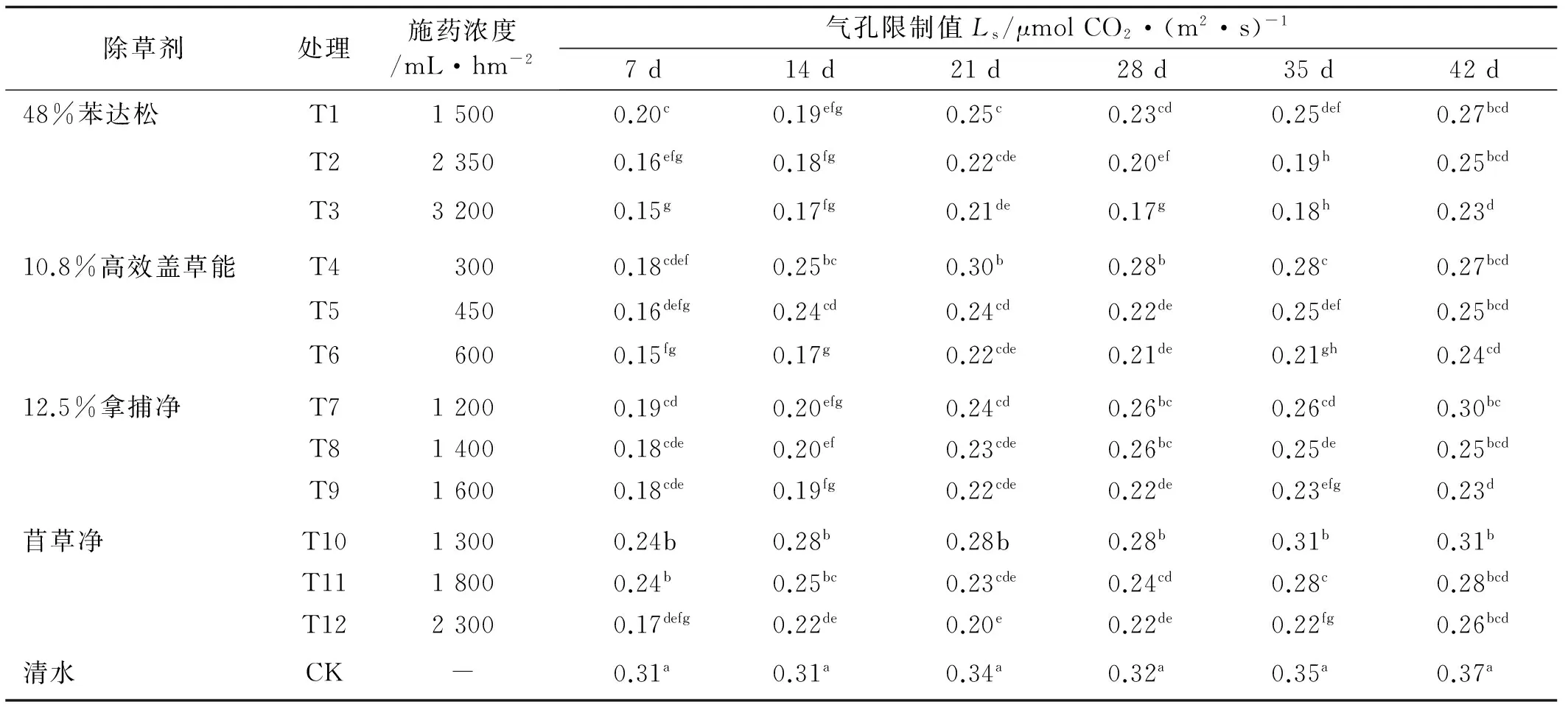
表8 不同除草剂处理下苜蓿的LsTable 8 Effect of different herbicides on Ls of alfalfa
2.3.4 除草剂对Tr的影响 蒸腾作用是植物吸收水分、矿质离子及其体内养分运输的动力[4]。与对照相比,除草剂处理后的苜蓿Tr均有不同程度的降低(表9)。随着除草剂浓度的升高,蒸腾速率显著下降。药后7 d,4种除草剂低浓度下的Tr较对照下降最小,说明高浓度的除草剂对苜蓿蒸腾速率抑制作用较大,低浓度抑制作用小。随着药后时间的推移,除草剂的抑制作用逐渐减小。药后7 d,苯达松最高浓度T3处理苜蓿蒸腾速率最低,只有对照的38.65%;药后28 d增加至59.81%,药后35 d,其蒸腾速率占对照的62.60%,药后42 d,这一数值增加至69.71%。其他中低浓度下苜蓿蒸腾速率回恢复更快,苜草净低浓度(T10)下从药后28 d开始就已经完全恢复,与对照无明显差异。

表9 不同除草剂处理下苜蓿的TrTable 9 Effect of different herbicides on Tr of alfalfa
2.3.5 除草剂对水分利用率(WUE)的影响 水分利用效率是指植物消耗单位重量H2O所固定CO2的量,是评价植物耗水量多少或适应干旱胁迫能力的一个重要生理指标,其数值越大,植物对水分的利用效率越高[20]。影响水分利用效率的因素有作物本身、环境因素、化学制剂、栽培措施以及耕作制度等[21]。各处理在施药后第7 d时WUE达到最大,其中,T6最大;药后21 d,T6的WUE仍然最大。施药后第28 d,T12的水分利用率最高,药后42 d,T12的WUE仍显著高于其他处理(表10)。除草剂胁迫下苜蓿的水分利用率提高。
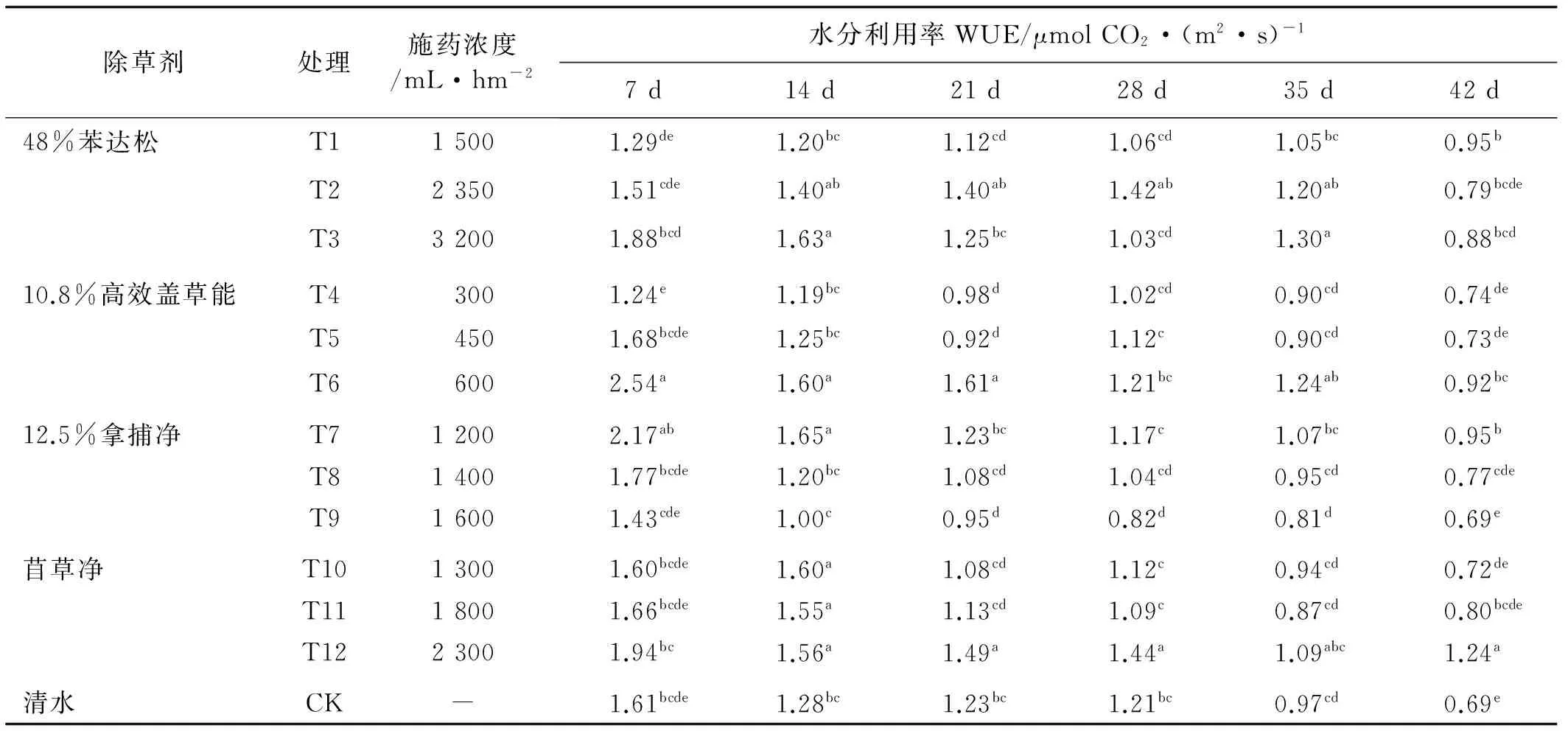
表10 不同除草剂处理下的苜蓿WUETable 10 Effect of different herbicides on WUE of alfalfa
3 讨论
除草剂作为一种胁迫,是通过对作物的不同选择来达到化学除草的目的,但这种选择是相对的,若使用不当容易造成药害[22]。植物的光合作用是一系列复杂代谢反应的总和,是植物的生存基础和全球碳氧循环的重要媒介。它的强弱对植物的生长、产量都有十分重要的影响,因而可作为判断植物生长和抗逆性大小的因素[23]。目前,有关苜蓿光合特性的研究主要集中在施肥[24]、干热胁迫[25]、基因型[26]、生长年限[27]等方面的比较,而关于除草剂对苜蓿光合特性的影响研究则相对较少。
试验所用5种除草剂,24%乙氧氟草醚高、中、低3个浓度下苜蓿均产生严重药害,植株全部死亡,因此,不建议苗期使用。高效盖草能、拿捕净和苜草净只有高浓度处理后有零星药斑出现,但随着苜蓿幼苗的生长,药斑逐渐消失。而苯达松的中浓度即表现出药害症状,这与穆丹等[5]、李群等[28]研究的结果不同。有关研究表明高温时苯达松药效高,但也易产生药害[29-31],所以分析试验中苯达松产生药害的原因可能是春末夏初室内温度过高所致。
植物的净光合速率Pn是反映光合作用强弱的重要指标,它主要受叶绿素、Ci、Gs和Ls的影响。研究中,经除草剂处理后,苜蓿的SPAD、Pn均有显著下降,这与原向阳等[32]、郭天财等[33]的研究一致。除草剂对苜蓿叶绿素含量及光合作用均有不利影响,进而影响干物质积累,最终影响产量和品质。已有研究表明[34],在逆境胁迫下,引起Pn下降的植物自身因素主要有气孔限制和非气孔限制两类:气孔限制是气孔部分关闭导致的,即Gs下降,阻止了CO2的供应;非气孔限制是叶肉细胞光合活性下降导致的,叶肉细胞利用CO2的能力降低,从而使胞间CO2含量增加。若Ci、Gs同时下降,Ls增大,则以气孔因素为主;若Ci上升,Ls减小,则以非气孔因素为主[35]。研究发现,经除草剂处理后Gs显著下降,这与张洪刚等[16]的报道一致,说明除草剂对苜蓿气孔开关具有一定的限制作用。在研究除草剂对Ci的影响时,发现Ci随着除草剂浓度的增大而增大,但Ls则表现出相反的状况,即Pn下降的同时,Ci上升,Ls减小,这表明叶肉细胞利用CO2的能力降低,导致Pn下降的主要原因是非气孔限制,这与胡占朝等[19]的结果一致。
WUE是植物光合与蒸腾特性的综合反映,用来说明植物消耗单位重量的水分所固定的CO2的数量[36],受气孔传导性[37]、植物本身结构特征(根、茎、叶)和环境因素[38]影响,通过改变气孔的开度等来与外界进行气体和水分的交换。一般来说,Gs越大,Tr越快。研究中,随着除草剂浓度的增加,苜蓿叶片的Gs和Tr呈下降趋势,且均低于对照,说明喷施除草剂可缩小气孔的开放程度,增大气孔阻力,抑制叶片的蒸腾速率,且Tr的变化趋势与Pn相一致,与宋宏峰等[2]的研究结果相符。高效盖草能和苜草净分别是通过抑制脂肪酸的合成和氨基酸的生物合成抑制光合作用,进而影响作物的水分利用率。
4 结论
(1) 供试的5种除草剂,乙氧氟草醚对苜蓿药害严重,短期内致全部植株死亡,不适合苗期苜蓿田使用。苯达松浓度较高时在高温下可产生轻微药害,在使用时应注意温度变化。
(2) 除草剂苯达松、高效盖草能、拿捕净、苜草净均显著降低了苜蓿的SPAD值,且随着浓度的增加,SPAD逐渐减小;随着药后时间的推移,SPAD逐渐增加至对照水平。
(3)除草剂对苜蓿光合特性影响显著,Pn、Gs、Tr和Ls值随着除草剂浓度的增加而明显降低,Ci随除草剂浓度的增加显著升高。除草剂胁迫下苜蓿的水分利用效率提高。
(4)供试的4种除草剂,苯达松适宜在苜蓿苗期施用的剂量为1 500 mL/hm2;高效盖草能对苜蓿幼苗安全的剂量为300~450 mL/hm2;拿捕净的安全剂量为1 200~1 400 mL/hm2;苜草净的安全施用量为1 300~2 300 mL/hm2。这只是各个除草剂对苜蓿幼苗的安全剂量,要确定其在苜蓿田除草的最佳剂量,还需要结合田间杂草防除试验来确定。
[1] 吕林有,何跃,赵立仁.不同苜蓿品种生产性能研究[J].草地学报,2010,18(3):365-371.
[2] 宋宏峰,郭磊,张斌斌,等.除草剂对毛桃幼苗生长与光合的影响[J].园艺学报,2014,41(11):2208-2214.
[3] 党建友,张定一,裴雪霞,等.除草剂对冬小麦光合特性、籽粒产量及品质的调控效应[J].西北植物学报,2007,27(7):1438-1445.
[4] 吕苗苗,郭平毅,原向阳,等.花蕾期喷施克阔乐对罂粟光合特性的影响[J].山西农业大学学报,2011,31(2):137-141.
[5] 穆丹,梁英辉,薛勇.越冬之星苜蓿苗期除草剂筛选及杂草防除[J].安徽农业科学,2011,39(30):18601-18602,18609.
[6] 刘杰淋,张月学,唐凤兰,等.紫花苜蓿苗期除草剂筛选试验[J].黑龙江农业科学,2006(1):45-47.
[7] 王刚,王占哲,赵殿忱,等.哈尔滨地区紫花苜蓿封闭灭草除草剂及剂量筛选试验研究[J].草原与草坪,2005,22(4):79-82.
[8] 曾昭海,胡跃高,张薇,等.几种除草剂防除苜蓿地杂草的试验[J].草业科学,2002,19(5):19-22.
[9] 林建海,许瑞轩,项敏,等.春播紫花苜蓿苗期杂草的化学防治研究[J].草地学报,2013,21(4):714-719.
[10] 戚志强,胡跃高,曾昭海,等.十四种化学除草剂对沧州地区苜蓿地杂草防效试验[J].草原与草坪,2005(6):41-44.
[11] 齐凤林,姚凤军,周桂兰,等.紫花苜蓿田间杂草防治技术试验报告[J].现代畜牧兽医,2005(1):19-20.
[12] 武菊英,江国铿,贾春虹,等.几种除草剂和助剂对苜蓿Medicago sative出苗和生长的影响[J].农药学学报,2002,4(1):52-57.
[13] 王正贵 ,周立云 ,郭文善 ,等.除草剂对小麦光合特性及叶绿素荧光参数的影响[J].农业环境科学学报,2011,30(6):1037-1043.
[14] 王建丽,申忠宝,钟鹏,等.紫花苜蓿和无芒雀麦叶片光合生理特性研究[J].草原与草坪,2010,30(2):69-73.
[15] 王正航,崔东亮,马宏娟,等.SPAD值在内吸传导型除草剂药效评价中的应用[J].农药,2012,51(6):461-463.
[16] 张红刚,郭平毅,原向阳,等.除草剂对黄芩叶片光合特性及叶绿素荧光参数的影响[J].山西农业大学学报,2011,31(6):522-528.
[17] 刘小文,王秋霞,郭美霞,等.两种除草剂对紫茎泽兰光合特性的影响[J].农业与环境科学学报,2010,29(7):1247-1253.
[18] 叶子飘,于强.植物气孔导度的机理模型[J].植物生态学报,2009,33(4):772-782.
[19] 胡战朝,赵桂琴,刘欢,等.4种除草剂对皮燕麦、裸燕麦不同生育时期光合特性的影响[J].草原与草坪,2012,32(4):44-49,55.
[20] 皇甫超河,杨殿林,刘红梅,等.转基因抗草甘膦大豆的光合及荧光特性[J].中国油料作物学报,2010,32(3):383-389.
[21] 江云,马友华,陈伟,等.作物水分利用率的影响因素及其提高途径探讨[J].中国农学通报,2007,23(9):269-273.
[22] 张定一,杨武德,党建友,等.除草剂对强筋小麦产量及生理特性的影响[J].应用与环境生物学报,2007,13(3):294-300.
[23] 马清,楼洁琼,王锁民.Na+对渗透胁迫下霸王幼苗光合特性的影响[J].草业学报,2010,19(3):198-203.
[24] 齐敏兴,刘晓静,张晓磊,等.不同磷水平对紫花苜蓿光合作用和根瘤固氮特性的影响[J].草地学报,2013,21(3):512-516.
[25] 牟兰,何承刚,姜华,等.干热胁迫对紫花苜蓿光合特性的影响[J].草地学报,2014,22(3):550-555.
[26] 陈托兄,郝文军,陈小兵,等.10个紫花苜蓿品种光合特性的比较[J].中国草地学报,2009,31(2):41-45.
[27] 胡守林,万素梅,贾志宽,等.黄土高原半湿润区不同生长年限苜蓿叶片光合性能研究[J].草业学报,2008,17(5):60-67.
[28] 李群,耿跃,徐蕾,等.苯达松防除黄花苜蓿田阔叶杂草试验[J].杂草科学,2002(3):34-36.
[29] 王险峰,关成宏.常见除草剂药害症状诊断与补救[J].农药,1998,37(4):35-40.
[30] 王永卫,阎纯博,衷庆生.新农药苯达松及其使用技术[J].新疆农垦科技,1985(1):36-37.
[31] 王云生,吴义林,张德文,等.温度对水稻敏感恢复系苯达松药效的影响[J].核农学报,2009,23(5):868-874.
[32] 原向阳,毕耀宇,王鑫,等.除草剂对抗草甘膦大豆光合作用和蒸腾作用的影响[J].农业现代化研究,2006,27(4):311-313.
[33] 郭天财,方保停,王晨阳,等.水分调控对小麦旗叶叶绿素荧光动力学参数及其产量的影响[J].干旱地区农业研究,2005,23(2):6-10.
[34] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982(33):317-345.
[35] 徐炳成,山仑,黄瑾,等.草坪草对干旱胁迫的反应及适应性研究进展[J].中国草地,2003,25(1):1-4.
[36] 文萍,刘济明,徐国瑞,等.水分胁迫对罗甸小米核桃光合与蒸腾作用的影响[J].贵州农业科学,2013,41(8):57-60.
[37] 陶汉之,严子范.茶树叶片蒸腾速率、气孔导度和水分利用率的研究[J].安徽农学院学报,1992,19(1):33-38.
[38] 张大龙,常毅博,李建明,等.大棚甜瓜蒸腾规律及其影响因子[J].生态学报,2014,34(4):953-962.
Effect of different herbicides on photosynthetic characteristics of alfalfa in seedling stage
CAI Peng-yuan,ZHAO Gui-qin
(CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcologySystem,MinistryofEducation,Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China)
In order to identify the effect of several herbicides on safty and photosynthetic characteristics of alfalfa in seedling stage,5 herbicides with high,medium and low concentrations were used to study their effects on chlorophyll relative content (SPAD),net photosynthetic rate (Pn),transpiration rate (Tr),intercellular CO2concentration (Ci) and stomatal conductance (Gs) ,etc.The results showed that Oxyfluorfen had the largest phytotoxicity among 5 herbicides and was not suitable for applying to alfalfa seedlings.Bntazone,Haloxyfop-R-Methyl,Sethoxydim,lmazet hay reduced the SPAD,Pn,Gs,TrandLsof alfalfa,and they were furtherly reduced with the increase of dosage.Cishowed a significant rising trend along with the increase of dosage.The water use efficiency was increased under the stress of herbicides.The safe dosages of Bntazone,Haloxyfop-R-Methyl,Sethoxydim and lmazet hay for alfalfa seedling were 1 500 ml/ha,3 00 to 4 50 ml/ha,1 200 to 1 400 ml/ha and 1 300 to 2 300 ml/ha respectively.The further field experiments should be conducted to find out the best dosage.
herbicides;alfalfa.;photosynthetic characteristics
2015-01-06;
2015-04-08
公益性行业科研专项(201403048-8)资助
蔡鹏元(1989-),女,吉林公主岭人,在读硕士研究生。E-mail:caipengyuan0808@163.com赵桂琴为通讯作者。
Q945;S541
A
1009-5500(2015)05-0075-09

