不同浓度硝普钠诱导兔软骨细胞凋亡模型的比较研究
陈启鑫,韩冠英,郭 斌,郭跃伟
·论著·
不同浓度硝普钠诱导兔软骨细胞凋亡模型的比较研究
陈启鑫,韩冠英,郭 斌,郭跃伟
目的 比较不同浓度硝普钠(SNP)诱导兔软骨细胞凋亡模型,为进一步探讨药物对软骨细胞凋亡的调控作用提供理论支持。方法 2014年9—12月选取4周龄健康雄性新西兰大耳白兔8只,体质量200~250 g,体外分离培养并鉴定兔软骨细胞,采用不同浓度SNP(0、0.062 5、0.125、0.25、0.5、1、2 mmol/L)诱导兔软骨细胞,分别于12、24、48 h采用四甲基偶氮唑盐比色试验法(MTT法)和末端脱氧核苷酸转移的dUTP缺口末端标记法(TUNEL法)评价并比较不同浓度SNP诱导软骨细胞凋亡模型,记录兔软骨细胞增殖情况(OD值)和兔软骨细胞凋亡率。结果 不同浓度SNP诱导的兔软骨细胞在不同时间点的OD值比较,差异均有统计学意义(P<0.05)。SNP浓度为0.062 5、0.125 mmol/L培养12、24、48 h时兔软骨细胞OD值高于SNP浓度为0 mmol/L(P<0.05);SNP浓度为0.25、0.5、1、2 mmol/L培养12、24、48 h时兔软骨细胞OD值均低于SNP浓度为0 mmol/L;SNP浓度为0.25、0.5、1、2 mmol/L培养12、24、48 h时兔软骨细胞OD值在不同浓度间两两比较,差异均有统计学意义(P<0.05)。不同浓度SNP诱导的兔软骨细胞在不同时间点的凋亡率比较,差异均有统计学意义(P<0.05)。SNP浓度为0.25、0.5、1、2 mmol/L培养12、24、48 h时兔软骨细胞凋亡率均高于SNP浓度为0 mmol/L(P<0.05);且不同浓度间两两比较,差异有统计学意义(P<0.05)。结论 SNP浓度为0.25~2 mmol/L且诱导12、24、48 h时可制备不同严重程度的软骨细胞凋亡模型,为进一步探讨药物对软骨细胞凋亡的调控作用提供了理论支持。
硝普钠;软骨细胞;细胞凋亡
陈启鑫,韩冠英,郭斌,等.不同浓度硝普钠诱导兔软骨细胞凋亡模型的比较研究[J].中国全科医学,2015,18(24):2939-2945.[www.chinagp.net]
Chen QX,Han GY,Guo B,et al.Rabbit chondrocytes apoptosis models induced by different concentrations of SNP[J].Chinese General Practice,2015,18(24):2939-2945.
骨关节炎(osteoarthritis,OA)是以关节软骨基质降解为特征的退行性关节疾病,其发病机制尚不清楚[1]。软骨细胞是关节软骨中与修复破坏软骨组织有关的细胞,在一定程度上能控制细胞外基质的分布,对维持软骨的内环境稳定和组织结构的完整性发挥着重要作用,软骨细胞的凋亡是OA发生发展的重要原因之一[2]。目前,体外常用于诱导软骨细胞凋亡模型的途径有过氧化氢、白介素1β(interleukin-1β,IL-1β)和一氧化氮(NO)等,其中采用NO诱导软骨细胞凋亡模型是常用方法之一[3-6]。NO通过两种途径诱导软骨细胞损伤,一种是抑制与线粒体呼吸传递系统及枸橼酸循环相关的酶,另一种是抑制与超氧阴离子反应生成氧化亚硝基的阴离子,其在一定条件下可分解为具有细胞毒性的OH-和NO2[7]。NO供体S-亚硝基-N-乙酰青霉胺(S-nitroso-N-acetylpenicillamine,SNAP),即硝普钠(SNP),可产生外源性的NO,进而诱导软骨细胞凋亡。采用SNP诱导软骨细胞凋亡模型的方法虽有报道,但SNP的剂量和诱导时间各不相同,且对不同浓度SNP诱导软骨细胞凋亡比较的研究较少,不利于不同严重程度凋亡模型的建立,进而影响药物对OA的疗效判定及作用机制研究。本研究采用不同浓度SNP诱导兔膝骨关节软骨细胞凋亡,以建立不同严重程度的凋亡模型,为进一步筛选治疗OA的药物并评价其疗效及作用机制提供理论支持。
1 材料与方法
1.1 研究材料 2014年9—12月选取4周龄健康雄性新西兰大耳白兔8只,体质量200~250 g,合格证号:Lnyxy20140507,由辽宁医学院动物实验中心提供。实验过程中对动物的处置经辽宁医学院伦理委员会批准。
1.2 研究试剂 Ⅱ型胶原酶、四甲基偶氮唑盐〔3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT〕、SNP(购自美国Sigma公司);DMEM/F-12培养基、胎牛血清(FBS)、胰蛋白酶(购自美国Gibco公司);Alexa 555连接的羊抗兔二抗、4,6-联脒-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)(购自美国Invitrogen公司);台盼
本研究背景:
骨关节炎(osteoarthritis,OA)是以关节软骨基质降解为特征的退行性关节疾病,其发病机制尚不清楚。目前我国OA的患病人数已达到1.5亿左右,是世界上OA患病人数最多的国家之一。OA导致的疼痛和功能障碍将影响患者的生活质量并给家庭和社会带来极大的经济负担。因此,开发有效治疗OA的药物具有很高的社会价值和应用价值。研究表明,药物对OA的疗效与OA的严重程度有关,故选择合适的模型对评价药物对OA的疗效及作用机制的研究具有重要意义。采用硝普钠诱导软骨细胞凋亡模型的方法虽有报道,但硝普钠的剂量和诱导时间各不相同,且对不同浓度硝普钠诱导软骨细胞凋亡的比较研究较少,不利于不同严重程度凋亡模型的建立,进而影响药物对OA的疗效判定及作用机制研究。本研究采用不同浓度硝普钠诱导兔膝骨关节软骨细胞凋亡,以建立不同严重程度的凋亡模型,为进一步筛选治疗OA药物并评价其疗效及作用机制提供理论支持。
蓝、甲苯胺蓝、番红-O (购自中国国药集团化学试剂有限公司);末端脱氧核苷酸转移的dUTP缺口末端标记法(terminal deoxynucleotidyltransferase-nediated dUTP-biotin nick end labeling,TUNEL )试剂盒(购自中国南京凯基生物科技发展有限公司),磷酸盐缓冲液(phosphate buffer solution,PBS)(购自中国北京索莱宝科技有限公司)。
1.3 兔软骨细胞的分离和培养 耳缘静脉注射空气20 ml栓塞处死白兔,无菌条件下取白兔股骨髁和胫骨平台表面软骨并剪碎(体积<1 mm3),加入10 ml 0.25%胰蛋白酶溶液于37 ℃水浴并振荡30 min,以1 500 r/min离心5 min(离心半径10 cm)后弃掉胰酶,加入10 ml 0.2%Ⅱ型胶原酶于37 ℃水浴并振荡,每2 h取上清液以1 500 r/min离心5 min(离心半径10 cm),收集细胞,重复3次并接种于培养瓶中,每3 d换液1次,连续换液3次,每24 h观察1次细胞形态,连续观察7 d。
1.4 兔软骨细胞鉴定
1.4.1 兔软骨细胞免疫组织化学检测 兔软骨细胞传代培养共2代,取第2代兔软骨细胞制备细胞悬液,台盼蓝染色,以1×105/ml接种于6孔板中,每孔2 ml加入经1%(W/V)明胶处理的盖玻片上。在含10% FBS的培养基中培养24 h后弃掉培养基,以PBS清洗,加入4%多聚甲醛溶液固定30 min。分别使用甲苯胺蓝染色30 min和番红-O染色10 min,脱水,封固,空气干燥,倒置显微镜下观察盖玻片上的软骨细胞并拍照。
1.4.2 兔软骨细胞免疫荧光检测 取第2代兔软骨细胞制备细胞悬液,台盼蓝染色,以1×105/ml接种于6孔板中,每孔2 ml加入经1%(W/V)明胶处理的盖玻片上。在含10% FBS的培养基中培养24 h 后弃掉培养基,以PBS清洗,加入4%多聚甲醛溶液固定30 min后,过氧化氢灭活30 min。5%正常山羊血清封闭,再加入兔抗Ⅱ型胶原单克隆抗体(1∶100),4 ℃过夜。PBS 清洗3次后加入Alexa 555标记的山羊抗兔二抗(1∶100),避光37 ℃孵育1 h,DAPI复染,PBS清洗3次。以PBS代替兔抗Ⅱ型胶原单克隆抗体作为阴性对照。共聚焦显微镜下观察盖玻片上的软骨细胞并拍照。
1.5 SNP诱导兔软骨细胞凋亡模型 取第2代兔软骨细胞制备细胞悬液,台盼蓝染色,以1×105/ml接种于96孔板内,每孔100 μl,每组各6个复孔,96孔板四周边缘各孔加入200 μl PBS。兔软骨细胞在含10% FBS的培养基中培养24 h后弃掉培养板中的培养基,PBS清洗1次,换无血清培养基培养24 h使其同步化,弃掉培养板中的无血清培养基,更换含SNP浓度为0 mmol/L、0.062 5 mmol/L、0.125 mmol/L、0.25 mmol/L、0.5 mmol/L、1 mmol/L和2 mmol/L的无血清培养基继续培养12、24、48 h并进行评价。
1.6 模型评价
1.6.1 MTT法检测兔软骨细胞增殖 采用MTT法检测兔软骨细胞增殖。每孔加入5 mg/ml MTT 20 μl,继续培养4 h,弃掉上清液,每孔加入150 μl二甲基亚砜,置振荡器振荡15 min。用96孔板边缘仅含有PBS的孔调零,在酶标仪上检测570 nm 波长处的吸光度(OD值),重复3次取均值。
1.6.2 TUNEL法检测兔软骨细胞凋亡 取第2代兔软骨细胞制备细胞悬液,台盼蓝染色,以1×105/ml接种于6孔板中,每孔2 ml加入经1%(W/V)明胶处理的盖玻片上。在含10% FBS的培养基中培养24 h 后弃掉培养基,PBS清洗1次后更换无血清培养基继续培养24 h后,弃掉培养基并加入含SNP浓度为0.25 mmol/L、0.5 mmol/L、1 mmol/L和2 mmol/L的无血清培养基继续培养24 h。弃掉无血清培养基,加入4%多聚甲醛溶液固定30 min,余下步骤按试剂盒说明书进行操作。DAB显色,苏木素轻度复染,显微镜下观察并拍照,重复3次。凋亡的软骨细胞核被染成棕黄色或褐色,正常细胞的细胞核被染成蓝色。兔软骨细胞凋亡率=(棕黄色或褐色兔软骨细胞数/兔软骨细胞总数)×100%。
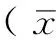
2 结果
2.1 兔软骨细胞形态学观察 原代培养的兔软骨细胞刚接种时呈小圆形,细胞大小相似,悬浮于培养液中,折光性强。培养8~24 h后细胞陆续贴壁,贴壁细胞轮廓清晰,呈星形(见图1A)。第2 天细胞圆形增大,呈扁平状并伸展为多边形,细胞核清晰为圆形或椭圆形,可见核仁,细胞质丰富。第3~4 天细胞聚集生长,多呈梭形,可见大多数细胞处于分裂期(见图1B)。第5天细胞增殖明显,紧密排列(见图1C)。第6~7天细胞铺满瓶底,可见“铺路石”样,细胞质回缩,分裂象少见(见图1D)。
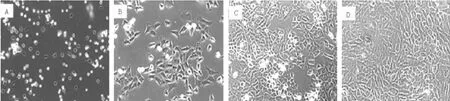
2.2 兔软骨细胞鉴定 倒置显微镜下:番红-O染色可见细胞被染成红色(见图2A);甲苯胺蓝染色可见细胞被染成蓝色(见图2B)。共聚焦显微镜下:Ⅱ型胶原免疫荧光染色细胞质和细胞膜可见红色荧光,DAPI复染后,细胞核呈蓝色荧光(见图 2C);阴性对照细胞核出现蓝色荧光而细胞质无红色荧光(见图2D)。
2.3 模型评价
2.3.1 兔软骨细胞增殖检测 不同浓度SNP诱导下兔软骨细胞在不同时间点OD值比较,差异均有统计学意义(P<0.05)。SNP浓度为0.062 5、0.125 mmol/L培养12、24、48 h时兔软骨细胞OD值高于SNP浓度为0 mmol/L,差异有统计学意义(P<0.05);SNP浓度为0.25、0.5、1、2 mmol/L培养12、24、48 h时兔软骨细胞OD值均低于SNP浓度为0 mmol/L,差异有统计学意义(P<0.05);SNP浓度为0.25、0.5、1、2 mmol/L培养12、24、48 h时兔软骨细胞OD值在不同浓度间两两比较,差异有统计学意义(P<0.05,见表1)。
注:A为第1天,B为第3天,C为第5天,D为第7天
图1 倒置显微镜下观察原代培养兔软骨细胞形态(×200)
Figure 1 The morphology of primary rabbit chondrocytes with inverted microscope
注:A为番红-O染色,B为甲苯胺蓝染色,C为Ⅱ型胶原免疫荧光染色,D为Ⅱ型胶原免疫荧光染色阴性对照
图2 倒置显微镜和共聚焦显微镜下第2代兔软骨细胞鉴定(×200)
Figure 2 The identification of rabbit chondrocytes of passage two with inverted microscope and confocal microscope
Table 1 Comparison of OD value of rabbit chondrocytes induced by different concentrations of SNP at different times
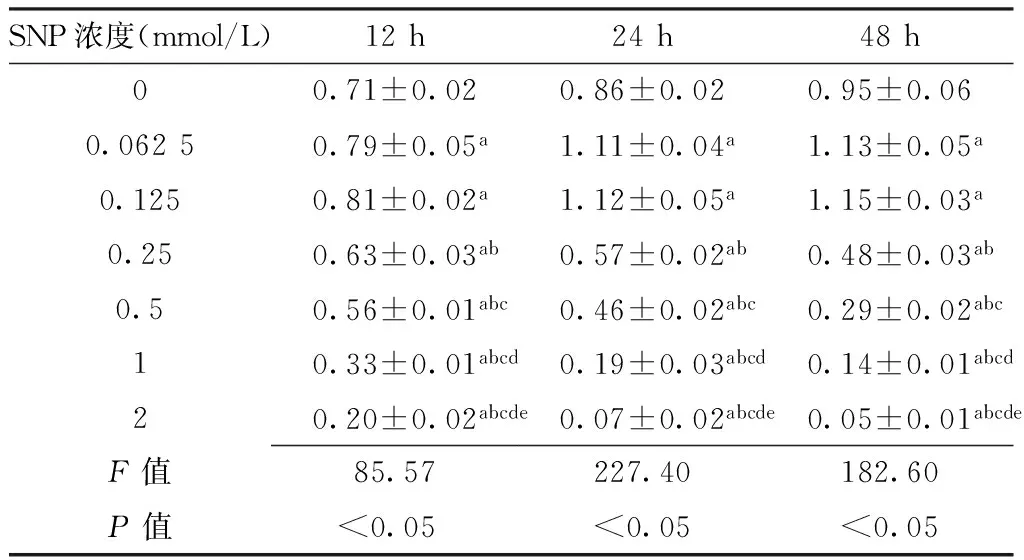
SNP浓度(mmol/L)12h24h48h00.71±0.020.86±0.020.95±0.060.06250.79±0.05a1.11±0.04a1.13±0.05a0.1250.81±0.02a1.12±0.05a1.15±0.03a0.250.63±0.03ab0.57±0.02ab0.48±0.03ab0.50.56±0.01abc0.46±0.02abc0.29±0.02abc10.33±0.01abcd0.19±0.03abcd0.14±0.01abcd20.20±0.02abcde0.07±0.02abcde0.05±0.01abcdeF值85.57227.40182.60P值<0.05<0.05<0.05
注:SNP=硝普钠;与SNP浓度为0 mmol/L比较,aP<0.05;与SNP浓度为0.125 mmol/L比较,bP<0.05;与SNP浓度为0.25 mmol/L比较,cP<0.05;与SNP浓度为0.5 mmol/L比较,dP<0.05;与SNP浓度为1 mmol/L比较,eP<0.05
2.3.2 兔软骨凋亡细胞形态学观察 SNP浓度为0 mmol/L培养兔软骨细胞排列紧密,轮廓清晰可见。12 h时,SNP浓度为0.25 mmol/L培养兔软骨细胞偶见
凋亡小体出现,SNP浓度为0.5、1、2 mmol/L 时,随着浓度的增加兔软骨细胞受损程度越严重并可见细胞排列稀疏、皱缩明显、凋亡小体大量出现甚至大片细胞脱落(见图3A~E);24 h时细胞较12 h细胞损伤程度严重,在SNP浓度为0.25 mmol/L时便可见细胞脱落,凋亡小体较多出现(见图3F~J);48 h时细胞形态较12、24 h体积明显减小,细胞从SNP浓度为0.5 mmol/L时开始脱落(见图3K~Q)。
2.3.3 兔软骨细胞凋亡检测 TUNEL染色结果表明,SNP浓度为0 mmol/L培养兔软骨细胞细胞核被染成蓝色(见图4A、F、K)。SNP浓度为0.25、0.5、1、2 mmol/L培养兔软骨细胞细胞核出现棕色和褐色,且随着浓度和时间的增加,棕色细胞核数目也随之增加(见图4B~E、G~J、L~O)。不同浓度SNP诱导下兔软骨细胞在不同时间点的凋亡率比较,差异均有统计学意义(P<0.05)。SNP浓度为0.25、0.5、1、2 mmol/L培养12、24、48 h时兔软骨细胞凋亡率均高于SNP浓度为0 mmol/L,差异有统计学意义(P<0.05);且不同浓度间两两比较,差异有统计学意义(P<0.05,见表2)。
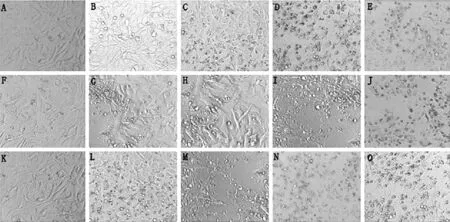
注:A~E为SNP浓度为0、0.25、0.5、1、2 mmol/L培养12 h时兔软骨细胞形态变化,F~J为SNP浓度为0、0.25、0.5、1、2 mmol/L培养24 h时兔软骨细胞形态变化,K~Q为SNP浓度为0、0.25、0.5、1、2 mmol/L培养48 h时兔软骨细胞形态变化
图3 倒置显微镜下兔软骨凋亡细胞形态学观察(×200)
Figure 3 The morphological observation of apoptotic cells of rabbit chondrocytes with inverted microscope
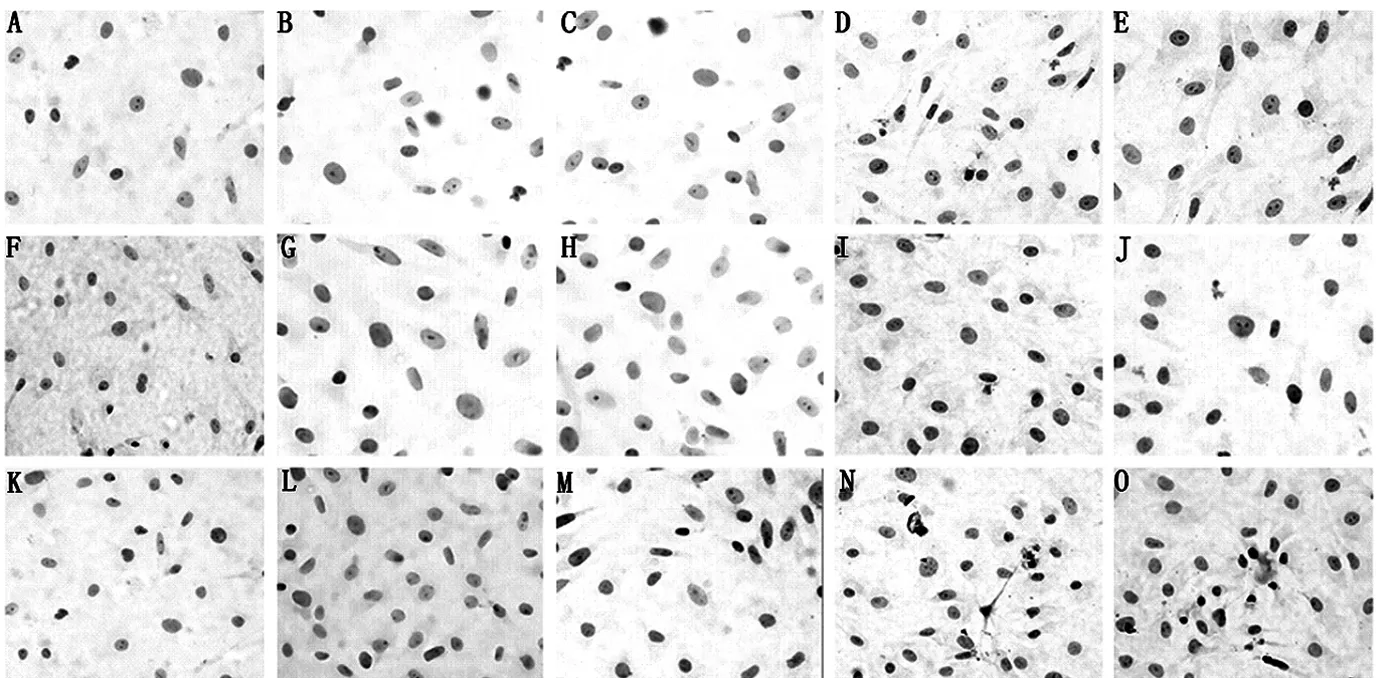
注:A~E为SNP浓度为0、0.25、0.5、1、2 mmol/L培养12 h时TUNEL染色,F~J为SNP浓度为0、0.25、0.5、1、2 mmol/L培养24 h时TUNEL染色,K~Q为SNP浓度为0、0.25、0.5、1、2 mmol/L培养48 h时TUNEL染色
图4 兔软骨细胞凋亡情况(TUNEL染色,×200)
Figure 4 The apoptosis of chondrocyte
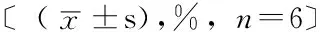
Table 2 Comparison of apoptosis rate of chondrocytes induced by different concentration of SNP at different times
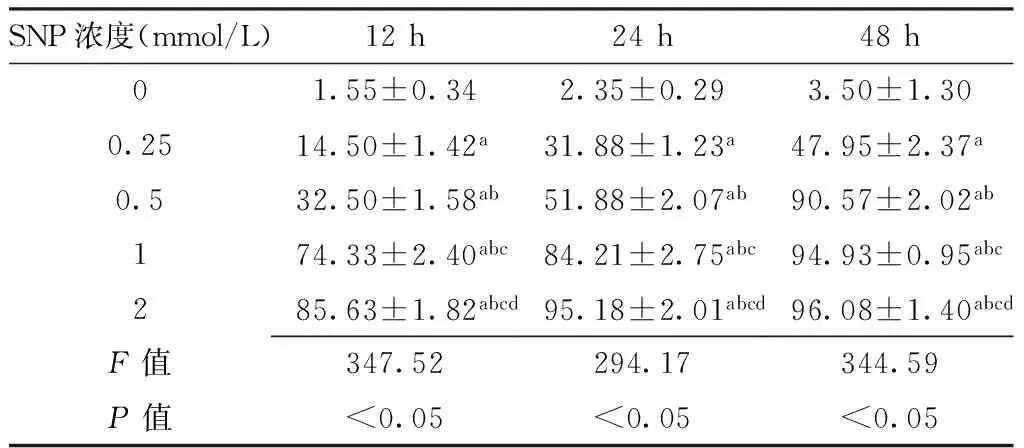
SNP浓度(mmol/L)12h24h48h01.55±0.342.35±0.293.50±1.300.2514.50±1.42a31.88±1.23a47.95±2.37a0.532.50±1.58ab51.88±2.07ab90.57±2.02ab174.33±2.40abc84.21±2.75abc94.93±0.95abc285.63±1.82abcd95.18±2.01abcd96.08±1.40abcdF值347.52294.17344.59P值<0.05<0.05<0.05
注:与SNP浓度为0 mmol/L比较,aP<0.05;与SNP浓度为0.25 mmol/L比较,bP<0.05;与SNP浓度为0.5 mmol/L比较,cP<0.05;与SNP浓度为1 mmol/L比较,dP<0.05
3 讨论
有研究发现,药物对OA的疗效与OA的严重程度有关[8-9]。因此,建立合适的模型对于筛选潜在治疗OA的药物具有重要意义。采用SNP诱导兔软骨细胞凋亡模型虽有多项报道,但SNP浓度和作用时间各异,不利于有针对性地筛选治疗OA的药物及评价疗效。Eo等[10]采用SNP浓度为1 mmol/L培养兔软骨细胞24 h,Todd Allen等[11]采用SNP浓度为0.5 mmol/L培养兔软骨细胞16 h,Wu等[12]采用SNP 浓度为2 mmol/L培养兔软骨细胞24 h,Terauchi等[13]和Tonomura等[14]采用SNP浓度为 0.5 mmol/L培养兔软骨细胞12 h和10 h建立兔软骨细胞凋亡模型。本研究通过不同浓度SNP、作用不同时间来考察SNP对兔软骨细胞凋亡的影响,采用MTT法在倒置显微镜下观察兔软骨凋亡细胞形态变化,TUNEL法评价与比较了不同浓度SNP诱导不同严重程度的软骨细胞凋亡模型。
有研究表明,低浓度SNP(0.1 mmol/L)可激活细胞外调节激酶1/2(ERK1/2)信号转导通路促进软骨细胞增殖,高浓度SNP(0.5~2 mmol/L)可通过激活p38信号转导通路促进软骨细胞凋亡[5,15-16]。因此,在采用SNP诱导软骨细胞凋亡时应筛选出可诱导细胞凋亡的SNP浓度范围。本研究分别采用SNP浓度为0.062 5、0.125、0.25、0.5、1、2 mmol/L培养兔软骨细胞,以建立不同严重程度的兔软骨细胞凋亡模型。体外培养兔膝关节软骨细胞并鉴定所培养的细胞可分泌糖胺聚糖以及Ⅱ型胶原等兔软骨细胞特异性成分,证实所培养的细胞为兔软骨细胞后,采用MTT法及TUNEL法比较了不同浓度SNP作用不同时间对兔软骨细胞凋亡的影响。本研究结果显示,SNP浓度为0.062 5、0.125 mmol/L培养12、24、48 h时兔软骨细胞OD值高于SNP浓度为0 mmol/L,SNP浓度为0.25、0.5、1、2 mmol/L培养12、24、48 h时兔软骨细胞OD值均低于SNP浓度为0 mmol/L,SNP浓度为0.25、0.5、1、2 mmol/L培养12、24、48 h时兔软骨细胞OD值在不同浓度间两两比较有差异。提示SNP浓度为0.062 5、0.125 mmol/L时可促进兔软骨细胞增殖,SNP浓度为0.25、0.5、1、2 mmol/L时可抑制兔软骨细胞增殖,能够制备不同严重程度的兔软骨细胞凋亡模型,且随着浓度的增加对兔软骨细胞增殖的抑制作用增强。
本研究结果显示,SNP浓度为0.25、0.5、1、2 mmol/L培养12、24、48 h时兔软骨细胞凋亡率均高于SNP浓度为0 mmol/L,且不同浓度间兔软骨细胞凋亡率比较有差异,提示随着SNP浓度的增加兔软骨细胞凋亡率增加。本研究结果还显示,建立凋亡率为10%~20%兔软骨细胞凋亡模型,可采用SNP浓度为0.25 mmol/L培养12 h;建立凋亡率为30%~60%兔软骨细胞凋亡模型,可采用SNP浓度为0.25 mmol/L培养24 h和48 h以及SNP浓度为0.5 mmol/L培养12 h和24 h;建立凋亡率为70%~90%兔软骨细胞凋亡模型,可采用SNP浓度为0.5 mmol/L培养48 h以及SNP浓度为1、2 mmol/L培养12、24和48 h。此外,在TUNEL实验过程中,可采用1%明胶包被的盖玻片来制备细胞玻片,可较好地防止细胞在后续处理过程中脱落。此外,还可适当增加聚乙二醇辛基苯基醚(Triton X-100)破膜的时间,本研究采用1% Triton X-100 通透软骨细胞7 min效果较好。研究中也可配制含0.1% Triton X-100的PBS作为洗液并适当增加洗涤次数和时间,可有效防止杂质对研究结果的影响[17]。
综上所述,本研究利用SNP诱导建立软骨细胞凋亡模型,比较了不同严重程度的凋亡模型,为筛选潜在治疗不同严重程度OA的药物提供合适的模型,便于进一步判定和探讨药物对OA的疗效及药物降低OA导致疼痛机制的研究。但本研究仅针对家兔膝关节软骨细胞进行考察,其他种属来源的膝关节软骨细胞尚未进行研究,而不同种属间存在一定差异,故仍需在今后进行深入探讨。
[1]Lee AS,Ellman MB,Yan D,et al.A current review of molecular mechanisms regarding osteoarthritis and pain[J].Gene,2013,527(2):440-447.
[2]van der Kraan PM,van den Berg WB.Chondrocyte hypertrophy and osteoarthritis:role in initiation and progression of cartilage degeneration[J].Osteoarthritis Cartilage,2012,20(3):223-232.
[3]Ma J,Li A,Zhu S,et al.Response toTNF/TNFR signal transduction pathway-mediated anti-apoptosis and anti-inflammatory effects of sodium ferulate on IL-1beta-induced rat osteoarthritis chondrocytes in vitro[J].Arthritis Res Ther,2013,15 (3):408-409.
[4]Chen Q,Liu SQ,Du YM,et al.Carboxymethyl chitosan protects rabbit chondrocytes from interleukin-1β-induced apoptosis[J].Eur J Pharmacol,2006,541 (1/2):1-8.
[5]Wang H,Wang Z,Chen J,et al.Apoptosis induced by NO via phosphorylation of p38 MAPK that stimulates NF-kB,p53 and caspase-3 activation in rabbit articular chondrocytes[J].Cell Biol Int,2007,31(9):1027-1035.
[6]Bhatti FU,Mehmood A,Wajid N,et al.Vitamin E protects chondrocytes against hydrogen peroxideinduced oxidative stress in vitro[J].Inflamm Res,2013,62(8):781-789.
[7]Abramson SB,Attur M,Yazici Y.Prospects for disease modification in osteoarthritis[J].Nat Clin Pract Rheumatol,2006,2(6):304-312.
[8]宁德花,朱瑜琪.膝关节骨关节炎应用透明质酸钠注射配合中药熏洗治疗的疗效观察与护理[J].中国全科医学,2005,8(22):1892-1893.
[9]Chen LX.Diagnesis and treatment of ostarthritis of knee joints[J].Chinese General Practice,2009,12(4):297-298.(in Chinese) 陈临新.膝关节骨关节炎的诊疗[J].中国全科医学,2009,12(4):297-298.
[10]Eo SH,Cho H,Kim SJ.Resveratrol inhibits nitric oxide-induced apoptosis via the NF-Kappa B pathway in rabbit articular chondrocytes[J].Biomol Ther (Seoul),2013,21(5):364-370.
[11]Todd Allen R,Robertson CM,Harwood FL,et al.Characterization of mature vs aged rabbit articular cartilage:analysis of cell density,apoptosis-related gene expression and mechanisms controlling chondrocyte apoptosis[J].Osteoarthritis Cartilage,2004,12 (11):917-923.
[12]Wu W,Gao X,Xu X,et al.Saponin-rich fraction from Clematis chinensis Osbeck roots protects rabbit chondrocytes against nitric oxide-induced apoptosis via preventing mitochondria impairment and caspase-3 activation[J].Cytotechnology,2013,65(2):287-295.
[13]Terauchi R,Takahashi KA,Arai Y,et al.Hsp70 prevents nitric oxide-induced apoptosis in articular chondrocytes[J].Arthritis Rheum,2003,48 (6):1562-1568.
[14]Tonomura H,Takahashi KA,Mazda O,et al.Glutamine protects articular chondrocytes from heat stress and NO-induced apoptosis with HSP70 expression[J].Osteoarthritis Cartilage,2006,14(6):545-553.
[15]Kim HA,Lee KB,Bae SC.The mechanism of low-concentration sodium nitroprusside mediated protection of chondrocyte death[J].Arthritis Res Ther,2005,7(3):R526-535.
[16]Ryu JS,Jung YH,Cho MY,et al.Co-culture with human synovium-derived mesenchymal stem cells inhibits in?ammatory activity and increases cell proliferation of sodium nitroprusside-stimulated chondrocytes[J].Biochem Biophys Res Commun,2014,447 (4):715-720.
[17]Han G,Shao H,Zhu X,et al.The protective effect of xanthan gum on interleukin-1β induced rabbit chondrocytes[J].Carbohydr Polym,2012,89 (3):870-875.
(本文编辑:李婷婷)
Rabbit Chondrocytes Apoptosis Models Induced by Different Concentrations of SNP
CHENQi-xin,HANGuan-ying,GUOBin,etal.
CollegeofPharmacy,LiaoningMedicalUniversity,Jinzhou121001,China
Objective To compare the chondrocytes apoptosis models induced by different concentrations of sodium nitroprusside (SNP),in order to provide theoretical support for the further investigation of the regulating effect of drugs on chondrocytes apoptosis.Methods Eight 4-week-old healthy New Zealand male rabbits (weight,200-250 g) were selected from September to December in 2014.Rabbit chondrocytes were cultured and researched in vitro.Different concentrations of SNP (0.062 5,0.125,0.25,0.5,1,2 mmol/L) were used to induce rabbit chondrocytes.At 12,24 and 48 h,MTT method and TUNEL method were employed to evaluate the chondrocytes apoptosis models induced by different concentrations of SNP.The OD value and apoptosis rate of rabbit chondrocytes were recorded.Results At different time points,chondrocytes apoptosis models induced by different concentrations of SNP were significantly different (P<0.05) in OD value.At 12,24 and 48 h,chondrocytes apoptosis models induced by 0.062 5 mmol/L and 0.125 mmol/L of SNP were higher (P<0.05) than the chondrocytes apoptosis model induced by 0 mmol/L of SNP in OD value;at 12,24 and 48 h,chondrocytes apoptosis models induced by 0.25,0.5,1 and 2 mmol/L of SNP were lower (P<0.05) than the chondrocytes apoptosis model induced by 0 mmol/L of SNP in OD value;at 12,24 and 48 h,chondrocytes apoptosis models induced by 0.25,0.5,1 and 2 mmol/L of SNP were significantly different (P<0.05) in OD value.At different time points,chondrocytes apoptosis models induced by different concentrations of SNP were significantly different (P<0.05) in apoptosis rate.At 12,24 and 48 h,chondrocytes apoptosis models induced by 0.25,0.5,1 and 2 mmol/L of SNP were higher (P<0.05) than the chondrocytes apoptosis model induced by 0 mmol/L of SNP in apoptosis rate;chondrocytes apoptosis models induced by different concentrations of SNP were significantly different (P<0.05) in apoptosis rate.Conclusion Chondrocytes apoptosis models of different severity degrees can be build by SNP with the concentration ranging from 0.25 mmol/L to 2 mmol/L,which provides theoretical support for the regulating effect of drugs on chondrocytes apoptosis.
Nitroprusside;Chondrocytes;Apoptosis
国家自然科学基金资助项目(81302681);国家“十二五”重大新药创制基金(2012ZX093016-002);辽宁省自然科学基金资助项目(2013022051);辽宁医学院校长基金-奥鸿博泽基金(XZJJ20130106-02);辽宁医学院校长基金-全民口腔研究生科研创新基金(QM2014007)
121001辽宁省锦州市,辽宁医学院药学院(陈启鑫);辽宁医学院附属第一医院(韩冠英,郭斌);中国科学院上海药物研究所(韩冠英,郭跃伟)
韩冠英,121001 辽宁省锦州市,辽宁医学院附属第一医院,中国科学院上海药物研究所;E-mail:hgy19800223@163.com
R 963
A
10.3969/j.issn.1007-9572.2015.24.y01
2015-02-21;
2015-06-13)

