bcr/abl基因特异性小干扰RNA对K562细胞增殖凋亡和SH2肌醇磷脂酶基因表达的影响研究
刘小军,杨 琳,潘玉夏,王兴哲,尚银涛,王 茜,杨敬慈,罗建民
·论著·
bcr/abl基因特异性小干扰RNA对K562细胞增殖凋亡和SH2肌醇磷脂酶基因表达的影响研究
刘小军,杨 琳,潘玉夏,王兴哲,尚银涛,王 茜,杨敬慈,罗建民
目的 通过小干扰RNA(siRNA)沉默K562细胞bcr/abl基因使SH2肌醇磷脂酶(SHIP)基因表达增加,探讨SHIP基因缺失对K562细胞增殖凋亡的影响及机制。方法 构建bcr/abl基因的化学合成siRNA,并转染到K562细胞,分为转染特异性siRNA实验组、转染非特异性siRNA对照组、空白对照组。Western blotting法检测转染后K562细胞p210表达量,实时荧光定量PCR(FQ-RT-PCR)检测各组细胞中SHIP mRNA表达量;Western blotting法检测SHIP、磷酸化蛋白激酶B 308(p-Akt308)和磷酸化蛋白激酶B 473(p-Akt473)的表达量;MTT比色法检测K562细胞增殖率;流式细胞仪检测K562细胞凋亡率;酶联免疫吸附试验(ELISA)法检测核因子(NF)-κB活性。结果 转染特异性siRNA实验组K562细胞p210表达量、p-Akt308表达量、p-Akt473表达量较空白对照组和转染非特异性siRNA对照组降低,SHIP mRNA表达量、SHIP表达量、细胞凋亡率较空白对照组和转染非特异性siRNA对照组升高(P<0.05);空白对照组与转染非特异性siRNA对照组K562细胞p210表达量、SHIP mRNA表达量、SHIP表达量、p-Akt308表达量、p-Akt473表达量、细胞凋亡率比较,差异无统计学意义(P>0.05)。第1天、第3天、第5天转染特异性siRNA实验组K562细胞增殖率较空白对照组和转染非特异性siRNA对照组降低(P<0.05);空白对照组与转染非特异性siRNA对照组K562细胞增殖率比较,差异无统计学意义(P>0.05)。第3天、第5天转染特异性siRNA实验组NF-κB活性较空白对照组和转染非特异性siRNA对照组降低(P<0.05);空白对照组与转染非特异性siRNA对照组NF-κB活性比较,差异无统计学意义(P>0.05)。结论 SHIP基因表达受bcr/abl基因的调控,SHIP表达缺失可能是K562细胞过度增殖和凋亡减少的重要因素。
白血病;基因,bcr/abl;RNA,小分子干扰;细胞增殖;细胞凋亡
刘小军,杨琳,潘玉夏,等.bcr/abl基因特异性小干扰RNA对K562细胞增殖凋亡和SH2肌醇磷脂酶基因表达的影响研究[J].中国全科医学,2015,18(24):2934-2938,2945.[www.chinagp.net]
Liu XJ,Yang L,Pan YX,et al.Effects of siRNA against bcr/abl on expression of SHIP and the proliferation and apoptosis of K562[J].Chinese General Practice,2015,18(24):2934-2938,2945.
人类SH2肌醇磷脂酶(SHIP)基因位于染色体2q36-q37.1,属肌醇5′磷酸酶家族,主要在造血细胞表达。其编码的145 KD蛋白为一种含有SH2结构域的肌醇磷酸酶,能选择性去除肌醇-1,3,4,5-四磷酸(IP4)和肌醇-3,4,5-三磷酸(PIP3)的5′-磷酸,从而负调控磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)信号转导通路。SHIP-/-小鼠会出现外周血白细胞计数异常增高、脾脏增大及肺部中性粒细胞浸润,与人类慢性粒细胞性白血病(chronic myelogenous leukemia,CML) 相似[1]。在一系列bcr/abl转化的小鼠造血细胞系、Ph阳性细胞系及来源于CML患者的原代细胞与未转化细胞系或bcr/abl阴性的CML细胞系相比,SHIP表达明显减少甚至缺失[2];abl特异性抑制剂——CGP57148B(STI571)能很快恢复SHIP的表达[3],表明bcr/abl能直接且可逆地抑制SHIP表达。已证实abl转化的细胞中存在PIP3聚集,abl原癌基因激活PI3K/Akt信号转导通路不仅通过增加PIP3的合成,还能通过阻断PIP3降解起作用[4]。本课题组前期研究已证实,在K562细胞中SHIP表达缺失,且bcr/abl的表达抑制SHIP的表达[5]。本研究旨在利用小干扰RNA(siRNA)特异性封闭bcr/abl的表达,探讨SHIP基因功能丢失与白血病发病的关系。
1 材料与方法
1.1 主要试剂 K562细胞株由本实验室保存;针对bcr/abl基因的siRNA按文献[6]由武汉晶赛生物工程技术有限公司合成;Ficoll淋巴细胞分离液、M-MLV反转录酶、Taq DNA聚合酶、RNA酶抑制剂(RNAsin)、dNTP、随机六聚体引物均购自Promega公司;标准胎牛血清(FBS)购自HyClone公司;Caspase-3荧光底物Z-DEVD-AFC购自Novabiochem-Calbiochem公司;碘化丙啶(PI)、核糖核酸酶A(RNase A)购自Sigma公司;实时荧光定量PCR(FQ-RT-PCR)试剂盒(针对bcr/abl和SHIP)由达安基因股份有限公司设计合成。SHIP引物序列:上游引物:5′-GCATTGCCCTTCGGTTAG-3′,下游引物:5′-TCATCACGCTCCGTCTTC-3′;探针:5′-FAM-ACATCA
本研究创新点:
慢性粒细胞性白血病(CML)是当前影响人类健康的一类重大疾病,一旦进入加速急变期将很难有挽救的机会,目前能根治的手段只有骨髓移植,蛋白酪氨酸酶抑制剂可有效控制病情,但难以治愈,且随时面临耐药问题,此两种手段给患者造成的经济负担也较大。因而进一步明确其发病机制,寻找新的靶点是当前紧要任务。bcr/abl是导致CML患者细胞成熟受阻的主要原因,然而对其下游传导通路及导致细胞成熟受阻的概率仍不十分明确,为此有必要进一步研究以明确发病机制。SH2肌醇磷脂酶(SHIP)是调控三磷酸肌醇代谢的重要调控酶,对细胞的增殖和凋亡有重要影响,已有研究表明其在CML中存在量和质的变化,SHIP在CML中是否参与了疾病的形成尚未完全明了。本实验通过干扰RNA特异性封闭了bcr/abl基因的表达,进而观察其下游信号通路上SHIP的表达,并通过观察增殖凋亡及核因子(NF)-κB活性,得出SHIP基因表达受bcr/abl的调控,SHIP表达缺失可能是bcr/abl阳性细胞过度增殖和凋亡减少的重要因素。
CTCACCGCTTCACGCACC-TAMRA-3′,片段长度166 bp。鼠抗人SHIP单克隆抗体、磷酸化Akt308(p-Akt308)抗体、磷酸化Akt473(p-Akt473)抗体、鼠抗人β-actin单克隆抗体均购自美国Santa Cruz公司。
1.2 细胞培养和siRNA转染 K562细胞培养于含10% FBS的RPMI 1640培养基,加入青霉素(100 U/ml)和链霉素(100 μg/ml),在37 ℃,含5%CO2、饱和湿度条件孵育,每2~3 d换用新鲜培养液。将不超过5代的生长对数期K562细胞以1 500 r/min离心5 min(离心半径16 cm),用磷酸盐缓冲液(PBS)洗涤3次,去除培养液,取约1×107细胞放入电转杯无菌密封后以250 V、900 μF进行电转。
1.3 实验分组 转染成功后重悬于RPMI 1640培养基中培养,分为转染特异性siRNA实验组、转染非特异性siRNA对照组、空白对照组。转染特异性siRNA实验组转染特异性针对bcr/abl基因的siRNA;转染非特异性siRNA对照组转染非特异性siRNA序列;空白对照组不转染任何载体的K562细胞。
1.4 FQ-RT-PCR和Western blotting法检测转染效果 FQ-RT-PCR检测bcr/abl基因表达:Trizol一步法提取细胞总RNA,紫外分光光度计定量。取4 μl mRNA加入试剂盒反转录,取5 μl mRNA进行定量扩增。扩增条件如下:93 ℃ 2 min;93 ℃ 45 s,55 ℃ 45 s,40个循环。GENE 5700软件分析结果,结果计算按公式:A(拷贝数/μg总RNA)=B(拷贝数/μl cDNA)÷样本RNA的OD260值×1.05。
Western blotting法检测转染后K562细胞p210表达量:收集转染后72 h细胞,提取总蛋白。SDS-聚丙烯酰胺凝胶电泳(PAGE)分离蛋白质,转膜,室温封闭,单克隆c-abl一抗4 ℃反应过夜,洗膜,二抗室温孵育,洗膜,化学发光法检测后分析结果。
1.5 FQ-RT-PCR和Western blotting法检测细胞中SHIP mRNA表达及SHIP、p-Akt308、p-Akt473表达量 收集转染后48 h细胞,FQ-RT-PCR检测各组细胞中SHIP mRNA表达量;收集转染后72 h细胞,Western blotting法检测各组细胞中SHIP、p-Akt308和p-Akt473表达量,β-actin为内参照。实验重复3次。
1.6 MTT比色法检测K562细胞增殖率 各组调整细胞密度至1×104/ml,接种于96孔无菌培养板中,200 μl/孔。设6个复孔,实验重复3次。每日取出1板,加入MTT溶液20 μl(10 mg/ml),孵育4 h后应用平板离心机3 000 r/min离心10 min(离心半径1.35 cm),弃上清液,再加入200 μl二甲基亚砜(DMSO)终止反应,应用全自动酶标仪测570 nm处OD值。以转染特异性siRNA实验组和转染非特异性siRNA对照组OD值比空白对照组OD值的比值反映细胞增殖率。分别于第0、1、3、5天收集转染细胞进行检测,实验重复3次。
1.7 流式细胞仪检测K562细胞凋亡率 收集转染后48 h细胞,PBS洗涤2次,加无血清培养基培养24 h,调整细胞密度至1×106/ml,取100 μl细胞悬液于1.5 ml EP管中,分别加入Annexin V-FITC 5 μl和20 μg/ml PI溶液10 μl,混匀后室温避光孵育15 min,然后加入PBS 400 μl,采用流式细胞仪检测K562细胞凋亡率,实验重复3次。
1.8 核因子(NF)-κB活性测定 收集细胞,按照上海康成生物工程有限公司ArrayStarTMNF-κB活性酶联免疫吸附试验(ELISA)试剂盒说明书操作步骤提取细胞核蛋白,用考马斯亮蓝法测定蛋白浓度。每孔取样本20 μg采用ELISA法定量检测NF-κB活性。在0.5 ml离心管中采用完全DNA结合缓冲液准备成总体积为55 μl的反应体系,用于检测。预先标记特定的寡核苷酸κB序列5′-GGGACTTTCC-3′。一抗为NF-κB活性形式的p65亚基抗体(1∶1 000),二抗为辣根过氧化物酶(HRP)标记抗体(1∶1 000)。用分光光度计于450 nm波长测定NF-κB活性。分别于第0、1、3、5天收集转染细胞进行检测,实验重复3次。
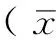
2 结果
2.1 Western blotting法检测各组K562细胞p210表达量 转染72 h后,Western blotting法检测各组K562细胞p210表达量,结果显示,转染特异性siRNA实验组K562细胞p210表达量较空白对照组和转染非特异性siRNA对照组降低,差异有统计学意义(P<0.05);空白对照组与转染非特异性siRNA对照组K562细胞p210表达量比较,差异无统计学意义(P>0.05,见表1)。
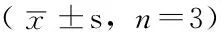
表1 各组K562细胞p210表达量比较
注:siRNA=小干扰RNA;与转染特异性siRNA实验组比较,aP<0.05
2.2 FQ-RT-PCR法检测各组K562细胞SHIP mRNA表达量 转染48 h后,FQ-RT-PCR检测各组K562细胞SHIP mRNA表达量,结果显示,转染特异性siRNA实验组K562细胞SHIP mRNA表达量较空白对照组和转染非特异性siRNA对照组升高,差异有统计学意义(P<0.05);空白对照组与转染非特异性siRNA对照组K562细胞SHIP mRNA表达量比较,差异无统计学意义(P>0.05,见表2)。
2.3 Western blotting法检测各组K562细胞SHIP、p-Akt308和p-Akt473表达量 转染72 h后,Western blotting法检测各组K562细胞SHIP表达量,结果显示,转染特异性siRNA实验组K562细胞SHIP表达量较空白对照组和转染非特异性siRNA对照组升高,p-Akt308和p-Akt473表达量较空白对照组和转染非特异性siRNA对照组降低,差异有统计学意义(P<0.05);空白对照组与转染非特异性siRNA对照组K562细胞SHIP、p-Akt308和p-Akt473表达量比较,差异无统计学意义(P>0.05,见表3,图1~2)。
2.4 各组不同时间K562细胞增殖率比较 第1天、第3天、第5天转染特异性siRNA实验组K562细胞增殖率较空白对照组和转染非特异性siRNA对照组降低,差异有统计学意义(P<0.05);空白对照组与转染非特异性siRNA对照组K562细胞增殖率比较,差异无统计学意义(P>0.05,见表4)。
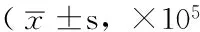
表2 各组K562细胞SHIP mRNA表达量比较拷贝,n=3)
注:SHIP=SH2肌醇磷脂酶;与转染特异性siRNA实验组比较,aP<0.05
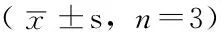
Table 3 Comparison of expression of SHIP,p-Akt308 and p-Akt473 of K562 cells in each group
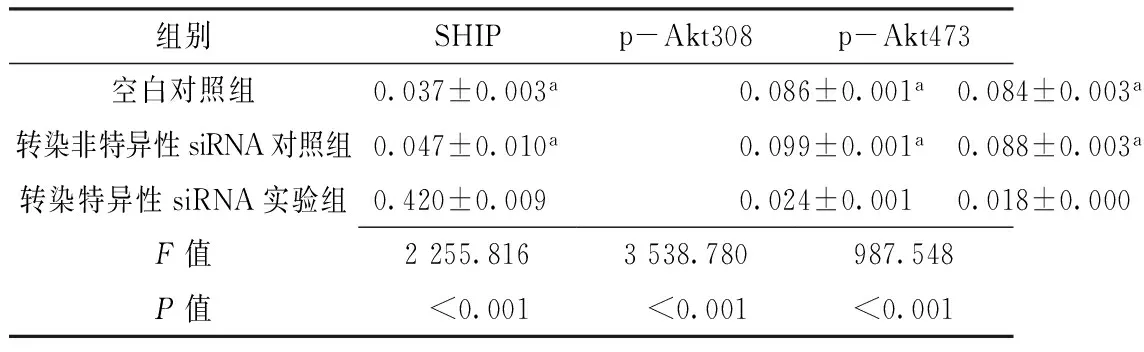
组别SHIPp-Akt308p-Akt473空白对照组0.037±0.003a0.086±0.001a0.084±0.003a转染非特异性siRNA对照组0.047±0.010a0.099±0.001a0.088±0.003a转染特异性siRNA实验组0.420±0.0090.024±0.0010.018±0.000F值2255.8163538.780987.548P值<0.001<0.001<0.001
注:p-Akt308=磷酸化蛋白激酶B 308,p-Akt473=磷酸化蛋白激酶B 473;与转染特异性siRNA实验组比较,aP<0.05
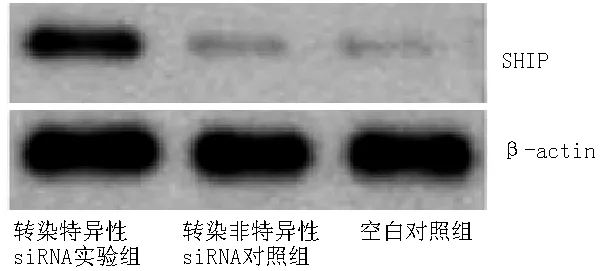
注:siRNA=小干扰RNA,SHIP=SH2肌醇磷脂酶
图1 Western blotting法检测各组K562细胞SHIP表达量
Figure 1 Expression of SHIP in K562 cells shown by the Western blotting method in each group
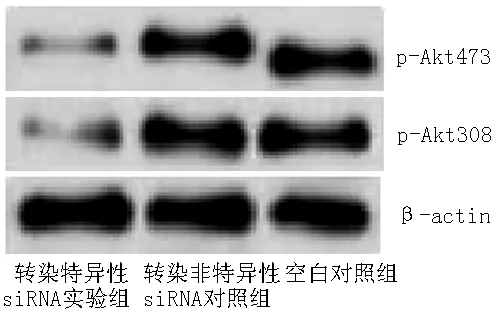
注:p-Akt308=磷酸化蛋白激酶B 308,p-Akt473=磷酸化蛋白激酶B 473
图2 Western blotting法检测各组K562细胞p-Akt308和p-Akt473表达量
Figure 2 Expression of p-Akt308 and p-Akt473 in K562 cells shown by the Western blotting method in each group
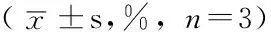
Table 4 Comparison of proliferation rates of K562 cells in each group at different time points
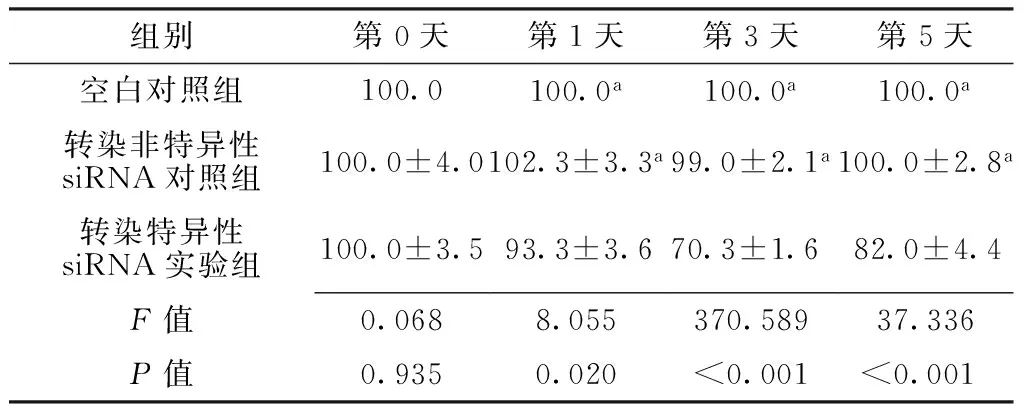
组别第0天第1天第3天第5天空白对照组100.0100.0a100.0a100.0a转染非特异性siRNA对照组100.0±4.0102.3±3.3a99.0±2.1a100.0±2.8a转染特异性siRNA实验组100.0±3.593.3±3.670.3±1.682.0±4.4F值0.0688.055370.58937.336P值0.9350.020<0.001<0.001
注:与转染特异性siRNA实验组比较,aP<0.05
2.5 各组K562细胞凋亡率比较 转染48 h后,流式细胞仪检测显示,转染特异性siRNA实验组K562细胞凋亡率较空白对照组和转染非特异性siRNA对照组升高,差异有统计学意义(P<0.05);空白对照组与转染非特异性siRNA对照组K562细胞凋亡率比较,差异无统计学意义(P>0.05,见表5、图3)。
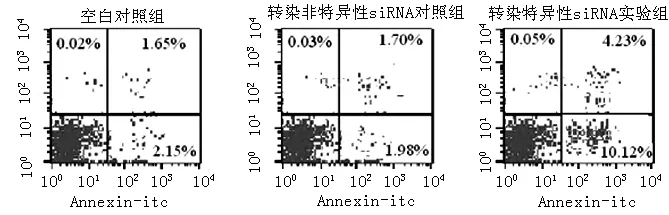
图3 流式细胞仪检测各组K562细胞凋亡率
Figure 3 Apoptosis rate of K562 cells shown by flow cytometry in each group
2.6 各组不同时间NF-κB活性比较 第0天、第1天3组NF-κB活性比较,差异无统计学意义(P>0.05)。第3天、第5天转染特异性siRNA实验组NF-κB活性较空白对照组和转染非特异性siRNA对照组降低,差异有统计学意义(P<0.05);空白对照组与转染非特异性siRNA对照组NF-κB活性比较,差异无统计学意义(P>0.05,见表6)。
表5 各组K562细胞凋亡率比较
注:与转染特异性siRNA实验组比较,aP<0.05
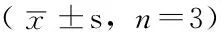
Table 6 Comparison of the activity of NF-κB in each group at different time points
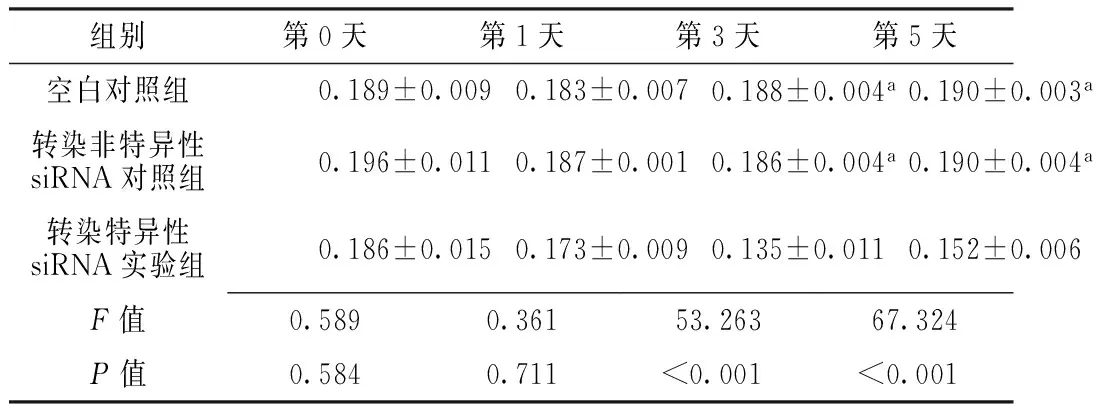
组别第0天第1天第3天第5天空白对照组0.189±0.0090.183±0.0070.188±0.004a0.190±0.003a转染非特异性siRNA对照组0.196±0.0110.187±0.0010.186±0.004a0.190±0.004a转染特异性siRNA实验组0.186±0.0150.173±0.0090.135±0.0110.152±0.006F值0.5890.36153.26367.324P值0.5840.711<0.001<0.001
注:与转染特异性siRNA实验组比较,aP<0.05
3 讨论
研究显示,bcr/abl是CML和部分急性淋巴细胞白血病的致病基因,其编码的融合蛋白p210具有持续酪氨酸激酶活性[7],被认为是CML发病的一个重要原因。格列卫作为酪氨酸激酶抑制剂,在CML的治疗中起重要作用,但格列卫耐药现象的出现迫使学者寻找新的治疗方案。在bcr/abl活化的信号路径中寻找新的突破点是一个良好的选择。PI3K/Akt是bcr/abl下游的一条重要通路,在CML发病中起关键作用。
人类SHIP基因是继与张力蛋白同源的10号染色体缺失的磷酸酶基因(PTEN)之后发现的又一肌醇5′磷酸酶家族成员,仅限于造血细胞表达,其主要功能是特异性降解PIP3的5′磷酸成PI(3,4)P2,在Akt活化及维持细胞存活和对抗细胞凋亡的信号转导通路中发挥负调节功能[5]。敲除SHIP基因(SHIP-/-)小鼠出现类似CML样的髓系细胞高度增殖、肝脾肿大及肺部髓系细胞浸润;2003年,罗建民等[8]报道了,CML患者存在SHIP基因的功能结构域遗传学突变。随后张苏江等[9]也在急性隨细胞白血病中发现了两种SHIP基因突变(A>T,Q1154L Q1153L),SHIP基因在淋巴细胞白血病发病中的作用尚不完全清楚。本课题前期研究发现,SHIP基因在CML患者中表达明显降低,尤其在CML急变期患者表达减低更为明显;siRNA封闭bcr/abl能恢复K562细胞SHIP表达[5]。这些研究提示SHIP基因在CML发病过程中发挥重要作用。然而,SHIP重新表达是否参与了p210对细胞的恶性转化尚不清楚。
NF-κB位于PI3K/Akt信号转导通路下游,在CML的发生、发展中起重要作用[9]。NF-κB活化后,不仅可以调节与细胞生长和增殖相关基因的表达,更重要的是,还可上调凋亡抗性分子bcl-2、bcl-xL等基因的表达,从而使肿瘤细胞逃避凋亡,成为肿瘤细胞生存的关键因素;相反,抑制NF-κB活性,则能诱导细胞凋亡,抑制肿瘤的生长。Gloire等[10]报道,SHIP能通过抑制NF-κB活性而抑制凋亡。
本研究结果显示,转染特异性siRNA实验组K562细胞p210表达量较空白对照组和转染非特异性siRNA对照组降低,SHIP表达量升高,细胞增殖率显著受抑,细胞凋亡率增加;同时,K562细胞p-Akt308和p-Akt473表达量下调,其下游的NF-κB活性亦下调。表明,靶向干扰bcr/abl基因的表达可使K562细胞凋亡,其机制可能与SHIP重新表达,下调p-Akt表达量和NF-κB活性有关。提示SHIP基因表达缺失与K562细胞p-Akt高表达密切相关。虽然目前结果尚不能完全推断此变化没有bcr/abl 功能缺失其他因素的参与,但提示SHIP的表达变化可能参与了CML的发生发展。故构建稳定的携带SHIP基因载体进一步研究SHIP基因在CML中的作用,有可能为CML提供潜在的新治疗靶点。
综上所述,SHIP表达量减低很可能是CML发生发展中的重要一环。bcr/abl 基因可通过下调SHIP表达量,进而影响下游Akt的磷酸化以及NF-κB活性等一系列与增殖凋亡相关的信号蛋白,参与CML形成。本研究不足之处在于仅进行了体外实验,今后将进一步在实验动物上进行活体实验,以得到更贴切的实验数据。
[1]Yang L,Luo JM,Liu XJ,et al.The mechanism for SHIP gene to induce the apoptosis of human leukemia cell line K562[J].Acta Physiologica Sinica,2009,61(2):146-154.(in Chinese) 杨琳,罗建民,刘小军,等.SHIP基因诱导白血病细胞株K562凋亡及其机制[J].生理学报,2009,61(2):146-154.
[2]Jiang X,Stuible M,Chalandon Y,et al.Evidence for a positive role of SHIP in the BCR-ABL-mediated transformation of primitive murine hematopoietic cells and in human chronic myeloid leukemia[J].Blood,2003,102(8):2976-2984.
[3]任金海,罗建民,杨敬慈,等.白血病细胞内SHIP基因表达及其对AKT磷酸化的影响[J].中华血液学杂志,2007,28(12):844-845.
[4]Kharas MG,Fruman DA.ABL oncogenes and phosphoinositide 3-kinase:mechanism of activation and downstream effectors[J].Cancer Res,2005,65(6):2047-2053.
[5]Liu XJ,Luo JM,Yang L,et al.Expression changes of SHIP1 and the possible mechanism in the chronic mylogenous leukemia[J].Med J Chin PLA,2008,33(6):701-703.(in Chinese) 刘小军,罗建民,杨琳,等.慢性粒细胞性白血病中SHIP1基因的表达变化及机制探讨[J].解放军医学杂志,2008,33(6):701-703.
[6]Withey JM,Marley SB,Kaeda J,et al.Targeting primary human leukaemia cells with RNA interference:Bcr-Abl targeting inhibits myeloid progenitor self-renewal in chronic myeloid leukaemia cells[J].Br J Haematol,2005,129(3):377-380.
[7]Hoy SM.Ponatinib:a review of its use in adults with chronic myeloid leukaemia or Philadelphia chromosome-positiveacute lymphoblastic leukaemia[J].Drugs,2014,74(7):793-806.
[8]Luo JM,Liu ZL,Hao HL,et al.Mutation analysis of SHIP gene in acute leukemia[J].Chin J Hematol,2004,25(7):385-388.(in Chinese) 罗建民,刘泽林,郝洪岭,等.急性白血病细胞SHIP基因的突变分析[J].中华血液学杂志,2004,25(7):385-388.
[9]Zhang SJ,Li JY,Shi JY,et al.Study of mutation and single nucleotide polymorphism of PDGFRβ and SHIP gene in acute myeloid leukemia[J].Chin J Hematol,2006,27(6):383-385.(in Chinese) 张苏江,李建勇,施静艺,等.急性髓系白血病患者PDGFRβ和SHIP基因突变及其单核苷酸多态性研究[J].中华血液学杂志,2006,27(6):383-385.
[10]Gloire G,Charlier E,Rahmouni S,et al.Restoration of SHIP-1 activity in human leukemic cells modifies NF-kappaB activation pathway and cellular survival upon oxidative stress[J].Oncogene,2006,25(40):5485-5494.
(本文编辑:陈素芳)
Effects of siRNA Against bcr/abl on Expression of SHIP and the Proliferation and Apoptosis of K562
LIUXiao-jun,YANGLin,PANYu-xia,etal.
DepartmentofHematology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China
Objective Through silence the expression of bcr/abl with siRNA to increase the expression of SHIP so that we can study the influence of SHIP gene expression to the proliferation and apoptosis of K562 together with its possible mechanism. Methods Construct synthetic siRNA specific to bcr/abl fusion gene and tranfect it into cell line K562, non-specific siRNA trasfected group and untreated group were used as control,then Western blotting was employed to detect the expression of p210,SHIP and level of p-Akt(308,437),SHIP mRNA level was detected through FQ-RT-PCR, proliferation of K562 through MTT, and apoptosis of K562 through flow cytometre, NF-κB activity was examined through ELISA. Results fter transfected with siRNA specific to bcr/abl,the expression of p210, p-Akt308,p-Akt473 was dramatically decreased in the bcr-abl-specific siRNA transfected group compare to the non-specific transfected control and untreated group of K562 cells,while the SHIP mRNA, protein expression, apoptosis rate increased in bcr-abl-specific transfected K562 cells compare to the other two control groups(P<0.05). All these changes were not detected between the non-specific transfected group and untreated group of K562 cells(P>0.05). The proliferation decreased in the bcr-abl-specific transfected group compare to the other two controls on day 1,day 3 and day 5 respectively(P<0.05), but no significance was found between the two control groups(P>0.05). NF-κB activity decreased in bcr-abl-specific transfected group compare to the other two control groups on day 3 and day 5(P<0.05),but no significance was found between the two control groups(P>0.05). Conclusion Our results suggested that SHIP expression is controlled by bcr/abl. Reduced expression of SHIP partly responsible for the increased proliferation and decreased apoptosis of bcr/abl positive cells.
Leukemia;Genes,bcr/abl;RNA,small interfering;Cell proliferation;Apoptosis
国家自然科学基金资助项目(30240011);河北省自然科学基金资助项目(2007000858);卫生行业科研专项基金(201202017)
050000 河北省石家庄市,河北医科大学第二医院血液科,河北省血液病重点实验室
罗建民,050000 河北省石家庄市,河北医科大学第二医院血液科,河北省血液病重点实验室;
E-mail:luojm315@163.com
R 733.7
A
10.3969/j.issn.1007-9572.2015.24.013
2015-01-23;
2015-06-27)

