内质网应激相关因子CCAAT/增强子结合蛋白同源蛋白在蛛网膜下腔出血后早期脑损伤中的作用
黄啸元,赵 冬,刘 祺,许 晖,戴 晶,代林志,徐伟华,王业忠
·论著·
内质网应激相关因子CCAAT/增强子结合蛋白同源蛋白在蛛网膜下腔出血后早期脑损伤中的作用
黄啸元,赵 冬,刘 祺,许 晖,戴 晶,代林志,徐伟华,王业忠
目的 探讨内质网应激相关因子CCAAT/增强子结合蛋白同源蛋白(CHOP)的表达及其在蛛网膜下腔出血(SAH)后早期脑损伤(EBI)中的作用。方法 选取健康雄性SD大鼠78只,采用随机数字表法将其分为空白对照组(6只)、假手术组(36只)与SAH组(36只)。将假手术组和SAH组分别于1、6、12、24、48、72 h,采用简单随机抽样法选取6只大鼠处死。比较各组不同时间点光镜及电镜下大鼠海马神经元形态改变、CHOP相对表达水平、海马神经元凋亡细胞水平及神经行为学评分。结果 3组大鼠6、12、24、48 h时CHOP相对表达水平比较,差异均有统计学意义(P<0.05);其中SAH组大鼠6、12、24、48 h时CHOP相对表达水平均高于空白对照组和假手术组(P<0.05)。空白对照组和假手术组大鼠不同时间点CHOP相对表达水平比较,差异无统计学意义(P>0.05)。空白对照组与假手术组仅有极少数海马神经元凋亡细胞;SAH组1 h海马神经元未见明显凋亡改变;SAH组6、12 h海马神经元凋亡细胞较前增多,部分散在的海马神经元凋亡细胞的细胞核呈棕褐色;SAH组24 h海马神经元凋亡细胞明显增多;SAH组48 h海马神经元凋亡细胞逐渐减少,72 h可见少量海马神经元凋亡细胞。3组大鼠6、12、24、48 h时海马神经元凋亡细胞水平比较,差异均有统计学意义(P<0.05);其中SAH组大鼠6、12、24、48 h时海马神经元凋亡细胞水平均高于空白对照组和假手术组(P<0.01)。空白对照组和假手术组大鼠不同时间点海马神经元凋亡细胞水平比较,差异无统计学意义(P>0.05)。空白对照组、假手术组及SAH组大鼠实验前神经行为学评分比较,差异无统计学意义(P>0.05)。3组大鼠6、12、24、48 h时神经行为学评分比较,差异均有统计学意义(P<0.05);其中SAH组大鼠6、12、24、48 h时神经行为学评分均低于空白对照组和假手术组(P<0.01)。空白对照组和假手术组大鼠不同时间点神经行为学评分比较,差异无统计学意义(P>0.05)。SAH组CHOP相对表达水平与海马神经元凋亡细胞水平呈正相关(r=0.933,P<0.01)。结论 SAH后早期CHOP表达增高,海马神经元凋亡细胞增多,神经行为学评分降低,提示CHOP在SAH后内质网应激诱导的细胞凋亡中发挥重要作用。
蛛网膜下腔出血;脑损伤;内质网应激;CCAAT增强子结合蛋白类;血管痉挛,颅内;细胞凋亡
黄啸元,赵冬,刘祺,等.内质网应激相关因子CCAAT/增强子结合蛋白同源蛋白在蛛网膜下腔出血后早期脑损伤中的作用[J].中国全科医学,2015,18(24):2911-2916,2921.[www.chinagp.net]
Huang XY,Zhao D,Liu Q,et al.Effects of endoplasmic reticulum stress-induced transcriptional factor CHOP on early brain injury after subarachnoid hemorrhage[J].Chinese General Practice,2015,18(24):2911-2916,2921.
自发性蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是一种临床常见的急性脑血管疾病,该病致残率和病死率较高。尽管目前诊断技术、显微外科技术以及介入治疗技术发展迅速,但其预后并未明显改善。近期研究表明,造成SAH患者预后差的主要原因可能为早期脑损伤( early brain injury,EBI)[1]。EBI发病机制复杂,包括:神经血管炎症、血-脑脊液屏障破坏、脑损伤和脑水肿、急性脑血管痉挛(CVS)、微循环功能障碍和细胞凋亡等[2],其中细胞凋亡则是EBI发生发展过程中的主要病理生理机制。Mehmet[3]研究发现,内质网可能是细胞内诱导凋亡的一个新场所,因此提出了内质网应激(endoplasmic reticulum stress,ERS) 反应性凋亡途径,而CCAAT/增强子结合蛋白同源蛋白 (C/EBP-homologous protein,CHOP)是ERS介导的凋亡通路中最重要的凋亡信号分子之一。已有文献报道,CHOP在缺血再灌注后细胞凋亡中起着重要作用[4]。本研究拟通过观察SAH后CHOP的表达水平和SAH后EBI的变化来探讨CHOP在SAH后EBI过程中所发挥的作用。
1 材料与方法
1.1 实验材料 健康雄性SD大鼠78只,3~4月龄,体质量(290±40)g,由新疆维吾尔自治区动物实验中心提供。采用随机数字表法将大鼠分为空白对照组6只、假手术组36只与SAH组36只。
1.2 主要试剂 CHOP单克隆抗体购自英国abcam公司,内参β-actin购自北京中杉金桥生物技术有限公司,TUNEL试剂盒购自美国Roche公司,DAB显色试剂盒购自丹麦Dako公司。
本研究要点:
内质网应激(ERS)介导的细胞凋亡是蛛网膜下腔出血(SAH)后早期脑损伤(EBI)发病机制的重要组成部分,CCAAT/增强子结合蛋白同源蛋白(CHOP)/GADD153 (生长停滞因子及DNA损伤基因)是ERS的特异转录因子,CHOP表达升高是ERS的标志,其在ERS和细胞凋亡的联系中起到重要作用,是一个举足轻重的中间信号分子,目前国内外关于ERS相关因子CHOP在EBI细胞凋亡中作用的报道尚少,因此本研究通过观察海马神经元内CHOP在SAH后海马组织中表达的时相性变化,分析CHOP表达的变化与海马神经元凋亡细胞水平之间的关系,探讨CHOP在SAH后EBI过程中所发挥的作用,为寻找SAH后EBI的潜在治疗靶点提供理论依据。
1.3 实验方法
1.3.1 建立大鼠模型 SAH组大鼠每100 g给予35 g/L水合氯醛1 ml腹腔注射麻醉,完全麻醉后分离暴露股动脉并穿刺置管,将头固定于立体定向仪上,取颅顶正中矢状线切口,逐层分离头皮,暴露颅骨,于冠状缝前5 mm,中线旁开3 mm处钻透露颅骨,显露额极,挑开硬脑膜,可见清亮脑脊液流出,将PE10导管从额极紧贴前颅窝底向双耳连线中点送入,进入深度约为10 mm,骨蜡封闭骨孔。连接1 ml无菌注射器,回抽可见清亮脑脊液,取自体动脉血0.3 ml,连接导管,在12 s内匀速注入大鼠蛛网膜下腔。小心拔出导管,骨蜡封闭骨孔,逐层缝合头皮,并保持大鼠头低位30 min。假手术组除将自体血换为0.3 ml 0.9%氯化钠溶液注入蛛网膜下腔外,余步骤均与SAH组相同。空白对照组不予任何处理。
1.3.2 组织固定及处理 造模成功后,将假手术组和SAH组分别于1、6、12、24、48、72 h,采用简单随机抽样法选取6只大鼠处死,断头取脑后完整剥离两侧海马,一部分迅速放入无酶EP管中-80 ℃冻存用于免疫印迹法检测,一部分放入4%多聚甲醛溶液中固定后常规HE染色制作切片光镜下观察细胞形态,另一部分放入2.5%戊二醛溶液中固定后由新疆医科大学电镜室制作切片并观察大鼠海马神经元超微结构变化。空白对照组大鼠直接处死后,固定及处理方法同上。
1.3.2.1 免疫印迹法检测CHOP相对表达水平 各组均称取30 mg海马组织,放入不同无酶EP管中,各加入150 μl裂解液,超声粉碎组织,4 ℃条件下,13 000 r/min离心15 min(离心半径10 cm),后取上清液。紫外分光光度计测CHOP表达水平,各组测3次,取平均值。CHOP变性后,进行SDS凝胶电泳分离蛋白,转至聚偏二氟乙烯(PVDF)膜上,用5%脱脂奶粉封闭2 h后,加入CHOP抗体(1∶500)及β-actin抗体(1∶1 000),4 ℃孵育过夜,TBST洗膜后,加入二抗(辣根过氧化物酶标记的大鼠抗小鼠二抗IgG)常温孵育2 h,后TBST洗膜,增强化学发光法(ECL)显色,图像分析仪测定各条带灰度值,将各组CHOP条带灰度值与相应内参β-actin条带灰度值相比,计算各组CHOP相对表达水平。
1.3.2.2 TUNEL法检测大鼠海马神经元凋亡细胞水平 各组在66 ℃烘片后,常规脱蜡、水化,20 μg/ml的蛋白酶K消化组织15 min,磷酸盐缓冲液(PBS)震洗后,用焦碳酸二乙酯(DEPC)水浸泡45 min,后PBS震洗5 min (3次),滴加50 μl TUNEL反应混合液(酶溶液∶标记液=1∶9);37 ℃湿盒中孵育1 h,PBS震洗后滴加过氧化物酶(POD)转换液,后 37 ℃湿盒中孵育30 min,后PBS震洗5 min(3次),滴加DAB并在镜下控制显色程度,清水洗净后HE复染,后梯度乙醇溶液脱水,二甲苯透明,中性树胶封固。在高倍镜(×400)下随机选取不重复的10个视野,细胞核呈棕黄色为阳性细胞,计数视野下阳性细胞数及细胞总数,阳性细胞率=阳性细胞数/细胞总数×100%,以阳性细胞率的均值作为海马神经元凋亡细胞水平。
1.4 神经行为学评分 各组大鼠均采用加西亚(Garcia)评分法[5]于实验前、6、12、24、48、72 h处死前进行神经行为学评分,评分范围为5~18分,共分6项进行评价:自主活动、四肢活动对称性、前肢伸展活动、攀爬能力、本体感觉、胡须触碰反射。得分越低表示大鼠神经功能受损越严重。
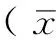
2 结果
2.1 建立大鼠模型 SAH组中共有2只大鼠因麻醉意外死亡,1只在注血后死亡,及时补做3只。SAH组大鼠开颅后于大脑willis环附近蛛网膜下腔可见大量积血,前循环处可见血凝块;假手术组蛛网膜下腔未见血凝块(见图1)。
注:SAH=蛛网膜下腔出血
图1 建立大鼠模型
Figure 1 Images of the rat models
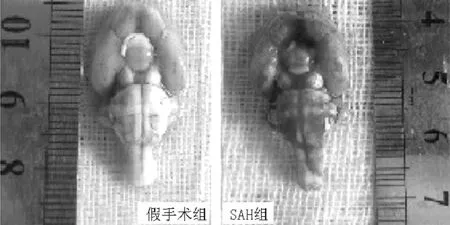
2.2 光镜及电镜下海马神经元超微结构变化 光镜下:空白对照组大鼠海马神经元大小及染色质分布均匀;假手术组海马神经元出现皱缩,细胞核染色质浓缩明显;SAH组海马神经元皱缩,出现核固缩现象。电镜下:空白对照组及假手术组大鼠海马神经元形态饱满,异染质少见,细胞器形态正常;SAH组1 h可见海马神经元核内异染质稍增多,细胞器形态基本正常;SAH组6 h可见明显内质网脱颗粒、扩张,线粒体肿胀、空泡早期凋亡,广泛的细胞水样变性及脑组织间质水肿;SAH组12 h可见细胞水肿较前消退,但细胞核内异染质增多,细胞膜皱缩明显,细胞质密度增加;SAH组24 h海马神经元凋亡变化最为明显,可见细胞核膜内陷、染色质固缩边集、细胞质密度增高、内质网明显扩张;SAH组48 h仍可见细胞核内异染质增加,细胞质密度增加;SAH组72 h海马神经元形态大致正常,与空白对照组和假手术组比较无明显变化(见图2)。
2.3 3组大鼠不同时间点CHOP相对表达水平比较 各组不同时间点CHOP表达水平电泳图见图3。3组大鼠6、12、24、48 h时CHOP相对表达水平比较,差异均有统计学意义(P<0.05);其中SAH组大鼠6、12、24、48 h时CHOP相对表达水平均高于空白对照组和假手术组,差异有统计学意义(P<0.01)。空白对照组和假手术组大鼠不同时间点CHOP相对表达水平比较,差异无统计学意义(P>0.05,见表1)。
2.4 3组大鼠不同时间点海马神经元凋亡细胞水平比较 空白对照组与假手术组仅有极少数海马神经元凋亡细胞;SAH组1 h海马神经元未见明显凋亡改变;SAH组6、12 h海马神经元凋亡细胞较前增多,部分散在的海马神经元凋亡细胞的细胞核呈棕褐色;SAH组24 h海马神经元凋亡细胞明显增多;SAH组48 h海马神经元凋亡细胞逐渐减少,72 h可见少量海马神经元凋亡细胞(见图4)。3组大鼠6、12、24、48 h时海马神经元凋亡细胞水平比较,差异均有统计学意义(P<0.05);其中SAH组大鼠6、12、24、48 h时海马神经元凋亡细胞水平均高于空白对照组和假手术组,差异有统计学意义(P<0.01)。空白对照组和假手术组大鼠不同时间点海马神经元凋亡细胞水平比较,差异无统计学意义(P>0.05,见表2)。
2.5 3组大鼠不同时间点神经行为学评分比较 空白对照组、假手术组及SAH组大鼠实验前神经行为学评分比较,差异无统计学意义(P>0.05)。3组大鼠6、12、24、48 h时神经行为学评分比较,差异均有统计学意义(P<0.05);其中SAH组大鼠6、12、24、48 h时神经行为学评分均低于空白对照组和假手术组,差异有统计学意义(P<0.01)。空白对照组和假手术组大鼠不同时间点神经行为学评分比较,差异无统计学意义(P>0.05,见表3)。
注:a为空白对照组神经元大小及染色质分布均匀(HE染色,×200);b为SAH组海马神经元皱缩,出现核固缩现象(HE染色,×200);c为空白对照组海马神经元形态饱满,异染质少见,细胞器形态正常(电镜,×8 000);d为SAH组1 h时海马神经元核内异染质稍增多,细胞器形态基本正常(电镜,×8 000);e为SAH组6 h时明显内质网脱颗粒、扩张,线粒体肿胀、空泡早期凋亡,细胞质密度减低,组织间质出现明显的水样变性(电镜,×8 000);f为SAH组12 h时细胞核内异染质增多,细胞核膜皱缩,细胞质密度较前增高(电镜,×8 000);g为SAH组24 h时细胞核膜内陷、染色质固缩边集、细胞质密度增高、内质网明显扩张(电镜,×8 000);h为SAH组48 h时仍可见细胞核内异染质增加,细胞质密度增加(电镜,×8 000);i为SAH组72 h时海马神经元形态大致正常(电镜,×8 000);j为假手术组海马神经元形态饱满,异染质少见,细胞器形态正常(电镜,×8 000)
图2 光镜及电镜下大鼠海马神经元超微结构变化
注:与SAH组比较,aP<0.05;SAH=蛛网膜下腔出血
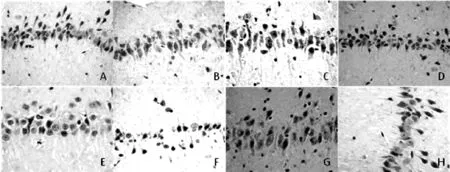
注:A为空白对照组,B为1 h SAH组,C为6 h SAH组,D为12 h SAH组,E为24 h SAH组,F为48 h SAH组,G为72 h SAH组,H为假手术组
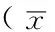
图4 光镜下大鼠海马神经元凋亡细胞(TUNEL染色,×400)
注:与SAH组比较,aP<0.05
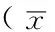
表3 3组大鼠不同时间点神经行为学评分比较±s,分,n=6)
注:与SAH组比较,aP<0.05
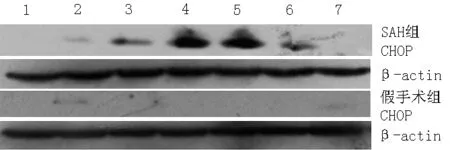
注:1泳道为空白对照组, 2泳道为1 h,3泳道为6 h,4泳道为 12 h,5泳道为24 h, 6泳道为48 h,7泳道为72 h;CHOP=CCAAT/增强子结合蛋白同源蛋白
图3 SAH组和假手术组不同时间点CHOP表达水平电泳图
Figure 3 Electrophoretogram of the expression level of CHOP of SAH group and sham operation group at different time points
2.6 SAH组大鼠CHOP相对表达水平与海马神经元凋亡细胞水平的相关性分析 SAH组CHOP相对表达水平与海马神经元凋亡细胞水平呈正相关(r=0.933,P<0.01)。
3 讨论
影响SAH预后的原因主要有CVS和EBI两个方面[6]。既往学者在CVS上做了大量研究,但患者的预后没有改善[7]。有学者认为,SAH后EBI是SAH患者死亡的首要原因[8]。因此,目前越来越多的研究转向EBI。EBI是一个整体性的概念,其涉及SAH后72 h内脑组织发生的所有病理及生理变化[9],包括颅内压增高、脑血流量减少以及血液流入蛛网膜下腔后对中枢神经系统的直接毒性反应等,这些反应促使早期脑水肿、氧化应激以及脑梗死的发展[10],导致广泛性的细胞凋亡[11],主要包括血-脑脊液屏障、海马和血管内皮细胞等,其损伤程度与SAH后导致的神经行为功能障碍有关。深入研究SAH后EBI的发生发展机制,对于降低SAH致残率和病死率具有重要意义[12]。
笔者既往研究显示,ERS在SAH后的EBI中发挥重要作用[13]。内质网是细胞维持正常生理功能的重要亚细胞器,是分泌蛋白和膜蛋白在细胞内进行折叠、修饰和组装的场所,这些过程是细胞成熟所必需的条件。内质网通过激活未折叠蛋白质反应(unfolded protein response,UPR) 以保护细胞损伤,过强、过久的ERS反应则会诱导细胞凋亡[14]。ERS介导的细胞凋亡是最近几年才被发现的细胞凋亡途径。该凋亡途径共分为3种:CHOP/GADD153通路、Caspase通路、JNK通路。CHOP作为ERS通路中特异性的转录因子,正常情况下很少表达,但持久、过度的应激则会通过UPR引起CHOP的大量激活,调控下游的促凋亡基因Bcx/Bak、抗凋亡基因Bcl-2等,导致细胞凋亡。
本研究通过透射电镜观察发现,SAH组6 h可见明显内质网脱颗粒、扩张,线粒体肿胀、空泡早期凋亡,广泛的细胞水样变性及脑组织间质水肿,提示此时内质网和线粒体的结构与功能受到了一定影响,已存在ERS,神经元也开始出现凋亡前期的表现[15];SAH组24 h海马神经元凋亡变化最为明显,可见细胞核膜内陷、染色质固缩边集、细胞质密度增高、内质网明显扩张,而在72 h海马神经元形态已趋于正常,与王春梅等[16]研究相似。以上提示SAH早期全脑缺血引发了细胞水肿[17-18],随着内质网形态与功能的持续损害,海马神经元逐渐出现凋亡征象,虽未见凋亡小体等凋亡晚期表现,但其染色质的变化已属于凋亡改变,结果与Asher等[19]的研究结果相符合。本研究发现,SAH组大鼠6、12、24、48 h时海马神经元凋亡细胞水平均高于空白对照组和假手术组,且6、12、24、48 h时神经行为学评分均低于空白对照组和假手术组,3组两种指标不同时间点变化一致,说明在SAH后早期海马神经元凋亡导致了神经行为功能障碍。
本研究发现,SAH组大鼠6、12、24、48 h时CHOP相对表达水平均高于空白对照组和假手术组,其余时间点比较无差异,说明CHOP在建模后6 h表达水平开始增加,提示了SAH早期ERS的出现;1 h和72 h CHOP相对表达水平同空白对照组无差别,24 h达到高峰,这与海马神经元凋亡细胞水平变化一致。由此笔者认为,在SAH后24 h,CHOP的表达和细胞凋亡同时达到高峰,说明了SAH后持续的应激导致了内质网功能障碍,从而诱导CHOP大量表达,引起细胞凋亡,但随着时间推移,细胞凋亡情况与行为学评分逐渐恢复,这可能与ERS的保护效应有关。本研究相关性分析显示,CHOP相对表达水平与海马神经元凋亡细胞水平呈正相关,进一步说明了ERS在海马神经元凋亡中所发挥的作用。CHOP的表达升高是ERS的标志,CHOP在ERS和海马神经元凋亡联系中发挥重要作用。
综上所述,SAH后早期发生了ERS,刺激CHOP表达水平增高,从而进一步诱导海马神经元凋亡并造成神经功能障碍,说明CHOP在SAH后EBI的病理过程中发挥了重要作用,这将为今后深入研究CHOP的作用以及寻找针对性的治疗提供理论依据。
本文链接:
异染质:在细胞周期中,间期、早期或中、晚期,某些染色体或染色体的某些部分的固缩常较其他染色质早些或晚些,其染色较深或较浅,具有这种固缩特性的染色体称为异染质。细胞核内异染质增多可看作为细胞凋亡早期的表现。
[1]Sehba FA,Pluta RM,Zhang JH.Metamorphosis of subarachnoid hemorrhage research:from delayed vasospasm to early brain injury[J].Mol Neurobiol,2011,43(1):27-40.
[2]Cahill J,Calvert JW,Zhang JH.Mechanisms of early brain injury after Subarachnoid hemorrhage[J].J Cereb Blood Flow Metab,2006,26(11):1341-1353.
[3]Mehmet H.Caspases find a new place to hide[J].Nature,2000,403 (6765 ):29-30.
[4]Hu YQ,Tang N,Lei LM,et al.Changes of protein kinase-like endoplasmic reficulum kinase and glucose-regulated protein 78 expression in rats after focal ischemic preconditioning[J].Chinese Journal of Neurology,2012,45(1):45-50.(in Chinese) 胡跃强,唐农,雷龙鸣,等.大鼠局灶性脑缺血预处理后蛋白激酶样内质网激酶及葡萄糖调节蛋白78表达的变化[J].中华神经科杂志,2012,45(1):45-50.
[5]Garcia JH,Wagner S,Liu KF,et al.Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats.Statistical validation[J].Stroke,1995,26(4):627-634.
[6]Ciurea AV,Palade C,Voinescu D,et al.Subarachnoid hemorrhage and cerebral vasospasm-Literature review[J].J Med Life,2013,6(2):120-125.
[7]Hou J,Zhang JH.Does prevention of vasospasm in subarachnoid hemorrhage improve clinical outcome? No[J].Stroke,2013,44(6 Suppl 1):S34-36.
[8]Ayer RE,Zhang JH.Oxidative stress in subarachnoid hemorrhage:significance in acute brain injury and vasospasm [J].Acta Neurochir Suppl,2008,104:33-41.
[9]Kusaka G,Ishikawa M,Nanda A,et al.Signaling pathways for early brain injury after subarachnoid hemorrhage[J].J Cereb Blood Flow Metab,2004,24(8):916-925.
[10]Ayer R,Chen W,Sugawara T,et al.Role of gap junctions in early brain injury following subarachnoid hemorrhage[J].Brain Res,2010,1315:150-158.
[11]Sugawara T,Jadhav V,Ayer R,et al.Thrombin inhibition by argatroban ameliorates early brain injury and improves neurological outcomes after experimental subarachnoid hemorrhage in rats[J].Stroke,2009,40(4):1530-1532.
[12]King MD,Laird MD,Ramesh SS,et al.Elucidating novel mechanisms of brain injury following subarachnoid hemorrhage:an emerging role for neuroproteomics [J].Neurosurg Focus,2010,28(1):E10.
[13]Yao JL,Zhao D,Dai J,et al.Research of the gene expression levels of Caspase-12 and neuronal apoptosis in the hippocampus after subarachnoid hemorrhage[J].Chinese Journal of Neurosurgery,2012,28(5):466-470.(in Chinese) 姚俊岭,赵冬,戴晶,等.蛛网膜下腔出血后Caspase-12表达及海马细胞凋亡的研究[J].中华神经外科杂志,2012,28(5):466-470.
[14]Szegezdi E,Logue SE,Gorman AM,et al.Mediators of endoplasmic reticulum Stress induced apoptosis[J].EMBO Rep,2006,7 (9):880.
[15]Zhu YR,Liu ZM.Progress of research on apoptosis[J].Guizhou Journal of Animal Husbandry And Veterinary Medicine,2008,32(1):25-27.(in Chinese) 朱永仁,刘志明.细胞凋亡的研究进展[J].贵州畜牧兽医,2008,32(1):25-27.
[16]王春梅,黄晓峰,杨家骥.细胞超微结构与超微结构病理基础[M].西安:第四医大学出版社,2004:142-143.
[17]Cahill J,Calvert JW,Zhang JH.Mechanisms of early brain injury after subarachnoid hemorrhage[J].J Cereb Blood Flow Metab,2006,26(11):1341-1353.
[18]Ayer R,Zhang J.Connecting the early brain injury of aneurysmal subarachnoid hemorrhage to clinical practice[J].Turk Neurosurg,2010,20(2):159-166.
[19]Asher E,Payne CM,Bernstein C.Evaluation of cell death in EBV-transformed lymphocytes using agarose gel electrophoresis,light microscopy and electron microscopy.Ⅱ.Induction of non-classic apoptosis ("para-apoptosis") by tritiated thymidine[J].Leuk Lymphoma,1995,19(1/2):107-119.
(本文编辑:李婷婷)
Effects of Endoplasmic Reticulum Stress-induced Transcriptional Factor CHOP on Early Brain Injury After Subarachnoid Hemorrhage
HUANGXiao-yuan,ZHAODong,LIUQi,etal.
DepartmentofNeurosurgery,theFirstAffiliatedHospitaloftheMedicalCollege,ShiheziUniversity,Shihezi832000,China
Objective To investigate the effects of endoplasmic reticulum stress factor-induced transcriptional factor CHOP on early brain injury (EBI) after subarachnoid hemorrhage (SAH).Methods A total of 78 healthy male Sprague-Dawley rats were selected and randomly assigned into control group (n=6),sham operation group (n=36) and SAH group (n=36).At 1, 6, 12, 24, 48 and 72 h,we selected 6 rats from both sham operation group and SAH group using simple random sampling method and killed these rats.Comparison was made in the morphological change of hippocampal neurons,the relative expression level of CHOP,the apoptosis level of hippocampal neuron cells and the score of neuroethology observed under light microscope and electron microscope among the three groups at different time points.Results In each group,the relevant expression levels of CHOP at 6,12,24 and 48 h were significantly different (P<0.05).SAH group was higher (P<0.05) than control group and sham operation group in the relative expression level of CHOP at 6,12,24 and 48 h.No significant difference (P>0.05) was noted between control group and sham group in the relevant expression level of CHOP at different time points.In control group and sham operation group,very few apoptotic hippocampal neuron cells were observed;in SAH group,no obvious apoptosis of hippocampal neuron cells was observed at 1 h;in SAH group,the apoptotic hippocampal neuron cells increased at 6 and 12 h than before,and the karyons of some scattered apoptotic hippocampal neuron cells took on the color of sepia;in SAH group,apoptotic hippocampal neuron cells increased notably at 24 h and decreased gradually at 48 h,and a small number of apoptotic hippocampal neuron cells were observed at 72 h.In each group,the apoptosis levels of hippocampal neuron cells at 6,12,24 and 48 h were significantly different (P<0.05).SAH group was higher (P<0.01) than control group and the sham operation group in the apoptosis level of hippocampal neuron cells at 6,12,24 and 48 h.No significant difference (P>0.05) was noted between control group and sham group in the apoptosis level of hippocampal neuron cells at different time points.No significant difference (P>0.05) was noted among the three groups in the score of neuroethology before intervention.In each group,the scores of neuroethology at 6,12,24 and 48 h were significantly different (P<0.05).SAH group was lower (P<0.01) than control group and sham operation group in the score of neuroethology at 6,12,24 and 48 h.No significant difference (P>0.05) was noted between control group and sham group in the score of neuroethology at different time points.In SHA group,the expression level of CHOP was positively correlated with the apoptosis level of hippocampal neuron cells (r=0.933,P<0.01).Conclusion At the early stage following SAH,the expression of CHOP increases,the apoptotic hippocampal neuron cells increase,and the score of neuroethology decreases.It suggests that CHOP plays an important role in cell apoptosis induced by endoplasmic reticulum stress after SAH.
Subarachnoid hemorrhage;Brain injuries;Endoplasmic reticulum stress;CCAAT-enhancer-binding proteins;Vasospasm,intracranial;Apoptosis
国家自然科学基金资助项目(81360186);石河子大学“自然科学与技术创新”资助项目(ZRKXYB-15)
832000新疆石河子市,石河子大学医学院第一附属医院神经外科
王业忠,832000新疆石河子市,石河子大学医学院第一附属医院神经外科;E-mail:Wangyz2008@126.com
R 651.15
A
10.3969/j.issn.1007-9572.2015.24.009
2015-02-21;
2015-06-13)
——疾病防治的新靶标

