枸杞多糖及其硫酸酯体外免疫及抗肿瘤活性*
王君敏,薛敬礼,葛蓓蕾,庄玉伟,杜春燕,薛 昆
1)郑州大学实验动物中心 郑州 450052 2)河南省科学院高新技术研究中心 郑州 450002 3)郑州大学第一附属医院心血管内科 郑州 450052
△女,1984年10月生,博士,副教授,研究方向:多糖硫酸化修饰及活性研究,E-mail:wangjunmin@zzu.edu.cn
枸杞多糖及其硫酸酯体外免疫及抗肿瘤活性*
王君敏1)△,薛敬礼1),葛蓓蕾1),庄玉伟2),杜春燕1),薛昆3)
1)郑州大学实验动物中心 郑州 4500522)河南省科学院高新技术研究中心 郑州 4500023)郑州大学第一附属医院心血管内科 郑州 450052
△女,1984年10月生,博士,副教授,研究方向:多糖硫酸化修饰及活性研究,E-mail:wangjunmin@zzu.edu.cn
关键词硫酸化枸杞多糖;脾淋巴细胞增殖;细胞因子;EC109 细胞;细胞迁移
摘要目的:研究枸杞多糖及其硫酸酯体外免疫和抗肿瘤活性。方法:分别采用水提一步醇沉法和分步醇沉法提取不同的多糖LBPS30、LBPS70和LBPSt,纯化后用氯磺酸-吡啶法修饰得到3种硫酸化枸杞多糖sLBPS30、sLBPS70和sLBPSt。采用MTT法检测多糖对小鼠脾淋巴细胞增殖和食管癌EC109细胞抑制的影响,ELISA法检测细胞上清液中TNF-α、IL-2、IFN-γ和IL-24的含量,划痕法检测细胞迁移情况。结果:sLBPSt和 sLBPS30的淋巴细胞增殖率和不同时间点对EC109细胞的抑制率都较高; sLBPSt组细胞上清液中4种淋巴细胞因子含量均显著高于细胞对照组(P<0.05);sLBPSt组细胞迁移数显著低于其余各组(P<0.05)。结论:硫酸化修饰能显著增强体外脾淋巴细胞增殖,促进淋巴细胞四种细胞因子的分泌,并能抑制EC109细胞生长,降低EC109细胞迁移速率,且与硫酸基含量有一定的关系。sLBPSt和sLBPS30总体效果较好。
AbstractAim: To screen the effective Lycium barbarum polysaccharides(LBPSs) according to researching the effects of immunity and antitumor activity on LBPSs and their sulfates in vitro. Methods: Three types of LBPSs, LBPS30,LBPS70 and LBPSt were extracted by water decoction and stepwise or one-step ethanol precipitation methods and further modified using the chlorosulfonic acid-pyridine method based on previous experiments, yielding three sulfated LBPSs (sLBPSs), sLBPSt, sLBPS30, sLBPS70, respectively. The effects of six polysaccharides spleen lymphocyte proliferation and their antitumor activities against EC109 cells in vitro were evaluated by MTT method. The contents of TNF-α, IL-2, IFN-γ and IL-24 in cell supernatant were determined by ELISA method. Cell migration model was induced by scratch method and the migrating cells were counted to observe the effects of polysaccharides on EC109 cell migration inhibition. Results: The lymphocyte proliferation ratios and inhibition ratio against EC109 of sLBPSt and sLBPS30 group at different time points were higher than those of other groups, the contents of four cytokines of sLBPSt group were significantly higher than those of the control group(P<0.05), the migrating cells of sLBPSt group were also fewer than those of other group(P<0.05). Conclusion: sLBPSs could increase conA-activated lymphopoiesis, promote the secretion of TNF-α, IL-2, IFN-γ and IL-24. Moreover, they could inhibit the EC109 cells′ viability and reduce the rates of tumor cell migration in vitro, indicating that sulfated modification enhanced the immunoregulatory and antitumor activities of LBPSs. sLBPS30 and sLBPSt showed the best performance, could be used as materials for further research.
硫酸化多糖(SPS) 是指含硫酸基团的天然及半合成的酸性多糖,是大分子链中单糖分子的某一羟基被硫酸基取代而形成的多功能生理活性物质,包括从各种动植物中提取分离出来的各种糖复合物,是含硫酸根水溶性的杂多糖[1]。枸杞是我国驰名中外的名贵中药材,药食同源,其药用价值备受历代医家的推崇,在我国传统医学中具有重要的地位。枸杞多糖 (Lycium barbarum polysaccharide,LBP) 是枸杞主要的生物活性物质之一。研究[2]证明枸杞多糖具有增强机体的免疫功能、抑制肿瘤、降血糖、降血脂等多种功能。该实验采用氯磺酸-吡啶法分别对一种总枸杞多糖和两种分级多糖进行硫酸化修饰后,比较硫酸化多糖体外对脾淋巴细胞增殖以及抑制EC109细胞活性的影响,同时筛选出效果较好的多糖,为下一步研究提供理论依据。
1材料与方法
1.1主要试剂及仪器氯磺酸 (上海实验试剂有限公司);吡啶(西陇化工股份有限公司);DMEM培养基(Hyclone 公司),GT-T551(TaKaRa公司),鼠外周血淋巴细胞分离液(天津灏洋生物公司);胎牛血清(美国Gibco公司);MTT、DMSO(美国Sigma公司);RPMI 1640、伴刀豆素球蛋白(ConA)均购自 Hyclone 公司,ConA使用前用RPMI 1640培养液配制;枸杞(禹州凯旋药业)。人食管癌EC109细胞系为郑州大学实验动物中心实验室保存。细胞培养箱(Thermo Scientific 8000),光学显微镜(XDS-1A),倒置拍照显微镜(Leica DMI3000B),低速离心机(上海卢湘仪 TDZ4B-WS),酶标检测仪(Thermo MK3 型),摇床(Qilinbeier TS-1000)。
1.2硫酸化多糖的制备
1.2.1多糖的提取和纯化取枸杞经水煎和一步醇沉得到总枸杞多糖(total LBPS,LBPSt)。将LBPSt稀释成1 g/mL的溶液,用分步醇沉法依次缓慢加入体积分数95%乙醇使乙醇终体积分数分别达30%、50%、70%、80%,得到4个不同的分级多糖,然后分别将醇沉体积分数为30%、70%的分级多糖以及总多糖用Sevage法[3]去蛋白,Sephadex G-150柱过滤,冷冻干燥,得到种纯化的枸杞多糖(LBPS30、LBPS70、LBPSt)。
1.2.2氯磺酸-吡啶法[4]硫酸化修饰多糖将带有搅拌装置和冷凝装置的三颈烧瓶置于冰盐水浴中,加入25 mL预冷的无水吡啶,剧烈搅拌,在40 min内逐滴匀速加入3.125 mL氯磺酸,待烧瓶中出现大量淡黄色固体时终止反应,酯化试剂制备完成备用。精确称取纯化多糖400 mg加入装有酯化试剂的三颈烧瓶中,90 ℃水浴振荡搅拌反应2 h。反应结束后冷却至室温,反应液加入预冷的100 mL冰水中,用饱和NaOH 溶液中和至pH 7.5,之后边搅拌边缓慢加入3倍体积的无水乙醇,静置24 h,离心取沉淀。用自来水流水透析48 h、蒸馏水透析24 h。透析液经冷冻干燥,得到3种硫酸化枸杞多糖sLBPS30、sLBPS70和sLBPSt。超声-酸性铬酸钡分光光度法检测3种硫酸化枸杞多糖中硫酸盐的质量分数分别为542.75、291.71和390.67 mg/g。经红外光谱测定,sLBPSs在1 235 cm-1和812 cm-1有两个特征性吸收峰,证明了硫酸基已经和多糖结合成酯。实验前,将6种多糖按照净含量倍比稀释20、21、22、23、24倍使其质量浓度分别为0.391、0.196、0.098、0.049、0.024 mg/L,常规消毒备用。
1.3多糖体外免疫效果测定
1.3.1多糖对体外小鼠脾淋巴细胞增殖影响的测定以颈椎脱臼法处死小鼠,无菌取出脾脏,置于预先倒入Hanks液的培养皿中,按照200目钢网研磨法制备小鼠单细胞悬液。计数活细胞比例大于95%后,用RPMI 1640培养液调整细胞密度为1×107mL-1,加入到96孔细胞培养板,每孔100 μL,然后每孔加入从高到低不同浓度多糖100 μL,每个样品重复5孔,另设ConA对照组(终浓度为10 mg/L),细胞对照组(CC组,仅加等体积的细胞培养液)。37 ℃、体积分数5% CO2条件下培养48 h。培养结束前4 h,取出加入MTT 30 μL/孔,继续培养4 h后,每孔加入100 μL DMSO,将细胞板置于微量振荡器上振荡混匀5 min使沉淀完全溶解。在570 nm波长处测定吸光值(A570),作为T淋巴细胞增殖的指标。若多糖组A570值显著大于对照组,则表明多糖显著促进T淋巴细胞增殖。同时计算淋巴细胞增殖率。增殖率=(A多糖组-A对照组)/A对照组×100%。
1.3.2ELISA检测外周血淋巴细胞细胞因子的表达肝素抗凝鼠外周血5 mL,常规分离淋巴细胞。活细胞计数后,用培养液调整浓度为1×105mL-1,接种于12孔细胞培养板,每孔1 mL,24 h后离心去上清,对照组加入RPMI 1640,实验组均加入6.25 mg/L的相应药物,500 μL/孔,37 ℃,体积分数5% CO2培养箱内培养。24 h后取上清液1 000 r/min离心20 min,除去杂质及细胞碎片,取上清检测TNF-α、IL-2、IFN-γ和IL-24的含量。严格根据ELISA试剂盒使用说明书进行操作。
1.4多糖体外抗肿瘤效果测定
1.4.1多糖对食管癌EC109细胞增殖的影响EC109细胞常规培养于含体积分数10%胎牛血清的RPMI 1640培养基中,置体积分数5%CO2、37 ℃培养箱孵育,2.5 g/L胰酶消化传代。将对数生长期的EC109细胞密度调整为1×105mL-1,接种于96孔板,每孔100 μL,37 ℃,体积分数5%CO2培养箱内培养24 h。实验组加入用RPMI 1640培养液稀释成不同浓度的多糖,每孔200 μL;同时设单纯细胞对照组
(CC组),每组5个复孔,分别培养24、48、72 h后每孔加入15 μL MTT,继续培养4 h,弃去培养液,每孔加入DMSO 100 μL,室温避光震荡10 min,酶联免疫检测仪检测492 nm波长吸光值(A492)。计算细胞生长抑制率=(1-A多糖组)/A对照组×100%。
1.4.2细胞划痕实验将制备好的EC109细胞接种于6孔板,然后,用200 μL枪头在每个孔板中央轻轻垂直进行“一”字划痕,PBS 缓冲液冲洗细胞表面 3 次。各组(每组3个复孔)分别迅速加入6.25 mg/L的不同药物和淋巴细胞,淋巴细胞对照组(CC组)不加药物,只加入淋巴细胞,空白对照组(BC组)加入等量的GT-T551,每孔2.5 mL,放进细胞培养箱培养24 h后将细胞培养板取出,在相差倒置显微镜下放大100 倍观察细胞迁移情况并拍照,利用 IPP 计数软件计算越过划痕的细胞数。
1.5统计学处理采用SPSS 13.0分析,各组淋巴细胞细胞因子和EC109细胞迁移的差异采用单因素方差分析和SNK-q检验。检验水准α=0.05。
2结果
2.1多糖体外免疫测定结果
2.1.1多糖对淋巴细胞增殖的影响见图1。sLBPSt组的淋巴细胞增殖效果最好,其次为sLBPS30与LBPS30组。
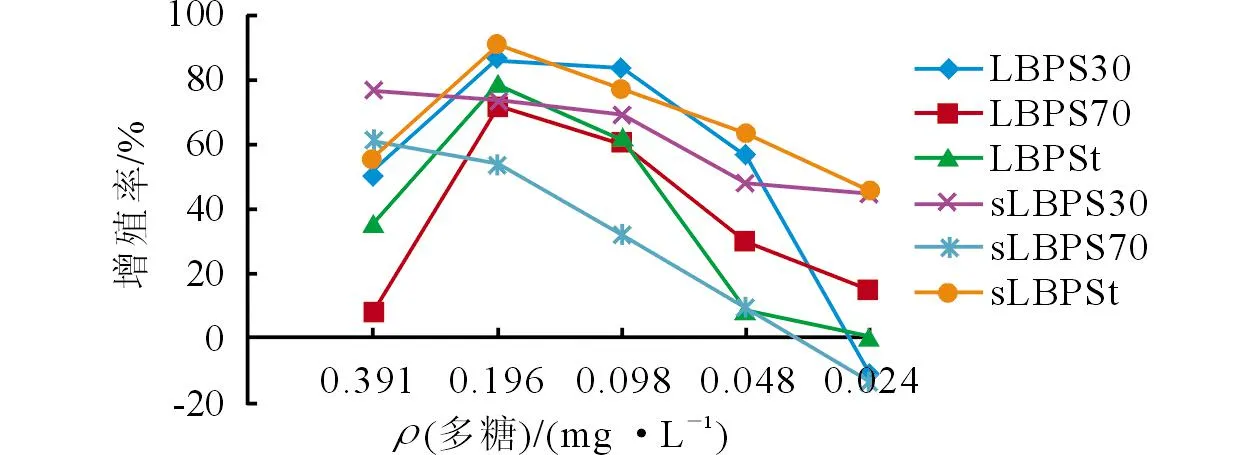
图1 各组脾淋巴细胞的增殖率
2.1.2细胞因子测定结果见表1。
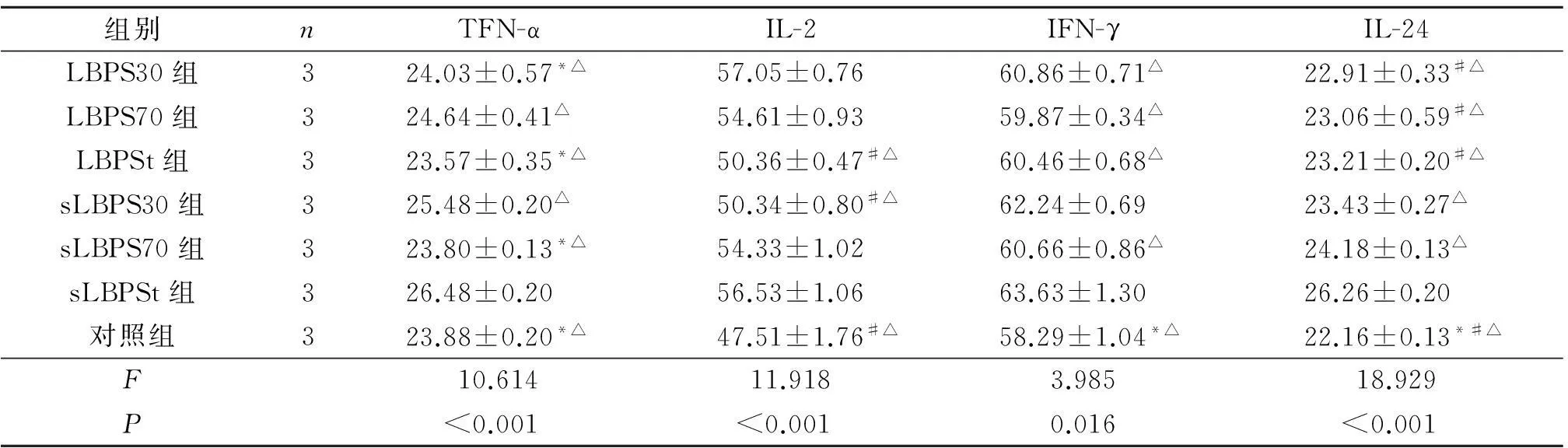
表1 各组细胞因子测定结果 ng·L-1
*:与sLBPS30组比较,P<0.05; #:与sLBPS70组比较,P<0.05;△:与sLBPSt组比较,P<0.05。
2.2多糖体外抗肿瘤效果测定结果
2.2.1多糖作用于EC109细胞24 h后的抑制作用
抑制率结果(图2)显示,sLBPS30的总体平均抑制率最高(26.74%),其次为sLBPSt(24.21%)与LBPS70(23.53%)。

图2 多糖作用24 h后EC109细胞生长抑制率
2.2.2多糖作用于细胞48 h后的抑制效果抑制率结果(图3)显示,除了LBPSt和LBPS30外,其余多糖的抑制率均随着浓度的逐渐增大而升高,其中sLBPSt的总体平均抑制率最高(36.95%),其次为sLBPS30(32.33%)与LBPSt(28.86%)。
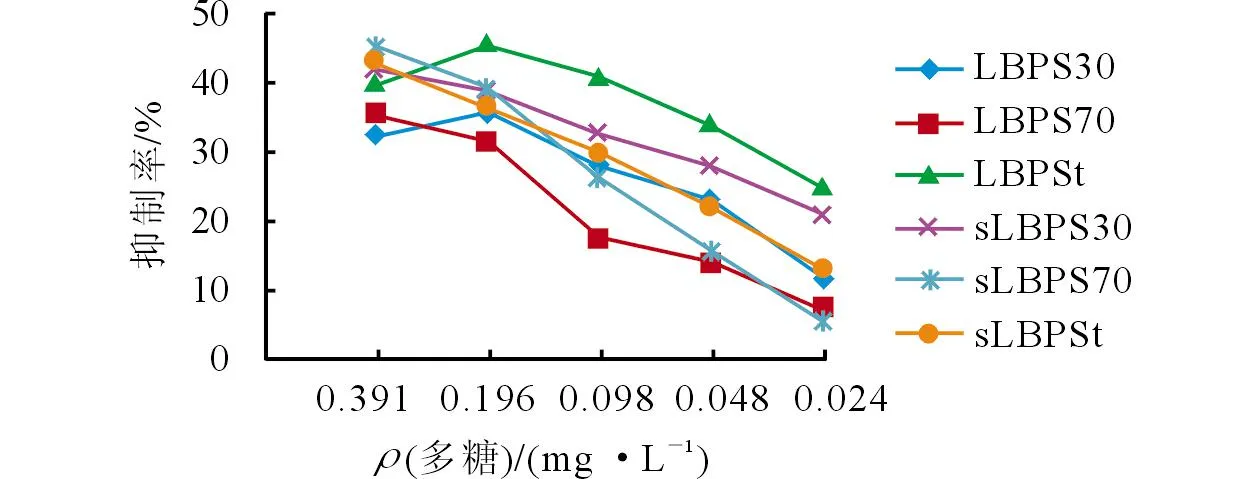
图3 多糖作用48 h后EC109细胞生长抑制率
2.2.3多糖作用于细胞72 h后的抑制效果抑制率结果(图4)显示,除了LBPSt和LBPS30外,其余多糖的抑制率均随着浓度的逐渐增大而升高,其中sLBPS30的总体平均抑制率最高(48.83%),其次为sLBPSt(46.35%)与LBPSt(40.47%)。
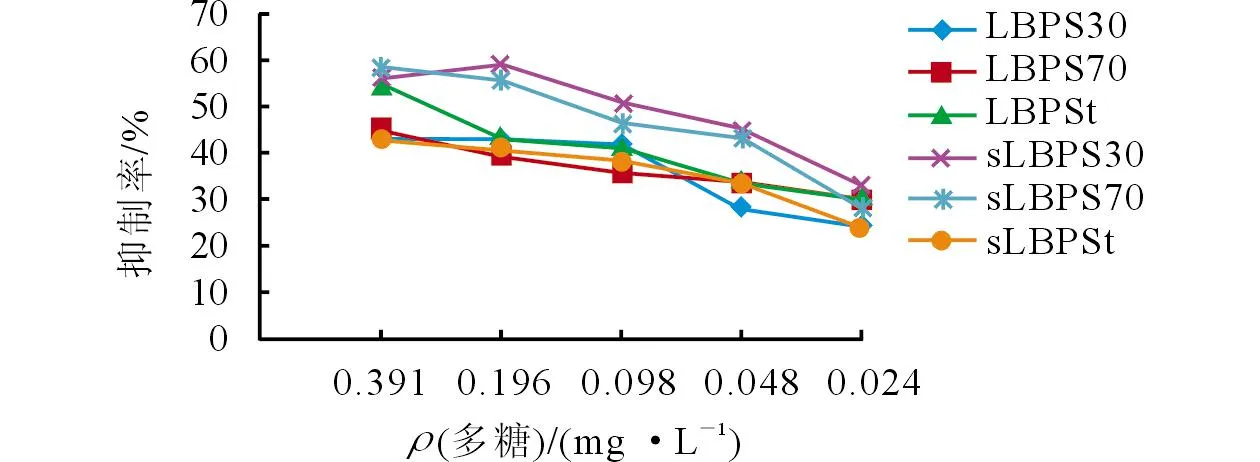
图4 多糖作用72 h后EC109细胞生长抑制率
2.2.4多糖对EC109细胞迁移的影响结果(表2)显示所有枸杞多糖组的细胞迁移数量均小于空白对照组和淋巴细胞对照组(P<0.05),其中细胞迁移数最低的是sLBPSt。

表2 各组EC109细胞迁移数的比较
F=375.171,P<0.001;*:与BC和CC组比较,P<0.05。
3讨论
淋巴细胞增殖实验是在淋巴细胞有丝分裂原ConA刺激下,淋巴细胞的蛋白质及核酸合成增加,体积增大最终转化为具有分裂能力的淋巴母细胞,其增殖反应能力是反映机体细胞免疫功能最直接的指标[5-6]。该体外淋巴细胞增殖实验结果显示,几种枸杞多糖在一定浓度范围内均能显著促进淋巴细胞的增殖反应,其中sLBPSt、sLBPS30的增殖效果最好。
TNF-α、IL-2、 IFN-γ均是生物体内具有免疫调节作用的细胞因子,具有广泛的生物活性,在机体抗肿瘤免疫中起着重要的作用,尤其与肿瘤的发生、发展与转移具有密切关系,不仅能够在一定程度上间接反映肿瘤的生长状况,同时也参与了与肿瘤相关的免疫调节活动,直接或间接发挥抗肿瘤作用[7-9]。IL-24是最近发现的、具有细胞因子样特性的肿瘤抑制基因,经研究证实它不但能选择性地抑制多种肿瘤生长、诱导凋亡,还能抑制肿瘤血管形成、抑制肿瘤转移,而且还不会影响正常细胞[10-11]。ELISA实验结果表明6.25 mg/L的各多糖组4种抗肿瘤因子的含量均大于细胞对照组,其中sLBPSt能对淋巴细胞的TNF-α、IL-2、 IFN-γ、IL-24分泌可以达到明显的促进作用,sLBPS30对TNF-α、IFN-γ、IL-24分泌促进作用明显。说明这两种硫酸化多糖能够通过较好的诱导细胞因子的分泌加强机体免疫。
细胞增殖失控是恶性肿瘤重要的生物学特征。该实验研究结果表明不同浓度的各多糖对EC109细胞作用不同时间后,细胞受到不同程度的抑制,且具有一定的时效和量效关系,相关性分析显示
EC109细胞抑制率与药物浓度及作用时间呈显著正相关性。枸杞多糖硫酸化后抗肿瘤效果活性明显增强,其中sLBPS30和sLBPSt在不同时间段的抑制率都比较高,即抑制EC109细胞增殖效果较好。以往的研究[12]也证实枸杞多糖硫酸化后能显著提高脾淋巴细胞增殖,提高机体的抗体效价。肿瘤细胞的运动能力对于肿瘤转移来说至关重要,该研究发现各多糖组均能够显著降低肿瘤细胞迁移速率,抑制肿瘤细胞扩散。其中sLBPSt迁移细胞数量最小,表明其抑制细胞增殖和迁移能力最强,促进细胞凋亡效果最明显。
硫酸化多糖的性质不仅与硫酸根的含量有关,还有相对分子质量、结构有一定的关系。研究[13]表明,多糖硫酸酯的生物活性与其取代度在一定范围内呈正相关。以上实验结果显示,sLBPS30硫酸基含量最高,其次为sLBPSt。sLBPSt和sLBPS30具有较明显的体外增强免疫和抗肿瘤活性,sLBPS70则效果不显著,可能与其硫酸基含量较低有直接关系。sLBPSt的综合效果优于sLBPS30,可能与相对分子质量和一级结构有关,具体还需要进行下一步研究。
以上结果表明,硫酸化修饰能显著增强枸杞多糖体外的增强免疫和抗肿瘤活性。3个硫酸化枸杞多糖相比,sLBPSt和sLBPS30组的效果优于sLBPS70,可以作为下一步研究的材料。
参考文献
[1]罗佳捷,张彬,王洁,等.硫酸化多糖的研究进展[J].饲料博览,2012(12):12
[2]Lu SP,Zhao PT.Chemical characterization of Lycium barbarum polysaccharides and their reducing myocardial injury in ischemia/reperfusion of rat heart[J].Int J Biol Macromol,2010,47(5):681
[3]Yi P,Li N,Wan JB,et al.Structural characterization and antioxidant activity of a heteropolysaccharide from Ganoderma capense[J].Carbohydr Polym,2015,121:183
[4]Liu C,Chen J,Li E,et al.The comparison of antioxidative and hepatoprotective activities of codonopsis pilosula polysaccharide(CP) and sulfated CP[J].Int Immunopharmacol,2015,24(2):299
[5]谭建蓉,李文桂,覃婷.日本血吸虫重组Bb(pGEX-Sj32)疫苗诱导BALB/c鼠脾细胞增殖、亚群及细胞因子的动态变化[J].南方医科大学学报,2015,35(2):202
[6]汤海玲,范丽梅.多发性骨髓瘤小鼠注射重组鼠源促红细胞生成素后对免疫功能的影响[J].西安交通大学学报:医学版,2015,36(4):487
[7]Durairaj H,Steury MD,Parameswaran N.Paroxetine differentially modulates LPS-induced TNFα and IL-6 production in mouse macrophages[J].Int Immunopharmacol,2015,25(2):485
[8]Mouzaki A,Panagoulias I,Raptis G,et al.Cord blood leptin levels of healthy neonates are associated with IFN-γ production by cord blood T-cells[J].PLoS One,2012,7(7):e40830
[9]宋海珠,罗荣城,姜波.肿瘤基因治疗的研究进展和展望[J].解放军医学杂志,2002,27(7):651
[10]郑鹏生,顾婷婷. MDA-7/IL-24:肿瘤基因治疗的新武器[J].西安交通大学学报:医学版,2010,31(5):651
[11]马群风,江红, 刘锟,等. mda-7/IL-24腺病毒对小细胞肺癌NCI-H446细胞增殖的抑制作用研究[J].解放军医学杂志,2006,31(7):679
[12]Wang J,Hu Y,Wang D,et al.Sulfated modification can enhance the immune-enhancing activity of lycium barbarum polysaccharides[J].Cell Immunol,2010,263(2):219
[13]成伟华,付国平,赵改红,等.生物大分子的硫酸化修饰及其生物活性的研究进展[J].天然产物研究与开发,2012,24(10):1486
*河南省科技攻关计划项目2011020054
Immunomodulatory and antitumor activities of Lycium barbarum polysaccharides in vitro and their sulfates
WANGJunmin1),XUEJingli1),GEBeilei1),ZHUANGYuwei2),DUChunyan1),XUEKun3)
1)LaboratoryAnimalCenter,ZhengzhouUniversity,Zhengzhou4500522)High&NewTechnologyResearchCenterofHenanAcademyofSciences,Zhengzhou4500023)DepartmentofCardiology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
Key wordssulfated Lycium barbarum polysaccharides; spleen lymphocyte proliferation; cytokine; EC109 cell; cell migration
doi:10.13705/j.issn.1671-6825.2015.06.021
中图分类号R927