α硫辛酸对阿尔茨海默病模型大鼠海马区PKA-CREB信号通路的影响
杨丽萍,凌书建,张国华,王珊(邯郸市中心医院,河北邯郸05600;河北医科大学第二医院)
α硫辛酸对阿尔茨海默病模型大鼠海马区PKA-CREB信号通路的影响
杨丽萍1,凌书建1,张国华2,王珊2
(1邯郸市中心医院,河北邯郸056001;2河北医科大学第二医院)
摘要:目的探讨α硫辛酸对Aβ1-42所致阿尔茨海默病模型大鼠海马区PKA-CREB信号通路的影响。方法24只雄性SD大鼠按随机数字表分为正常对照组、假手术组、模型组和硫辛酸组各6只。模型组和硫辛酸组采用双侧海马一次性注射Aβ1-42的方法建立AD模型。各组均采用Morris水迷宫行定位航行试验和空间探索试验,检测记忆能力(逃避潜伏期)及学习能力(跨越平台次数);采用Western blotting法检测海马组织中蛋白激酶A(PKA)Ⅱα与p-CREB蛋白。结果与模型组比较,α硫辛酸组、对照组及假手术组逃避潜伏期明显延长、跨越平台次数明显减少(P均<0.01);海马区组织PKAⅡα、p-CREB蛋白表达明显升高(P均<0.01)。其中α硫辛酸组海马区组织PKAⅡα、p-CREB蛋白相对表达分别为0.739±0.417和0.380±0.329,明显高于模型组0.520± 0.462、0.219±0.452,P均<0.01。结论α硫辛酸能够明显提高AD大鼠的学习记忆和空间探索能力;其机制可能为活化PKA-CREB信号通路,提高PKAⅡα、p-CREB蛋白表达。
关键词:阿尔茨海默病;蛋白激酶A; cAMP反应元件结合蛋白;α硫辛酸;大鼠
阿尔茨海默病(AD)是目前神经退行性疾病及痴呆的最常见原因,其发病机制仍不明确。AD特征性的病理改变是在大脑皮质和海马区域的细胞外出现以β-淀粉样蛋白(Aβ)为核心的老年斑、细胞内神经原纤维缠结以及选择性的神经元缺失。α硫辛酸(α-LA)是一种独特的氧化-还原双向的氧化应激强效抑制剂,主要通过清除自由基,螯合金属离子,再生其他抗氧化剂和修复氧化损伤而发挥抗氧化作用[1]。2012年2月~2013年1月,我们观察了α硫辛酸对AD模型大鼠海马组织蛋白激酶A(PKA)、cAMP反应元件结合蛋白(CREB)表达的影响,探讨α硫辛酸的脑保护作用及其机制,为其临床治疗AD提供可能的理论依据。
1 材料与方法
1.1材料健康雄性SD大鼠24只,4个月龄,体质量(200±34)g,由河北医科大学基础医学院动物实验中心提供,饲养于标准实验环境中,自由摄取饮食。大鼠立体定位仪(日本东京成茂科学器械研究所),水迷宫(北京新天地公司),红外线扫描仪(Odyssey Li-cor Gene公司),Aβ1-42(Sigma公司),PKA Ⅱα试剂盒(Santa公司),p-CREB试剂盒(CS T公司),α硫辛酸(Sigma公司)。
1.2模型制作与干预按随机数字表将24只大鼠分为正常对照组、假手术组、模型组和α硫辛酸组各6只。行水迷宫训练3天后,模型组和α硫辛酸组制作AD模型[2]: 10%水合氯醛(300mg/kg)腹腔注射麻醉。将大鼠固定于脑立体定位仪上,选择双侧海马CA1区为注射靶区,于前囟向后4.5mm,中线旁开2mm处,钻开颅骨,暴露硬脑膜,微量注射器自脑表面垂直进针2mm,将5 μL聚集态1 μg/ μL Aβ1-42溶液缓慢注入,留针10min,使Aβ1-42充分浸润局部组织,缓慢撤针,用骨蜡封闭颅骨创口,缝合切口。正常对照组不予处理,假手术组注入等体积生理盐水。造模后24 h,α硫辛酸组腹腔注射α硫辛酸100mg/(kg·d),正常对照组、假手术组、模型组腹腔注射等体积生理盐水,1次/d,共21天。
1.3相关指标观察
1.3.1学习记忆能力测试药物干预后各组均采用Morris水迷宫行定位航行试验和空间探索试验[2]。①定位航行试验:将大鼠面向池壁分别从四个入水点放入水中,2min内寻找到平台的时间即为逃避潜伏期。若2min内未找到平台,则用手牵引帮助其至平台上并停留10 s,其逃避潜伏期为2min。每次训练间隔60 s,连续测试5天,每天上下午各2次。②空间探索试验:测试第6天撤除平台,将大鼠从入水点放入水中,记录其2min内穿越原来平台位置的次数。
1.3.2海马组织PKAⅡα、p-CREB蛋白表达检测
采用Western blotting法。学习记忆能力测试后麻醉大鼠迅速断头取脑,分离出海马组织(冰上操作),立即置液氮中保存。取50mg海马组织,转移到离心管中,加入裂解液500 μL,蛋白磷酸酶抑制剂混合物5 μL,采用超声匀浆器破碎组织;离心,取上清作为待分析的样品。用BCA法[3]测定蛋白浓度。取含60 μg蛋白质的样品经12% SDS-聚丙烯酰胺凝胶电泳分离后,电转到PVDF膜,室温封闭1 h,与PKAⅡα、p-CREB抗体进行杂交,4℃过夜,用TBST洗膜3次,与二抗辣根酶标记的羊抗兔IgG和GAPDH进行杂交,避光置于摇床,室温下孵育1 h,TBST洗二抗,4次,应用Odyssey双色红外激光成像系统检测PKAⅡα和p-CREB蛋白表达。
1.4统计学方法采用SPSS13.0统计软件。计量资料检验正态分布后,以珋x±s表示,多组间的比较采用单因素方差分析,组间比较用SNK检验。P<0.05为差异有统计学意义。
2 结果
2.1各组学习记忆能力
2.1.1定位航行试验模型组逃避潜伏期第1~5天下降不明显,余各组均有明显下降趋势。模型组逃避潜伏期明显长于正常对照组及假手术组(P<0.01),且随着训练天数的增加,这种差异表现得更为明显;α硫辛酸组逃避潜伏期明显短于模型组,但均高于正常对照组与假手术组(P均<0.01);假手术组与正常对照组避潜伏期比较,差异无统计学意义(P>0.05);见表1。
表1 各组逃避潜伏期比较(s,)

表1 各组逃避潜伏期比较(s,)
注:与假手术组及正常对照组比较,*P<0.01;与模型组比较,#P<0.01。
组别 n 第1天 第2天 第3天 第4天 第5天正常对照组 6 69.92±3.97 60.67±1.50 50.83±3.54 41.25±3.08 30.92±3.68假手术组 6 71.75±3.19 63.33±4.76 53.17±3.93 42.50±3.71 30.42±2.47模型组 6 80.67±4.48* 78.92±4.08* 77.83±3.01* 77.00±3.52* 76.08±3.94*α硫辛酸组 6 75.67±3.96* # 72.08±3.40* # 66.08±3.18* # 60.75±3.16* # 51.50±4.29*#
2.1.2空间探索试验正常对照组、假手术组、模型组、α硫辛酸组2min内跨越平台的次数分别为(16.25±3.48)次、(14.75±2.99)次、(5.88± 1.83)次和(9.54±3.09)次,模型组跨越平台的次数明显少于假手术组及正常对照组(P<0.01),α硫辛酸组跨越平台次数明显多于模型组,但少于少于假手术组及正常对照组(P均<0.01)。
2.2各组海马组织PKAⅡα、p-CREB蛋白表达与正常对照组和假手术组比较,模型组海马组织PKAⅡα、p-CREB蛋白表达明显降低(P均<0.01);与模型组比较,α硫辛酸组海马组织PKAⅡα、p-CREB蛋白表达明显增多(P均<0.01)。见表2、图1、图2。
表2 各组海马组织PKAⅡα和p-CREB蛋白表达比较(相对表达量,)

表2 各组海马组织PKAⅡα和p-CREB蛋白表达比较(相对表达量,)
注:与正常对照组及假手术组比较,*P<0.01;与模型组比较,#P<0.01。
组别 n PKAⅡαp-CREB正常对照组6 0.910±0.263 0.523±0.526假手术组 6 0.898±0.279 0.503±0.267模型组 6 0.520±0.462* 0.219±0.452*α硫辛酸组 6 0.739±0.417* # 0.380±0.330*#
3 讨论
研究证实,Aβ沉积于细胞外所致的神经毒性作用是AD形成和发展的关键因素[3]。Aβ导致的炎症反应和氧化应激及诱发神经细胞变性和凋亡是AD患者认知机能障碍的主要原因[4]。采用Morris水迷宫行为学方法,测定各组学习记忆能力。模型组平均逃避潜伏期明显长于假手术组及正常对照组,跨越平台次数明显减少,提示大鼠出现显著的学习和记忆功能障碍。
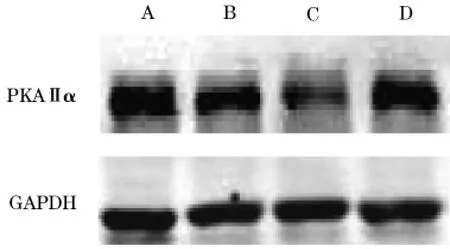
图1 各组海马组织PKAⅡα蛋白表达
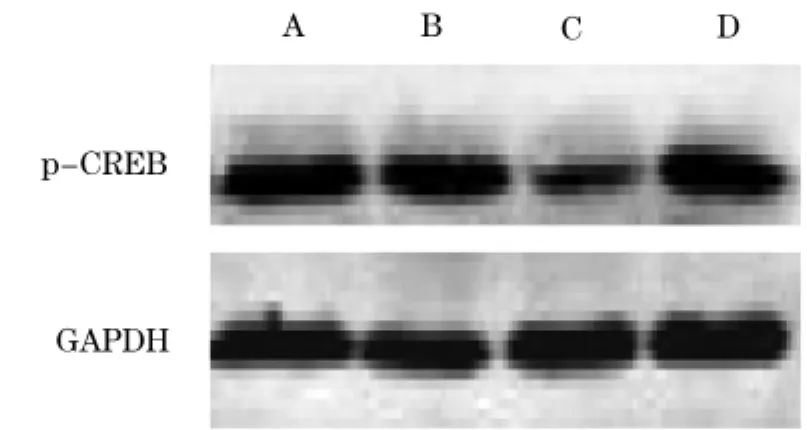
图2 各组海马组织p-CREB蛋白表达
CREB是多种蛋白激酶的磷酸化底物。因其能刺激基因转录,故又称为“转录增强因子”。PKA是
最早被确认,也是最重要的蛋白激酶。研究发现,长时性记忆需要新蛋白质的合成[5],而PKA-CREB信号通路在新蛋白质的合成过程中发挥重要作用[6]。其中CREB的活化是学习记忆的分子标志,能够促进长时性记忆的形成[7~9]。活化的PKA能够使CREB的Ser133磷酸化,从而引起其分子构像的变化,刺激了CREB调节转录的活性,促进学习记忆基因被大量转录,并进一步影响促进与学习记忆相关的新蛋白质合成。在这些新蛋白质中包括大量与长时性记忆相关的因子,如脑源性神经营养因子、即刻早期基因产物c-Fos、神经营养因子、Bcl-2蛋白等,均参与学习记忆的形成和维持。实验证明,Aβ能够抑制腺苷酸环化酶的活化,使细胞内cAMP水平降低,致使PKA失活,最终使CREB不能磷酸化而抑制LTM的形成[10]。Takeo等[11]报道PKA抑制剂的使用可明显阻碍长期记忆的形成。本研究结果显示,模型组海马PKAⅡα及p-CREB蛋白表达水平明显低于正常对照组和假手术组,提示其海马PKACREB信号转导通路的活动受抑制,损害了大鼠的记忆学习能力。
许多学者认为,氧化应激在AD发生的过程中起重要作用,研究显示Aβ可诱导神经细胞生产氧自由基,认为Aβ的神经毒作用部分是由自由基介导的[12]。α硫辛酸是已知天然抗氧化剂中效果最强的,被誉为“万能抗氧化剂”。α硫辛酸的抗氧化性主要表现在清除活性氧自由基、螯合金属离子、再生内源性抗氧化剂及修复氧化损伤细胞等方面。Kenjiro等[13]研究发现,α硫辛酸能够在体外能抑制Aβ蛋白聚集,减少Aβ的形成,还能够使已经聚集的Aβ降解。魏文青等[14]对β淀粉样蛋白诱导的PC12细胞的研究也表明,α硫辛酸可拮抗Aβ1-42诱导的细胞损伤,对神经细胞具有一定的保护作用。对一些转基因AD模型大鼠的研究也表明,大鼠α硫辛酸干预后学习和记忆能力明显增强[15]。本研究结果显示,与模型组比较,α硫辛酸组学习记忆能力明显好于模型组,海马组织PKAⅡα、p-CREB蛋白水平表达明显高于模型组,证实α硫辛酸的神经保护作用确切,其作用可能是通过PKA-CREB信号通路的活化来实现的。
综上所述,α硫辛酸能够抑制Aβ对海马神经细胞的损害,提高AD模型大鼠的学习记忆能力。其作用机制可能是上调PKA、CREB的表达。
参考文献:
[1]Smith AR,Shenvi SV,Widlanskym,et al.Lipoic acid as a potential therapy for chronicdisease associated with oxidative stress [J].Currmed Chem,2004,11(9): 1135-1146.
[2]Giovannelli L,Casamenti F,Scali C,et al.Differential effects of amyloid peptides beta-(1-40)and beta-(25-35)injections into the rat nucleus basalis[J].Neuroscience,1995,66(4): 781-792.
[3]Bayer TA,Wirths O,Majtenyik,et al.Key factors in Alzheimer'sdisease: beta-amyloid precursor protein processing,metabolism and intraneuronaltransport[J].Brain Pathol,2003,11(1): 1-5.
[4]刘辉,陈俊抛,田时雨,等.Aβ1-40海马注射对大鼠脑内一氧化氮合酶表达的影响[J].中华神经科杂志,2001,34(2): 92-95.
[5]Cooke SF,Bliss TV.The genetic enhancement ofmemory[J].Cellmol Life Sci,2003,60(1): 1-5.
[6]Nguyen PV,Woo NH.Regulation of hippocampal synaptic plasticity by cyclic AMP-dependent protein kinases[J].Neurobiology,2003,71(6): 401-437.
[7]Brightwell JJ,Smith CA,Countryman RA,et al.Hippocampal over expression ofmutant creb blocks long-term,but not short-termmemory for a socially acquired food preference[J].Learnmem,2005,12(1): 12-17.
[8]Brightwell JJ,Smith CA,Neve RL,et al.Long-termmemory for Place learning is facilitated by expression of cAMP response element-binding protein in thedorsal hippocampus[J].Learnmem,2007,14(3): 195-199.
[9]Countryman RA,Gold PE.Rapid forgetting of social transmission of food preferences in aged rats: Relationship to hippocampal CREB activation[J].Learnmem,2007,14(5): 350-358.
[10]Vitolo OV,Sant-Angelo A,Costanzo V,et al.Amyloid beta-peptide inhibition of the PKA/CREB pathway and long-term potentiation: reversibility bydrugs that enhance AMP signaling[J].Proc Natl Acad Sci USA,2002,99(20): 13217-13221.
[11]Takeo S,Niimuram,Miyake-Takagi K,et al.A possiblemechanism for improvement by a cognition-enchanter nefiracetam of spatialmemory function and cAMP-mediated signal transduction system in sustained cerebral ischaernia in rat[J].Br J Pharmacol,2003,138(4): 642-654.
[12]Gella A,Durany N.Oxidative stress in Alzheimerdisease[J].Cell Adhmigr,2009,3(1): 88-93.
[13]Kenjiro O,Mie H,Masahito Y.Alpha-lipoic acid exhibits antiamyloid fibrils in vitro[J].BBRC,2006,341(4): 1046-1052.
[14]魏文青,刘晶,张艳,等.α硫辛酸对β淀粉样蛋白诱导的PC12细胞损伤的保护作用[J].中国新药杂志,2009,18(21): 2065-2067.
[15]Farr SA,Price TO,Banks WA,et al.Effect of Alpha-lipoic acid onmemory,oxidation,and lifespan in SAMP8mice[J].J Alzheimersdis,2012,32(2): 447-455.
·临床研究·
收稿日期:( 2014-12-29)
文章编号:1002-266X(2015)36-0029-03
文献标志码:A
中图分类号:R741
doi:10.3969/j.issn.1002-266X.2015.36.010

