褪黑素联合顺铂、甲氨蝶呤对骨肉瘤SaOS- 2细胞增殖的影响
王亚鹏,杨志平
山东大学 齐鲁医院骨科,济南 250012
褪黑素联合顺铂、甲氨蝶呤对骨肉瘤SaOS- 2细胞增殖的影响
王亚鹏,杨志平
山东大学齐鲁医院骨科,济南 250012
摘要:目的探讨褪黑素(Mel)联合顺铂(DDP)、甲氨蝶呤(MTX)对骨肉瘤细胞系SaOS- 2增殖的影响,以及Mel与DDP、MTX是否具有协同抗肿瘤作用。方法Mel、DDP、MTX、Mel+DDP、Mel+MTX作用于SaOS- 2细胞后,CCK- 8法检测药物对细胞活性的影响,应用Compusyn软件分析药物的合并效应,流式细胞术分析细胞周期分布及细胞凋亡率。结果与对照组相比,Mel、DDP、MTX单独均能显著降低SaOS- 2细胞活性(P均<0.05),且呈剂量-效应关系。与单用DDP或MTX相比,Mel与DDP或MTX联合应用能显著降低SaOS- 2细胞的活性(P均<0.05)。1 mmol/L的Mel与6.67、16.67、33.33、66.66 μmol/L 的DDP合用时,联合用药指数(CI)分别为1.18、1.21、1.09、0.84,与0.1、0.5、1、2、4 mmol/L MTX合用后,CI分别为0.88、0.88、0.83、0.78、0.81。与对照组相比,Mel组与Mel+MTX组的G1期细胞比例显著增多(P均<0.05),S期细胞比例显著减少(P均<0.05);MTX组的S期细胞比例显著增多(P均<0.05)。药物作用组的细胞凋亡率均显著高于对照组(P均<0.05),联合用药组的细胞凋亡率显著高于单药组(P均<0.05)。结论Mel在体外能抑制SaOS- 2细胞的活性,阻滞细胞周期于G1期,诱导凋亡,发挥抗肿瘤效应,与较低浓度DDP呈拮抗效应,而与MTX、较高浓度DDP联合应用时呈协同抗肿瘤效应。
关键词:骨肉瘤;褪黑素;顺铂;甲氨蝶呤
ActaAcadMedSin,2015,37(2):215-220
骨肉瘤是好发于青少年的骨原发性恶性肿瘤。以顺铂(cis-platinum,DDP)、大剂量甲氨蝶呤为主的新辅助化疗能提高骨肉瘤患者的生存率,但是化疗药物的毒副作用、化疗耐药以及患者的化疗依从性限制了骨肉瘤的治疗效果。研究证实,作为一种肿瘤化疗的辅助用药,褪黑素(melatonin,Mel)不仅能减少骨肉瘤化疗的副作用[1- 2],还能降低肿瘤化疗的耐药发生率[1- 3],提高患者化疗依从性[4- 6]。Mel不仅能直接杀伤骨肉瘤细胞,而且使细胞周期阻滞于G1期[7],诱导细胞凋亡。DDP属于重金属盐类,是非特异性细胞周期药物,DDP分子中的Pt与DNA络合后,诱导细胞凋亡。二氢叶酸还原酶抑制剂甲氨蝶呤(methotrexate,MTX)能阻滞细胞周期,抑制肿瘤细胞增殖,诱导细胞凋亡,理论上Mel与DDP和MTX联用时应该具有协同抗肿瘤作用。本研究将Mel、DDP、MTX单独或联合作用于骨肉瘤SaOS- 2细胞,比较细胞活性、细胞周期分布和凋亡率的变化,并采用Compusyn软件分析药物的合并效应,旨在研究Mel与DDP、MTX是否具有协同抗肿瘤作用,为Mel作为骨肉瘤化疗的辅助用药提供依据。
材料和方法
细胞培养及传代人成骨肉瘤细胞株SaOS- 2购自中国科学院上海细胞库。细胞培养于含10%胎牛血清(Hyclone公司,USA)的McCOY’s 5A培养基(Gibco公司,美国),置于湿度饱和、含5% CO2、37 ℃培养箱中培养,贴壁生长,每周传代2次,按1∶2或1∶3传代。
CCK- 8检测细胞增殖将细胞按2×103/孔密度接种于96孔板,待细胞贴壁后更换含药物的培养基。Mel购自大连美仑生物技术公司,溶解于无水乙醇,终浓度<1%;DDP购自山东省齐鲁制药有限公司,溶解于0.9% NaCl溶液,使用时用培养基至少稀释100倍;MTX购自江苏恒瑞制药股份有限公司,溶解于0.9% NaCl溶液,使用时用培养基至少稀释12.5倍。
分组如下:(1)以培养基为对照组,以Mel(0.5、1、2、4、5 mmol/L)、DDP(3.33、6.67、16.67、33.33、66.66 μmol/L)、MTX(0.1、0.5、1、2、4 mmol/L)为实验组,每组设3个复孔,药物分别作用24、48 h后,加入CCK- 8,避光孵育4 h,上机检测490 nm波长的光密度(optical density,OD)值。CCK- 8细胞增殖及细胞毒性检测试剂盒购自上海贝博公司。(2)以培养基为对照组,以Mel(1 mmol/L)+DDP(3.33、6.67、16.67、33.33、66.66 μmol/L)、Mel(1 mmol/L)+MTX(0.1、0.5、1、2、4 mmol/L)为实验组,每组设3个复孔,孵育细胞48 h后检测OD值。计算细胞活性(%)=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%。采用Compusyn软件分析合并用药效应,联合用药指数(combination index,CI)<1为协同效应,CI=1为相加效应,CI>1为拮抗效应[8]。
细胞周期和凋亡测定以培养基为对照组,以Mel(1 mmol/L)、DDP(16.67 μmol/L)、MTX(0.5 mmol/L),Mel(1 mmol/L)+DDP(16.67 μmol/L)、Mel(1 mmol/L)+MTX(0.5 mmol/L)为实验组,每组3个复孔。取对数生长期的细胞消化离心后,制备细胞悬液,以3×106/孔接种于6孔板,过夜后弃培养基,加入含药物的培养基,培养48 h后收集细胞,按试剂盒说明书检测细胞周期和凋亡。碘化丙锭单染法检测细胞周期分布;Annexin V-FITC和碘化丙锭双染法检测细胞凋亡,细胞凋亡率=(FITC标记细胞数/总细胞数)×100%。细胞周期检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒均购自上海贝博公司。
统计学处理采用SPSS 20.0软件进行统计学分析。计量资料用均数±标准差表示,采用方差分析进行组间均数比较。P<0.05为差异有统计学意义。
结果
药物对细胞活性的影响对照组的细胞活性为100%。与对照组相比,Mel显著降低SaOS- 2细胞活性(P均<0.01);当Mel的浓度大于2 mmol/L时,Mel作用48 h的SaOS- 2细胞活性显著低于Mel作用24 h的细胞(P均<0.01)(图1A)。
与对照组比较,3.33 μmol/L的DDP作用48 h后,细胞活性无改变(P>0.05),其他浓度的DDP单独作用或与1 mmol/L Mel联合使用均能显著降低SaOS- 2细胞活性(P均<0.01)。1 mmol/L的Mel与6.67、16.67、33.33、66.66 μmol/L 的DDP合并用药时,CI分别为1.18、1.21、1.09、0.84,表明Mel与较低浓度DDP呈拮抗效应,与较高浓度的DDP(66.66 μmol/L)时呈协同效应(图1B)。
MTX作用于SaOS- 2细胞48 h后,细胞活性显著降低(P均<0.05)。Mel与MTX联合应用能显著降低SaOS- 2细胞的活性(P均<0.05)。1 mmol/L Mel与0.1、0.5、1、2、4 mmol/L MTX联合用药后,CI分别为0.88、0.88、0.83、0.78、0.81,表明Mel能促进MTX的抗肿瘤效应(图1C)。
药物对细胞周期分布和细胞凋亡的影响与对照组比较,Mel组与Mel+MTX组的G1期细胞比例显著增多(P均<0.05),S期细胞比例减少(P均<0.05);MTX组的S期细胞比例增多(P均<0.05)。DDP组和Mel+DDP组的G1期和S期细胞比例与对照组比较差异无统计学意义(P均>0.05);各实验组的G2期细胞比例与对照组比较差异无统计学意义(P均>0.05)。即Mel能够阻滞细胞于G1期,MTX能阻滞细胞于S期,而DDP对细胞周期无影响(图2)。
Mel、DDP、MTX、Mel+DDP、Mel+MTX孵育骨肉瘤SaOS- 2细胞48 h后,细胞凋亡率分别为(16.38±0.21)%、(18.54±1.16)%、(17.77±1.36)%、(39.49±1.75)%、(37.77±2.64)%(图3)。与对照组(3.97±0.02)%相比,各实验组的细胞凋亡率显著提高(P均<0.05)。Mel+DDP、Mel+MTX组分别与对应单药组Mel、DDP、MTX比较,细胞凋亡率显著提高(P均<0.05)。
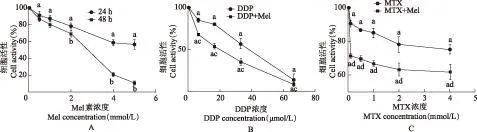
Mel:褪黑素;DDP:顺铂;MTX:甲氨蝶呤;对照组的细胞活性为100%;与对照组比较,aP<0.01;与药物作用24 h组比较,bP<0.01;与DDP组比较,cP<0.05;与MTX组比较,dP<0.05
Mel:melatonin;DDP:cis-platinum;MTX:methotrexate;the cell activities of SaOS- 2 in the control group were 100%;aP<0.01 compared with the control group;bP<0.01 compared with the cell activities of SaOS- 2 treated by Mel for 24 hours;cP<0.05 compared with the DDP group;dP<0.05 compared with the MTX group
A.Mel分别作用SaOS- 2细胞24、48 h的细胞活性;B.DDP处理SaOS- 2细胞48 h后的细胞活性;C.MTX处理SaOS- 2细胞48 h后的细胞活性
A.the cell activities of SaOS- 2 treated by Mel for 24 and 48 hours,respectively;B.the cell activities of SaOS- 2 treated by DDP for 48 hours;C.the cell activities of SaOS- 2 treated by MTX for 48 hours
图 1药物作用后SaOS- 2细胞活性的比较
Fig 1Comparisons of cell activities of SaOS- 2 treated with drugs

图 2药物作用 48 h后SaOS- 2细胞周期分布
Fig 2Cell cycle distribution of SaOS- 2 cells treated by the three drugs alone or in combination for 48 hours
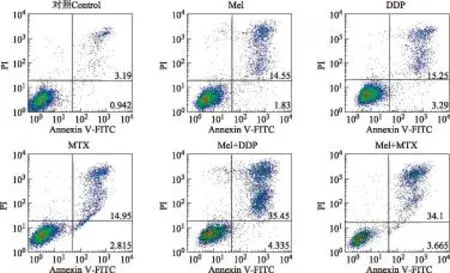
PI:碘化丙锭;Annexin V-FITC:;磷脂酰丝氨酸蛋白抗体-异硫氰酸荧光素
PI:propidium iodide;Annexin V-FITC:Annexin V-fluorescein isothiocyanat
图 3流式细胞术检测药物作用 48 h对SaOS- 2细胞凋亡的影响
Fig 3Apoptosis of SaOS- 2 cells treated by the three drugs alone or in combination for 48 hours
讨论
有研究表明Mel能诱导多种肿瘤细胞凋亡[9- 14]。另有研究显示,骨肉瘤组织中Mel受体MT1的表达明显提高,且与肿瘤细胞是否转移成正相关[15]。研究显示低于0.01 mmol/L浓度的Mel对骨肉瘤细胞系MG- 63的增殖无影响[16],0.25~1 mmol/L的Mel能不同程度地抑制骨肉瘤细胞增殖[17]。Liu等[7]的研究进一步验证了Mel对骨肉瘤MG- 63细胞增殖的影响呈剂量—效应关系。本研究显示,0.5、1、2、4、5 mmol/L浓度的Mel作用SaOS- 2细胞24、48 h后,细胞的增殖均受到抑制,且呈时间—剂量—效应关系。
Casado-Zapico等[18]研究显示高浓度Mel主要通过抑制细胞增殖和细胞毒性效应发挥抗肿瘤作用,抑制细胞增殖的可能机制是调节细胞周期,细胞毒性效应的可能机制是启动外源性或内源性细胞凋亡通路。本研究显示SaOS- 2细胞在与Mel共孵育48 h后,G1期细胞的比例显著增多,S期细胞的比例显著减少,细胞凋亡率显著增加。提示Mel可能通过下调与G1/S期细胞相关的周期蛋白细胞周期素D1和细胞周期素依赖激酶 4[7],阻滞细胞于G1期;同时上调P53、细胞色素C等外源性凋亡通路相关蛋白,下调Bcl2等[19],诱导细胞凋亡。
Mel还与许多化疗药物具有协同抗肿瘤作用。Mel通过去磷酸化串联灭活ERK/p90RSK/HSP27途径,增强DDP对卵巢癌SK-OV- 3细胞系的凋亡作用[17]。Mel通过上调Caspase- 3、Caspase- 8、Caspase- 9表达,激活外源性细胞凋亡途径,增强长春新碱、异环磷酰胺对尤文肉瘤SK-N-MC细胞的杀伤作用[18]。本研究1 mmol/L的Mel分别与6.67、16.67、33.33的DDP联合应用时,SaOS- 2细胞的活性显著低于DDP单独作用的细胞(P均<0.05),然而二者的抗肿瘤作用呈拮抗效应(CI>1),这可能与Mel[20]清除了DDP产生的一部分自由基[21],削弱了DDP对肿瘤细胞的杀伤作用有关。Mel与66.66 μmol/L 的DDP联合用药时,二者呈现协同抗肿瘤效应,提示联合应用Mel与DDP时要考虑二者的浓度关系。由于DDP对细胞周期无明显调节作用,主要通过启动外源性或内源性凋亡途径直接发挥肿瘤细胞杀伤作用[22],因此,Mel与DDP联合用药组的细胞周期分布与对照组差异无统计学意义,而细胞凋亡率较对照组显著增高。本研究显示Mel与MTX联用组SaOS- 2细胞的活性较MTX单药作用细胞显著下降(P<0.05),细胞凋亡率显著提高(P<0.05),二者具有协同抗肿瘤效应(CI<1),这可能与Mel阻滞细胞于G1期,MTX阻滞细胞于S期,二者的细胞周期阻滞作用相互叠加,同时Mel发挥细胞毒性效应杀伤肿瘤细胞有关。
综上,Mel在体外能抑制SaOS- 2细胞的活性,阻滞细胞周期于G1期,诱导凋亡,发挥抗肿瘤效应,与较低浓度DDP呈拮抗效应,而与MTX、较高浓度DDP联合应用时呈协同抗肿瘤效应。
参考文献
[1]Berk L,Berkey B,Rich T,et al. Randomized phase Ⅱ trial of high-dose melatonin and radiation therapy for RPA class 2 patients with brain metastases(RTOG 0119)[J].Int J Radiat Oncol Biol Phys,2007,68(3):852- 857.
[2]Di Bella G,Mascia F,Ricchi A,et al. Evaluation of the safety and efficacy of the first-line treatment with somatostatin combined with melatonin,retinoids,vitamin D3,and low doses of cyclophosphamide in 20 cases of breast cancer:a preliminary report [J].Neuro Endocrinol Lett,2013,34(7):660- 668.
[3]Schernhammer ES,Giobbie-Hurder A,Gantman K,et al. A randomized controlled trial of oral melatonin supplementation and breast cancer biomarkers [J].Cancer Causes Control,2012,23(4):609- 616.
[4]Tan DX,Poeggeler B,Reiter RJ,et al. The pineal hormone melatonin inhibits DNA-adduct formation induced by the chemical carcinogen safroleinvivo[J].Cancer Lett,1993,70(1- 2):65- 71.
[5]Espino J,Bejarano I,Paredes SD,et al. Protective effect of melatonin against human leukocyte apoptosis induced by intracellular calcium overload:relation with its antioxidant actions [J].J Pineal Res,2011,51(2):195- 206.
[6]Yu Q,Miller SC,Osmond DG.Melatonin inhibits apoptosis during early B-cell development in mouse bone marrow [J].J Pineal Res,2000,29(2):86- 93.
[7]Liu L,Xu Y,Reiter RJ.Melatonin inhibits the proliferation of human osteosarcoma cell line MG- 63 [J].Bone,2013,55(2):432- 438.
[8]Chou TC.Drug combination studies and their synergy quantification using the Chou-Talalay Method [J].Cancer Res,2010,70(2):440- 446.
[9]Garcia-Santos G,Antolin I,Herrera F,et al. Melatonin induces apoptosis in human neuroblastoma cancer cells [J].J Pineal Res,2006,41(2):130- 135.
[10]García-Santos G,Martin V,Rodríguez-Blanco J,et al. Fas/Fas ligand regulation mediates cell death in human Ewing’s sarcoma cells treated with melatonin[J].Br J Cancer,2012,106(7):1288- 1296.
[11]Winczyk K,Pawlikowski M,Karasek M.Melatonin and RZR/ROR receptor ligand CGP52608 induce apoptosis in the murine colonic cancer [J].J Pineal Res,2001,31(2):179- 182.
[12]Carbajo-Pescador S,Steinmetz C,Kashyap A,et al. Melatonin induces transcriptional regulation of Bim by FoxO3a in HepG2 cells [J].Br J Cancer,2012,108(2):442- 449.
[13]Joo SS,Yoo Y.Melatonin induces apoptotic death in LNCaP cells via p38 and JNK pathways:therapeutic implications for prostate cancer [J].J Pineal Res,2009,47(1):8- 14.
[14]Gonzalez A,Del Castillo-Vaquero A,Miro-Moran A,et al. Melatonin reduces pancreatic tumor cell viability by altering mitochondrial physiology [J].J Pineal Res,2011,50(3):250- 260.
[15]段康颖,杨志平.褪黑素受体MT1在骨肉瘤患者中的表达及临床意义 [J].医学与哲学,2011,32(5):57- 58.
[16]Panzer A,Lottering ML,Bianchi P,et al. Melatonin has no effect on the growth,morphology or cell cycle of human breast cancer(MCF- 7),cervical cancer(HeLa),osteosarcoma(MG- 63)or lymphoblastoid(TK6)cells [J].Cancer Lett,1998,122(1- 2):17- 23.
[17]Kim J,Jeong S,Kim B,et al. Melatonin synergistically enhances cisplatin-induced apoptosis via the dephosphorylation of ERK/p90 ribosomal S6 kinase/heat shock protein27 in SK-OV- 3 cells [J].J Pineal Res,2012,52(2):244- 252.
[18]Casado-Zapico S,Rodriguez-Blanco J,Garcã A-Santos G,et al. Synergistic antitumor effect of melatonin with several chemotherapeutic drugs on human Ewing sarcoma cancer cells:potentiation of the extrinsic apoptotic pathway [J].J Pineal Res,2010,48(1):72- 80.
[19]Cheng Y,Cai L,Jiang P,et al. SIRT1 inhibition by melatonin exerts antitumor activity in human osteosarcoma cells[J].Eur J Pharmacol,2013,715(1- 3):219- 229.
[20]Tan DX,Reiter RJ,Manchester LC,et al. Chemical and physical properties and potential mechanisms:melatonin as a broad spectrum antioxidant and free radical scavenger[J].Curr Top Med Chem,2002,2(2):181- 197.
[21]Baliga R,Zhang Z,Baliga M,et al.Invitroandinvivoevidence suggesting a role for iron in cisplatin-induced nephrotoxicity [J].Kidney Int,1998,53(2):394- 401.
[22]Ormerod MG,Orr RM,Peacock JH.The role of apoptosis in cell killing by cisplatin:a flow cytometric study [J].Br J Cancer,1994,69(1):93- 100.
DOI:10.3881/j.issn.1000- 503X.2015.02.013
Effects of Melatonin Combined with Cis-platinum or Methotrexate on the Proliferation of Osteosarcoma Cell Line SaOS- 2
WANG Ya-peng,YANG Zhi-ping
Department of Osteology,Qilu Hospital of Shandong University,Jinan 250012,China
Corresponding author:YANG Zhi-pingTel:13505412856,E-mail:yzpyzp@163.com
ABSTRACT:ObjectiveTo evaluate the effects of melatonin(Mel)combined with cis-platinum(DDP)or methotrexate(MTX)on the proliferation of osteosarcoma cell line SaOS- 2,and to explore whether Mel combined with DDP or MTX could play a synergistic antitumor effect.MethodsSaOS- 2 was treated with Mel alone or Mel combined with DDP or MTX.Cell counting kit- 8 assay was used to measure the cell activities.Combination index(CI)value was used to evaluate the combined effects:CI<1 indicating synergetic effect,CI=1 additive,and CI>1 antagonistic.Flow cytometry was used to analyze cell cycle distribution and cell apoptosis.ResultsAfter treated with Mel(0.5,1,2,4,5 mmol/L),DDP(6.67,16.67,33.33,66.66 μmol/L)or MTX(0.1,0.5,1,2,4 mmol/L)alone,SaOS- 2 cell activities decreased in a dose-dependent manner(allP<0.05).The activities of SaOS- 2 cell treated with both Mel(1 mmol/L)and DDP or MTX were significantly lower than that of DDP or MTX alone(allP<0.05).CI values of cells exposed to 1 mmol/L Mel plus 6.67,16.67,33.33,and 66.66 μmol/L DDP were 1.18,1.21,1.09,and 0.84,respectively,and CI values of cells exposed to 1 mmol/L Mel plus 0.1,0.5,1,2,and 4 mmol/L MTX were 0.88,0.88,0.83,0.78,and 0.81,respectively.The G1-stage cells were increased and the S-stage cells were reduced when the cells were treated with Mel(1 mmol/L)alone or combined with MTX(0.5 mmol/L)(P<0.05).The S-stage cells were increased when the cells treated with MTX(0.5 mmol/L)(P<0.05).The apoptotic cells were increased when they treated with Mel(1 mmol/L)alone or combined with DDP(16.67 μmol/L)or MTX(0.5 mmol/L)(P<0.05).When the cells were treated with Mel combined with DDP or MTX,the apoptotic cells were more than that of DDP or Mel alone(P<0.05).ConclusionsMel can inhibit SaOS- 2 cells activity,block the cell cycle at G1-stage,and induce apoptosis.Mel has an antagonistic effect with lower concentration of DDP but a synergistic effect with MTX or higher concentration of DDP.
Key words:osteosarcoma;melatonin;cis-platinum;methotrexate
(收稿日期:2014- 09- 12)
中图分类号:R738.1
文献标志码:A
文章编号:1000- 503X(2015)02- 0215- 06
通信作者:杨志平电话:13505412856,电子邮件:yzpyzp@163.com

