Accutase和胰蛋白酶消化传代对人胚纹状体来源神经干细胞凋亡的影响
李 婷,李 晨,张翠英,赵 杰
1长治医学院生理学教研室,山西长治 046000
2中南大学 湘雅医学院病理生理学系,长沙 410008
3中南大学 湘雅医院神经外科,长沙 410008
Accutase和胰蛋白酶消化传代对人胚纹状体来源神经干细胞凋亡的影响
李婷1,2,李晨1,张翠英1,赵杰3
1长治医学院生理学教研室,山西长治 046000
2中南大学湘雅医学院病理生理学系,长沙 410008
3中南大学湘雅医院神经外科,长沙 410008
赵杰电话:0731- 84327039,电子邮件:steelzj@126.com
摘要:目的探讨Accutase和胰蛋白酶消化神经干细胞(NSCs)后对其凋亡过程的影响。方法来自人类12~16周自然流产胚胎纹状体组织,分离并体外培养NSCs,将体外培养的第3~5代神经球,分别用胰蛋白酶、Accutase消化,消化过程中仅振荡打散,避免巴斯德吸管反复吹打。将神经球打散成的单细胞悬液接种。用Annexin V/碘化丙啶染色、Hoechst 33342活细胞染色镜下观察等方法,在培养传代后2和24 h时间点检测神经干细胞凋亡率。结果两种酶消化后立即用台盼蓝染色判断细胞活性,Accutase消化后活细胞比例为(91.65±4.43)%,胰蛋白酶仅有(83.10±6.76)%,二者比较差异有统计学意义(P<0.05)。体外培养的第3~5代人胚纹状体NSCs形成的神经球传代后2 h,Accutase和胰蛋白酶传代的细胞凋亡率差异有统计学意义(P<0.01),而到24 h时间点,Accutase消化的细胞凋亡率经Annexin V/碘化丙啶、Hoechst 33342活细胞染色两种方法检测已经达到50%,而胰蛋白酶消化后的细胞凋亡率在此时间点维持在15%~20%。Accutase消化后的NSCs生长4 d后,克隆形成率和神经球直径分别为(7.83±1.32)%和(43.5±9.76)μm,均显著低于胰蛋白酶传代组的(19.22±3.66)%和(58.4±18.73)μm(P<0.01)。结论虽然台盼蓝染色显示Accutase消化神经球后的细胞存活比胰蛋白酶更多,但消化后24 h内,Accutase消化的细胞凋亡率显著升高,最终神经球新克隆形成率低,直径更小。胰蛋白酶消化振荡打散神经球后的凋亡率较Accutase具有明显优势;神经球消化后台盼蓝即时染色的结果不足以预示后期NSCs凋亡率。
关键词:神经干细胞;神经球;Accutase;胰蛋白酶;凋亡
DOI:10.3881/j.issn.1000- 503X.2015.02.009
Effect of Accutase or Trypsin Dissociation on the Apoptosis of Human Striatum-derived Neural Stem Cells
LI Ting1,2,LI Chen1,ZHANG Cui-ying1,ZHAO Jie3
ActaAcadMedSin,2015,37(2):185-194
神经干细胞(neural stem cells,NSCs)的维持对于神经系统发育的正常进行至关重要。哺乳动物成年后,仅在海马齿状回和室管膜下区能够检测到神经干细胞,这些NSCs的维持与认知等高级神经活动以及嗅觉的产生等有关[1- 3]。另有研究表明,体外利用神经干细胞可以分化为多种神经细胞的特性,通过在患者体内进行神经干细胞移植,具有治疗神经退行性疾病等多种神经系统疾病的潜力[4- 7]。在研究各种基因对神经干细胞增殖、分化等生命活动影响过程中,不可避免地涉及NSCs传代培养的问题,目前常用的有剪切传代[8],或者用Accutase[9]、胰蛋白酶传代的方法。剪切传代过程需要将细胞置于无液体的环境中,容易增加污染危险,而且无法得到单个细胞,不利于进行转基因等操作。新的消化酶Accutase因为传代后用台盼蓝染色发现存活细胞显著高于胰蛋白酶传代,所以近年来Accutase 消化逐渐成为NSCs消化传代的主要方法[10]。笔者在前期实验中发现,人类神经干细胞体外培养的自我更新率,即形成新的神经球的比率,通常小于10%,不能成球生长的细胞必然在培养液中凋亡并逐渐死亡,显然NSCs传代后台盼蓝染色的高存活率没有预示出随后发生的细胞凋亡和死亡过程的程度,很有可能在传代后的一段时间里,较大量的NSCs经历了凋亡、死亡的过程。而且,Accutase和胰蛋白酶传代对NSCs凋亡过程的影响也需要进一步了解,此外,目前对于人类NSCs体外生长过程中的凋亡状况缺乏详细的实验观察。常用的检测细胞凋亡的方法,例如Annexin Ⅴ/碘化丙啶(propidium iodide,PI),Hoechst 33342等应用于NSCs凋亡的特点也未深入研究过。本研究通过体外培养人类胚胎纹状体来源的NSCs形成神经球,并分别用Accutase和胰蛋白酶将神经球打散成单细胞后传代培养,观察不同时间点的NSCs凋亡,从而探讨不同酶消化神经干细胞对其凋亡过程的影响。
材料和方法
材料细胞培养试剂DMEM/F12、DMEM、胎牛血清、牛血清白蛋白、N2、双抗(青链霉素)、消化用酶Accutase、胰蛋白酶以及培养板铺底的层黏连蛋白等购自美国Life technoloty公司。碱性成纤维细胞生长因子、表皮生长因子购自美国R&D 公司。铺板用多聚鸟氨酸购自Sigma公司。巢蛋白、Sox- 2抗体购自美国R&D公司。β-Ⅲ型微管蛋白(β-Ⅲ-tubulin,Tuj- 1),神经胶质酸性蛋白(glial fibrillary acidic protein,GFAP)抗体购自美国Promega公司。Annexin V、Hoechst 33342和PI染色试剂盒购自美国B & D公司。
神经干细胞培养和鉴定取12~16周自然流产的新鲜人胚胎(由长治医学院附属和平医院产科提供,经长治医学院医学伦理委员会批准,获患方签署知情同意书),无菌操作下取出纹状体,在Hank’s平衡盐溶液中漂洗掉血迹。剪碎后用巴斯德管轻轻吹打2~3次,于75 μm孔径滤网过滤,去除组织块和细胞团等,制成单细胞悬液,经台盼蓝染色镜下计数活细胞,按(0.5~1)×105/cm2密度接种于细胞培养皿中培养,用于NSCs的培养液成分包括:DMEM/F12+B27+20 ng/ml碱性成纤维细胞生长因子+20 ng/ml表皮生长因子+左旋谷氨酰胺+双抗[10]。原代培养2~3 d后会有大量聚集而成的细胞团,第1、2次传代采用剪切和巴斯德管吹打的机械方法,第2次传代后调整细胞密度为(2~4)×104/cm2,置于37 ℃,5% CO2环境中培养,每2天半量换液。为进行染色鉴定,将传代后培养3 d的神经球移至预先用20 μg/ml多聚鸟氨酸和20 μg/ml层黏连蛋白包被过的24孔板中。用NSCs细胞培养基继续培养。培养7 d,进行神经干细胞巢蛋白,Sox- 2特异性标志物检测。一抗分别为抗人巢蛋白IgG(1∶400)、Sox- 2 IgG(1∶400)。40倍荧光显微镜下于6~9个点摄像计数,取其平均值。计数后计算巢蛋白、Sox- 2阳性细胞占全部细胞的百分数。
酶消化过程消化需要达到的标准是尽量打散神经球获得单细胞,同时尽量避免消化对细胞的损伤。预实验显示,0.25%胰蛋白酶的破坏力较强,甚至少于1 min的时间就会导致多量细胞死亡;而Accutase是一种消化能力较弱的酶,对其进行稀释不利于其消化作用。所以本研究使用0.05%胰蛋白酶和所购Accutase 原液。对于培养时间较长,例如超过1周的致密神经球,无论胰蛋白酶还是Accutase通过8~10 min的消化经常还会剩余部分未被打散的细胞团,对于分析结果不利。研究中采用第3~5代,传代后3~4 d的神经球,此时新神经球明显形成,但不是非常致密,易于被胰蛋白酶或者Accutase分散开。由空调控制的23~25 ℃室温情况下,收集神经球,离心去掉培养基,PBS洗1遍。加胰蛋白酶或者Accutase后,在振荡器上间断涡旋震荡,0.05%胰蛋白酶需要3~5 min、Accutase通常需要5~7 min可分散神经球。一旦无肉眼可见的神经球,立即加5倍体积完全培养基,离心去除含酶的消化液。
凋亡检测凋亡检测时间点为传代后第2、24小时。在预实验中显示神经球打散后的凋亡进展速度较快,在传代后次日即达到50%。选择传代后2 h用来代表酶消化后早期的状况,选择24 h的原因在于呈现较多表现为核质浓缩、甚至碎裂的凋亡中后期的细胞,并整体上展示凋亡细胞数量和严重程度上的进展。
Annexin V/PI染色:第3代NSCs形成的神经球传代4 d后经Accutase或胰蛋白酶打散后贴壁培养,细胞密度5×104/cm2,于2、24 h立即进行Annexin V和PI染色测定。具体操作过程按照试剂盒的要求简述如下,弃去培养液。用孵育缓冲液洗涤1次,加入结合有异硫氰酸荧光素(fluorescein isothiocyanate,FITC)的Annexin V染液和PI染液室温下避光孵育10 min,期间轻柔震荡混匀。染色完成后不可洗涤,在1 h内直接用488 nm波长为激发光,于515 nm波长检测FITC荧光。
Hoechst 33342 活细胞染色:第3代NSCs形成的神经球经Accutase或胰蛋白酶打散后贴壁培养,细胞密度5×104/cm2,于2、24 h立即进行Hoechst 33342染色测定。贴壁细胞用1 mg/ml Hoechst 33342室温作用10 min,荧光显微镜下观察并计数凋亡率,或称凋亡指数。每个样本随机观察10~20个视野进行计数。凋亡指数=凋亡细胞数/细胞总数×100%。
细胞的克隆形成数和新生神经球的直径检测传代后新神经球形成率和新神经球直径可以代表原神经球中具有克隆形成能力的NSCs的数量和增殖能力。本研究用这些定量数据检测Accutase 和胰蛋白酶消化对NSCs的影响[11]。将两种酶消化传代后的NSCs以相同的密度(3000/孔)分别接种于96孔板中,培养1周后,在100倍显微镜下计数每个孔内形成的新克隆总数,新克隆以细胞数≥8个为标准。将96孔板底面划分为9个面积近似的区域,每个区域随机取1个视野并照相,用图像分析软件测量图像中新生神经球的直径。比较两种酶消化后的神经干细胞在克隆形成率和新生神经球直径方面的区别。
细胞分化观察两种酶消化后第4天,将无血清培养的神经干细胞球接种到铺有20 μg/ml层黏连蛋白和20 μg/ml多聚鸟氨酸的24 孔培养板上,使其贴壁。加入分化培养基DMEM/F12+B27+1%胎牛血清+谷氨酰胺,连续培养14 d,每2天半量换液。分化完成后进行神经元标志物Tuj- 1、神经胶质细胞标志物GFAP的免疫荧光染色。取神经球周围放射状的单层细胞区中间部分进行计数,40倍荧光显微镜下于6~9个点照相计数,取其平均值。计数后计算GFAP、Tuj- 1阳性细胞占全部细胞的百分数。
统计学处理采用SPSS 13.0统计软件,对两组实验数据进行配对样本t检验,实验均重复3次,实验数据以均数±标准差表示。P<0.05为差异有统计学意义。
结果
NSCs的体外培养和鉴定结果人胚胎纹状体NSCs在无血清培养基中原代培养2~3 d,即有“神经球” 形成。神经球较松散、形态不规则,大小不一,不排除由多个细胞聚集而成,还不是严格意义上的单克隆神经球。神经球的周围有散在的单个细胞(图1A)。随着神经球不断增大,当其直径达200~300 μm时,用剪切法传代。从第3代开始用Accutase或胰蛋白酶传代,传代后细胞生长良好,代谢较快,约3 d后即可重新长成球形,即可进行再次传代,随着传代次数的增加,神经球变得致密,周边散在的单个细胞,随着换液而逐渐减少(图1B)。每次传代后都有多量细胞不能形成新的神经球,Accutase消化的NSCs形成新的克隆的形成率只有6%~8%。这在对NSCs进行染色鉴定或分化前的贴壁培养时更加明显,贴壁的NSCs呈现扁平和梭形倾向,周围可见明显的圆形单个细胞(图1C)。对培养的NSCs的免疫荧光染色验证显示,培养细胞高表达NSCs的标志抗原巢蛋白(图1D、1E、1F)和Sox- 2(图1G、1H、1I),巢蛋白和Sox- 2的阳性细胞数均>95%。
传代2 h后的凋亡检测结果神经球被酶消化后即时进行台盼蓝检测,结果显示Accutase消化后的细胞大于(91.65±4.43)%的都是拒染的活细胞,而胰蛋白酶消化后的细胞只有(83.10±6.76)%是拒染的,二者差异具有统计学意义(P<0.05)。Accutase消化传代后2 h,正常细胞为圆形,体积较大(图2A),直径达到(16.3±2.4)μm,不被Annexin V/PI 着色,Hoechst 33342染色为弱蓝色(图2B)。作为凋亡的标志物,Annexin V FITC绿色和Hoechst 33342高蓝只要具有其中之一,就是凋亡细胞。在传代后2 h检测到具有Hoechst 33342/PI 染色的凋亡NSCs,其直径为(8.72±1.43)μm,比正常细胞显著缩小。此时的凋亡细胞表现为Annexin V 阳性(图2C),或者Hoechst 33342高蓝色和PI低红色(图2B、2D)。Annexin V染色和Hoechst 33342以及PI的红色均可有重叠,但并非所有Annexin V染色均和Hoechst 33342染色重叠(图2B~2H),Annexin V染色和PI重合(图2H),但未和Hoechst 33342染色重叠(图2F)。用胰蛋白酶消化的神经球,在消化后2 h可以明显看到细胞形态更完整(图2I、2M),部分细胞碎裂后释出的DNA在Hoechst 33342 染色下形成的拖尾痕迹(图2J),说明消化过程中有较多的细胞死亡,这一现象和用胰蛋白酶消化后台盼蓝染色显示的死亡细胞较多相吻合。胰蛋白酶消化的神经球形成的单细胞,Annexin V着色的细胞染色较浅(图2K)和Hoechst 33342、PI的染色不完全重叠(图2N、2P);PI的染色也较弱(图2L),但PI和Hoechst 33342的高蓝色重叠形成双标记(图2L、2O)。此时间点神经球经过Accutase 消化后,通过计数显示,Annexin V染色阳性的细胞为细胞总数的(23.75±5.21)%,以Hoechst 33342/PI 染色确定的凋亡率为(28.63±6.24)%,二种方法的检测结果差异无统计学意义。经过胰蛋白酶消化Annexin V染色和Hoechst 33342染色计数出的凋亡率为(11.53±3.63)%和(9.35±2.26)%,二种方法的检测结果差异无统计学意义。无论用何种凋亡鉴定方法,Accutase 消化后的凋亡率都显著高于胰蛋白酶(P<0.01)。

NSCs:神经干细胞;DAPI:4,6-联脒- 2-苯基吲哚
NSCs:neural stem cells;DAPI:diamidino-phenyl-indole
A.悬浮培养的第2代的神经球;B.长时间培养的神经球;C.传代后贴壁培养的神经干细胞;D.神经球的巢蛋白染色;E.同一视野的细胞核DAPI染色;F.D和E的合并图;G.贴壁生长的神经干细胞Sox- 2染色;H.同一视野光镜下的NSCs;I.G和H合并图显示培养的NSCs为Sox- 2 阳性
A.neurospheres of passage 2 in suspension culture;B.with the elongation of culture time,the single cells around the spheres become less and less;C.the NSCs were cultured adherently after passaging;D.identification of neurospheres by nestin staining;E.DAPI staining of the same view-field;F.merged image of D and E;G.the Sox- 2 staining of the adherently cultured neurospheres;H.phase contrast of NSCs at the same view-field;I.merged image of G and H
图 1NSCs的体外培养和鉴定
Fig 1Invitroculture and identification of NSCs
传代24 h后的凋亡检测结果随着传代后时间的延长,用Accutase消化的NSCs的凋亡率明显增加,到24 h达到50%~60%。表现为部分细胞形态开始皱缩(图3A),Hoechst 33342 染成高蓝色的细胞核也比正常细胞核缩小(图3B)。和传代后2 h比较,Annexin V 染色更加明显(图3C),同时,PI活细胞染色的红色也更加显著(图3D)。从Hoechst 33342和光镜的合并图可以看出,Accutase消化后的绝大多数的细胞核染色都可以和光镜中的细胞轮廓相对应(图3E)。但是少数细胞没有明确的细胞核染色(图3E、3F、3I、3K),这些细胞在相应的Annexin V染色中显示绿色,但是在PI的染色中未着色,说明这些细胞的细胞核结构已经破坏,虽然可以看到细胞轮廓,但是已经开始崩解,Annexin V染到的是尚未完全碎裂的细胞膜结构,这些细胞已经不是通常意义上的凋亡细胞(图3F),而应当归入死亡并开始碎裂的细胞范围内,所以在凋亡细胞计数中未计算在内。此外,Hoechst 33342的亮蓝色和 Annexin V携带FITC荧光(图3F)以及和PI的红色荧光的重合率达到了98%(图3G)。与传代后2 h两种酶消化过的NSCs形态相似不同,在传代后24 h,胰蛋白酶消化的NSCs细胞形态维持正常的数量比Accutase消化组更多(图3I)。Hoechst 33342染色低蓝色(图3J)、Annexin V阴性(图3K),是本研究界定的正常细胞。Annexin V阳性和/或Hoechst 33342染色后为高蓝色的细胞仍是凋亡细胞(图3J),细胞核碎裂为多瓣(图3J),Annexin V使凋亡细胞着色(图3K、3L)。Hoechst 33342和光镜的合并图可见,到24 h,即使已经显示高蓝色的凋亡细胞,其细胞形态依然相对于Accutase消化的NSCs比较完整(图3M)。此时已经有部分细胞碎片存在,这些碎片仍然可以是Annexin V染色阳性(图3N)。PI 染色和Annexin V(图3P)以及Hoechst 33342染色的重叠性较高(图3O)。此时间点经过Accutase消化后Annexin V染色和Hoechst 33342染色计数的凋亡率分别为(51.52±9.8)%和(49.32±8.71)%。而用胰蛋白酶消化后Annexin V染色和Hoechst 33342染色计数的凋亡率分别为(18.98±3.50)%和(17.63±2.72)%。不同的染色方法得到的凋亡率差异无统计学意义,Accutase消化后的NSCs凋亡率明显高于胰蛋白酶消化后的凋亡率(P<0.01)。
NSCs传代后凋亡的特点Hoechst 33342 对凋亡细胞的染色经历了逐渐变化的过程,正常细胞为Hoechst 33342低蓝色、PI阴性、Annexin V阴性,体积较大(图3I),凋亡开始后逐渐出现Annexin V和PI染色(图3F),随后随着凋亡的进行Hoechst 33342逐渐变为高蓝色,细胞逐渐皱缩,细胞核也逐渐缩小(图3B、3J)、蓝色进一步增强,与此相适应,PI染色的变化也由低红色逐渐加强。最后细胞核崩解,蓝色和红色均变弱消失,因为Hoechst 33342的消失慢于PI,能观察到低蓝色而无红色的死亡细胞(图3B),但Hoechst 33342的蓝色也会很快消失(图3I~3K),随后细胞彻底崩解。所以判断NSCs传代后凋亡的依据,应是具有Annexin V染色,或者Hoechst 33342 高蓝色。
神经干细胞的克隆形成数和新生神经球的直径两种酶消化后的神经干细胞以相同的密度(3000/孔)分别接种于96孔板中,培养96 h计数克隆形成数和新生神经球直径。培养96 h,胰蛋白酶(图4A~4C)和Accutase(图4D~4F)消化后的NSCs相比较,新克隆较多,周边凋亡细胞较少。Hoechst 33342 不仅可以作为核染料显示细胞核,即除死亡崩解外的大部分细胞,还可以通过高蓝色显示凋亡细胞。新形成的NSCs 克隆均为淡蓝色,为存活的正常细胞,胰蛋白酶和Accutase消化后均有较多的细胞不能形成克隆,逐步凋亡呈亮蓝色(图4B、4E)。换液后这些不能形成新克隆的细胞均会逐渐被洗掉。到接种后7 d,显微镜下所见为边界清晰的新克隆(图4G、4H)。

PI:碘化丙啶;黑色三角形:正常神经干细胞;白色三角形:Hoechst 33342 亮蓝色的凋亡细胞;白色箭形:Annexin V+/Hoechst 33342-细胞;加粗白色箭形:PI阳性细胞
PI:propidium iodide;Black triangle:normal NSCs;White triangle:Hoechst 33342 positive apoptotic cells;White arrow:Annexin V+/Hoechst 33342-cells;Bold white arrow:PI positive cells
A~H.Accutase消化;I~P.胰蛋白酶消化;A.光镜下的NSCs,正常细胞为圆形,形态完整(黑色三角形);B.Hoechst 33342染色后,可见亮蓝色凋亡细胞(白色三角形)和淡蓝色正常细胞;C.Annexin V染色,部分Annexin 阳性细胞没有Hoechst 33342 着色(白色箭形);D.PI染色(加粗白色箭形);E.A和B合并图,凋亡细胞核在胞浆内(白色三角形);F.B和C的合并图,E中部分失去Hoechst 33342的细胞仍然是Annexin V阳性(白色箭形);G.B和D的合并图,绝大多数Hoechst 33342阳性细胞也是PI阳性;H.C和D的合并图,Annexin V和PI重合良好;I.光镜下胰蛋白酶传代的NSCs大多为正常细胞,圆形、体积较大、没有皱缩;J.Hochest 33342染色,部分凋亡细胞显示为高亮蓝色(白色三角形);K.Annexin V染色很暗,但仍可见;L.PI染色(加粗白色箭形);M.I和J的合并图;N.J和K的合并图,有弱AnnexinV阳性物质并不是完整的细胞;O.J和L的合并图;P.K和L的合并图
A-H.Accutase passaging;I-P.trypsin passaging;A.phase contrast of NSCs,normal cells are round and integrate(black triangle);B.after Hoechst 33342 staining,the bright blue apoptotic cells(white triangle)exist together with dim blue normal cells;C.staining of Annexin V,some Annexin V+cells lost their nucleus staining of Hoechst 33342(white arrow);D.the staining of PI(bold white arrow);E.merged image of A and B,the apoptotic nucleus were located within cytoplasm(white triangle);F.merged image of B and C,some cells which lost Hoechst 33342 staining in E were still positive for AnnexinV(white arrow);G.merged image of B and D,most of the Hoechst 33342+cells are positive for PI;H.merged image of C and D,the green staining of Annexin V overlapped well with PI;I.most of the NSCs after passaging by trypsin are normal,round,big and without shrinkage;J.some apoptotic cells are stained bright blue by Hoechst 33342(white triangle);K.Annexin V staining was dim but detectable;L.PI staining of the same view field(bold white arrow);M.merged image of I and J;N.merged image of J and K note that the tiny Annexin V+materials are not whole cells;O.merged image of J and L;P.merged image of K and L
图 2NSCs传代2 h后的凋亡检测
Fig 2NSCs apoptosis at 2 hours after Accutase and trypsin digestion

黑色三角形:正常细胞;白色三角形:Hoechst 33342 亮蓝色的凋亡细胞;白色箭形:部分凋亡细胞失去了Hoechst 33342 染色,但有Annexin V染色;#1~#8:NSCs凋亡进展的代表性状态
Black triangle:normal NSCs;White triangle:Hoechst 33342 positive apoptotic cells;White arrow:Annexin V+/Hoechst 33342-cells;#1-#8:representive image of NSCs apoptosis development
A~H.Accutase消化;I~P.胰蛋白酶消化;A.光镜下的NSCs;B.Hoechst 33342染色;C.Annexin V染色;D.PI染色;E.A和B合并图,有些细胞没有Hoechst 33342核染色,但细胞尚未解体(白色箭形);F.B和C的合并图,有细胞失去了Hoechst 33342的高蓝色,仍为Annexin V阳性(白色箭形);G.B和D的合并图,绝大多数Hoechst 33342 阳性细胞也是PI阳性;H.C和D的合并图,Annexin V的绿色和PI的红色重合良好;I.绝大多数NSCs为正常状态(黑色三角),圆形无皱缩;J.Hoechst 33342亮蓝色的凋亡细胞具有不同的染色强度和细胞核完整性(白色三角形);K.与Accutase消化后的细胞类似,仍然可见Annexin V+、Hoechst 33342-的细胞(白色箭形);L.PI染色;M.I和J的合并图,亮蓝色细胞的直径比正常细胞显著缩小;N.Hoechst 33342 和Annexin V 染色合并图,可见一些Annexin V+的物质不是完整细胞;O.PI 和 Hoechst 33342合并图;P.PI和Annexin V合并图
A-H.Accutase digestion;I-P.trypsin digestion;A.phase contrast of NSCs;B.the staining of Hoechst 33342;C.Annexin V staining;D.the red staining of PI;E.merged image of A and B,some cells lost nucleus staining,but still be found as a integrate cell(white arrow);F.merged image of B and C,the cells lost Hoechst 33342 staining in E were still positive for Annexin V(white arrow);G.merged image of B and D,most of the Hoechst 33342+cells could be found also positive for PI;H.merged image of C and D,the green staining of Annexin V covered all the red of PI;I.most of the NSCs are normal(black triangle),round in shape and without shrinkage;J.the apoptotic cells with bright Hoechst 33342 blue are different in their staining density and nucleus integration(white triangle);K.Annexin V staining,as the cells treated by Accutase,the Annexin V+but Hoechst 33342-cells still could be found(white arrow);L.PI staining of the same view field;M.merged image of I and J,the diameter of bright blue cells is significantly smaller than those normal cells;N.merged image of Hoechst 33342 and Annexin V note that the tiny Annexin V+materials are not whole cells;O.merged image of PI and Hoechst 33342;P.merged image of PI and Annexin V
图 3NSCs传代24 h后的凋亡检测
Fig 3NSCs apoptosis at 24 hours after Accutase and trypsin digestion
通过计数显示,在传代后2、24 h,Annexin V染色和Hoechst 33342两种染色方法计数出的凋亡率差异无统计学意义(P>0.05);无论用何种凋亡鉴定方法,Accutase 消化后的凋亡率均显著高于胰蛋白酶(图4I)(P<0.01)。Accutase消化组和胰蛋白酶消化组新克隆形成率分别为(7.83±1.32)%和(19.22±3.66)%,二者比较差异具有统计学意义(P<0.01)(图4J)。Accutase消化组和胰蛋白酶消化组新生神经球直径分别为(43.51±9.76)μm和(58.39±17.57)μm,二者比较差异具有统计学意义(P<0.01)(图4K)。
新生神经干细胞的分化分化完成后,Accutase消化组和胰蛋白酶消化组均可见多量神经元和星形胶质细胞。以胰蛋白酶消化组为例,分化出的神经元呈现特异性标志物Tuj- 1染色,胶质细胞呈现特异性GFAP染色(图5)。通过计数Accutase消化组和胰蛋白酶消化组新生神经球分化成为神经元和星形胶质细胞的比例,二者比较差异无统计学意义(P>0.05)。

与Accutase比较,aP<0.01
aP<0.01 compared with Accutase
A~F.传代后4 d新克隆形成;A~C.胰酶消化;D~F.Accutase 消化;A,D.消化96 h后的新克隆的光镜图像;B,E.新克隆的Hoechst 33342染色;C,F.光镜和荧光的合并图;G,H.传代后7 d新克隆形成;G.胰蛋白酶消化传代后的神经球;H.Accutase消化传代后的神经球;I.Accutase消化组和胰蛋白酶消化组NSCs在2、24 h的凋亡率;J.Accutase消化组和胰蛋白酶消化组新克隆形成率;K.Accutase消化组和胰蛋白酶消化组新生神经球直径
A-F.the new clone formation at 4 days after passaging;A-C.trypsin digestion;D-F.Accutase digestion;A,D.new colonies formed at 96 hours after passaging;B,E.Hoechst 33342 staining of new formed colonies;C,F.merged image of phase contrast and fluorescence;G-H.the new clone formation at 7 days after passaging;G.newly formed neurospheres after trypsin passaging;H.newly formed neurospheres after Accutase passaging;I.the apoptosis rates of trypsin and Accutase digestion at 2,24 hours identified by Annexin V/PI and Hoechst 33342 staining;J.the colony formation rates of trypsin and Accutase digestion;K.the diameter of new formed neurospheres after trypsin and Accutase digestion
图 4两种酶消化NSCs后4、7 d的克隆形成
Fig 4New colony formation at 4 and 7 days after Accutase and Trypsin passaging
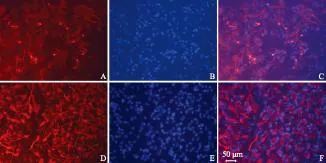
A.神经元特异性标志抗原Tuj- 1染色;B.同一视野的细胞核DAPI染色;C.A和B的合并图;D.胶质细胞特异性标志抗原GFAP染色;E.同一视野的细胞核DAPI染色;F.D和E的合并图
A.the staining of neurons specific marker,Tuj- 1;B.DAPI staining of the same view field;C.merged image of A and B;D.the staining of astrocyte specific marker,GFAP;E.nucleus staining of DAPI in the same view field;F.merged image of D and E
图 5胰蛋白酶消化传代后新生NSCs向神经元和胶质细胞分化
Fig 5Differentiation of newly formed NSCs after trypsin digestion into neurons and astrocytes
讨论
NSCs的传代在NSCs的培养、增殖中非常重要。不同实验室有不同的传代方法。通常在神经球生长至直径约300 μm时,将神经球剪切成小的块状,辅以巴斯德管吹打,使神经球分成较小的细胞团块进行传代。剪切传代法不能得到单细胞,所以NSCs培养传代还需要酶消化方法。NSCs传代之后的凋亡情况鲜有报道。在具体实践中发现,部分NSCs传代后发生了细胞凋亡,而酶消化后立即进行的台盼蓝染色不足以预示后期细胞的凋亡率。为选择合适的消化酶以减少NSCs凋亡率、增加NSCs的产出率,有必要研究用Accutase或胰蛋白酶消化对NSCs凋亡的影响。本研究对人类纹状体NSCs体外培养形成的神经球进行酶消化,然后检测NSCs传代后2、24 h细胞的凋亡率变化。本研究采用比较经典的Annexin V/PI活细胞染色,以及Hoechst 33342活细胞染色的方法,结合对NSCs形态的观察,探讨不同酶对NSCs凋亡过程的影响。
Annexin V 是一个早已公认的检测细胞早期凋亡的标志。磷脂酰丝氨酸(phosphatidylserine,PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,可从破损细胞膜的内侧翻转到细胞膜的表面。Annexin V可以与暴露于细胞外的PS相结合。将Annexin V进行荧光素(FITC、PE等)标记后,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。
Hoechst 33342 染色不仅是较早期细胞凋亡的敏感标志,还可以鉴定中后期细胞凋亡。荧光染料Hoechst 33342能少许进入正常细胞膜,使其显示低蓝色。凋亡细胞早期细胞膜的完整性虽未明显改变,但细胞膜的通透性已有增强,因此进入凋亡细胞中的Hoechst 33342比正常细胞的多,所以逐渐显示高蓝色。
通常认为,Annexin V是鉴定早期凋亡的标志,PI是鉴定细胞死亡的标志。具体到NSCs,本研究在已经有明显细胞核固缩的细胞,可以看到Annexin V染色,表明Annexin V实际可以标记的凋亡细胞范围大于早期凋亡。同时本研究观察到Annexin V/PI双阳性细胞,也说明这一点。Hoechst 33342高蓝色和PI红色的重合率非常高,除了凋亡末期接近崩解的细胞仅显示Hoechst 33342高蓝色,其他情况下二者完全重合。
为了排除酶浓度不同造成实验结果的差异。本研究试用了多种酶的浓度,其中0.05%的胰蛋白酶消化神经球较为合适,更低的浓度则不能有效使神经球解离,更高的浓度会造成NSCs消化过程中大量死亡。Accutase的使用也经过多种浓度调试,达到最佳分离神经球的效果。本研究显示,对NSCs消化后的长期存活,胰蛋白酶消化对NSCs的破坏作用比Accutase更小。主要有以下几点依据:首先,早在消化后2 h,Accutase消化后的NSCs已经可见Annexin V 染色,而胰蛋白酶消化的细胞Annexin V染色尚不可见。而且PI 染色随着活细胞逐渐凋亡有一个染色增强的过程,在此时间点,胰蛋白酶消化后的PI染色比Accutase更弱。其次,虽然Accutase消化后即时染色显示细胞存活率比胰蛋白酶高,但在消化后的24 h内,其凋亡率增加到50%~60%,而胰蛋白酶的凋亡率显著低于Accutase。最终克隆形成率实验和新生神经球直径的检测均证明,Accutase消化神经球生成单细胞造成了比胰蛋白酶更大的损伤。
本研究表明,NSCs用Accutase传代后立即台盼蓝染色的高存活率不能预示随后发生的细胞凋亡的程度。恰恰是显著高于胰蛋白酶消化后的细胞存活率,使人们容易认为Accutase传代比胰蛋白酶有利于NSCs存活。有研究显示Accutase消化NSCs比胰蛋白酶导致的细胞死亡少,新生细胞增多[10],但这些研究在具体操作中,均使用了巴斯德管机械吹打,细胞传代过程中除了酶消化的直接损伤作用外,还有巴斯德管机械吹打的损伤,二者在损伤程度中的权重尚没有直接的报道。本研究用涡旋震荡代替巴斯德管吹打,结果的差异是否与避免了机械吹打直接有关,尚需要更多的工作来验证。本研究Hoechst 33342高亮染色出现最早,在传代后2 h就明确可见,此时显示亮蓝色的NSCs有的尚未出现凋亡的形态变化。在此时间点,AnnexinV和PI染色仅在Accutase消化后的细胞明显,用胰蛋白酶消化的NSCs,其AnnexinV/PI染色较弱;在荧光显微镜下不如Hoechst 33342 的高蓝色清晰。
从本研究对NSCs凋亡鉴定的具体情况来看,Annexin V和凋亡细胞的结合不是抗原抗体反应或者共价键结合的模式,这种结合非常松散,如果染色完毕后用PBS洗一遍,可以将绝大多数染色洗掉;另一个问题是,Annexin V 着色的是细胞膜上的磷脂酰丝氨酸,当细胞崩解后的碎片会显示出染色阳性,对结果的判断造成干扰,加上凋亡后部分细胞形态皱缩,和一些大的细胞碎片难以区分,这使在荧光显微镜下观察比较困难,用流式细胞仪的鉴定对设“门”的经验要求较高,需把碎片排除在读取数据的那部分细胞之外。
并非所有Annexin V染色均和Hoechst 33342染色重叠(图2B~2H、图3I~3K),有些仅有Annexin V染色,无细胞核结构的染色。这些细胞的归类比较困难,有两种可能的解释:第一,凋亡早期可能部分细胞已经表现Annexin V弱阳性,但是这些细胞的胞膜相对比较完整,在精确控制的染色时间里(本研究是10 min),尚未被Hoechst 33342 着色。提示检测原理不同,在同一个早期凋亡的细胞上,不一定同时表现所有的早期凋亡标志;第二,凋亡晚期细胞,细胞核结构已经消失,细胞即将崩解,但相对完整的细胞膜结构依然可以被Annexin V染色。考虑本研究观察到的这些细胞的光镜下形态均有凋亡改变,笔者倾向于认为后一种解释更加合理,加之这些Annexin V+Hoechst 33342-细胞已经丧失细胞核结构,应当被认为是死亡细胞。
参考文献
[1]Jun H,Mohammed Qasim Hussaini S,Rigby MJ,et al. Functional role of adult hippocampal neurogenesis as a therapeutic strategy for mental disorders[J].Neural Plast,2012,2012:854285.
[2]Balu DT,Lucki I.Adult hippocampal neurogenesis:regulation,functional implications,and contribution to disease pathology[J].Neurosci Biobehav Rev,2009,33(3):232- 252.
[3]Barkho BZ,Zhao XY.Adult neural stem cells:response to stroke injury and potential for therapeutic applications[J].Curr Stem Cell Res Ther,2011,6(4):327- 338.
[4]Ogawa D,Okada Y,Nakamura M,et al. Evaluation of human fetal neural stem/progenitor cells as a source for cell replacement therapy for neurological disorders:properties and tumorigenicity after long-terminvitromaintenance[J].J Neurosci Res,2009,87(2):307- 317.
[5]Cummings BJ,Uchida N,Tamaki SJ,et al. Human neural stem cells differentiate and promote locomotor recovery in spinal cord-injured mice[J].Proc Natl Acad Sci USA,2005,102(39):14069- 14074.
[6]Ormerod BK,Palmer TD,Caldwell MA.Neurodegeneration and cell replacement[J].Philos Trans R Soc Lond B Biol Sci,2008,363(1489):153- 170.
[7]Martino G,Pluchino S.The therapeutic potential of neural stem cells[J].Nat Rev Neurosci,2006,7(5):395- 406.
[8]Svendsen CN,ter Borg MG,Armstrong RJ,et al. A new method for the rapid and long term growth of human neural precursor cells[J].J Neurosci Methods,1998,85(2):141- 152.
[9]Widera D,Mikenberg I,Kaus A,et al. Nuclear factor-kappa B controls the reaggregation of 3D neurosphere culturesinvitro[J].Eur Cell Mater,2006,11:76- 84;discussion 85.
[10]Wachs FP,Couillard-Despres S,Engelhardt M,et al. High efficacy of clonal growth and expansion of adult neural stem cells[J].Lab Invest,2003,83(7):949- 962.
[11]Molofsky AV,Pardal R,Iwashita T,et al. Bmi- 1 dependence distinguishes neural stem cell self-renewal from progenitor proliferation[J].Nature,2003,425(6961):962- 967.
1Department of Physiology,Changzhi Medical College,Changzhi,Shanxi 046000,China
2Department of Pathophysiology,Xiangya School of Medicine,Central South University,Changsha 410008,China
3Department of Neurosurgery,Xiangya Hospital,Central South University,Changsha 410008,China
Corresponding author:ZHANG Cui-yingTel:0355- 3151440,E-mail:zhangcy157@sohu.com;
ZHAO JieTel:0731- 84327039,E-mail:steelzj@126.com
ABSTRACT:ObjectiveTo observe the apoptosis of neural stem cells(NSCs)at differential time points after the dissociation of neurospheres by Accutase or trypsin.MethodsThe NSCs were isolated from striatum of human fetals that suffered abortion at 12- 16 weeks of pregnancy.The 3rd- 5thpassages of NSCs were digested by Accutase or trypsin.Only vortexing was applied,and the triturating by Pasteur pipette was avoided to attenuate the injury to the cells during the dissociation.The single cells were then stained by Annexin V/propidium iodide and Hoechst 33342.The apoptosis rates 2 and 24 hours after passaging were evaluated.ResultsThe trypan blue staining confirmed that immediately after the dissociation,the viability of cells digested by trypsin was(83.10±6.76)%,which was significantly lower than that digested by Accutase,which was(91.65±4.43)%(P<0.05).The apoptosis of the NSCs digested by Accutase was higher than that digested by trypsin at both 2 and 24 hours after passaging(P<0.01).Four days after the passaging,both the new clone formation rate and diameter of new spheres after trypsin digestion were significantly higher than those after Accutase digestion(P<0.01).ConclusionsAlthough the viability of NSCs immediately after the disassociation by trypsin is lower than that digested by Accutase,the apoptosis of NSCs subsequently caused by trypsin is lower than that caused by Accutase.Trypan blue test immediately after the disassociation can not be used as an indicator in estimating the apoptosis of NSCs during the expanding.
Key words:neural stem cells;neurosphere;Accutase;trypsin;apoptosis
(收稿日期:2014- 08- 13)
中图分类号:R 392.2+8
文献标志码:A
文章编号:1000- 503X(2015)02- 0185- 10
通信作者:张翠英电话:0355- 3151440,电子邮件:zhangcy157@sohu.com;
基金项目:国家自然科学基金青年基金(81100057)和长治医学院创新团队项目(CX201408)Supported by the National Natural Sciences Youth Foundation of China(81100057)and Changzhi Medical College Innovation Team Project(CX201408)
·论著·

