1 cm以下磨玻璃密度肺腺癌的CT征象与病理亚型及免疫组织化学的相关性
吴 芳,蔡祖龙,田树平,金 鑫,景 瑞,杨越清,李颖娜,赵绍宏
中国人民解放军总医院放射诊断科,北京 100853
1 cm以下磨玻璃密度肺腺癌的CT征象与病理亚型及免疫组织化学的相关性
吴芳,蔡祖龙,田树平,金鑫,景瑞,杨越清,李颖娜,赵绍宏
中国人民解放军总医院放射诊断科,北京 100853
摘要:目的探讨1 cm以下局灶性磨玻璃密度(fGGO)肺腺癌的CT征象与病理亚型及免疫组织化学的相关性。方法回顾性分析本院59例经手术病理证实为肺腺癌的最大直径≤1 cm的fGGO患者的CT、病理以及免疫组织化学资料,将CT征象(包括位置、大小、密度、形状、空泡征、空气支气管征、病灶边缘、胸膜凹陷征、瘤肺界面)与病理亚型 [不典型腺瘤样增生(AAH)、原位腺癌(AIS)、微浸润性腺癌(MIA)及浸润性腺癌(IPA)]和免疫组织化学结果 [人表皮生长因子受体(HER)- 1、HER- 2、Ki- 67、血管内皮生长因子(VEGF)、拓扑异构酶Ⅱα(Top-Ⅱα)]对照,患者年龄、病变大小、密度与病理亚型比较采用单因素方差分析或秩和检验;患者性别、病变位置、形状、空泡征、空气支气管征、病灶边缘、胸膜凹陷征、瘤肺界面与病理亚型和免疫组织化学结果对照采用卡方检验或Fisher精确检验。结果CT表现为1 cm以下fGGO的肺腺癌各病理亚型间,性别分布、年龄大小、病变位置、形状、空气支气管征、胸膜凹陷征、瘤肺界面差异无统计学意义(P值分别为0.194、0.126、0.609、0.678、0.091、0.374、0.339),各病理亚型间病变大小、密度、空泡征的有无以及边缘情况差异有统计学意义(P值分别为0.028、0.002、0.003、0.046),Ki- 67在不同形状结节间表达程度差异有统计学意义(P=0.015),HER- 1在瘤肺界面是否清晰的结节间表达程度差异有统计学意义(P=0.019),HER- 2在是否有空泡征的结节间表达程度差异有统计学意义(P=0.049),而CT征象与VEGF和Top-Ⅱα的表达无相关性(P均>0.05)。结论表现为1 cm以下fGGO的肺腺癌中,IPA的空泡征出现率最高,而AAH最低,且浸润前病变(AAH+AIS)多表现为边缘光滑,MIA和IPA则多表现为分叶征+毛刺征;且一些CT征象在特定免疫组织化学结果之间也有相关性。
关键词:局灶性磨玻璃密度;肺腺癌;免疫组织化学;病理亚型;计算机断层成像
ActaAcadMedSin,2015,37(2):163-170
局灶性磨玻璃密度(focal ground-glass opacity,fGGO)结节是指整个结节部分区域密度较淡,呈磨玻璃状,而不掩盖肺血管纹理。引起fGGO最常见的原因是肺腺癌[1],且有研究显示≤1 cm的fGGO除了不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinoma in situ,AIS)外还包括一些微浸润性腺癌(minimally invasive adenocarcinoma,MIA)和浸润性腺癌(invasive pulmonary adenocarcinoma,IPA)[2],而临床上对于AAH、AIS、MIA以及IPA的处理方法有着较大差异[3],所以临床认为早期诊断和鉴别诊断fGGO对早期对症治疗有积极的意义。人表皮生长因子受体(human epidermal growth factor receptor,HER)- 1、HER- 2、Ki- 67、血管内皮生长因子(vascular endothelial growth factor,VEGF)和 拓扑异构酶Ⅱα(DNA topoisomeraseⅡα,Top-Ⅱα)在肺腺癌中表达与否对于治疗有着至关重要的意义[4]。但目前≤1 cm的fGGO的CT征象特点在AAH、AIS、MIA以及IPA之间有无差异以及其与肺腺癌免疫组织化学检查结果(HER- 1、HER- 2、Ki- 67、VEGF、Top-Ⅱα)之间的相关性报道较少。本研究回顾性分析CT图像上表现为fGGO且最大直径≤1 cm的肺腺癌患者的CT、病理以及免疫组织化学资料,总结CT征象特点,并与手术病理及免疫组织化学检查结果对照,旨在发现≤1 cm的fGGO的肺腺癌各病理亚型的CT征象特点以及与肺腺癌免疫组织化学检查结果(HER- 1、HER- 2、Ki- 67、VEGF、Top-Ⅱα)之间的相关性。
资料和方法
资料回顾性分析本院2012年3月至2013年3月经手术病理证实为肺腺癌的最大直径≤1 cm的fGGO的59例患者的CT、病理以及免疫组织化学资料:总结CT特点(包括位置、大小、密度、形状、空泡征、空气支气管征、病灶边缘、胸膜凹陷征、瘤肺界面),记录病理类型(AAH、AIS、MIA以及IPA)、免疫组织化学结果(HER- 1、HER- 2、Ki- 67、VEGF、Top-Ⅱα)。分别按照病理类型及免疫组织化学结果进行分组,分别比较各组间各个CT征象有无差异。
检查方法所有患者至少行1次CT扫描,采用Siemens Cardiac 64或GE LightSpeed 64排螺旋CT扫描仪,常规层厚5 mm扫描,1.25 mm或1.5 mm薄层重建,使用Lung及Std算法双窗技术(肺窗WWl500,WL- 600,纵隔窗WW400,WL40)。由1名主治医师分析临床病例记录,并记录患者的病史。在CT图像上病灶有实性成分(磨玻璃样病灶中的中央条状、片状、带状致密影)则判定为混合磨玻璃密度结节(mixed ground-glass opacity,mGGO),否则为纯磨玻璃密度结节(pure ground-glass opacity,pGGO)。所需分析的CT表现包括:病变的位置、大小(测量fGGO在薄层CT横断位图像上最大直径)、密度(测量感兴趣区面积=10 mm2,pGGO分别在病变3个不同位置测量CT值,取平均值,而mGGO的CT值则由公式:实性成分比例×实性成分平均CT值+磨玻璃成分比例×磨玻璃成分平均CT值得出,其中实性部分和磨玻璃部分CT值分别测3次,取平均值)、形状[圆形、椭圆形、多角形(病灶的边缘由两个以上的角组成)、不规则形]、空泡征、空气支气管征、病灶边缘(光滑、分叶、毛刺、分叶+毛刺)、瘤肺界面(清楚/不清楚)。由2名具有15年以上影像诊断工作经验的医师在不知道病理结果及免疫组织化学结果的情况下进行阅片、分析及诊断,并记录胸部CT表现,如果两人诊断意见不一致,采用协商的办法解决。
统计学处理采用SPSS 22.0统计软件。计量资料以均数±标准差表示,组间比较采用单因素方差分析或秩和检验;计数资料以数值或百分数表示,组间比较采用卡方检验或Fisher精确检验。P<0.05为差异具有统计学意义。
结果
一般情况共有59例患者纳入本研究,其中男性23例、女性36例,各病理分类间性别分布差异无统计学意义(P=0.194);年龄26~78岁,平均(55.19±10.23)岁,各病理分类间年龄差异无统计学意义(P=0.126)。48例无任何临床症状,为体检或其他原因检查时偶然发现,5例表现为咳嗽、咳痰,6例表现为胸闷不适。吸烟19例,被动吸烟12例。59例中共发现59个最大直径≤1 cm的结节,pGGO 40例、mGGO 19例;按2011年国际肺癌研究协会/美国胸科学会/欧洲呼吸学会病理分类,将其分为AAH、AIS、MIA、IPA 4组,其中AAH 15例(图1)、AIS 16例(图2)、MIA 15例(图3)、IPA 13例(图4)。
CT表现与病理分型59个病灶中,最大径4.0~10.0 mm,平均(0.88±0.16)mm。右肺上叶22例、右肺中叶8例、右肺下叶12例、左肺上叶8例、左肺下叶9例,各病理分型间病变的位置分布差异无统计学意义(P=0.609)。病变CT表现与病理类型的对比情况显示,随着病变恶性程度的提高(由AAH到IPA),病变大小也在增大,而且差异具有统计学意义(P=0.028)。其中AAH与AIS、MIA、IPA之间病变大小差异均有统计学意义(P值分别为0.008、0.001、0.024),但AIS与MIA、IPA,MIA与IPA之间病变大小的差异无统计学意义(P值分别为0.456、0.774、0.323)。随着病变恶性程度的提高,病变的密度也在增大,而且差异具有统计学意义(P=0.002),其中AAH与MIA和IPA,AIS与IPA之间病变密度的差异均有统计学意义(P值分别为0.016、0.000、0.008),但AAH与AIS、AIS与MIA、MIA与IPA之间病变密度的差异均无统计学意义(P值分别为0.201、0.219、0.128)。对于空泡征,随着病变的恶性程度增加,空泡征出现的概率也随之增大,由AAH的13.3%增加到IPA的76.9%,差异具有统计学意义(P=0.003),其中AAH与IPA、AAH与MIA、AIS与IPA间空泡征的有无差异有统计学意义(P值分别为0.001、0.008、0.014)。随着病变恶性程度的提高(由AAH到IPA),病灶的边缘变得不光滑,分叶、毛刺或分叶+毛刺出现的概率明显增加,差异具有统计学意义(P=0.046),且AAH与IPA和AIS与IPA间病灶的边缘差异有统计学意义(P均=0.016)(表1)。

AAH:不典型腺瘤样增生;pGGO:纯磨玻璃密度结节
AAH:atypical adenomatous hyperplasia;pGGO:pure ground-glass opacity
A.薄层CT上示左肺下叶直径约0.7 cm的pGGO(箭头),平均CT值-729 HU,类圆形,未见分叶、毛刺征,瘤肺界面欠清楚;B.同一患者的低倍光镜图(HE染色,×40)
A.thin-section CT scan shows pGGO(arrow)located in inferior lobe of left lung with diameter of 0.7 cm,mean CT value of -729HU,and round-like shape but without lobular,spiculated margin and clear tumor-lung interface;B.low-power photomicrograph of the same patient(HE stain,×40)
图 1AAH的CT及病理图片
Fig 1CT and histopathologic photomicrograph of AAH

AIS:原位腺癌
AIS:adenocarcinoma in situ
A.薄层CT上示左肺上叶直径约0.8 cm的pGGO,平均CT值-576 HU,椭圆形,边缘光滑,瘤肺界面较清楚;B.同一患者的高倍光镜图(HE染色,×100)
A.thin-section CT scan shows pGGO located in superior lobe of left lung with diameter of 0.8 cm,mean CT value of -576 HU,oval shape,smooth margin,and clear tumor-lung interface;B.high-power photomicrograph of the same patient(HE stain,×100)
图 2AIS的CT及病理图片
Fig 2CT and histopathologic photomicrograph of AIS
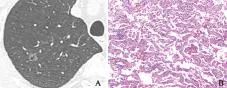
MIA:微浸润性腺癌
MIA:minimally invasive adenocarcinoma
A.薄层CT上示右肺上叶直径约0.9 cm的pGGO,平均CT值-613 HU,类圆形,浅分叶,瘤肺界面较清楚,内见空泡征;B.同一患者的高倍光镜图(HE染色,×100)
A.thin-section CT scan shows pGGO located in superior lobe of right lung with diameter of 0.9 cm,mean CT value of -613HU,round-like shape,shallow lobulated margin,clear tumor-lung interface,and bubble-like sign;B.high-power photomicrograph of the same patient(HE stain,×100)
图 3MIA的CT及病理图片
Fig 3CT and histopathologic photomicrograph of MIA
免疫组织化学与病理分型HER- 1和HER- 2参照美国临床肿瘤协会/美国病理医师协会提出的检测指南:(-):肿瘤细胞没有染色或少于10%细胞膜染色;(+):>10%细胞有不完整的胞膜染色;(++):>10%细胞有完整的但较弱的胞膜染色;(+++):>30%细胞有完整的较强的胞膜染色病变。Ki- 67以在细胞核呈现清晰的棕黄色颗粒为阳性,按阳性细胞所占比例数分为:(-):≤l0%;(+):11%~25%;(++):25%~50%;(+++):≥50%。VEGF以400倍视野下着色细胞占视野细胞总数的多少分为(-):0;(+):<25%;(++):26%~50%;(+++):≥50%。Top-Ⅱα 阳性表达主要见于细胞核,核呈棕黄色的细胞数,按阳性细胞所占比例数分为:(-):<10%;(+):10%~25%;(++):26%~75%;(+++):>76%。免疫组织化学与病理类型的对比情况显示,各病理分型间HER- 1、HER- 2、Ki- 67、VEGF、Top-Ⅱα的表达程度差异均无统计学意义(P均>0.05)(表2)。

IPA:浸润性腺癌
IPA:invasive pulmonary adenocarcinoma
A.薄层CT上示左肺上叶直径约0.9 cm的混合磨玻璃密度结节,平均CT值-453HU,类圆形,边缘见毛刺、分叶,瘤肺界面较清楚,内见空泡征;B.同一患者的高倍光镜图(HE染色,×100)
A.thin-section CT scan shows mixed ground-glass opacity located in superior lobe of left lung with diameter of 0.9 cm,mean CT value of -453HU,round-like shape,shallow lobulated and spiculated margin,clear tumor-lung interface and bubble-like sign;B.high-power photomicrograph of the same patient(HE stain,×100)
图 4IPA的CT及病理图片
Fig 4CT and histopathologic photomicrograph of IPA
CT表现与免疫组织化学病变CT表现与免疫组织化学的对比情况显示,Ki- 67在不同形状结节间表达程度差异有统计学意义(P=0.015),且圆形与不规则形间、椭圆形与不规则形间的表达程度差异有统计学意义(P=0.022,P=0.005);HER- 1在瘤肺界面是否清晰的结节间表达程度差异有统计学意义(P=0.019),且在HER- 1阴性(-)与阳性(++)、阴性(-)与强阳性(+++)结果间,瘤肺界面是否清楚差异有统计学意义(P=0.002,P=0.048);HER- 2在是否有空泡征的结节间表达程度差异有统计学意义(P=0.049),且在HER- 2阴性(-)与阳性(++)、弱阳性(+)与阳性(++)、阳性(++)与强阳性(+++)结果间,空泡征的有无差异有统计学意义(P=0.021,P=0.038,P=0.011)(表3)。
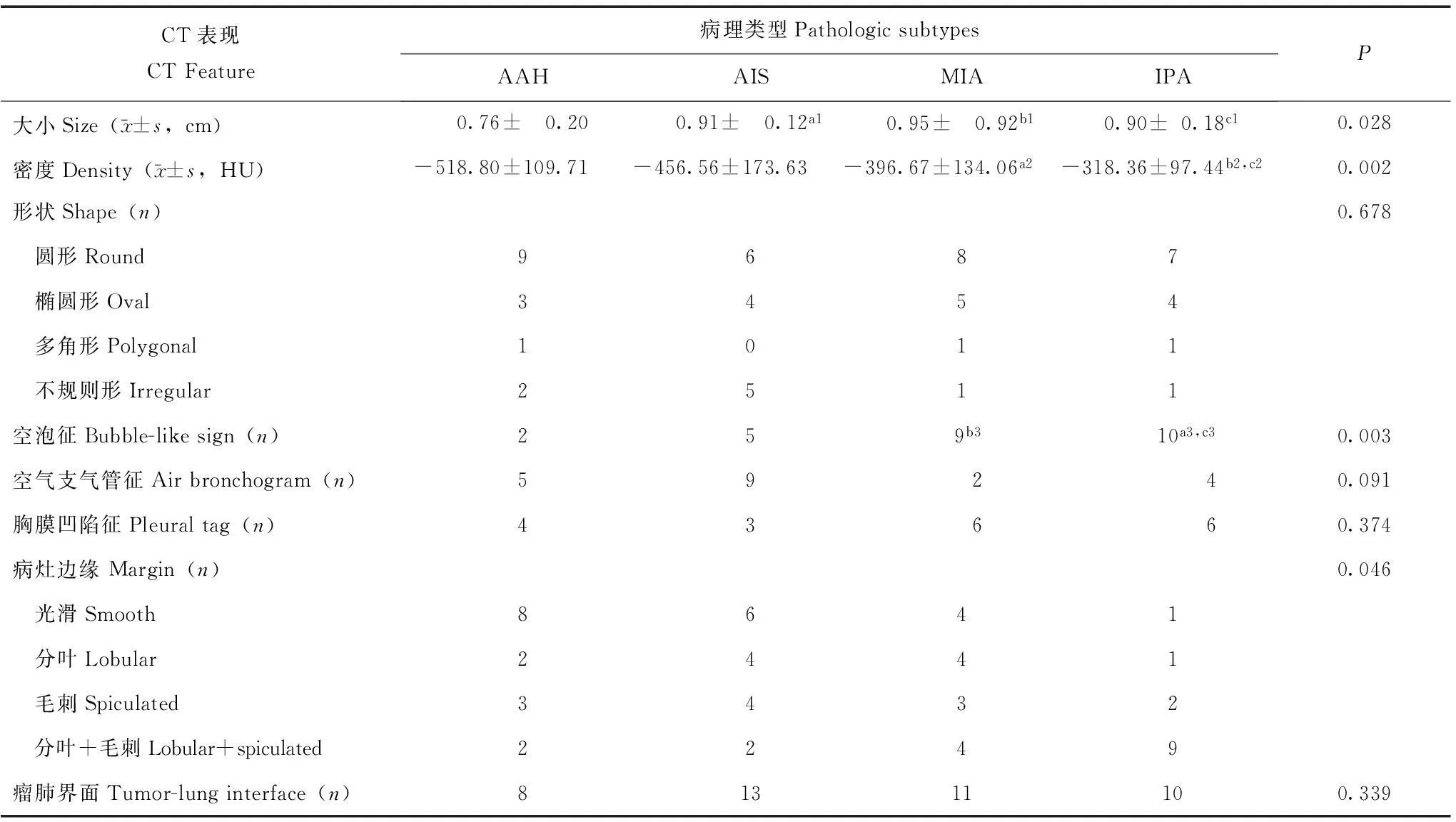
表 1 病变CT表现与病理类型的对比
病理亚型间大小、密度的差异采用单因素方差分析或秩和检验,病理亚型间其他CT征象的差异采用卡方检验或Fisher精确检验;与AAH病变大小比较,a1P=0.008,b1P=0.001,c1P=0.024;与AAH病变密度比较,a2P=0.016,b2P=0.000;与AIS病变密度比较,c2P=0.008;与AAH病变空泡征比较,a3P=0.001,b3P=0.008;与AIS病变空泡征比较,c3P=0.014;AAH与IPA,AIS与IPA病灶边缘比较,P均=0.016
Lesion size and density were compared with pathologic subtypes using analysis of variance or nonparametric Wilcoxon tests;other CT features were compared with histopathologic subtypes usingΧ2test or Fisher’s exact test;a1P=0.008,b1P=0.001,c1P=0.024 compared with AAH size;,a2P=0.016,b2P=0.000 compared with AAH density;c2P=0.008 compared with AIS density;a3P=0.001,b3P=0.008 compared with AAH bubble-like sign;c3P=0.014 compared with AIS bubble-like sign;allP=0.016 AAHvs. IPA,AISvs. IPA margin
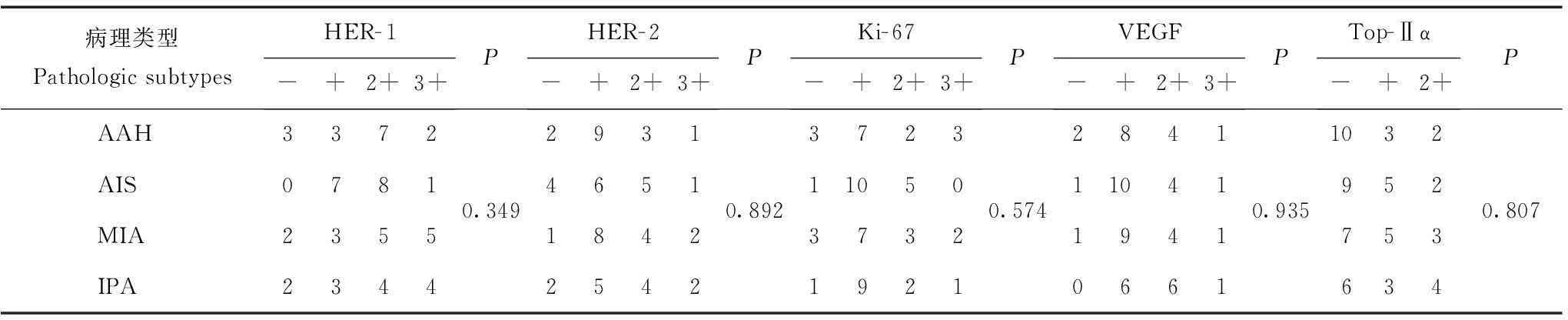
表 2 免疫组织化学与病理类型的对比(n)
HER:人表皮生长因子受体;VEGF:血管内皮生长因子;Top-Ⅱα:拓扑异构酶Ⅱα;病理亚型间免疫组织化学的表达采用卡方检验或Fisher精确检验
HER:human epidermal growth factor receptor;VEGF:vascular endothelial growth factor;Top-Ⅱα:DNA topoisomerase Ⅱα;Immunohistochemical implication were compared with histopathologic subtypes usingΧ2test or Fisher’s exact test
讨论
根据2011年国际肺癌研究协会/美国胸科学会/欧洲呼吸学会对肺腺癌进行的新的病理分类[5],1 cm以下fGGO除了可以是浸润前病变(AAH、AIS),也存在MIA和IPA的可能[2],虽然这几种病理分型间存在着CT征象的重叠[3],但本研究显示,随着病变恶性程度的提高(由AAH到IPA),病变增大,密度增加,实变程度(CT值)增加,空泡征、分叶征、毛刺征出现的概率增大;免疫指标的表达在不同病理亚型间的差异无统计学意义。而在CT征象与免疫组织化学对比的研究中显示圆形和椭圆形病灶Ki- 67更多的表达阳性,而不规则形结节更多的表达强阳性;瘤肺界面不清楚的病灶HER- 1更多的表达强阳性结果;有空泡征的病灶HER- 2更多的表达弱阳性结果。而CT征象与VEGF和Top-Ⅱα的表达不存在相关性。

表 3 病变CT表现与免疫组织化学的对比
CT征象与免疫组织化学表达程度的对比采用卡方检验或Fisher精确检验;圆形与不规则形间、椭圆形与不规则形间Ki- 67的表达程度比较,P值分别为0.022和0.005;HER- 1结果为阴性(-)与阳性(2+)、阴性(-)与强阳性(3+)结果间瘤肺界面是否清楚比较,P值分别为0.002和0.048;HER- 2结果为阴性(-)与阳性(2+)、弱阳性(+)与阳性(2+)、阳性(2+)与强阳性(3+)结果间空泡征的有无比较,P值分别为0.021、0.038和0.011
CT features were compared with immunohistochemical implication usingΧ2test or Fisher’s exact test.There were statistically significant differences between roundvs. irregular lesions and ovalvs. irregular lesions in terms of Ki- 67(P=0.022,P=0.005).There were statistically significant differences between negativevs. positive results and negativevs. strongly positive results of HER- 1 in terms of tumor-lung interface(P=0.002,P=0.048).There were statistically significant differences between negativevs. positive results,weakly positivevs. positive results,positivevs. strongly positive results of HER- 2 in terms of bubble-like sign(P=0.021,P=0.038,P=0.011)
近年来,随着影像技术的发展和肺腺癌发病率的提高,表现为fGGO的肺腺癌的检出率亦逐年提高[6- 7],且临床对于其不同病理亚型的治疗方案有较大差异[3],所以对fGGO作出准确的CT评估至关重要。肺腺癌的女性发病率高于男性[8],本研究59例患者中,男性23例、女性36例,女性患者多于男性患者,但是各病理分型间性别的差异无统计学意义。有研究表明,浸润前病变(AAH+AIS)的大小明显小于浸润性病变,最合适的临界值是1 cm[9],但也有研究显示小于1 cm的fGGO也包括一些微浸润以及浸润性腺癌[2]。GGO的病理基础为肺泡内气体减少,细胞数量增多,肺泡上皮细胞增生,肺泡间隔增厚和终末气囊内部分液体充填[10],因此GGO的密度是结合了软组织与空气的密度,其CT值也随软组织的比例而变化,由于AAH是一类局限性、小的增殖病灶,由排列在肺泡壁上或排列在呼吸性细支气管壁上的Ⅱ型肺泡上皮细胞和/或Clara 细胞轻度到中度不典型增生引起,而AIS是一类局限性的小腺癌,肿瘤细胞仅沿原有的肺泡结构生长(伏壁样生长),无间质、血管或胸膜浸润[5],故AAH较AIS有更多的空气和更少的细胞成分,前者较后者的CT值更低。另有研究显示,直径<1.5 cm的pGGO具有相对高CT值(>-472 HU)者更可能是浸润性肺腺癌,因此不同大小及密度的范围和阈值可以区分不同的病理类型[11]。本研究显示表现为1 cm以下fGGO的肺腺癌的大小和密度在AAH、AIS、MIA、IPA 4种病理分型间差异有统计学意义,这与之前的文献报道是一致的。AAH与AIS、MIA、IPA病变大小之间差异均有统计学意义(P值分别为0.008、0.001、0.024),但AIS与MIA、IPA,MIA与IPA病变大小之间的差异无统计学意义(P值分别为0.456、0.774、0.323)。本研究病例AAH平均大小为(0.76±0.20)cm,目前许多学者认为AAH的诊断标准为<0.5 cm,本研究结果较目前认为的诊断标准偏大,这可能是由于本研究病例选择的是手术病例,不能完全排除选择性的偏倚。AAH与MIA和IPA,AIS与IPA病变密度之间差异均有统计学意义(P值分别为0.016、0.000、0.008),但AAH与AIS,AIS与MIA,MIA与IPA病变大小之间的差异均无统计学意义(P值分别为0.201、0.219、0.128)。所以随着病变浸润程度的增加,其大小和密度也会随之增大。
有文献表明,浸润前病变的一些CT征象如分叶征及毛刺征等较浸润性病变少[9],也有文献报道以上征象在不同病理类型中的表现无差异,这可能与样本量大小不一致有关[12]。在对本研究一些CT征象与病理分型相关性研究显示,各病理分型间病变是否有空泡征差异有统计学意义,空泡征在不同病理类型中所占比例分别为:AAH:13.3%;AIS:31.3%;MIA:60%;IPA:76.9%,可见随着病理分级的升高,空泡征出现的概率逐渐增加,并且AAH与IPA、AAH与MIA、AIS与IPA间空泡征的有无差异有统计学意义(P值分别为0.001、0.008、0.014)。各病理分型间病变边缘情况(分叶、毛刺)差异也有统计学意义,且AAH与IPA和AIS与IPA间病灶的边缘差异有统计学意义(P值均为0.016),因此浸润前病变(AAH+AIS)多表现为边缘光滑(53.3%、37.5%),MIA和IPA则多表现为分叶+毛刺(26.7%、69.2%)。
肿瘤一些生物标志物可以对肿瘤的生物学行为产生深远影响,决定肿瘤的生长方式、增殖速度、形态特征、恶性程度、复发和转移等,同时肿瘤的生物学行为决定其组织病理大体形态,病理大体形态改变又是影像表现的基础,所以有研究表明肺腺癌的CT征象对其生物标志物有一定预测作用[4]。一些肿瘤生物标志物如HER- 1、HER- 2、Ki- 67、VEGF、Top-Ⅱα可能与早期肺腺癌的CT征象有关[4]。HER- 1和HER- 2是表皮生长因子受体家族成员,有研究表明HER- 1、HER- 2的过度表达与肺癌患者术后预后呈负相关,是肺癌患者预后的标记指标之一,但不同文献对于此研
究结果也不一致。Ki- 67作为细胞增殖的标志,被国内外许多研究者确定其与肺癌的发生、发展关系密切,检测放化疗治疗前后Ki- 67的表达情况,有利于判断疗效,指导疗效。VEGF在许多人类肿瘤中均有较高水平,它可以促进肿瘤的克隆生长及浸润和转移,影响肿瘤的生物学行为。Top-Ⅱα是与细胞有丝分裂有关的重要核酶,在DNA复制和重组中发挥重要作用,在乳腺癌中与HER- 2呈正相关,在肺癌中研究较少。本研究显示Ki- 67在不同形状结节间表达程度差异有统计学意义,且圆形与不规则形间,椭圆形与不规则形间的表达程度差异有统计学意义(P=0.022,P=0.005),表明圆形和椭圆形病灶Ki- 67更多的表达阳性,而不规则形结节更多的表达强阳性;HER- 1在瘤肺界面是否清晰的结节间表达程度差异有统计学意义(P=0.019),且在HER- 1阴性(-)与阳性(++)、阴性(-)与强阳性(+++)结果间,瘤肺界面是否清楚差异有统计学意义(P=0.002,P=0.048),表明瘤肺界面不清楚的病灶HER- 1更多地表达强阳性结果;HER- 2在是否有空泡征的结节间表达程度差异有统计学意义(P=0.049),且在HER- 2阴性(-)与阳性(++)、弱阳性(+)与阳性(++)、阳性(++)与强阳性(+++)结果间,空泡征的有无差异有统计学意义(P=0.021,P=0.038,P=0.011),表明有空泡征的病灶HER- 2更多的表达弱阳性结果。然而,由于本研究样本量不多,致使在CT征象与免疫组织化学相关性的研究中各组统计数据偏小,可能会导致数据结果分析的偏倚。
本研究存在一定的局限性:首先,样本量小,由于大部分1 cm以下磨玻璃结节的患者选择随访观察,致使病例收集不多;其次,样本的选择存在偏倚,本研究只纳入了单发磨玻璃结节而对多发磨玻璃结节未予讨论;最后,在对一些密度欠均匀的结节的CT值的测量上可能存在误差。
综上,表现为1 cm以下fGGO的肺腺癌的一些CT征象在其不同病理亚型间存在差异,IPA的空泡征出现率最高,而AAH最低,且浸润前病变(AAH+AIS)多表现为边缘光滑,MIA和IPA则多表现为分叶征+毛刺征;且一些CT征象与特定免疫组织化学结果之间也存在相关性。因此,通过CT征象分析,可以推测肺腺癌病理亚型及预测免疫组织化学结果,以指导临床制定合理的治疗方案。
参考文献
[1]Haro A,Yano T,Kohno M,et al. Ground-glass opacity lesions on computed tomography during postoperative surveillance for primary non-small cell lung cancer[J].Lung Cancer,2012,76(1):56- 60.
[2]Yoon HE,Fukuhara K,Michiura T,et al. Pulmonary nodules 10 mm or less in diameter with ground-glass opacity component detected by high-resolution computed tomography have a high possibility of malignancy[J].Jpn J Thorac Cardiovasc Surg,2005,53(1):22- 28.
[3]Lee HJ,Kim YT,Kang CH,et al. Epidermal growth factor receptor mutation in lung adenocarcinomas:relationship with CT characteristics and histologic subtypes[J].Radiology,2013,268(1):254- 264.
[4]Kadota K,Yeh YC,D’Angelo SP,et al. Associations between mutations and histologic patterns of mucin in lung adenocarcinoma:invasive mucinous pattern and extracellular mucin are associated with KRAS mutation[J].Am J Surg Pathol,2014,38(8):1118- 1127.
[5]Travis WD,Brambilla E,Noguchi M,et al. International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma[J].J Thorac Oncol,2011,6(2):244- 285.
[6]Xing Y,Li Z,Jiang S,et al. Analysis of pre-invasive lung adenocarcinoma lesions on thin-section computerized tomography[J].Clin Respir J,2014,11(10):12142.
[7]Lee HY,Lee KS.Ground-glass opacity nodules:histopathology,imaging evaluation,and clinical implications[J].J Thorac Imaging,2011,26(2):106- 118.
[8]Sasada S,Miyata Y,Tsubokawa N,et al. Role of positron emission tomography/computed tomography findings for adjuvant chemotherapy indications in stage T1b- 2aN0M0 lung adenocarcinoma [J].Ann Thorac Surg,2014,21(14):927- 928.
[9]Lee SM,Park CM,Goo JM,et al. Invasive pulmonary adenocarcinomas versus preinvasive lesions appearing as ground-glass nodules:differentiation by using CT features[J].Radiology,2013,268(1):265- 273.
[10]刘建东,廖强,李建国,等.肺部磨玻璃密度影的CT诊断与鉴别诊断[J].影像与介入,2011,18(13):94- 96.
[11]Lee HY,Choi YL,Lee KS,et al. Pure ground-glass opacity neoplastic lung nodules:histopathology,imaging,and management[J].Am J Roentgenol,2014,202(3):W224- W233.
[12]Kim HY,Shim YM,Lee KS,et al. Persistent pulmonary nodular ground-glass opacity at thin-section CT:histopathologic comparisons[J].Radiology,2007,245(1):267- 275.
DOI:10.3881/j.issn.1000- 503X.2015.02.006
Correlations between Pathologic Subtypes/Immunohistochemical Implication and CT Characteristics of Lung Adenocarcinoma≤1 cm with Ground-glass Opacity
WU Fang,CAI Zu-long,TIAN Shu-ping,JIN Xin,JING Rui,YANG Yue-qing,LI Ying-na,ZHAO Shao-hong
Department of Radiology,Chinese PLA General Hospital,Beijing 100853,China
Corresponding author:ZHAO Shao-hongTel:010- 66939590,E-mail:zhaoshaohong@aliyun.com
ABSTRACT:ObjectiveTo discuss the correlation of pathologic subtypes and immunohistochemical implication with CT features of lung adenocarcinoma 1 cm or less in diameter with focal ground-glass opacity(fGGO).MethodsCT appearances of 59 patients who underwent curative resection of lung adenocarcinoma≤1 cm with fGGO were analyzed in terms of lesion location,size,density,shape(round,oval,polygonal,irregular),margin(smooth,lobular,spiculated,lobular and spiculated),bubble-like sign,air bronchogram,pleural tag,and tumor-lung interface.Histopathologic subtypes were classified according to International Association for the Study of Lung Cancer/ American Thoracic Society/European Respiratory Society classification of lung adenocarcinoma.Common molecular markers in immunohistochemical study included human epidermal growth factor receptor(HER)- 1,HER- 2,Ki- 67,vascular endothelial growth factor(VEGF)and DNA topoisomerase Ⅱα.Patients’ age and lesions’ size and density were compared with pathologic subtypes using analysis of variance or nonparametric Wilcoxon tests.Patients’ gender,lesion location,shape and margin,bubble-like sign,air bronchogram,pleural tag,and tumor-lung interface were compared with histopathologic subtypes and immunohistochemical implication usingΧ2test or Fisher’s exact test.ResultsThe patients’gender,age,lesion location,shape,air bronchogram,pleural tag,and tumor-lung interface were not significantly different among different histopathologic subtypes(P=0.194,0.126,0.609,0.678,0.091,0.374,and 0.339,respectively),whereas the lesion size,density,bubble-like sign,and margin showed significant differences(P=0.028,0.002,0.003,0.046,respectively).The expression of Ki- 67 significantly differed among nodules with different shapes(P=0.015).Statistically significant difference also existed between tumor-lung interface and HER- 1 expression(P=0.019)and between bubble sign and HER- 2 expression(P=0.049).ConclusionsOf lung adenocarcinoma≤1 cm with fGGO,bubble-like sign occurs more frequently in invasive pulmonary adenocarcinoma and less frequently in atypical adenomatous hyperplasia.In additon,preinvasive lesions(atypical adenomatous hyperplasia and adenocarcinoma in situ)more frequently demonstrates smooth margin,while invasive lesions(minimally invasive adenocarcinoma and invasive pulmonary adenocarcinoma)more frequently demonstrates lobular and spiculated margin.Some CT features are associated with immunohistochemical implication of lung adenocarcinoma≤1 cm with fGGO.
Key words:focal ground-glass opacity;lung adenocarcinoma;immunohistochemistry;pathologic subtypes;computed tomography
(收稿日期:2014- 08- 25)
中图分类号:R814.4
文献标志码:A
文章编号:1000- 503X(2015)02- 0163- 08
通信作者:赵绍宏电话:010- 66939590,电子邮件:zhaoshaohong@aliyun.com

