活性维生素D3对UUO模型大鼠肾间质OPN、TGF-β1表达的影响①
刘艳姝,桑吉武,刘中柱,史为伍,牛效清,张国艳,赵春艳,蔡天蕊
(佳木斯大学附属第一医院肾内科,黑龙江 佳木斯 154003)
活性维生素D3对UUO模型大鼠肾间质OPN、TGF-β1表达的影响①
刘艳姝,桑吉武,刘中柱,史为伍,牛效清,张国艳,赵春艳,蔡天蕊
(佳木斯大学附属第一医院肾内科,黑龙江 佳木斯 154003)
目的:研究活性维生素D3在单侧输尿管梗阻模型(UUO)模型肾小管间质纤维化病理过程中对骨桥蛋白(osteopontin,OPN)、转化生长因子-β1(TGF-β1)表达的影响,寻找防治肾间质纤维化的方法。方法:36只清洁级雄性Wistar大鼠,随机分为3组,假手术组(n=12) 、UUO模型组(n=12)活性维生素D3治疗组(n=12)。于输尿管上1/3处用手术缝线结扎活性维生素D3治疗组及UUO模型组大鼠。罗盖全(骨化三醇)给予活性维生素D3治疗组灌胃,共28d。UUO模型组及假手术组等量生理盐水灌胃。于术后第14天、第28天分批处死各组大鼠,留取造模侧肾脏供病理分析。实验结束时,检测各组大鼠血清尿素氮(BUN)值和肌酐(Scr)。HE染色及Masson染色法观察各组大鼠肾小管间质纤维化情况,OPN及TGF-β1在大鼠肾脏的表达情况应用免疫组化法测定。结果:随着梗阻时间延长,UUO模型组、活性维生素D3治疗组大鼠肾脏病理肾小管结构紊乱、周围肾间质增宽,肾间质纤维化面积明显高于假手术组,活性维生素D3治疗组的肾间质纤维化面积低于UUO模型组(P<0.05)。OPN、TGF-β1在UUO模型组和活性维生素D3治疗组表达高于假手术组,UUO模型组OPN、TGF-β1的表达高于治疗组(P<0.05)。结论:①OPN、TGF-β1的表达随着梗阻时间延长逐渐增加。提示OPN、TGF-β1参与了肾间质纤维化的发生及发展。②活性维生素D3治疗组肾间质纤维化程度较UUO模型组改善,且OPN、TGF-β1表达减少,表明活性维生素D3可减少TGF-β1、OPN表达,抑制肾间质纤维化。
骨桥蛋白;转化生长因子-β1;活性维生素D3;肾间质纤维化;单侧输尿管梗阻
肾间质纤维化(RIF)是由各种细胞、细胞因子和炎症递质相互作用导致以胶原蛋白为主的细胞外基质在肾间质异常积聚,最终导致肾小管萎缩,肾间质纤维化。肾间质纤维化与化学因子、钙盐沉积、代谢性酸中毒等多种因素有关[1,2]。OPN是一种重要细胞外基质结构组分,是吸引肾间质巨噬细胞最重要的趋化因子,其表达量与间质炎症和纤维化程度密切相关[3]。目前OPN在RIF中的研究较少,探讨如何阻断OPN在肾脏的表达,对于肾间质纤维化的治疗具有重要意义。TGF-β1广泛分布于不同类型的细胞组织中,被认为是最重要的致纤维化因子之一。TGF-β1能够促进ECM成分如胶原Ⅰ、Ⅲ、Ⅳ的合成,促进蛋白多糖的合成;TGF-β1还可通过诱导成纤维细胞生长因子的表达, 使肾脏成纤维细胞合成增多, 导致肾间质纤维化[4]。活性维生素D3即1,25-二羟维生素D3[1,25-(OH)2D3],其经典作用是参与体内钙磷代谢调节。近年研究发现,活性维生素D3能够减轻肾小管间质纤维和纤维化,延缓肾功能减退等作用。
本实验通过UUO模型模拟肾间质纤维化过程,并给予活性维生素D3干预治疗,观察OPN、TGF-β1在肾脏的表达、分布,探讨其在肾间质纤维化中的作用。同时观察活性维生素D3在肾间质纤维化中的作用,为肾间质纤维化的早期诊断、临床治疗探寻新的方法。
1 材料与方法
1.1 实验动物模型的建立及分组
36只Wistar雄性大鼠体重180~220g,随机分为3组,活性维生素D3治疗组(n=12)、UUO模型组(n=12)、假手术组(n=12)。将UUO模型组大鼠以及活性维生素D3治疗组大鼠称重,水合氯醛6mL/kg腹腔注射麻醉。将大鼠仰卧位且四肢固定于清洁手术台,备皮消毒后行腹中线左侧切口,沿左侧肾脏下极用眼科镊游离左侧肾脏及输尿管,于输尿管上1/3处手术缝线上下结扎两处。术后将肾脏逐层缝合。假手术组分离输尿管不做结扎,手术过程与其它两组相同。活性维生素D3治疗组给予活性维生素D33ng/100g每日灌胃一次,假手术组和UUO模型组给予每日一次0.1mL生理盐水灌胃至实验结束。各组大鼠分别各取6只于结扎术后第14、28天眦静脉取血1~2mL测定Scr和BUN。然后处死大鼠,迅速取出左侧肾脏, 10%中性福尔马林固定液固定,48h后石蜡包埋,将肾组织切成切片。
1.2 肾功能检测
佳木斯大学附属第一医院生化室检测血肌酐、血尿素氮。
1.3 肾脏的病理学检查及免疫组化染色
石蜡包埋的肾组织做2μm连续切片进行HE、Masson染色。应用Image-ProPlus图像分析系统对Masson染色照片进行分析。先在低倍镜下每只动物的切片随机取20个视野,取视野的中央,在200 倍镜下留取图像。计算每个视野下蓝染区域占总视野面积的百分比,取均值。OPN、TGF-β1表达:随机选取15个高倍镜视野(×400),用高清晰度彩色病理图文报告分析系统进行分析,分析每个视野下棕黄色累积光密度值,计算均值。肾组织OPN、TGF-β1免疫组织化学染色采用SABC法,DAB棕黄色反应呈阳性,通过光学显微镜放大400倍摄取图像。
1.4 统计学方法
采用SPSS16.0分析软件,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 梗阻侧肾脏组织大体观察
假手术组大鼠肾脏组织红润,大小正常。UUO组和活性维生素D3治疗组梗阻侧肾脏肾实质变薄,肾盂肾盏高度扩张,体积明显增大,可见肾内积水。
2.2 各组大鼠血肌酐、血尿素氮测定
各时间点血肌酐、血尿素氮水平在假手术组、UUO组活性维生素D3治疗组之间差异无显著性(P>0.05),见表1。
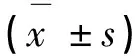
表1 各组大鼠血肌酐、血尿素氮结果
2.3 各组大鼠肾脏病理检查
HE染色镜检结果: 假手术组各时间点大鼠肾脏肾小球均无明显病理改变。肾小管排列紧密,小管周围肾间质无增宽;肾小球、小管结构正常。活性维生素D3治疗组和UUO模型组早期可见肾间质炎症细胞局灶浸润,肾小管扩张不明显.术后第14天,光镜下可见多数小管扩张、灶性萎缩,肾小管上皮细胞弥漫性肿胀、空泡变性,肾小球病理改变不明显。肾小管结构紊乱、变形,肾间质增宽。术后28d,间质纤维化程度加深,小管周围肾间质有散在或多灶性单核、淋巴细胞浸润增多,肾间质明显增宽。活性维生素D3治疗组与UUO模型组相比,同时间点肾小管间质病变程度减轻,肾间质纤维化相对面积也明显减少。活性维生素D3治疗组在术后第14天、28天炎症细胞浸润,肾间质增宽。Masson染色镜检结果:UUO模型组术后14d肾间质增宽、小管上皮细胞弥漫性肿胀,可见单核巨噬细胞、淋巴细胞浸润。术后28d上述情况加剧。假手术组镜下未见明显异常。与UUO模型组在同时间点相比,活性维生素D3治疗组胶原沉积程度和肾小管扩张显著减少(P<0.01),见表2。
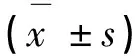
表2 大鼠体内Masson染色肾间质纤维化面积百分比
*与假手术组比较,P<0.05;#与UUO模型组比较,P<0.05。
3 免疫组化染色
3.1 OPN、TGF-β1染色
假手术组大鼠肾间质有极少量OPN、TGF-β1的表达;UUO模型组中术后14d可见OPN、TGF-β1在远曲小管、髓袢升支粗段及一些集合管上皮表达增加,术后28d在上述肾组织OPN表达明显增加,活性维生素D3治疗组也有一定量的OPN、TGF-β1表达,但与同时间点的UUO模型组相比,表达量降低(P<0.05)。
3.2 免疫组织化学结果半定量分析
应用医学图像分析系统,每例切片在200倍光学显微镜下随机选取20个不重叠且不含肾小球以及血管的间质区域,用免疫组化分析软件计算视野下OPNTGF-β1、阳性染色面积与肾间质面积比值,见表3。
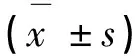
表3 免疫组织化学各组OPN、TGF-β1阳性表达面积百分比
*与假手术组比较,P<0.05;#与UUO模型组比较,P<0.05;##与UUO模型组比较,P<0.01。
4 讨论
肾间质纤维化的发病机制主要与间质炎性细胞浸润、致纤维化细胞因子过度表达,一方面引起细胞外基质合成增加而降解减少,另一方面促使肾小管上皮细胞和间质细胞发生表型转变,表现肌纤维母细胞表型,表达α平滑肌肌动蛋白,获得平滑肌细胞的某些特性,表现为增殖活性增强,表达、分泌细胞外基质能力增强。 肾间质纤维化过程中有促纤维化因子和抑制纤维化因子参与。趋化因子导致的单核巨噬细胞的浸润被认为是小管间质损伤的启动及中心环节。Ophascharornsuk等研究发现,OPN与整合素受体结合可介导巨噬细胞的黏附和迁移,而与CD44结合对巨噬细胞有趋化作用[5]。我们在以往的研究中报道,活性维生素D3治疗UUO大鼠肾组织结缔组织生长因子表达减少,肾间质纤维化程度下降[6]。
OPN具有多种生物学效应,是吸引肾间质巨噬细胞最重要的趋化因子,其表达量与间质炎症和纤维化程度密切相关。本实验结果显示随着间质炎症和纤维化程度的加深,肾小管周围及肾间质的OPN表达增加,提示OPN参与了肾间质纤维化的发生、发展。Giachelli和Pichler在鼠的间质性肾炎动物模型中发现在肾间质损伤区域肾小管上皮细胞内OPNmRNA和OPN蛋白呈过度表达,在肾小管损伤区域OPN的表达部位与巨噬细胞浸润的部位密切相关,且OPN的表达出现在巨噬细胞浸润之前,因此OPN可作为肾小管损伤的一个早期标志[6]。骨桥蛋白参加纤维化的机制可能通过参与炎症反应、促进细胞增殖、重建, 抑制细胞凋亡;参与NO信号途径,且与AngII功能有关。研究提示如早期阻断OPN在肾脏的表达,可对肾间质纤维化存有潜在的治疗价值[7]。
TGF-β1在RIF的发生发展中起着重要作用。TGF-β1能促进炎症细胞的浸润;可刺激成纤维细胞分泌ECM[8];能诱导肾小管上皮细胞凋亡或肾小管上皮细胞-间充质细胞的转化(epithelial-to-mesenchymaltransition,EMT),使其丧失正常表型,表达α-平滑肌肌动蛋白,转分化为肌成纤维细胞,参与肾间质纤维化的形成[9]。本实验结果显示在单侧输尿管梗阻术后第14天在肾间质细胞胞浆中及肾小管周围可见TGF-β1的表达,第28天肾间质区域TGF-β1阳性表达面积增加。提示单侧输尿管梗阻术后肾间质纤维化已经开始逐步形成,说明该动物实验的模型建立是成功的,TGF-β1参与了肾间质纤维化的形成。TGF-β1是参与肾小管上皮细胞-肌纤维母细胞表型转换的重要细胞因子,可作为预测肾间质纤维化进展的理想指标。
活性维生素D3不仅在调节机体钙磷代谢平衡方面有重要作用。许多研究发现,活性维生素D3还对调控RAS系统、改善糖代谢、调节免疫及促进组织细胞的分化与抑制增殖等方面也发挥着重要作用。
在结扎后2周,该侧肾脏出现肾间质纤维化的病理特点,梗阻侧肾脏体积明显增大。随着梗阻时间延长,纤维化程度加深,模型大鼠在术后4周已出现肾小管萎缩、坏死。活性维生素D3治疗组的病理改变较UUO模型组明显减轻,OPN及TGF-β1的表达减少,本实验我们发现活性维生素D3能够延缓肾间质纤维化的进程,具有肾脏保护作用。活性维生素D3对肾脏有保护作用的机制可能是:维生素D抑制炎症因子表达和炎症反应,通过调节SmaD3和转化生长因子通路,促纤维生成细胞因子产生减少[10]。维生素D调节RAS系统,控制血压。维生素D受体敲除的大鼠由于信号转导缺陷, 肾素水平及血压升高,肾间质纤维化加重。通过激活caspases途径以及非caspases途径诱导细胞凋亡,减轻肾间质纤维化[11,12]。 通过本实验,我们推论活性维生素D3对肾间质纤维化模型大鼠的防治作用机制之一可是下调OPN、TGF-β1的表达,预防及治疗肾间质纤维化。
[1]王锁刚, 张翥. 肌成纤维细胞与肾小管间质纤维化[J]. 医学综述,2008,14(7):982-984
[2]MatusanK,DordevieG,MozetieV,etal.ExpressionofosteopontinandCD44moleculeinpapillaryrenalcelltomors[J].PathOloneolRes,2005,11(2):10-13
[3]XieY,SakatsumeM,NishiS,etal.Expression,roles,receptors,andregulationofosteopontininthekidney[J].KidneyInt,2001,60(5):1645-1657
[4]刘艳姝,刘文思,刘中柱,等.活性维生素D3抑制UUO模型大鼠肾间质纤维化的研究及其对α-SMA表达的影响[J].黑龙江医药科学,2013,36(2):72-73
[5]GiachelliCM,PichlerR,LombardiD,etal.OsteopontinexpressioninangiotensionⅡinducedtubulointerstitialnephritis[J].Kidneylnt,1994,45(2):515-524
[6]刘艳姝,于晓崴,刘中柱,等.CTGF在单侧输尿管梗阻大鼠肾组织中的表达及活性维生素D3干预治疗的研究 [J].黑龙江医药科学,2012,35(4):22-23
[7]ZhengW,LiR,PanH,etal.Roleofosteopontinininductionofmonocytechemoattractantprotein1andmacrophageinflammatoryprotein1betathroughtheNF-kappaBandMAPKpathwaysinrheumatoidarthritis[J].ArthritisRheum,2009,60(7):1957-1965
[8]HironobyT,HironobuMD.Pathogenesisoffibrosis:roleofTGF-βandCTGF[J].CurrentOpinion,2002,14(6):681-685
[9]韩敏,徐钢,曾锐,等.β-连环素酪氨酸磷酸化调控E-钙黏蛋白表达参与转化生长因子-β1诱导的人肾小管上皮细胞转分化[J].中华肾脏病杂志, 2006,22(8):494-498
[10]YuanW,PanW,KongJ,etal.25dihydroxyvitaminD3suppressesreningenetranscriptionbyblockingtheactivityofthecyclicAMPresponseelementinthereningenepromoter[J].BiolChem, 2007, 282: 821-830
[11]ChenS,SimsGP,ChenXX,etal.Modulatoryeffectsof1, 25dihydroxyvitaminD3onhumanBcelldifferentiation[J].JImmunol,2007,179: 1634-1647
[12]NishidaM,andHamaokaK.Macrophagephenotypeandrenalfibrosisinobstructivenephropathy[J].NephronExpNephrol,2008, 110(1): 31-36
The influence of active vitamin D3on the expression OPN and TGF-β1in UUO model rat
LIUYan-shu,SANGJi-wu,LIUZhong-zhu,SHIWei-wu,NIUXiao-qing,ZHANGGuo-yan,ZHAOChun-yan,CAITian-rui
(The Department of Nephrology, the First Affiliated Hospital of Jiamusi University ,Jiamusi 154003, China)
Objetive:Using left ureteral ligation to construct unilateral ureteral obstruction models by using left ureteral ligation; And to observe distribution and expression of the transforming growth factor-β1( TGF-β1)and osteopontin (OPN)in kidney tissues in the process of renal interstitial fibrosis; and to explore the influence of active vitamin D3on renal tubule interstitial fibrosis and on the expression OPN and TGF-β1 in UUO model rat. Methods:36 SD rats were randomly divided into sham operated group (n=12),UUO model group (n=12),active vitamin D3treatment group (n=12).In the UUO model group and active vitamin D3treatment groupp, rats were constructed unilateral ureteral obstruction models by left ureteral ligation. We giave calcitriol lavage (3ng/100g)to active vitamin D3treatment group.Animals were sacrificed at 14 and 28 days after operation, and the expression and the distribution of the OPNand TGF-β1 in the kidney tissues were detected by immunohistochemistry. Results:The renal interstitial fibrosis area were significantly higher in UUO model group and active vitamin D3treatment group than those in sham operated group.The renal interstitial fibrosis area in UUO model group wasis higher than that inof active vitamin D3treatment group (P<0.05).TheexpressionofOPNandTGF-β1increasedinUUOmodelgroupandinactivevitaminD3treatmentgroupcomparedwiththatofshamoperatedgroup.TtheOPNandTGF-β1expressioninUUOmodelgroupandactivevitaminD3treatmentgroupincreased.TheexpressionofOPNinUUOmodelgroupwashigherthanthatintheactivevitaminD3treatmentgroup(P< 0.05). Conclusion:①The expression of OPN mainly concentrated in the renal tubule and renal interstitial around. With the obstruction prolonged, OPN expression gradually increase,OPN takes part in renal interstitial fibrosis. ②Active vitamin D3can decrease the expression of OPN and TGF-β1 to relieve renal interstitial fibrosis.
osteopontin;transforming growth factor-β1;unilateral ureteral obsrtution; active vitamin D3
黑龙江教育厅科研项目,编号:12531702。
刘艳姝(1971~)女,黑龙江佳木斯人,硕士,副主任医师,硕士研究生导师。
R693
A
1008-0104(2015)04-0003-03
2015-03-02)

