不同温度下哈维氏弧菌和白斑综合症病毒对凡纳滨对虾的致病性
向赟,吴宇学,王刚,陈兆明,张锐,孙成波、3
(1.广东海洋大学水产学院,广东湛江524025;2.广东海洋大学实验教学部,广东湛江524025;3.广东高校热带海产无脊椎动物养殖工程技术研究中心,广东湛江524025)
凡纳滨对虾Litopenaeus vannamei为世界主要人工养殖对虾品种之一[1],其养殖业已受到多种细菌病和病毒病的威胁,其中白斑综合症病毒作为一种对虾高致死性病毒,传染性强,宿主广泛,危害极大[2]。白斑综合症暴发的原因不仅与虾体免疫水平、感染方式、病毒数量、环境因子有关[3-4],而且还与其他病原体有关,如副溶血弧菌、哈维氏弧菌等。其中哈维氏弧菌属革兰氏阴性,呈弧状,极生单鞭毛,广泛分布于近岸温暖海洋环境中,能感染多种海洋无脊椎和脊椎动物[5],主要感染苗期及幼体的动物,如哈维氏弧菌会引起中国对虾及凡纳滨对虾幼体发病死亡[6-7],也会引起成虾发病死亡。陈月忠等[8]报道,哈维氏弧菌会引起长毛对虾、日本对虾成虾发病死亡,严重制约了全球对虾养殖业的发展。本研究中,对携带白斑综合症病毒 (WSSV)的凡纳滨对虾在不同温度条件下注射感染不同浓度的哈维氏弧菌,探讨哈维氏弧菌对感染WSSV的凡纳滨对虾的影响,旨在为对虾养殖业健康可持续发展提供指导。
1 材料与方法
1.1 材料
健康凡纳滨对虾取自广东海洋大学东海岛海洋生物研究基地,体长为 (8.12±0.83)cm。
试验用哈维氏弧菌Vibrio harveyi由西北农林科技大学刘小林教授提供。
1.2 方法
试验前将凡纳滨对虾暂养5 d,每日投喂对虾人工配合饵料2次,换水1次,日换水量接近100%。试验前随机抽取10尾对虾进行荧光定量PCR检测,检测结果为阴性。
1.2.1 WSSV粗提液的制备 取感染WSSV症状明显的凡纳滨对虾,去除甲壳,按1∶1(g∶mL)加入高盐PBS,冰浴中匀浆,将匀浆液于4℃下以7000 r/min离心15 min;离心后的上清液加入蔗糖至终浓度为30%(质量分数),4℃下以16 000 r/min超速离心 50 min,弃上清,沉淀用 PBS(pH 7.4)重悬,将重悬液用 0.22 μm 的滤膜过滤,分装后于冰箱 (-80℃)中保存备用。
1.2.2 菌悬液的制备 将哈维氏弧菌经接种、活化培养24 h后,用无菌PBS缓冲液稀释,制成菌悬液。
1.2.3 DNA模板提取和引物设计 参照Sun等[9]的方法提取DNA模板,参照You等[10]的方法设计PCR引物,并由生工生物工程 (上海)股份有限公司合成。
1.2.4 标准品的制备 参照程晓燕等[11]的方法制备重组质粒标准品,用核酸分析仪测定重组质粒的DNA浓度,根据下式计算重组质粒的拷贝数:

其中:阿伏加德罗常数为6.02×1023;重组质粒分子量=1个碱基对的平均分子量 (660 g/mol)×重组质粒的总长度 (bp)。
1.2.5 不同温度条件下哈维氏弧菌和WSSV对凡纳滨对虾的致病性试验 采用人工注射感染,在凡纳滨对虾第2腹节与第3腹肌之间往心脏方向注射40 μL病原缓冲液。
将试验对虾放入盛有60 L水的0.1 m3塑料桶中,分别在温度为(19±1)、(25±1)、(31±1)℃下进行培养。试验设继发感染组、单独感染组和对照组,各组均设3个平行,每个平行放对虾30尾。其中,继发感染组先注射 40 μL含 1.0×103copy/μL WSSV病毒粗提液稀释液,一天后再分别注射 40 μL 浓 度 为 1.1 × 105、1.1 × 104、1.1 ×103cfu/mL的哈维氏弧菌菌悬液,分别记为W+V高、W+V中、W+V低组;单独感染组单独注射40 μL 含1.0×103copy/μL WSSV 病毒粗提液稀释液和单独注射浓度为1.1× 105、1.1 × 104、1.1 ×103cfu/mL的哈维氏弧菌菌悬液,分别记为 W、V高、V中、V低组;对照组注射40 μL PBS缓冲液。试验过程中,每日投喂对虾人工配合饵料2次,24 h充气,定时吸出排泄物,日换水量为20%。及时捞出死亡对虾放入冰箱 (-20℃)中保存。各组在感染后0、6、12、24、48、72、96 h取样保存。观察记录对虾发病及死亡情况,定期检测对虾组织中的病毒含量,并对死亡对虾进行病毒检测。
1.2.6 病毒的检测 采用荧光定量PCR方法并参考程晓燕等[11]的方法检测病毒的含量。
2 结果与分析
2.1 (19±1)℃水温下感染哈维氏弧菌对携带WSSV的凡纳滨对虾的影响
2.1.1 凡纳滨对虾的死亡情况 从图1可见,温度为 (19±1)℃时,单独感染不同浓度的哈维氏弧菌和WSSV与继发感染两种病原对凡纳滨对虾的累积死亡率影响不大,至试验结束各组累积死亡率均低于8.9%。
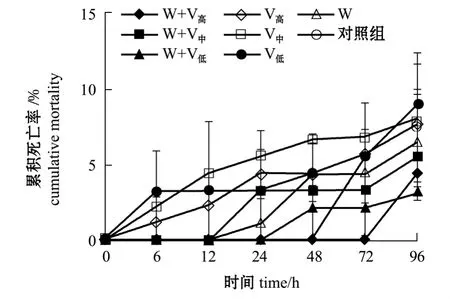
图1 温度为 (19±1)℃条件下感染哈维氏弧菌和WSSV病毒凡纳滨对虾的累积死亡率Fig.1 Cumulative mortality of Pacific white leg shrimp Litopenaeus vannamei infected with Vibrio harveyi and WSSV at(19 ±1)℃
2.1.2 凡纳滨对虾的病毒携带量 从表1可见:温度为 (19±1)℃时,整个试验过程中,单独感染WSSV组对虾体内携带的病毒量在6 h时显著高于继发感染组 (P<0.05);24、48 h时继发感染浓度为1.1×105cfu/mL组的病毒携带量明显高于其他组 (P<0.05);72 h时各组病毒携带量均很高,最大值为3.9×104copy/g。
2.2 (25±1)℃水温下感染哈维氏弧菌对携带WSSV的凡纳滨对虾的影响
2.2.1 凡纳滨对虾的死亡情况 从图2可见:温度为 (25±1)℃时,0~24 h时各组的累积死亡率低于13.3%(P>0.05);至48 h时继发感染浓度为1.1×105cfu/mL 组对虾累积死亡率 (34.3%)明显高于另外两个继发感染浓度组 (P<0.05);至72 h时3个继发感染组和单独感染WSSV组对虾累积死亡率明显高于单独感染不同浓度细菌组,且单独感染WSSV组 (62.2%)和继发感染浓度1.1×105cfu/mL 组(65.7%)显著高于其他组(P<0.05);至96 h时3个继发感染组和单独感染WSSV组的累积死亡率显著高于单独感染不同浓度的细菌组(P<0.05)。
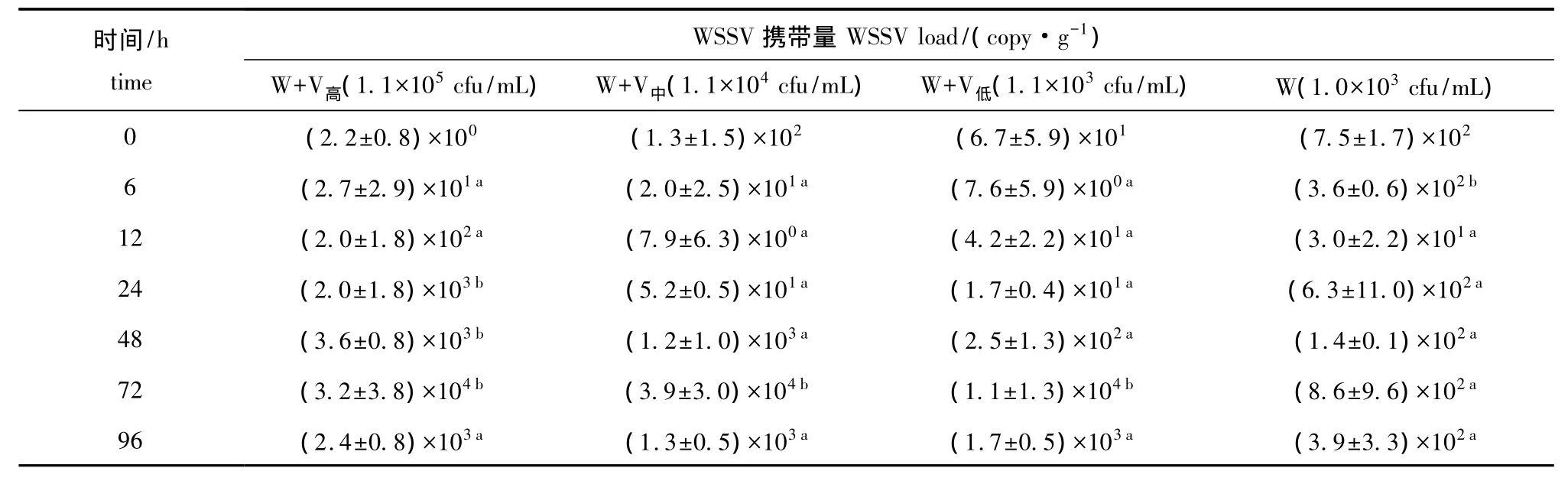
表1 温度为 (19±1)℃条件下感染不同浓度哈维氏弧菌对凡纳滨对虾病毒携带量的影响 (平均值±标准差)Tab.1 Effects of infected concentrations of Vibrio harveyi on amount of virus in Pacific white leg shrimp Litopenaeus vannamei at(19±1)℃ (mean±S.D.)
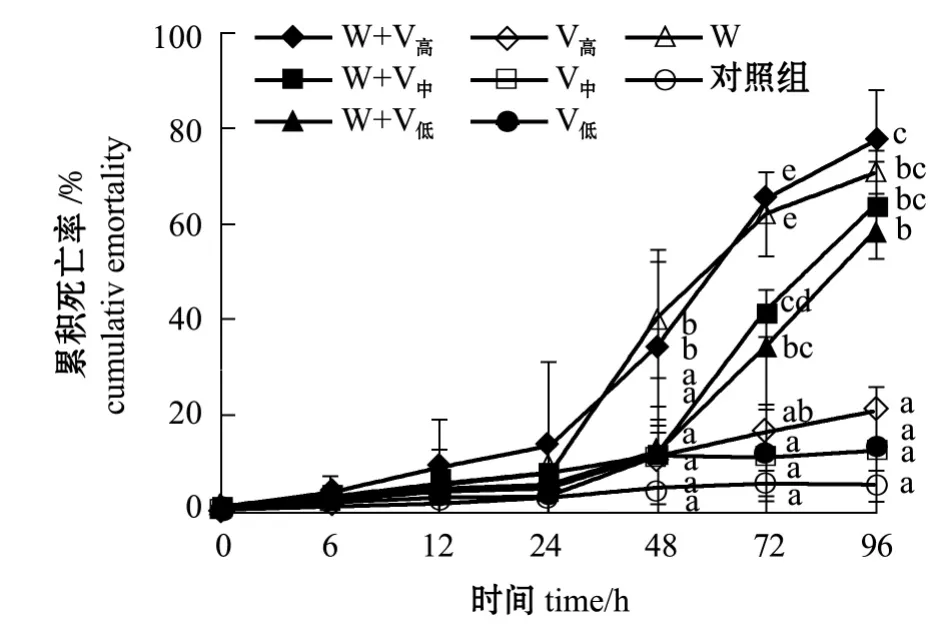
图2 温度为 (25±1)℃条件下感染哈维氏弧菌和WSSV病毒凡纳滨对虾的累积死亡率Fig.2 Cumulative mortality of Pacific white leg shrimp Litopenaeus vannamei infected with Vibrio harveyi and WSSV at(25±1)℃
2.2.2 凡纳滨对虾的病毒携带量 从表2可见:温度为 (25±1)℃时,整个试验过程中,至48 h时单独感染WSSV组对虾体内携带WSSV的病毒量显著高于3个继发感染组 (P<0.05);72 h时单独感染WSSV组对虾体内携带病毒量显著低于3个继发感染组 (P<0.05);96 h时继发感染浓度1.1×105cfu/mL组的病毒携带量明显高于其他组 (P<0.05)。
2.3 (31±1)℃水温下感染哈维氏弧菌对携带WSSV的凡纳滨对虾的影响
2.3.1 凡纳滨对虾的死亡情况 从图3可见:温度为 (31±1)℃时,0~24 h时各组对虾的累积死亡率低于12.0%(P>0.05);至48 h时单独感染WSSV组的累积死亡率显著低于继发感染浓度1.1×103、1.1×105cfu/mL 组 (P<0.05);至 72 h时单独感染WSSV组累积死亡率 (42.3%)明显高于单独感染细菌组 (P<0.05),但明显低于3个继发感染组 (P<0.05),而继发感染浓度1.1×105cfu/mL组的累积死亡率最大,为80.0%。
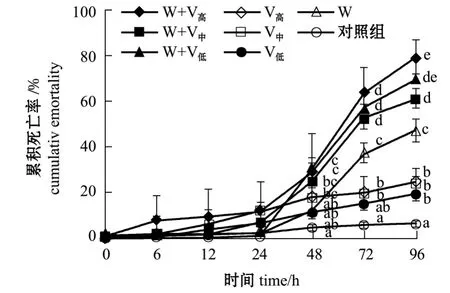
图3 温度为 (31±1)℃条件下感染哈维氏弧菌和WSSV病毒凡纳滨对虾的累积死亡率Fig.3 Cumulative mortality of Pacific white leg shrimp Litopenaeus vannamei infected with Vibrio harveyi and WSSV at(31±1)℃
2.3.2 凡纳滨对虾的病毒携带量 从表3可见:温度为 (31±1)℃时,整个试验过程中,6 h时继发感染浓度1.1×105cfu/mL组与其他组存在显著性差异 (P<0.05);12 h时单独感染WSSV组病毒携带量显著低于浓度为 1.1×105、1.1×104cfu/mL的2个继发感染组 (P<0.05),随着细菌浓度的增加病毒携带量也增加;24 h时病毒开始加快增殖,继发感染浓度1.1×105cfu/mL、1.1×104cfu/mL 组明显高于另两组 (P<0.05);48~72 h时各组病毒携带量均很高;72、96 h时单独感染WSSV组显著低于继发感染组 (P<0.05)。

表2 温度为 (25±1)℃条件下感染不同浓度哈维氏弧菌对凡纳滨对虾病毒携带量的影响 (平均值±标准差)Tab.2 Effects of different concentrations of Vibrio harveyi on amount of virus in infected Pacific white leg shrimp Litopenaeus vannamei at(25±1)℃ (mean±S.D.)
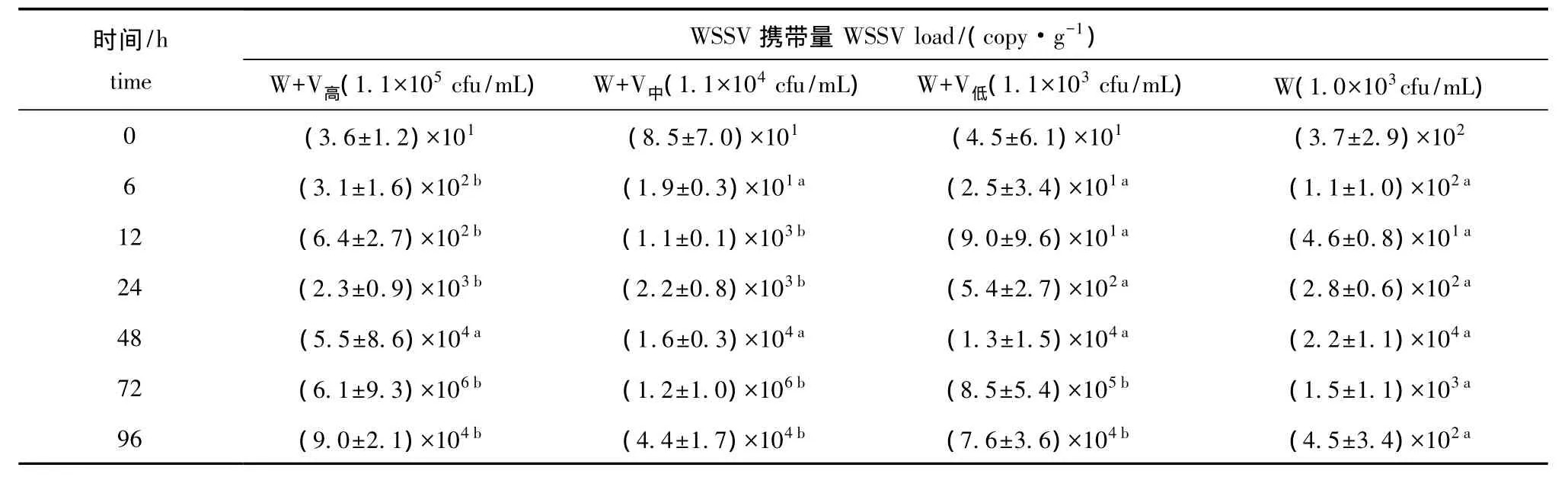
表3 温度为 (31±1)℃条件下感染不同浓度哈维氏弧菌对凡纳滨对虾病毒携带量的影响 (平均值±标准差)Tab.3 Effects of different concentrations of Vibrio harveyi on amount of virus in infected Pacific white leg shrimp Litopenaeus vannamei at(31±1)℃ (mean±S.D.)
3 讨论
温度作为最重要的环境因子之一,不仅直接影响对虾的新陈代谢、抗病能力、进食、生存发育,而且还对病毒在对虾体内增殖有重要影响。李侃等[12]报道,病毒在温度为21~30℃时增殖最快,而当温度低于20℃或超过30℃时,病毒的增殖速度受到部分抑制。Du等[13]报道,虾体内病毒携带量在低温 (10±1)℃条件下明显低于 (24±1)℃条件下,说明低温可以抑制WSSV在虾体内增殖。Jira等[14]报道,将感染WSSV的垂死小龙虾从22℃水温转移至16℃水温,可以延缓小龙虾的死亡,说明低温可以降低WSSV对小龙虾的致病性。Rahman等[15]报道,在对虾感染WSSV前期,高温33℃可以延缓疾病暴发,有效降低对虾死亡率,抑制WSSV在对虾体内增殖;Du等[16]通过试验也证明,高温 (33℃)可以延长病虾存活时间。Sudha等[17]将WSSV与对虾的关系分为3种:第一种为前期急性感染,机体高度感染WSSV,2~3 d时大面积死亡;第二种为急性和亚急性感染,机体中度或高度感染WSSV,7~10 d时出现高死亡率;第三种为慢性感染 (潜伏感染),机体轻微感染,15~28 d时出现死亡。虾体感染细菌后会打破细胞内水与离子含量平衡,促使细胞肿大,破坏细胞氧化酶系统,供能不足,引起物质代谢障碍和细胞功能下降[18],导致抗病能力下降,易引起二次感染。
本研究结果表明,在温度为 (19±1)℃条件下,各组累积死亡率都很低,低于8.9%。病毒携带量检测结果中也发现,随着时间的延长,继发感染组病毒含量有一个升高趋势,之后有下降波动,而单独感染病毒组则没有,各组的病毒含量均低于3.9×104copy/g,低于简旭凤[19]报道的对虾濒死时病毒携带临界值1.0×105copy/g,因此,感染WSSV未出现大量对虾死亡。哈维氏弧菌单独感染组中各浓度组同样未出现大量死亡,说明在低温条件下,两种病原体处于潜伏感染期。管越强[20]报道,水温处于低温 (15℃)对日本对虾体内WSSV的增殖有抑制作用。钟硕良等[21]报道,当水温高于32℃或低于28℃时,哈维氏弧菌生长速度降低,仔虾累积死亡率也随之降低。本试验中也证实,在温度 (19±1)℃下,不仅WSSV在凡纳滨对虾体内的增殖受到抑制,而且哈维氏弧菌在对虾体内的生长也受到影响。
在温度 (25±1)℃条件下,感染哈维氏弧菌后0~24 h,细菌最高浓度继发感染组累积死亡率比其他组高,但各组均低于13.4%;至24 h时继发感染组病毒携带量均低于5.2×103copy/g,但病毒携带量高于单独感染WSSV组;48 h后不同浓度继发感染组和单独感染组之间出现显著差异,单独感染WSSV组的对虾累积死亡率与最高浓度继发感染组相似,继发感染组的累积死亡率随细菌感染浓度的增加而升高,但单独感染WSSV组的死亡率明显高于另外两个浓度继发感染组的结果与丁燏等[22]报道的继发感染累积死亡率要比单独感染高的结果不相符,可能是因为试验温度条件不同所致。目前研究较多的是哈维氏弧菌对凡纳滨对虾仔虾、日本对虾成虾致病性的研究,在低于28℃条件下哈维氏弧菌对凡纳滨对虾成虾的致病性有待进一步研究。至48 h时单独感染WSSV组病毒携带量比继发感染组高,但至72 h时继发感染组病毒携带量迅速增加,明显高于单独感染组。说明随着时间的延长,哈维氏弧菌对对虾组织引起损伤,对虾抗病力下降,为WSSV增殖提供了条件。
在温度 (31±1)℃条件下,感染哈维氏弧菌后0~24 h,各组的累积死亡率低于12.0%,病毒携带量都低于2.3×103copy/g;48 h后继发感染组累积死亡率明显高于独感染组,而且病毒携带量随着细菌感染浓度的升高而增加。单独感染WSSV组累积死亡率和病毒携带量的研究结果说明,在温度为(31±1)℃条件下可以减缓WSSV的增殖,推迟了白斑综合症暴发的时间。此结果与Vidal等[23]报道的在高温 (32.3±0.8)℃ 条件下可推迟携带WSSV凡纳滨对虾暴发白斑综合症的结果相符。继发感染组累积死亡率和病毒携带量的研究结果也证实了钟硕良等[21]报道的在 (31±1)℃条件下有利于哈维氏弧菌生长的结论。先感染WSSV的对虾机体已有损伤,抗病能力下降,更加有利于哈维氏弧菌的侵染,随着细菌数量的增多,对虾抗病能力下降更快,加快WSSV在对虾体内增殖,从而加速对虾死亡。陈细法等[24]认为,携带病毒的对虾生长在良好养殖环境中,可处于潜伏感染期,但由于抗病能力下降会因外在胁迫因子变化引发病毒病。所以,给对虾注射感染细菌后,细菌随血淋巴循环扩散至全身,引起细菌大量繁殖,会加快疾病的发生。
综上,哈维氏弧菌和WSSV两种病原体在低温(19±1)℃条件下,致病力都较低,可能是低温条件不利于病原体在机体内增殖;在温度 (25±1)℃条件下,WSSV对对虾的致病力高于哈维氏弧菌的致病力;在温度为 (31±1)℃条件下,单独感染WSSV时,WSSV的致病力受到一定抑制,随着时间的延长,哈维氏弧菌致病力在感染后期引起WSSV致病力提高,使WSSV在对虾体内增殖加快。因此,温度调控对于对虾养殖中的病害预防有重要意义。
[1]王兴强,马甡,董双林.凡纳滨对虾生物学及养殖生态学研究进展[J].海洋湖沼通报,2005(4):94-100.
[2]Flegel T W.Current status of viral diseases in Asian shrimp aquaculture[C].Israeli Journal of Aquaculture Bamidgeh,2009:229-239.
[3]吴信忠.中国海洋病害学主流研究的进展[J].太平洋学报,2005,10:49-59.
[4]孙成波,何建国,黎子兰,等.凡纳滨对虾和斑节对虾对 WSSV敏感性的比较[J].湛江海洋大学学报,2006,26(3):17-20.
[5]Ramesh A,Venugopalan V.Response of enteric luminous bacteria to environmental conditions in the gut of the fish[J].Journal of Applied Bacteriology,1989,66(6):529-533.
[6]刘问,钱冬,杨国梁,等.南美白对虾虾苗淡化期间发光病病原研究[J].集美大学学报:自然科学版,2005,9(4):300-304.
[7]Vandenberghe J,Li Y,Verdonck L,et al.Vibrios associated with Penaeus chinensis(Crustacea:Decapoda)larvae in Chinese shrimp hatcheries[J].Aquaculture,1998,169(1):121-132.
[8]陈月忠,钟硕良,周宸.成虾发光病病原体的分离鉴定及防治技术研究[J].中山大学学报:自然科学版,2000,39:218-223.
[9]Sun Y,Li F,Xiang J.Analysis on the dynamic changes of the amount of WSSV in Chinese shrimp Fenneropenaeus chinensis during infection[J].Aquaculture,2013,376:124-132.
[10]You X X,Su Y Q,Mao Y,et al.Effect of high water temperature on mortality,immune response and viral replication of WSSV-infected Marsupenaeus japonicus juveniles and adults[J].Aquaculture,2010,305(1):133-137.
[11]程晓艳,刘庆慧,黄倢.实时荧光定量PCR检测对虾白斑综合症病毒方法的建立[J].安徽农业科学,2010(2):14265-14267.
[12]李侃,罗淑娅,徐丽美.温度影响对虾白斑综合症病毒增殖机制的研究[J].应用海洋学学报,2013(1):61-66.
[13]Du H,Dai W,Han X,et al.Effect of low water temperature on viral replication of white spot syndrome virus in Procambarus clarkii[J].Aquaculture,2008,277(3):149-151.
[14]Jira P,Söderhäll K,Söderhäll I.Effect of water temperature on the immune response and infectivity pattern of white spot syndrome virus(WSSV)in freshwater crayfish[J].Fish & Shellfish Immunology,2004,17(3):265-275.
[15]Rahman M M,Corteel M,Wille M,et al.The effect of raising water temperature to 33℃in Penaeus vannamei juveniles at different stages of infection with white spot syndrome virus(WSSV)[J].Aquaculture,2007,272(1):240-245.
[16]Du H H,Li W F,Xu Z R,et al.Effect of hyperthermia on the replication of white spot syndrome virus(WSSV)in Procambarus clarkii[J].Diseases of Aquatic Organisms,2006,71(2):175-178.
[17]Sudha P,Mohan C,Shankar K,et al.Relationship between white spot syndrome virus infection and clinical manifestation in Indian cultured penaeid shrimp[J].Aquaculture,1998,167(1):95-101.
[18]黄琪琰.水产动物疾病学[M].上海:上海科学技术出版社,1993.
[19]简旭凤.白斑综合症病毒(WSSV)原位PCR及定量PCR检测技术的建立[D].广州:中山大学,2003.
[20]管越强.主要环境因子对养殖对虾抗病力及白斑综合症发生的影响[D].北京:中国科学院研究生院,2003.
[21]钟硕良,陈月忠.环境因子对发光细菌的生长及日本对虾仔虾感染死亡率的影响[J].中国水产科学,2001,8(1):41-45.
[22]丁燏,王雷.对虾病毒病暴发前期病毒和弧菌相互作用关系[J].湛江海洋大学学报,2000,20(3):26-31.
[23]Vidal O M,Granja C B,Aranguren F,et al.A profound effect of hyperthermia on survival of Litopenaeus vannamei juveniles infected with white spot syndrome virus[J].Journal of the World Aquaculture Society,2001,32(4):364-372.
[24]陈细法,吴定虎.对虾病毒病和细菌合并感染的病理特点和诊断价值[J].病毒学报,1997,13(2):146-150.

