流式微球分析技术检测重组人干扰素α-2b治疗的慢性乙肝患者血清干扰素-α浓度
吕颖莹 王吉鸣 李均 冯靖祎
浙江大学医学院附属第一医院医工科,浙江杭州310003
流式微球分析技术检测重组人干扰素α-2b治疗的慢性乙肝患者血清干扰素-α浓度
吕颖莹 王吉鸣 李均 冯靖祎▲
浙江大学医学院附属第一医院医工科,浙江杭州310003
目的探讨流式微球分析技术检测重组人干扰素α-2b(安福隆)治疗的慢性乙肝患者血清干扰素-α浓度的可行性。方法采集2012年6月~2014年10月的健康体检者和安福隆治疗的慢性乙肝患者血清及临床资料,采用流式微球分析技术检测慢性乙肝患者治疗组和健康体检人群血清干扰素-α浓度,并与ELISA方法进行比较。结果重组人干扰素α-2b治疗的慢性乙肝患者血清标本中,CBA法检测血清IFN-α的含量范围为15.85~641.40 pg/mL,其浓度为(145.65±35.42)pg/mL;而ELISA法检测IFN-α的含量范围为10.43~495.90 pg/mL,其浓度为(113.73± 26.47)pg/mL;CBA法检测慢性乙肝治疗组IFN-α的含量略优于ELISA法(t=5.137,P=0.0065)。CBA法和ELISA法检测健康对照组中血清IFN-α的含量分别为(3.56±0.96)pg/mL和(3.49±0.92)pg/mL。结论流式微球分析技术能够很好检测血清中的干扰素-α的浓度,为临床上监测IFN-α治疗的慢性乙肝患者血清中的IFN-α的浓度提供参考价值。
流式微球分析技术;干扰素-α;ELISA
目前,干扰素-α(IFN-α)在治疗感染性疾病特别是慢性乙肝患者中发挥着重要的作用,不仅能够有效地阻断病毒繁殖和复制,降低肝癌和肝纤维化的发生,而且干扰素-α有效地促进机体的免疫功能,起到抗病毒的作用[1-3]。此外干扰素-α的血清浓度与治疗的效果密切相关[3-5],因此选择合适的方法准确可靠地检测干扰素-α的浓度是提高患者治疗效果的关键。目前流式微球分析技术(CBA)逐渐用于检测血清中的细胞因子[6,7],而对干扰素-α浓度的方法研究相对较少,本研究通过比较分析流式微球分析技术检测慢性乙肝患者和健康体检者血清干扰素-α的浓度,并与ELISA方法进行比较,为临床上合理地检测IFN-α治疗的慢性乙肝患者血清中的干扰素-α浓度提供参考价值。
1 资料与方法
1.1 临床资料
选择2012年6月~2014年10月30例健康体检者,由浙江大学医学院附属第一医院提供,35例重组人干扰素α-2b(安福隆)治疗慢性乙肝患者的血清标本由浙江大学医学院附属第一医院和湖州市中心医院提供。慢性乙肝患者中男24例,女11例,年龄21~52岁,平均(33.2±9.1)岁;健康体检者中男22例,女8例,年龄20~51岁,平均(34.7±10.2)岁。
1.2 材料
血清IFN-α流式微球检测试剂盒(No.560379)、FACSCalibur流式细胞仪和荧光校准微球,均购于BD公司;血清IFN-α ELISA检测试剂盒(No.BMS216)购于eBioscience公司;酶标仪(iMark)购于BIO-RAD公司。1.3方法
1.3.1 流式微球分析技术①空白对照1孔,加样本稀释液50 μL;②样本孔各1孔,取1∶4稀释的样本50 μL加入到孔中;③样本孔和对照孔中分别加入50 μL的捕获磁珠,混匀后室温孵育1 h;④每孔加入50 μL的PE标记检测抗体,室温避光孵育2 h;⑤每孔加入1 mL洗涤液,200 g离心5 min,并弃去上清;⑥每管加入300 μL洗涤液后混匀并上机检测。标准品初始浓度为2500 pg/mL,通过倍比稀释为:1250.0、625.0、312.5、156.0、80.0、40.0、20.0、10.0 pg/mL。计数>500个,得到每个测定样本的荧光强度。
1.3.2 ELISA方法①空白对照2孔,加样本稀释液100 μL;②样本孔各2孔,80 μL稀释液和20 μL样本到样本孔;③样本孔和对照孔中分别加入50 μL HRP标记的酶结合物,室温孵育2 h;④用洗液洗板3次;⑤每孔加入TMB底物显色液100 μL,室温孵育10 min;⑥加入100 μL终止液,于1 h内用450 nm波长的酶标仪检测分析。标准品初始浓度为1000 pg/mL,通过倍比稀释为:500.0、250.0、125.0、62.5、31.3、15.6、7.8 pg/mL。
1.4 统计学分析
应用Graph Pad统计学软件进行统计分析。两种方法检测结果的比价采用配对t检验,年龄比较采用非参数U检验,性别采用四格表的χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 CBA与ELISA方法标准曲线的建立
血清IFN-α浓度的检测,首先要建立良好的标准曲线,CBA法中标准品初始浓度为2500 pg/mL,通过倍比稀释为:1250.0、625.0、312.5、156.0、80.0、40.0、20.0、10.0 pg/mL。计数>500个,得到每个测定样本的荧光强度(图1A);ELISA法中标准品初始浓度为1000 pg/mL,通过倍比稀释为:500.0、250.0、125.0、62.5、31.3、15.6、7.8 pg/mL,用450 nm波长的酶标仪检测分析(图1B)。标准曲线的结果显示两种方法的线性均较好(R2=0.999),但CBA的线性范围更大,为3.9~1250.0 pg/mL;而ELISA法的范围仅为7.8~500.0 pg/mL。
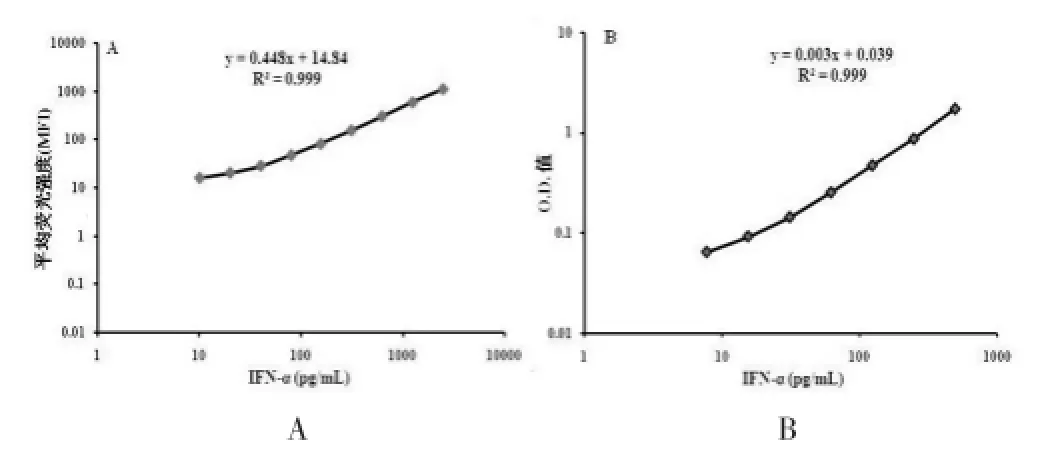
图1 IFN-α标准曲线的建立A.CBA标准曲线的建立;B.ELISA方法标准曲线
2.2 CBA与ELISA方法检测血清IFN-α的表达量
健康体检组和慢性乙肝组的年龄(U=484.5,P= 0.5983)和性别(χ2=0.1771,P=0.6739)均匹配。安福隆IFN-α治疗慢性乙肝患者的血清标本中,CBA法能够检测出血清中IFN-α的含量(图2)。35例慢性乙肝患者治疗前,CBA法检测的浓度分别为(2.95±0.76)pg/mL,安福隆IFN-α治疗患者的血清标本中,CBA法检测血清IFN-α的含量范围为15.85~641.40 pg/mL,平均浓度为(145.65±35.42)pg/mL;而ELISA法检测治疗前IFN-α的浓度为(2.85±0.54)pg/mL,治疗后IFN-α含量范围为10.43~495.90 pg/mL,平均浓度为(113.73± 26.47)pg/mL;流式微球分析技术和ELISA方法分别检测30例健康对照组中血清IFN-α的含量分别为(3.56±0.96)和(3.49±0.92)pg/mL。见表1。

图2 CBA法检测血清中IFN-α的表达量
表1 CBA与ELISA法检测血清IFN-α的含量(s,pg/mL)

表1 CBA与ELISA法检测血清IFN-α的含量(s,pg/mL)
方法健康对照组慢性乙肝组治疗前治疗后C B A E L I S A t值P值2 . 9 5 ± 0 . 7 6 2 . 8 5 ± 0 . 5 4 1 . 3 1 4 0 . 2 3 2 5 1 4 5 . 6 5 ± 3 5 . 4 2 1 1 3 . 7 3 ± 2 6 . 4 7 5 . 1 3 7 0 . 0 0 6 5 3 . 5 6 ± 0 . 9 6 3 . 4 9 ± 0 . 9 2 1 . 2 7 8 0 . 2 1 1 5
3 讨论
流式微球分析技术(cytometric beads array,CBA)是近年发展起来的新技术,它是流式细胞术与荧光微球相结合的成果。其实验或检测中的数据收集和分析是通过聚苯乙烯荧光微球上锁携带的信号来完成,而不再是细胞。流式微球分析技术是将聚苯乙烯微球、荧光染料标记系统、激光技术、应用流体学、数据分析软件及流式细胞仪有机地整合在一起而产生的新技术,又被称为“液态生物芯片”[6-8]。
流式微球分析技术与传统的ELISA基本一致,主要采用双抗体夹心的免疫检测模式,但有ELISA无法比拟的优越性。比如通量大:一次可同时分析多种不同的细胞因子,而ELISA每次只能分析单一成分;此外还具有样本用量少,特异性强,敏感度高及重复性好等优点,因此流式微球分析技术已广泛应用于临床及生物样品的蛋白检测中,如细胞因子的检测(IL-4、IL-6、IL-10等)、组织配型及自身抗体的检测等[7-10]。
目前,国内外对于血清中IFN-α的检测主要应用酶联免疫吸附法(ELISA),放射免疫法及免疫印迹法(Western blot)等,由于其检测结果的重复性差,方法的本身缺陷,且需要的样本量较大等缺点,导致临床应用较少。因此流式微球分析技术在检测血清学中细胞因子(IFN-α)等可溶性蛋白中,将有非常广阔的研究和应用价值[9,10]。我国是一个乙肝大国,IFN-α的治疗目前已经广泛应用于临床,相关药物浓度的检测和监测研究相对较少[11-14]。
本研究中,我们应用流式微球分析技术和ELISA方法分别检测IFN-α的浓度,其标准曲线显示其线性均较好(R2=0.999),但CBA法比ELISA法的线性范围更大,提示CBA法的敏感性较ELISA发更高。此外,两种方法分别检测健康体检者和慢性乙肝患者治疗前和安福隆治疗后血清中IFN-α的浓度,结果显示,CBA法检测治疗组血清IFN-α的含量范围(15.85~641.40 pg/mL)比ELISA法检测治疗组IFN-α的含量范围(10.43~495.90 pg/mL)更大(t=5.137,P=0.0065),提示ELISA法对高浓度的IFN-α含量检测存在局限性。此外两种方法对健康对照组(t=1.278,P=0.2115)和治疗前(t=1.314,P=0.2325)血清IFN-α的含量分别没有明显差异,提示健康体检者和慢性乙肝患者血清中的IFN-α含量均较低,其检测的结果与灵敏度有关,与其他研究结果基本一致[1,3]。
总之,应用流式微球分析技术检测安福隆等药物治疗的慢性乙肝患者血清中IFN-α的浓度,略优于ELISA法,为建立合理的干扰素-α治疗浓度体系奠定基础,为临床合理应用干扰素治疗慢性乙肝患者提供新的思路,对提高患者的疗效和减少其经济和社会负担具有重要的推广价值。
[1]Yeh ML,Peng CY,Dai CY,et al.Pegylated-interferon alpha therapy for treatment-experienced chronic hepatitis B patients[J].PLoS One,2015,10(4):e0122259.
[2]Mihm S.Activation of Type I and TypeⅢInterferons in Chronic Hepatitis C[J].J Innate Immun,2015,7(3):251-259.
[3]Zhang YL,Zhang J,Cui LY.Interferon-α combined with lamivudine versus lamivudine monotherapy for the emergence of YMDD mutations inchronic hepatitis B infection:A meta-analysis of randomized controlled trials[J].Hepatogastroenterology,2015,62(137):133-139.
[4]Guo P.Suppression of interferon-mediated antiviral immunity by hepatitis B virus:An overview of research progress[J].Scand J Immunol,2013,78(3):230-237.
[5]Brunetto MR,Bonino F.Interferon therapy of chronic hepatitis B[J].Intervirology,2014,57(3-4):163-170.
[6]Zhang F,Zou M,Li J,et al.Cytometric microsphere array for subtyping avian influenza virus[J].Viral Immunol,2011,24(5):403-407.
[7]Mayali X,Palenik B,Burton RS.Dynamics of marine bacterial and phytoplankton populations using multiplex liquid bead array technology[J].Environ Microbiol,2010,12(4):975-989.
[8]Fujiwara K,Shimano K,Tanaka H,et al.Application of bead array technology to simultaneous detection of human leucocyte antigen and human platelet antigen antibodies[J]. Vox Sang,2009,96(3):244-251.
[9]张洁,林远,金伯泉.流式微球载体技术在检测肾综合征出血热患者血清特异性抗体和细胞因子中的应用[J].细胞与分子免疫学杂志,2009,25(3):245-247.
[10]李金霖,黄艳,张琼丽,等.流式微球技术检测血小板膜糖蛋白自身抗体的方法建立及临床价值[J].临床血液学杂志,2010,23(3):285-288.
[11]黄湛镰,赵志新,邓洪,等.聚乙二醇干扰素-2a联合短程拉米夫定治疗HBeAg阳性慢性乙型肝炎的疗效[J].中华肝脏病杂志,2010,18(6):419-422.
[12]王蜀强,徐开菊,吴家,等.不同疗程干扰素联合核苷(酸)类似物治疗HBeAg阳性慢性乙型肝炎的疗效[J].中华肝脏病杂志,2011,19(10):785-786.
[13]李茂荚,袁学兰,张丸惠.聚乙二醇干扰素单用或联合核苷(酸)类似物治疗慢性乙型肝炎疗效与安全性的荟萃分析[J].中华肝脏病杂志,2012,20(6):442-447.
[14]刘汉屈,秦波.干扰素治疗慢性乙型肝炎的分子机制研究进展[J].世界华人消化杂志,2009,17(18):1803-1808.
The detection of serum IFN-α concentration in the of hepatitis B patients treated with recombinant interferon α-2b by cytometric bead array
LV YingyingWANG JimingLI JunFENG Jingyi
Department of Medical Engineering,the First Affiliated Hospital,School of Medicine,Zhejiang University,Hangzhou 310003,China
Objective To explore the feasibility of the cytometric bead array(CBA)in detecting concentration of interferon-alpha(IFN-α)in the serum of chronic hepatitis B(CHB)patients treated with recombinant interferon α-2b(Anferon). Methods The sera and clinical data of the healthy controls and the CHB patients treated with Anferon were collected from Jun 2012 to Oct 2014,IFN-α concentration was detected in the sera of healthy controls and CHB patients treated with Anferon by CBA method,comparing with ELISA method.Results In the serum of CHB patients treated with recombinant interferon α-2b,the IFN-α concentration tested with CBA method ranged from 15.85 to 641.40 pg/mL,was (145.65±35.42)pg/mL;concentration detected with ELISA method was(113.73±26.47)pg/mL,ranged from 10.43 to 495.90 pg/mL.The CBA method was slightly better than that of ELISA method in detecting the serum IFN-α concentration from CHB patients after treatment(t=5.137,P=0.0065).The concentration of IFN-α serum in healthy controls tested by CBA and ELISA method was(3.56±0.96)and(3.49±0.92)pg/mL,respectively.Conclusion The CBA method can detect serum IFN-α concentration,which provides reference value for clinical monitoring of IFN-α in the serum of CHB patients treated with interferon-alpha.
Cytometric bead array;Interferon-alpha;ELISA
R512.6
A
1673-9701(2015)24-0011-03
2015-05-21)
浙江省科技计划项目(2013C37049)
▲通讯作者

