CO2浓度变化下燕麦对干旱胁迫的生理响应
刘锦春, Johannes H.C. Cornelissen(.三峡库区生态环境教育部重点实验室,重庆市三峡库区植物生态与资源重点实验室,西南大学生命科学学院,重庆 40075; .Department of Ecological Science VU University Amsterdam De Boelelaan 085, 08 HV Amsterdam, the Netherlands)
CO2浓度变化下燕麦对干旱胁迫的生理响应
刘锦春1, Johannes H.C. Cornelissen2
(1.三峡库区生态环境教育部重点实验室,重庆市三峡库区植物生态与资源重点实验室,西南大学生命科学学院,重庆 400715; 2.Department of Ecological Science VU University Amsterdam De Boelelaan 1085, 1081 HV Amsterdam, the Netherlands)
利用步入式CO2生长室模拟研究了CO2浓度变化和土壤含水量的交互作用对燕麦(Avenasativa)的光合、生长及水分利用效率的影响。结果表明,低CO2浓度对燕麦的光合作用和生物量产生极大的抑制作用,而高CO2浓度产生一定的促进作用。在低CO2浓度下,燕麦的净光合速率和水分利用效率随着水分含量的降低没有发生显著变化,生物量和叶氮含量有少量降低,根冠比增加。在高CO2浓度下,燕麦的净光合速率、根冠比、水分利用效率随着水分含量的降低而有升高趋势,叶氮含量变化不显著,但生物量显著下降。研究认为过去低CO2浓度没有加剧干旱对燕麦的负面影响,将来高CO2浓度也未能减缓干旱对燕麦的负面影响。燕麦对过去低CO2浓度的适应可能限制了自身对将来高CO2浓度的响应。
CO2浓度升高;燕麦;水分胁迫;光合速率;生物量
植物进化过程中,大气CO2浓度发生了剧烈变化。在末次冰河时期(Last Glacial Maximum,LGM)和上新世晚期(Late Pliocene),大气CO2浓度达到最小值150~190 μmol·mol-1。最近200年,CO2浓度急剧上升,目前大约为 400 μmol·mol-1,预计在2100年可能达到700 μmol·mol-1[1]。地质史上低CO2浓度对植物的进化、生长和发育产生了重要影响,甚至影响了早期人类文明和农业的起源[2];将来CO2浓度升高对植物和整个社会的影响更是引起了全球的广泛关注[3]。
土壤水分是影响植物生长发育和生理生化响应的主要因子和限制植物生长的关键因素[4]。在CO2浓度较低的工业化前期,地球上的降水远低于目前水平[5-6],陆生植物的进化面临着低CO2浓度和干旱的双重胁迫。在CO2浓度升高的将来,全球气候变化异常,干旱等极端灾害事件将频繁发生并不断加剧[1]。因此,不管是在过去低CO2浓度环境下,还是在将来高CO2浓度环境下,干旱都与CO2浓度共同作用影响着植物的生理功能及生物量生产,从而又反过来影响全球气候[7-8]。
目前普遍认为,CO2浓度升高降低了干旱胁迫对植物的影响[9-11]。由此也推测CO2浓度降低将加剧水分胁迫的负面影响[6]。然而,植物在缺水和CO2浓度变化情况下,不得不面对这样一个可能的悖论:在高CO2条件下,植物只需打开较少的气孔,消耗较少的水分,但CO2的“施肥”作用将刺激植物的光合作用和生长速率,导致植物对水、肥的需求增加[12];在低CO2条件下,植物需打开较多的气孔消耗较多的水分,才能生产足够的光合产物,但由于生长速率的限制,植物的需水量和土壤耗水量又均可能降低[2]。因此,在“过去”C饥饿和“将来”C饱和情况下,再遭受干旱胁迫,植物会面临着更为严重的光合C获取和水分散失之间的平衡难题。 植物如何平衡这个矛盾?在长期的进化过程中,植物会对其生存环境产生一系列的生理生态适应性调节,这些适应主要涉及植物的表型可塑性、生理过程、碳氮在各器官中的分配和生物地球化学循环等各个尺度[13-15]。燕麦(Avenasativa)是一类比较抗旱、耐贫瘠、抗寒、喜阴的一年生植物[16],为我国主粮之一,也是营养价值极高的粮饲兼用植物,在世界上种植面积仅次于小麦(Triticumaestivum)、水稻(Oryzasativa)、玉米(Zeamays)而居于粮食植物的第四位[17]。燕麦在“过去”C饥饿和“将来”C饱和情况下如何利用有限的土壤水分?CO2浓度的变化是否改变燕麦对干旱胁迫的影响?这些问题的回答无疑对预测全球气候变化对农业生产及整个陆地生态系统的影响具有重要的意义。
1 材料与方法
试验在荷兰乌特勒支大学特制的步入式CO2浓度控制生长室内完成。以燕麦为材料,于2012年3月15日在当前CO2浓度(400 μmol·mol-1)生长室下进行发芽,出苗后选取长势基本一致的72株幼苗分成两组移栽于内盛1.5 kg沙子的花盆(内径15 cm),置于3个不同浓度CO2生长室(即180、400和700 μmol·mol-1)。同时对每个CO2生长室的幼苗进行3个水分含量处理(田间持水量的30%、50%、100%,下简称30%FC、50%FC和100%FC),共9个处理,每个处理8个重复。每2天对幼苗补充一次稀释2倍的Hoagland 营养液,待幼苗第1片真叶完全展开后,进行水分处理,并使每个处理仍然保持稀释2倍的Hoagland 营养液浓度。水分处理采用称重法控制[18]。试验处理为3周。3周后在上午9:00-11:00,每个处理选取3株幼苗,每株幼苗选取植株中段3片成熟健康叶片,利用光合测定分析仪(美国Li-COR公司生产的Li-6400便携式)进行光合测定。测定时,通过Li-6400 CO2钢瓶,控制CO2浓度在380 μmol·mol-1,温度25 ℃,相对湿度60%,光合有效辐射(PAR)为外加光源,控制在800 μmol·m-2·s-1。光合测定完成后,分成地上部分和地下部分进行收获,称量鲜重后装入牛皮纸袋,置入烘箱中105 ℃杀青15 min,然后在80 ℃下烘干至恒重,再称量各部分干重,进一步计算总生物量和根冠比(根冠比=地下部分生物量/地上部分生物量)。然后在所有叶片干样中随机选取3片叶子,用球磨仪磨样(MM200,Retsch,Haan Germany),利用稳定同位素比列质谱仪(DELTA,USA)进行δ13C的测定,利用Flash EA1112元素分析系统(Thermo Scientific,Rodana,Italy)进行叶片的N素测定。内在水分利用效率(WUE)=净光合速率(Pn)/气孔导度(Gs)。同时,为了表征不同水分梯度和CO2浓度梯度的影响差异,计算了水分效应幅度和CO2浓度效应幅度,以CO2浓度变化对光合速率的影响为例,当CO2浓度从180 μmol·mol-1升高到400 μmol·mol-1时,CO2浓度对光合速率的效应幅度为(Pn400-Pn180)/Pn180×100%,同样,当CO2浓度从400 μmol·mol-1升高到700 μmol·mol-1时,CO2浓度对光合速率的效应幅度为(Pn700-Pn400)/Pn400×100%,以此类推。
数据用SPSS 20.0进行统计,采用二因素方差分析(ANOVA)以分析不同CO2浓度和水分含量及其交互作用对燕麦的影响(P<0.05为显著差异水平)。
2 结果与分析
2.1 净光合速率
在低CO2浓度180 μmol·mol-1下,土壤水分含量降低对燕麦的净光合速率没有产生显著影响(P>0.05);在当前CO2浓度400 μmol·mol-1下,土壤水分含量降低引起燕麦的净光合速率下降,水分含量降低到30%田间持水量(30%FC)时,净光合速率与对照(100%FC)差异显著(P<0.05);在高CO2浓度700 μmol·mol-1下,燕麦的净光合速率随着土壤水分含量降低而有升高的趋势(图1,表1)。在不同水分条件下,CO2浓度升高总体上均使燕麦的净光合速率增加,但CO2浓度从180到400 μmol·mol-1时,其升高幅度远远大于从400升高到700 μmol·mol-1(图1,表1)。双因素方差分析表明,CO2和水分处理对燕麦的净光合速率没有显著的交互作用(表2)。
2.2 生物量积累和分配
在不同CO2浓度处理下,随着土壤水分含量的降低,燕麦的生物量较对照都显著降低(P<0.05)。在低CO2浓度下180 μmol·mol-1和高CO2浓度下700 μmol·mol-1,50%FC和30%FC含水量使其生物量显著下降,但两个水分处理间差异不显著(P>0.05);在当前CO2浓度400 μmol·mol-1下,50%FC和30%FC土壤含水量使其生物量下降幅度分别为63%和72%,两者间差异显著(图1,表1)。在不同水分处理下,CO2浓度升高均增加了燕麦的生物量积累。同样,CO2浓度从180到400 μmol·mol-1时,其生物量升高幅度远大于400升高到700 μmol·mol-1(图1,表1)。CO2和水分处理对燕麦的生物量具有极显著的交互作用(P<0.001)(表2)。
在低CO2浓度180 μmol·mol-1和高CO2浓度下700 μmol·mol-1,根冠比均随着水分含量的降低而升高,但在当前CO2浓度400 μmol·mol-1下,根冠比表现出先下降后上升的趋势,3种水分处理间没有显著差异(图1,表1)。在不同水分条件处理下,燕麦的根冠比均随着水分含量的降低而升高,其仍然表现为CO2浓度从180到400 μmol·mol-1的升高幅度大于CO2浓度从400升高700 μmol·mol-1(图1,表1)。方差分析结果表明,CO2浓度和水分处理对根冠比无显著交互作用(表2)。
2.3 叶氮含量
在低CO2浓度下180 μmol·mol-1,叶片氮含量随着水分含量下降而下降,但50%FC和30%FC下其下降幅度基本一致,不同水分处理间差异不显著(P>0.05)(图1,表1);在CO2浓度400 μmol·mol-1下,叶片氮含量下降幅度随土壤水分下降的幅度增大而增大,不同水分处理间差异显著(P<0.05);在高CO2浓度700 μmol·mol-1下,叶片氮含量随水分含量降低出现先升高而降低的趋势。在100%FC水分条件下,叶片氮含量随CO2浓度升高出现先增加后降低的趋势;在50%FC和30%FC下,叶片氮含量均随着CO2浓度升高而升高,且从CO2浓度180到400 μmol·mol-1下升高的趋势大于从400到700 μmol·mol-1(图1,表1)。在CO2浓度、水分处理及两者的交互作用对叶氮含量均有极显著作用(P<0.001)(表2)。
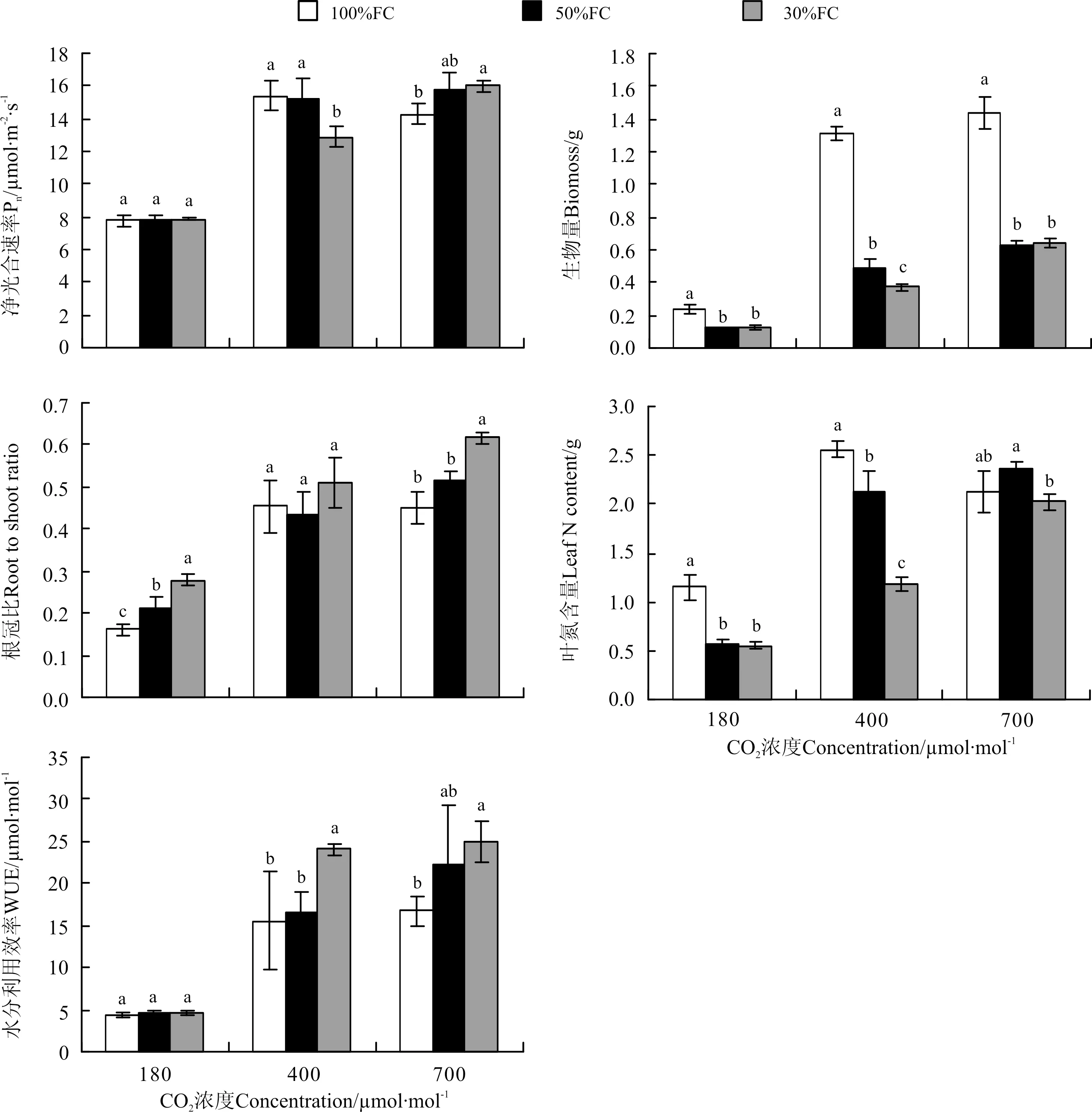
图1 CO2浓度和水分处理对燕麦的净光合速率、生物量生产和分配及水利用效率的影响 Fig.1 Effects of CO2concentration and water treatments on Pn, biomoss accumulation and allocation, leaf N, and water use efficiency (WUE) inA.sativa
注:不同小写字母表示同一CO2浓度下的不同水分处理间差异显著(P<0.05)。Note: Different lower case letters within the same CO2concentyration indicate significant difference among different water treatments at 0.05 level.
2.4 水分利用效率WUE
在低CO2浓度180 μmol·mol-1下,水分利用效率WUE随着水分含量的降低未发生显著变化(P>0.05);在400 μmol·mol-1和高CO2浓度700 μmol·mol-1下,水分利用效率随着水分含量的降低而呈现增加趋势。在任何水分处理下,CO2浓度升高都使燕麦的瞬时水分利用效率增加,且增加幅度也表现为从低CO2浓度到当前CO2浓度大于从当前CO2浓度到高CO2浓度(图1,表1)。方差分析表明,CO2浓度和水分处理对瞬时水分利用效率无显著交互作用(表2)。

表1 燕麦净光合速率、生物量积累和分配及水利用效率的水分效应幅度和CO2浓度效应幅度Table 1 The increase (decrease) extents of CO2and water effects on Pn, biomoss accumulation and allocation, leaf N, and water use efficiency (WUE) inA.sativa

表2 燕麦净光合速率、生物量积累和分配、叶片N含量及水利用效率对不同CO2浓度和土壤水分含量响应的二因素方差分析Table 2 Results of Two-way ANOVA test for the effects of CO2concentration and water availability on variables ofA.sativaunder two CO2concentrations and three water supplies
注:***表示差异极显著,P<0.001; ns表示差异不显著(P>0.05)。
Note: *** indicate significant difference at 0.01 level; ns, not significant difference at 0.05 level.
3 讨论
3.1 光合速率与生物量积累
光合作用是植物对CO2浓度和水分响应最直接最敏感的指标之一。本研究发现,在当前CO2环境浓度下,水分含量降低导致燕麦的净光合速率显著降低,从而也导致生物量积累显著减少。但在过去的低CO2浓度下(180 μmol·mol-1),燕麦的净光合速率并没有受到土壤水分含量的影响,在将来高CO2浓度下(700 μmol·mol-1),净光合速率随着水分含量下降甚至有升高的趋势。在低CO2浓度下,为了弥补C“饥饿”,植物需要打开较多的气孔,消耗较多的水分,才能生产足够的光合产物,这将加剧干旱胁迫的负面影响;但是,由于C的“限制”,植物生长速率受阻,植物的需水量和土壤耗水量均可能降低[2],这又将减缓干旱胁迫的负面影响。因此,在上述两方面的作用下,燕麦在C获取和水分散失间最终取得平衡,净光合速率没有受到干旱胁迫的影响。相反,在高CO2浓度下,植物通常需要降低气孔导度和蒸腾速率,使单位叶面积土壤水分耗损率降低,提高植物水分利用率,从而提高了植物避免干旱伤害的能力[19-20]。然而,有研究发现,在高CO2浓度处理时间较短或者与胁迫条件交互作用下,植物气孔导度并不会显著下降[21]。本研究中燕麦的净光合速率在高CO2浓度处理下并没随着水分含量下降而降低,可能原因之一就是气孔导度并没有下降。不管是在低CO2浓度下还是高CO2浓度下,即使净光合速率没有受到水分含量降低的显著影响或甚至有升高的趋势,生物量的积累却都是随着水分含量的降低而减少,其原因是水分胁迫导致植物生长过程受限,总叶面积减少,地上生物量降低,但瞬时光合表现却出现对干旱胁迫一定程度的正补偿效应。然而,在低CO2浓度下,生物量随水分降低而减少的幅度低于在高CO2浓度下减少的幅度,说明低CO2浓度并没有加剧干旱胁迫的负面影响,高CO2浓度也并没有显著降低干旱胁迫的负面影响。
在试验处理的任何水分条件下,总体上净光合速率和生物量均随着CO2浓度升高而显著增加,然而,从过去低CO2浓度到当前CO2浓度,其增加幅度远大于从当前CO2浓度到将来CO2浓度,这一结果证实了众多学者的观点:植物对过去低CO2浓度的响应限制了植物对将来高CO2浓度的响应[1,22]。
3.2 叶氮含量
在过去低CO2浓度和当前CO2浓度下,燕麦的叶氮含量总体上随着水分下降呈降低趋势,其可能原因是叶氮在干旱条件下的稀释作用,同时也有可能氮从叶片向根系和根际进行了转移[23]。但在将来高CO2浓度下,叶氮含量的变化并不受到水分含量的显著影响(P>0.05),这也正是在高CO2浓度下净光合速率没有受到水分含量显著影响的另一原因。
当CO2浓度从过去的低CO2浓度升高到当前CO2浓度时,不管在何种水分条件下,燕麦的叶氮含量均明显升高,表明CO2浓度的升高促进了根系的生长,提高了氮利用效率,从而导致叶氮含量的增加。当CO2浓度从当前CO2浓度升高到将来CO2浓度时,在水分条件较好情况下,燕麦的叶氮含量降低,这与很多的文献报道一致[24-25],这可能是在水分条件较好的情况下CO2浓度升高改变了燕麦的生理需求,导致氮在各器官中重新分配,使叶片中的氮降低幅度大于根系中氮的降低幅度,同时,降低的蒸腾速率也可能导致根系中氮的吸收降低,最终表现出叶片中氮含量有升高的趋势[26]。而在干旱条件下,叶氮含量却随着CO2浓度的升高而增加,表明CO2浓度升高提高了氮的吸收和利用效率,从而也增加了植物的光合。
3.3 资源分配和利用策略
植物资源分配是指植物将同化的资源分配于不同功能器官的比例。植物在环境资源限制条件下将光合作用所固定的能量进行优化分配,从而提高自身在多变环境中的适合度[27]。在干旱胁迫环境中,植物通常通过增大根质量分数,向深层土壤延伸以利用深层土壤水来适应干旱环境,维持生长[28]。研究表明在试验处理的各种CO2浓度下,燕麦根冠比均随着土壤水分含量的减少而增加, 说明燕麦确实能够通过提高根系生物量分配而提高对干旱环境的适应。在试验设置的各种水分条件下,CO2浓度升高也促进燕麦根系生物量分配,这是因为CO2浓度升高增加了植物叶片的净同化率,这样就使得整个冠层C获取增加,地下总非结构性碳水化合物迁移增加导致根系生物量增多[29]。
植物水分利用效率一定程度上衡量或评价植物对水分状况变化的适应能力和能量的转换效率。在低CO2浓度下,随着水分含量的降低,尽管资源分配(根冠比)增加,但水分利用效率基本保持不变,说明在低CO2浓度和干旱胁迫的双重胁迫下,燕麦通过保证稳定的水分利用效率,以保持光合能力的不变(图1),从而也保证了生物量积累降低幅度不大(图1),把双重胁迫的伤害降低到最小,以维持存活。在当前CO2浓度和高CO2浓度下,水分利用效率随着水分含量的降低而升高,但只在重度干旱时才与对照差异显著,说明燕麦在干旱环境加剧情况下才通过提高水分利用效率而提高对干旱环境的适应。
从过去低CO2浓度到当前CO2浓度,CO2浓度的升高提高了燕麦的水分利用效率,且与水分状况无关(无交互作用),这与多数的研究结果一致[7]。但从当前CO2浓度到将来高CO2浓度,水分利用效率并没有受到CO2浓度升高的刺激。这进一步表明,超过环境浓度的CO2浓度继续升高并没有通过降低气孔导度来提高水分利用效率。
总之,低CO2浓度对燕麦的净光合速率和生物量生产产生严重抑制作用,在与干旱胁迫的交互作用下,燕麦通过提高根系生物量分配,保持稳定的水分利用效率,以保持一定的净光合速率,降低C不足和干旱胁迫的双重影响,以保证存活。高CO2浓度对燕麦的光合和生物量生产有一定的促进作用,但在交互干旱胁迫时,燕麦仍然提高了根系生物量的分配和水分利用效率,并保证了较高的叶氮含量,从而提高了水分胁迫下的净光合速率,但消耗过大导致生物量仍然显著降低,因而CO2浓度升高也并未降低干旱胁迫对燕麦生长的影响。另一方面,研究也从侧面表明,燕麦对过去低CO2浓度的适应可能限制了自身对将来高CO2浓度的响应。
[1] Ward J K,Myers D A,Thomas R B.Physiological and growth responses of C3and C4plants to reduced temperature when grown at low CO2of the Last Ice Age[J].Journal of Integrative Plant Biology,2008,50(11):1388-1395.
[2] Sage R F.Was low atmospheric CO2during the Pleistocene a limiting factor for the origin of agriculture[J].Global Change Biology,1995,1(2):93-106.
[3] Xu Z H,Shimizu H,Ito S,Yagasaki,Yasumi,Zou C Z,Zhou G S,Zheng Y R.Effects of elevated CO2,warming and precipitation change on plant growth,photosynthesis and peroxidation in dominant species from North China grassland[J].Planta,2014,239:421-435.
[4] Biehler K,Fock H.Evidence for the contribution of the Mehler-peroxidase reaction in dissipating excess electrons in drought stressed wheat[J].Plant Physiology,1996,112:265-272.
[5] Yung Y L,Lee T,Wang C H,Shieh Y T.Dust:A diagnostic of the hydrologic cycle during the last glacial maximum[J].Science,1996,271:962-963.
[6] Lambert F,Delmonte B,Petit J R,Bigler M,Kaufmann P R,Hutterli M A,Stocker T F,Ruth U,Steffensen J P,Maqqi V.Dust-climate couplings over the past 800,000 years from the EPICA Dome C ice core[J].Nature,2008,452:616-619.
[7] Sage R F,Coleman J R.Effects of low atmospheric CO2on plants:More than a thing of the past[J].Trends in Plant Science,2001,6:18-24.
[8] Ripley B S,Cunniff J,Osborne C P.Photosynthetic acclimation and resource use by the C3and C4subspecies ofAlloteropsissemialatain low CO2atmospheres[J].Global Change Biology,2013,19(3):900-910.
[9] Joseph C V Vu,Leon H A Jr.Growth at elevated CO2delays the adverse effects of drought stress on leaf photosynthesis of the C4sugarcane[J].Journal of Plant Physiology,2009,166:107-116.
[10] Robredo A,Usue P L,Jon M A,Lacuesta M,Amaia M P,Alberto M R.Elevated CO2reduces the drought effects on nitrogen metabolism in barley plants during drought and subsequent recovery[J].Environmental and Experimental Botany,2011,71:399-408.
[11] Ward J K,Tissue D T,Thomas R B,Strain B R.Comparative responses of model C3and C4plants to drought in low and elevated CO2[J].Global Change Biology,1999,5(8):857-867.
[12] Fleisher D H,Timlin D J,Reddy V R.Elevated carbon dioxide and water stress effects on potato canopy gas exchange,water use,and productivity[J].Agricultural and Forest Meteorology,2008,148:6-7.
[13] 刘锦春,钟章成,何跃军.水分胁迫对重庆石灰岩地区不同龄级柏木(CupressuefunebrisEndl)幼苗气体交换的影响[J].生态学报,2007,27(9):3601-3608.
[14] 刘锦春,钟章成.水分胁迫和复水对石灰岩地区柏木幼苗根系生长的影响[J].生态学报,2009,29(12):6439-6445.
[15] 姜春明,于贵瑞.陆生植物对全球环境变化的适应[J].中国生态农业学报,2010,18(1):215-222.
[16] 黄相国,葛菊梅.燕麦(AvenasativaL.)的营养成分与保健价值探讨[J].麦类作物学报,2004,24(4):147-149.
[17] 李扬汉. 禾本科作物的形态与解剖[M].上海:科学技术出版社,1979:461-476.
[18] 刘锦春,钟章成,何跃军.干旱胁迫及复水对喀斯特地区柏木幼苗活性氧清除系统的影响[J].应用生态学报,2011, 22(11):2836-2840.
[19] 王润佳,高世铭,张绪成.高大气CO2浓度下C3植物叶片水分利用效率升高的研究进展[J].干旱地区农业研究,2010,28(6):190-195.
[20] 郝兴宇,李萍,杨宏斌,韩雪,林而达.大气CO2浓度升高对绿豆生长及C、 N吸收的影响[J].中国生态农业学报,2011,19(4):794-798.
[21] Curtis P S.A meta-analysis of leaf gas exchange and nitrogen in trees grown under elevated carbon dioxide[J].Plant Cell & Environment,1996,19(2):127-137.
[22] Temme A A,Cornwell W K,Cornelissen J H C,Aerts R.Meta-analysis reveals profound responses of plant traits to glacial CO2levels[J].Ecology and Evolution,2013,3:4525-4535.
[23] Lloret F,Peuelas J,Estiarte M.Ecophysiological responses of two Mediterranean shrubs,EricamultifloraandGlobulariaalypum,to experimentally drier and warmer conditions[J].Physiologia plantarum,2003,119:231-243.
[24] Gutiérrez E,Gutiérrez D,Morcuende R,Verdejo A L,Kostadinova S,Martinez-Carrasco R,Pérez P.Changes in leaf morphology and composition with future increases in CO2and temperature revisited:Wheat in field chambers[J].Journal of Plant Growth Regulation,2009,28:349-357.
[25] Ghannoum O,Phillips N G,Conroy J P,Smith R A,Attard R D,Woodfield R,Logan B A,Lewis J D,Tissue D T.Exposure to preindustrial,current and future atmospheric CO2and temperature differentially affects growth and photosynthesis in Eucalyptus[J].Global Change Biology,2010,16(1):303-319.
[26] McGrath J M,Lobell D B.Reduction of transpiration and altered nutrient allocation contribution to nutrient decline of crops grown in elevated CO2concentrations[J].Plant Cell & Environment,2013,36(3):697-705.
[27] 赵彬彬,牛克昌,杜国祯.放牧对青藏高原东缘高寒草甸群落27种植物地上生物量分配的影响[J].生态学报,2009,29(3):1596-1606.
[28] 郭建平,高素华.沙地植物生长对CO2增加和土壤干旱的响应[J].水土保持学报,2004,18(4):174-176.
[29] Wall G W,Adam N R,Brooks T J,Kimball B A,Pinter P J Jr,LaMorte R L.Acclimation response of spring wheat in a free- air CO2enrichment (FACE) atmosphere with variable soil nitrogen regimes.Net assimilation and stomatal conductance of leaves[J].Photosynthesis Research,2000,66:79-95.
(责任编辑 张瑾)
本刊如有印装质量问题,请将原杂志寄回编辑部,由本部负责调换。
Responses of photosynthesis, growth and water use efficiency ofAvenasativato drought under different CO2 concentrations
LIU Jin-chun1, Johannes H.C. Cornelissen2
(1.Key Laboratory of Eco-environment in Three Gorges Reservoir Region, School of Life Science, Southwest University, Chongqing 400715, China; 2.Systems Ecology, Department of Ecological Science, Faculty of Earth and Life Sciences, VU University, De Boelelaan 1085, 1081 HV Amsterdam, the Netherlands)
The interaction of CO2concentration and soil moisture on photosynthesis, growth and water use efficiency in oat (Avenasativa) was observed in the walk-in CO2chamber. The results showed that low CO2concentration inhibited photosynthesis and biomass production of oat greatly while elevated CO2promoted them slightly. With soil moisture content declined, net photosynthetic rate and water use efficiency didn’t change, whereas biomass and leaf N contents slightly decreased, and the ratio of root to shoot increased at low CO2concentration. Net photosynthetic rate, the ratio of root to shoot and water use efficiency increased, whereas biomass significantly decreased, and leaf N content did not change at high CO2concentration. These results suggested that low CO2concentration did not intensify the negative effects of drought, and high CO2concentration failed to relieve the negative effects of drought stress on oat. The adaptation of oat to low CO2concentration may limit its responses to future high CO2concentration.
increased CO2concentration;Avenasativa; water stress; photosynthetic rate; biomass
LIU Jin-chun E-mail:jinchun@swu.edu.cn
10.11829j.issn.1001-0629.2014-0501
2014-11-14 接受日期:2015-01-12
教育部第49批留学回国人员科研启动基金——喀斯特生态系统草本植物在CO2浓度变化条件下对干旱的生态适应[教外司(2015)311号];重庆市自然科学基金项目——喀斯特水逆境下无机碳源对AM真菌植物N、P利用的影响及机制研究(cstc2014jcyjA80016)
刘锦春(1977-),女,湖南洞口人,副教授,博士,主要从事植物生态生态学研究。E-mail:jinchun@swu.edu.cn
S512.603.4;Q945.78
A
1001-0629(2015)07-1116-08*
刘锦春,Johannes H C.Cornelissen.CO2浓度变化下燕麦对干旱胁迫的生理响应[J].草业科学,2015,32(7):1116-1123.
LIU Jin-chun,Johannes H C.Cornelissen.Responses of photosynthesis,growth and water use efficiency ofAvenasativato drought under different CO2concentrations[J].Pratacultural Science,2015,32(7):1116-1123.

