碱胁迫下硅促进冰草种子萌发
张一弓,王玉,刘梦,杨淑君,张荟荟(新疆畜牧科学院草业研究所,新疆 乌鲁木齐 830000)
碱胁迫下硅促进冰草种子萌发
张一弓,王玉,刘梦,杨淑君,张荟荟
(新疆畜牧科学院草业研究所,新疆 乌鲁木齐 830000)
以塔乌库姆冰草(Agropyroncristatumcv. Tawukumu)种子为材料,采用人工模拟碱(NaHCO3)胁迫,设10、30、60、90、120 mmol·L-15个浓度作为碱处理,各浓度添加1.0 mmol·L-1Na2SiO3溶液作为碱+硅处理,研究碱胁迫下硅对冰草种子萌发的影响。结果显示,在不同浓度的碱胁迫下添加外源硅显著增加了冰草种子发芽势、发芽率、发芽指数、活力指数、胚根和胚芽生物量(P<0.05),明显缩短了萌发时间,提高了发芽整齐度。这一结果初步说明在碱胁迫下硅参与种子的萌发过程,在一定程度上降低渗透胁迫和离子毒害,增强了冰草种子在碱胁迫下的抵抗力。
塔乌库姆冰草;外源硅;发芽率;胚芽;胚根
土壤盐渍化是当前人类面临的严峻生态环境问题[1]。全世界约有4×108hm2的盐渍土地,约占耕地的1/3,我国盐渍化面积达2.6×107hm2,已经成为影响植物生长的重要因素[2]。盐碱土可以进一步分为中性盐(NaCl和Na2SO4)和碱性盐(Na2CO3和NaHCO3),中性盐胁迫称为盐胁迫,碱性盐胁迫称为碱胁迫[3]。盐胁迫和碱胁迫是两种不同的胁迫,二者对植物的作用机制不同,植物对其生理适应机制也不同[4]。土壤中若含有HCO3-和CO32-,植物不仅受到渗透胁迫和离子毒害,而且还受到高pH胁迫,因此碱胁迫比盐胁迫具有更大的生态破坏力[5]。已有研究表明,碱胁迫会造成冰草(Agropyroncristatum)种子吸水困难,种子吸水量和吸水速率下降,发芽率下降,发芽时间推迟,胚芽和胚根的生长缓慢[6]。硅是地壳中含量第二的元素,Dedatta首次发现硅是水稻(Oryzasativa)生长不可缺少的重要元素[7]。随后,植物硅营养研究逐渐引起人们的关注,并先后证实了硅对水稻[8]、大麦(Hordeumvulagre)[9]、小麦(Triticumaestivum)[10]、甘蔗(Saccharumsinense)[11]和瓜果蔬菜[12]等植物在逆境条件下的生长具有显著的促进作用[13]。
塔乌库姆冰草(Agropyroncristatumcv. Tawukumu)是2004年从哈萨克斯坦引进的禾本科冰草属多年生草本植物,株型直立,分蘖再生性能强,品质优良,营养丰富,是一种刈牧兼用型牧草。适口性好,生态适应幅度宽,可用于建植栽培草地和改良退化天然草地,因此具有高度的开发和利用价值[14]。2009年经全国草品种审定委员会审定,登记为牧草新品种。目前针对这一冰草新品种已开展了相关的抗盐碱研究工作,但是有关外源硅对其碱胁迫下种子萌发的研究还未见报道,为了进一步开展新品种的推广和高效种植,这项研究显得尤为重要。
本研究以冰草新品种为对象,探讨碱(NaHCO3)胁迫下,施加外源硅(Na2SiO3)对冰草种子萌发的影响,为硅参与冰草种子萌发提供科学证据,同时也为这一牧草新品种的推广和盐碱地种植提供理论参考。
1 材料与方法
1.1 试验材料与设计
选取籽粒饱满、大小一致的冰草种子,用5%次氯酸钠溶液浸泡10 min,先用自来水冲洗数次,再用蒸馏水冲洗3次,最后用滤纸将水吸干。在90 mm玻璃培养皿中放入两层8.5 mm×8.5 mm用处理液浸湿的滤纸,然后挑选均匀饱满的种子100粒,置于滤纸上,放入光照培养箱中,培养温度为25 ℃,每天光照12 h,每天以称重法补充蒸发失去的水分,保持处理液浓度恒定。
添加Na2SiO3作为加硅处理,选择1.0 mmol·L-1Na2SiO3溶液,同时加入不同浓度的Na2SO4来维持Na+浓度的一致性,防止因Na+浓度差异导致种子渗透压出现差异。试验分为两组,每组6个处理,每个处理6个重复(表1)。

表1 冰草种子萌发试验处理液配方Table 1 Formula of treatment solution for germination ofAgropyroncristatumcv. Tawukumu
1.2 指标计算
以胚芽突破种皮确认为发芽,期间每日统计发芽数,在第12天停止发芽后,计算发芽率、发芽趋势、发芽势、发芽指数、活力指数,测量胚芽、胚根长度,称量胚芽、胚根鲜重。
发芽率(%)=(发芽终止期全部正常发芽的种子数/供试种子数)×100%;
发芽势(%)=(5 d内供试种子的发芽数/供试种子数)×100%;
发芽指数(GI)=∑Gt/Dt。
式中,Gt为在t日的发芽数,Dt为发芽天数;
活力指数(VI)=GI×S。
式中,GI为发芽指数,S为第12天的胚芽和胚根长度之和。
1.3 数据分析
采用SPSS 12.0软件进行单因素方差分析(ANOVA),以及平均数LSD多重比较检验,差异显著性水平为0.05。
2 结果与分析
2.1 硅对冰草发芽动态的影响
硅对冰草种子初始萌发时间具有明显的影响(图1)。在碱处理下,只有对照(CK)在处理后第2天开始萌发,其余处理液的种子均在第3天开始萌发;而添加外源硅后,10和30 mmol·L-1处理液种子在第2天便开始萌发,60、90和120 mmol·L-1处理液在第5天发芽数均占总发芽数的60%以上,相比同浓度下的碱处理有明显升高。由此可见,硅影响冰草种子集中萌发所需要的时间。同时,碱胁迫下冰草种子在第12天结束萌发,但是添加硅后,在第10天基本结束萌发。这说明硅能有效缩短种子萌发的时间,对碱胁迫起到一定的缓解作用。试验结果同时表明,硅对低浓度碱胁迫作用不明显,但随着胁迫浓度升高,促进萌发作用越明显。
2.2 硅对冰草发芽特性的影响
2.2.1 发芽率 施加外源硅可以明显提高碱胁迫下冰草种子的发芽率(图2)。在碱胁迫浓度≤30 mmol·L-1时,添加硅对发芽率没有显著影响,但随着碱胁迫浓度的增大,硅对碱胁迫下种子发芽的促进作用越明显,当碱胁迫浓度≥60 mmol·L-1,添加外源硅与不添加的发芽率有着显著差异(P<0.05),分别提高26%、25%和162%。
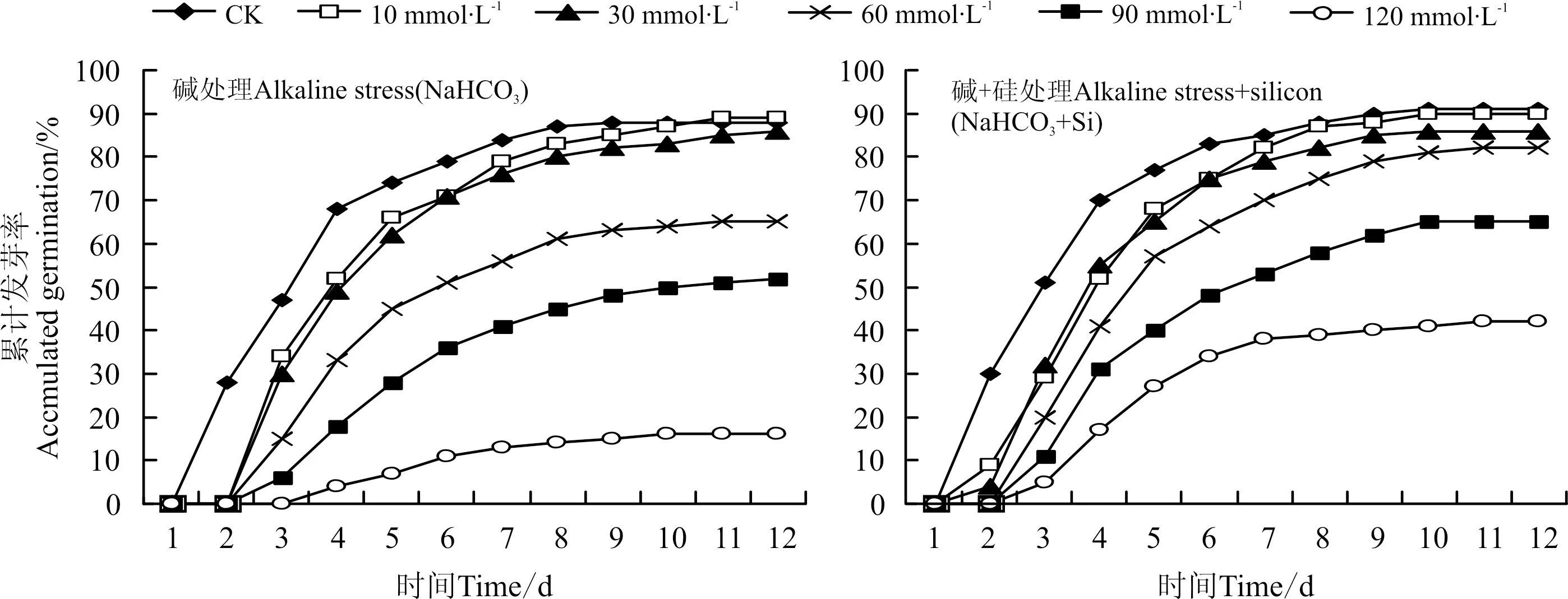
图1 碱和碱+硅处理对种子发芽过程的影响Fig.1 Effects of addition alkaline and alkaline+silicon on the germination progress

图2 碱和碱+硅处理对种子发芽率的影响Fig.2 Effects of addition alkaline and alkaline+silicon on the germination rate
注:不同小写字母表示同一处理不同浓度间差异显著(P<0.05);**表示同一浓度不同处理间差异显著(P<0.05)。下同。
Note: Different lower case letters show significant difference among different concentration in the same treatment at 0.05 level; ** show significant difference among different treatment in the same concentration at 0.05 level. The same below.
2.2.2 碱和碱+硅处理对种子发芽势、发芽指数和和种子活力指数的影响 碱胁迫处理下施加外源硅可以明显提高冰草种子的发芽势(表2)。随着碱胁迫浓度的升高发芽势呈显著下降(P<0.05),施加外源硅后,发芽势仍然随浓度升高呈下降趋势,但当NaHCO3浓度≥60 mmol·L-1时,与相同浓度碱胁迫相比,发芽势又有显著提高。与发芽势相同,随着碱胁迫浓度的升高发芽指数显著下降,施加外源硅后,发芽指数仍然降低,但当NaHCO3浓度≥60 mmol·L-1时,与相同浓度碱胁迫相比,发芽势又有显著提高。除NaHCO3浓度为10 mmol·L-1外,其他浓度的碱胁迫下添加外源硅对种子活力指数的增加尤为显著。
2.3 硅对碱胁迫下冰草幼苗生长的影响
2.3.1 硅对冰草胚芽、胚根长度的影响 随着处理液浓度的上升,碱胁迫和碱+硅胁迫胚芽长度均呈下降趋势(图3),但是碱浓度在60 mmol·L-1时开始出现显著差异(P<0.05),而施加外源硅后直到90 mmol·L-1才出现显著差异。两组处理相比,在处理液浓度≤30 mmol·L-1时,施加外源硅对胚芽长度的影响不显著(P>0.05),当碱浓度升至60 mmol·L-1时,碱+硅胁迫与碱胁迫具有显著性差异。在60、90和120 mmol·L-1碱+硅胁迫与碱胁迫相比,胚芽长度分别提高了41%、62%和113%。

表2 碱和碱+硅处理种子发芽势、发芽指数和种子活力指数的变化Table 2 The change of germination energy, germination index and seed vigor index under alkaline and alkaline+silicon treatments
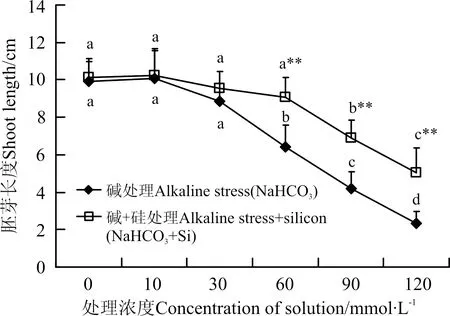
图3 碱和碱+硅处理对胚芽长度的影响Fig.3 Effects of addition alkaline and alkaline+silicon on the shoot length
随着处理液浓度的上升,胚根长度均呈下降趋势(图4)。在0和10 mmol·L-1时,在碱胁迫胚根长度差异显著(P<0.05),在硅+碱胁迫差异不显著(P>0.05)。当处理液浓度为30 mmol·L-1时,碱胁迫和硅+碱胁迫胚根长度均显著下降,但是碱胁迫降幅更为剧烈。两组处理相比,30和60 mmol·L-1时,胚根长度差异显著,硅+碱胁迫比碱胁迫分别增长了156%和127%。在120 mmol·L-1时,硅+碱胁迫胚根长度为0.09 cm,但碱胁迫胚根长度为0。
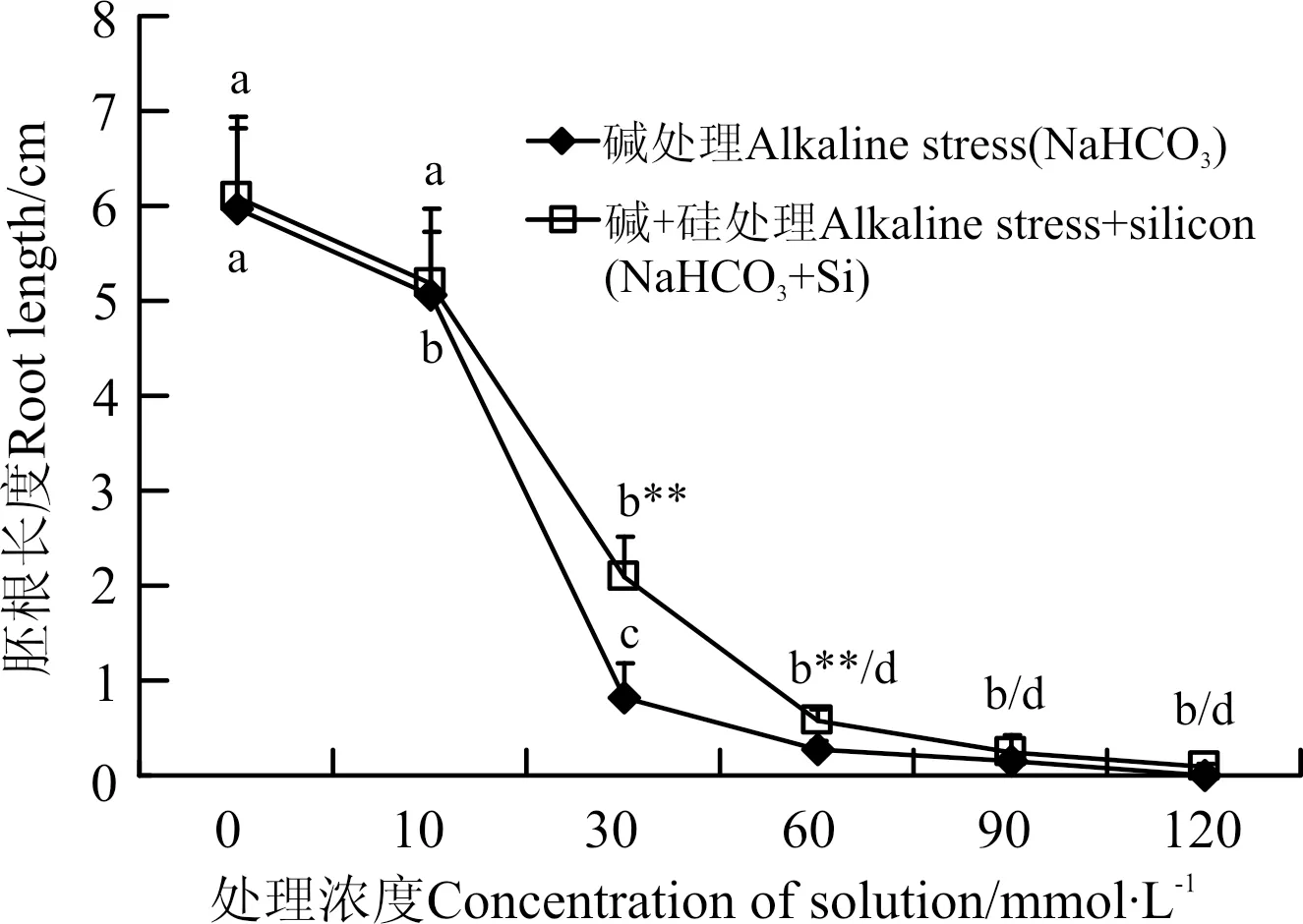
图4 碱和碱+硅处理对胚根长度的影响Fig.4 Effects of addition alkaline and alkaline+silicon on the root length
2.3.2 硅对碱胁迫下冰草胚芽、胚根鲜重的影响 随着处理液浓度的上升,碱胁迫下胚芽鲜重缓慢下降(图5),10和30 mmol·L-1时,胚芽鲜重略高于对照(CK),但差异不显著(P>0.05);90和120 mmol·L-1之间差异显著(P<0.05),同时与CK差异显著。碱+硅胁迫下,胚芽鲜重呈直线下降趋势,10和30 mmol·L-1与CK差异不显著,60、90和120 mmol·L-1与CK差异显著(P<0.05)。两组处理相比,碱+硅胁迫各浓度处理下鲜重均高于碱胁迫,在0、60和120 mmol·L-1时,差异显著,其中120 mmol·L-1碱+硅胁迫高出碱胁迫73%。
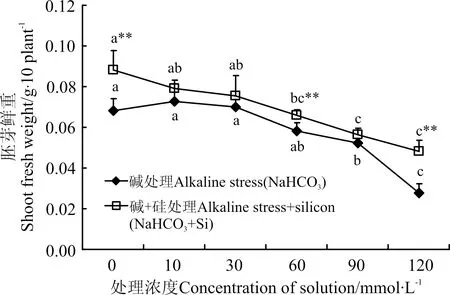
图5 碱和碱+硅处理对胚芽鲜重的影响Fig.5 Effects of addition alkaline and alkaline+silicon on the shoot fresh weight
随着处理液浓度的上升,碱胁迫和碱+硅胁迫胚根鲜重均表现出逐渐降低趋势(图6),同时各处理间差异显著(P<0.05)。除30 mmol·L-1以外,碱+硅胁迫各浓度胚根鲜重均显著高于碱胁迫。单一硅处理下较无碱无硅的胚根鲜重提高约40%,10 mmol·L-1时,提高28%,其余处理随浓度的升高,增幅依次减小。碱胁迫下胚根鲜重在90 mmol·L-1时降为0,而碱+硅胁迫在120 mmol·L-1时为0。

图6 碱和碱+硅处理对胚根鲜重的影响Fig.6 Effects of addition alkaline and alkaline+silicon on the root fresh weight
3 讨论与结论
土壤盐渍化已经成为影响全球生态系统的重要环境因素,严重的影响植物生长和作物安全。因此,在盐渍化土地中如何进行种植生产已成为重要的科学问题。盐碱胁迫下,植物细胞膜系统是受害的主要部位,表现为质膜透性增大,膜质过氧化产物升高,细胞膜正常生理功能损害,细胞代谢受影响,最终影响种子萌发和生长[15]。
硅作为地壳中的重要元素,对植物生长发育的影响始终是植物营养学研究的重要内容之一[16]。有研究报道,增施外源硅,能在一定程度上缓解盐害,提高种子的发芽率,加快种子发芽速率,降低幼苗在盐碱胁迫下的死亡现象[11]。硅通过影响植物的生态环境、增强植物抗逆性来影响植物。可以认为,硅能引起作物生理生化性质变化,进而影响作物生长发育[17]。目前,硅对促进禾本科植物生长发育的研究已被总结出两种途径,分为直接途径和间接途径,直接途径指硅参与了植物的生理生化过程,间接途径表现在硅通过改善植物生长环境的养分有效利用率而促进植物生长[13]。
本研究结果显示,塔乌库姆冰草种子在不同浓度的碱胁迫下加硅后,发芽率有了明显提高,萌发时间提前,萌发进程缩短,发芽整齐度提高,发芽指数、种子活力指数也有了明显提高,硅对碱胁迫下冰草种子胚根长度和胚芽长度的生长也具有明显促进作用,这与硅对玉米(Zeamays)[18-19]、紫花苜蓿(Medicagosativa)[13]、黄瓜(Cucumissativus)[20-21]、高羊茅(Festucaarundinacea)[22]、小麦[23]、水稻[24]等研究结果相一致。初步说明硅参与碱胁迫下种子的萌发过程,增强种子逆境胁迫的抵抗力[15,25]。种子在吸胀萌发过程中,细胞膜系统需要进行修复重建,而在碱胁迫下细胞膜的修复受阻,膜的选择吸收能力遭到破坏,引起大量离子涌入,但是硅能保护种子胶体结构和内部一些酶的活性,阻止碱胁迫对膜的降解,使种子在一定碱浓度下能够萌发生长[26],随着胁迫浓度的升高,这种保护作用越发明显。研究证实,碱胁迫对胚根的伤害程度较大,从而导致胚根降低幅度明显大于胚芽,这主要是因为胚根与处理液相接触,受到的伤害更直接,生长抑制更明显[27]。但是,添加外源硅后,硅的正四面体结构,能够充分的与处理液中的Na+、HCO3-相结合,形成一种螯合物,在一定程度上起了“缓冲”作用,从而降低离子的渗透胁迫,便于胚根吸收水分[26,28]。这也可能是当碱胁迫浓度>90 mmol·L-1胚根生物量为0,而添加硅后在120 mmol·L-1胚根仍然存在的原因。
[1] 高文俊,徐静,谢开云,董宽虎.Na2CO3和NaHCO3胁迫下冰草的生长及生理响应[J].草业学报,2011,20(4):299-304.
[2] 张满效,陈拓,肖雯,周吉俊,贾恢先.不同盐碱环境中宁夏枸杞叶生理特征和RAPD分析[J].中国沙漠,2005,25(3):391-392.
[3] Läuchli A,Lüttge U.Salinity:Environment-Plants-Molecules[M].Boston:Kluwer Academic Public,2002:21-23.
[4] 麻莹,曲冰冰,郭立泉,石德成,王德利.盐碱混合胁迫下抗碱盐生植物碱地肤的生长及其茎叶中溶质积累特点[J].草业学报,2007,16(4):25-33.
[5] Hartung W,Leport L,Ratcliffe,Sauter A,Duda R,Turner N C.Abscisic acid concentration,root pH and anatomy do not explain growth differences of chickpea (CicerarietinumL.) and lupin(LupinusangustifoliusL.)on acid and alkaline soil[J].Plant Soil,2002,240:191-199.
[6] 张一弓,贾那提,李学森,张荟荟,沙吾列,马海燕,唐森.碱胁迫下塔乌库姆冰草的萌发及生理响应[J].草地学报,2014,22(4):207-212.
[7] Dedatta S K.Principles and Practices of Rice Production[M].MA,USA:Wiley-Interscience Publication,1981.
[8] 庞贞武,师瑞红,谢国生,刘铁梅,柯文峰,蔡明历.铝、硒、硅和磷复合处理对水稻幼苗生长的影响[J].应用生态学报,2009,2(6):1375-1382.
[9] 黄昌勇,沈冰.硅对大麦铝毒害的消除和缓解作用研究[J].植物营养与肥料学报,2003,9(1):98-101.
[10] 朱佳,梁永超,丁燕芳,李兆君.硅对低温胁迫下冬小麦幼苗光合作用及相关生理特性的影响[J].中国农业科学,2006,39(9):1780-1788.
[11] Hattori T,Inanaga S,Araki H,Ping An,Morita S,LuxovM,Lux A.Application of silicon enhanced drought tolerance inSorghumbicolor[J].Physiologia Plantarum,2005,123:459-466.
[12] Raleigh G J.Evidence for the essentiality of silicon for growth of the beet plant[J].Plant Physiology,1993,14:823-828.
[13] 刘慧霞,申晓蓉,郭正刚.硅对紫花苜蓿种子萌发及幼苗生长发育的影响[J].草业学报,2011,20(1):155-160.
[14] 贾纳提,郭选政,朱昊,李莉.2种引进优良冰草的区域试验[J].草业科学,2009,26(4):43-49.
[15] 王耀晶,王厚鑫,刘鸣达.盐胁迫下硅对草地早熟禾生理特性的影响[J].中国草地学报,2012,34(6):12-17.
[16] 郭正刚,田福平,王锁民,张自和.硅对紫花苜蓿生物学特性的影响[J].生态学报,2006,26(10):3303-3307.
[17] 李清芳,马成仓,李韩平,萧云丽,刘雪艳.土壤有效硅对大豆生长发育和生理功能的影响[J].应用生态学报,2004,15(1):73-76.
[18] 马成仓,李清芳,束良佐,张经余.硅对玉米萌发和幼苗生长作用机制初探[J].作物学报,2002,28(5):665-669.
[19] Gao X P,Zou C,Wang L,Zhang F S.Silicon improves water use efficiency in maize plants[J].Journal of Plant Nutrition,2004,27:1457-1470.
[20] 李清芳,马成仓.土壤有效硅对黄瓜种子萌发和幼苗生长代谢的影响[J].园艺学报,2002,29(5):433-437.
[21] Hou Y H,Han X R,Yang J J,Wang J.Effects of silicon on cucumber seed germination and seedling growth under salt stress[J].Chinese Journal of Eco-Agriculture,2007,15(6):206-207.
[22] 刘慧霞,郭兴华,郭正刚.盐生境下硅对坪用高羊茅生物学特性的影响[J].生态学报,2011,31(23):7039-7046.
[23] Gong H J,Zhu X Y,Chen K M,Wang S M,Zhang C L.Silicon alleviates oxidative damage of wheat plants in pots under drought[J].Plant Science,2005,169:313-321.
[24] Sistani K R,Korndorfer G H,Reddy K C.Effect of rice hull ash silicon on rice seedling growth[J].Journal of Plant Nutrition,1997,20:195-201.
[25] 梁永超,丁瑞兴,刘谦.硅对大麦耐盐性的影响及其机制[J].中国农业科学,1999,32(6):75-83.
[26] 杨光.盐碱胁迫对豆科牧草种子萌发及其生理的影响[D].长春:东北师范大学硕士论文,2009.
[27] 吴欣明,王运琦,刘建宁,孙桂枝,高洪文,张冬玲,郭璞.羊茅属植物耐盐性评价及其对盐胁迫的生理响应[J].草业学报,2007,16(6):67-73.
[28] Liang Y C,Sun W C,Zhu Y G,Chirstie P.Mechanisms of silicon-mediated alleviation of abiotic stresses in higher plants:A review[J].Environmental Pollution,2007,147(2):422-428.
(责任编辑 张瑾)
Effects of silicon onAgropyroncristatumseed germination under alkaline stress
ZHANG Yi-gong, WANG Yu, LIU Meng, YANG Shu-jun, ZHANG Hui-hui
(Grassland institute, Xinjiang Academy of Animal Science, Urumqi 830000, China)
In order to study the effects of silion on seeds germination ofAgropyroncristatumcv. Tawukumu under alkaline stress, the seeds performance under alkaline +silicon treatments including five alkaline (NaHCO3) stress levels (10,30,60,90 and 120 mmol·L-1) with 1.0 mmol·L-1Na2SiO3solution were evaluated. The results showed that Na2SiO3treatment significantly increased (P<0.05) germination energy, germination percentage, seed germination index, vigor index, biomass of shoot and root and significantly reduced (P<0.05) germination time. The results preliminary explained that silicon involved in the germination under alkaline stress,reduced osmotic stress and ion toxicity and enhanced seed resistance.
Agropyroncristatumcv. Tawukumu; exogenous silicon; germination percentage; shoot; root
ZHANG Yi-gong E-mail:zhangyigong203@163.com
10.11829j.issn.1001-0629.2014-0525
2014-11-24 接受日期:2015-04-15
新疆维吾尔自治区自然科学基金项目(2014211B043)
张一弓(1984-),男,甘肃兰州人,助理研究员,在读博士,主要从事牧草生理生态学研究。E-mail: zhangyigong203@163.com
S543+.9;Q945.78
A
1001-0629(2015)07-1093-06*
张一弓,王玉,刘梦,杨淑君,张荟荟.碱胁迫下硅促进冰草种子萌发[J].草业科学,2015,32(7):1093-1098.
ZHANG Yi-gong,WANG Yu,LIU Meng,YANG Shu-jun,ZHANG Hui-hui.Effects of silicon onAgropyroncristatumseed germination under alkaline stress[J].Pratacultural Science,2015,32(7):1093-1098.

