控温条件下C3、C4草本植物碳同位素组成对温度的响应
刘贤赵, 宿 庆, 李嘉竹, 全 斌, 李朝奎, 张 勇, 王志强, 王国安
1 鲁东大学地理与规划学院, 烟台 264025 2 黄土高原土壤侵蚀与旱地农业国家重点实验室, 杨陵 712100 3 湖南科技大学建筑与城乡规划学院, 湘潭 411201 4 中国农业大学资源与环境学院, 北京 100193
控温条件下C3、C4草本植物碳同位素组成对温度的响应
刘贤赵1,2,3,*, 宿 庆3, 李嘉竹1, 全 斌3, 李朝奎3, 张 勇3, 王志强3, 王国安4
1 鲁东大学地理与规划学院, 烟台 264025 2 黄土高原土壤侵蚀与旱地农业国家重点实验室, 杨陵 712100 3 湖南科技大学建筑与城乡规划学院, 湘潭 411201 4 中国农业大学资源与环境学院, 北京 100193
采取人工控制实验,探讨了6种C3、C4草本植物在昼/夜温度指标为20/12℃——36/28℃的范围内植物碳同位素组成(δ13C)及其对温度变化的响应,并结合植物比叶面积(SLA)、胞间CO2浓度(ci)与环境CO2浓度(ca)的比值、碳同化率(净光合速率Pn/胞间CO2浓度ci)等光合生长指标对植物δ13C的影响进行了分析。结果表明:所有C3、C4植物样品的δ13C值分别变化在-28.3‰—-32.1‰和-14.4‰—-17.6‰之间;在C3植物中,油菜δ13C值分布范围最集中,位于-31.1‰—-32.1‰之间;C4植物中,谷子δ13C值分布范围最窄。在控制的温度范围内,3种C3植物的平均δ13C值随温度升高而显著变低,而C4植物δ13C平均值与温度呈先增大后减小的抛物型关系,但线性回归结果未达到显著水平(P> 0.05)。单个植物种的δ13C值对温度的响应不同,茄子、高粱的δ13C值与温度呈线性负相关,其它4种植物与温度均呈二次抛物线关系,这可能与不同植物种具有不同的光合最适温度以及植物δ13C分馏对温度变化的敏感程度不同有关。
草本植物; 碳同位素; 温度; 控制实验
植物的稳定碳同位素组成(δ13C)能够准确记录植物生长环境的气候信息(如温度、湿度、降水等),因而被广泛应用于自然生态过程研究以及古气候、古环境的定量重建[1- 6]。温度是影响植物δ13C组成最重要的气候因子之一。一方面,它通过改变植物光合作用过程中的系列酶促反应以及叶片的气孔导度等对植物δ13C分馏产生影响;另一方面,还通过改变植物叶片形态、厚度和叶片元素组成间接影响植物δ13C分馏。目前,关于温度与植物δ13C组成的关系研究,除极少数人工控制实验外,多数学者仍是基于树木年轮或一定的海拔梯度探讨植物δ13C对温度变化的响应,但所得结果差异较大。一些研究表明,植物δ13C与温度之间表现出显著的负相关关系[7- 11],即随温度的增加而降低,而更多的研究则是显示两者呈显著的正相关[12- 16],也有研究没有观察到植物δ13C与温度的关系[2, 4,17]。造成植物δ13C与温度之间关系不确定性的原因除了植物种间的生理生态过程与遗传特性存在差异外,一个很重要的原因就是在分析植物δ13C与温度因子的关系时,很难将其它气候环境因子(如降水因子)对植物δ13C的影响分开。这是因为自然气候的变化总是包含温度、降雨等气候参数的同时变化,植物δ13C组成不仅包含了温度因子的影响,同时也涉及了其它气候环境因子的相互叠加作用。为了消除降雨因子对植物碳同位素分馏的影响,王国安等[6]基于中国北方400mm等雨量线建立了植物δ13C与温度因子的关系,并用于古气候重建。但中国北方400mm等雨量线东西延伸约1500km,南北跨度达1900 km,在如此宽广的地域范围内,各个样点之间的土壤湿度、大气压、光照、云的盖度、大气CO2浓度等难免存在较大差异,而这些因素也是影响植物δ13C分馏的重要环境因子。这说明以目前建立的植物δ13C与温度的关系作为依据进行古气候定量重建与古环境信息提取还需要进一步完善。
人工控制实验能够按照研究者的要求将其它气候环境因子对植物δ13C的影响有效地分离,避免诸如降水、湿度、大气分压和CO2浓度等气候环境因子对植物δ13C的干扰,可以方便地模拟温度变化对植物δ13C组成的影响,在一定程度上能够弥补自然条件下研究植物δ13C与环境因子之间关系的不足。但由于控制实验涉及的植物种不可能太多,而且需要昂贵的大型控温设备以及试验结果不能完全反映植物在自然状态下碳同位素分馏的真实过程等,从而使一些学者利用控温实验研究温度与植物δ13C的关系受到限制。迄今为止,除Smith等[18]、Troughton和Card[19]以及林清[13]等利用控制实验探讨过植物δ13C与环境因子的关系外,其它借助控制条件系统研究植物δ13C对温度响应的报道很少。Smith等的研究发现,生长在昼/夜温度比为13/4—35/27℃范围内的3种C3植物(大麦、油菜、豌豆),其碳同位素在低温下的均比高温下的要高,但二者之间不存在线性关系[18];林清[13]通过设置6个温度处理,发现沉水植物—龙须眼子菜的碳同位素随温度上升明显增加,R2系数大于0.9;而Troughton和Card[19]的研究却发现,温度变化对6种C3植物的δ13C组成几乎没有影响,温度系数仅为-0.0125‰/℃。上述表明控温实验得到的结果仍存在明显差异。本文选取C3、C4各3种草本植物,利用人工气候箱设定昼/夜温度比(20/12—36/28℃)研究温度变化对植物δ13C的影响,并建立它们的定量关系,旨在探讨人工控制实验在研究植物δ13C与单一环境因子关系的有效性和可靠性,同时也为自然条件下获得的植物δ13C与温度之间的关系提供补充和验证,以拓宽在本领域的应用。
1 材料与方法
1.1 植物种植
选取大豆(Glycinemax)、油菜(Brassicacampestris)、茄子(Solanummelongena) 3种C3植物和玉米(Zeamaysvar.)、高粱(Sorghumbicolor)、谷子(Setariaitalica) 3种C4植物作为试材。种子经温室育苗,待长至2—3片真叶时,将长势一致的植株移入内径20 cm、深15 cm的塑料盆内,每盆3株。盆内供试土壤为校园外长期耕作的棕壤土(表1),土样按每1 kg土添加100 g腐熟的厩肥,自然风干后过2 mm筛,将肥料硝酸铵(NH4NO3)、磷酸二氢钾(KH2PO4)和硫酸钾(K2SO4)按N、P、K分别为10、5、15 g/kg的配合比例混匀施入土中,然后按体积质量1.34 g/cm3装土,测定其初始土壤湿度,并在移栽前将其浇灌至田间持水量。为调节土壤通气和排水,在盆底开一直径为2 cm的小孔,并铺一层由干沙、石砾组成的厚度约2 cm的滤水层。

表1 供试土壤理化性质Table 1 Physical and chemical properties of selected soil
OM: Organic matter; AP: Available phosphorus; AHN: Alkali-hydrolyzable nitrogen; TN: Total nitrogen; BD: Bulk density; WH: wilting humidity; FC: Field capacity; CC: clay content
1.2 实验设计
幼苗移栽后,在自然条件下缓苗1周。然后利用人工气候箱(SPX- 400IC,中国)进行控温处理。考虑到供试植物生长的温度范围,5个控温处理设置的昼/夜温度分别为20/12 ℃、24/16 ℃、28/20 ℃、32/24 ℃和36/28 ℃,温度变化幅度为±0.5 ℃,每个处理设置3个重复,处理时间为4周。实验过程中,除温度不同外,其它环境条件一致:即各气候箱内湿度均保持在40%,用加湿器(加去离子水)进行调节;箱内光照强度为10000lx,由冷白光荧光灯调控;光合周期为14 h(7:30—21:30),昼/夜温度转换与光合周期相同。为减少气候箱内因CO2损耗对植物碳同化造成的影响,每天早晚在变换昼/夜温度时开气候箱门通气5 min。植物生长所需的土壤水分用土壤水分测定仪(TZS-I,中国)进行监测,各处理土壤含水量均维持在田间持水量的75%左右。
1.3 观测项目
1.3.1 光合指标测定
在温度处理开始后的第3周,选取各处理植株主茎相同叶位、叶龄的叶片于10:00用便携式光合作用测定系统(CIRAS- 1,英国)对叶片净光合速率(Pn)、胞间CO2浓度(ci)等指标进行测定,每2d测定1次。测定时,参比CO2浓度直接采用大气CO2浓度(ca)。
1.3.2 比叶面积(SLA)测定
温度处理结束后立即对植物叶片进行采集。采样时,取每个处理的每一个重复的全部植株叶片作为该重复的一个样品,并快速进行叶面积量算。然后,将每一个重复的所有叶片用清水洗净、晾干,放入105 ℃的烘箱中10 min,杀青后在65℃下烘干至恒重,记录叶片的干重,用叶面积与叶干重之比计算每个重复的比叶面积。
1.3.3 碳同位素测定
在SLA测定的基础上,将上述烘干后的同一温度处理下的3个平行植物样品进行混合用于碳同位素组成分析。分析时将植物样品研磨粉碎,过80目筛,然后将处理好的样品3—5mg封入真空燃烧管,并加入催化剂和氧化剂,在1020℃下燃烧产生CO2,经结晶纯化后用德国生产的DeltaPlusXP质谱仪测定植物碳同位素比值。每个样品重复3—5次,测定误差小于0.15‰。碳同位素组成的表达式为:
δ13C=(Rsample/Rstandard-1)×1000‰
式中,Rsample和Rstandard分别为样品和标准的碳同位素比值,碳同位素结果采用国际V-PDB标准表示。碳同位素分析在中国农业大学同位素地球化学实验室完成。
1.4 统计分析
上述所有测定结果均以各处理重复的平均值表示,并用SAS8.20 (SAS Institute,NC,USA)软件对数据进行相关分析、回归分析和显著性检验。
2 结果
2.1 草本植物δ13C组成特征
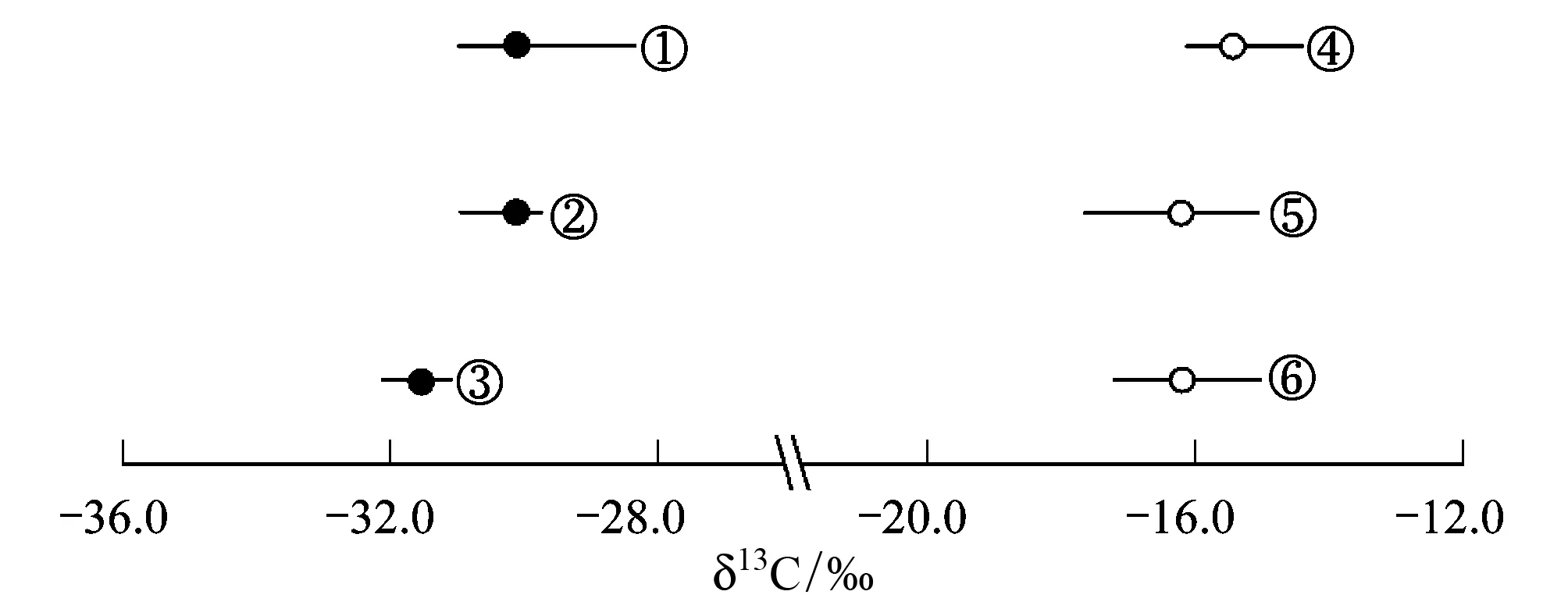
图1 控温条件下C3、C4草本植物δ13C分布
控温条件下3种C3草本植物和3种C4草本植物δ13C值的分布范围及其相应的平均值由图1给出,3种C3植物的δ13C值变化范围在-28.3‰ — -32.1‰之间,3种C4植物的δ13C值变化范围在-14.4‰ — -17.6‰之间。就测试的3种C3植物而言,茄子叶片δ13C的平均值为-30.1‰,较油菜叶片δ13C的平均值(-31.6‰)偏正1.4‰,但油菜叶片δ13C值分布最集中,仅变化范围在-31.1‰ — -32.1‰之间。在C4植物中,谷子叶片δ13C的平均值(-15.4‰)较玉米(-16.2‰)和高粱(-16.2‰)的平均值均要偏正,但叶片δ13C值变化范围最窄的是谷子(-14.4‰— -16.1‰),最宽的为高粱(-15.1‰— -17.2‰)。
2.2 草本植物δ13C对温度的响应
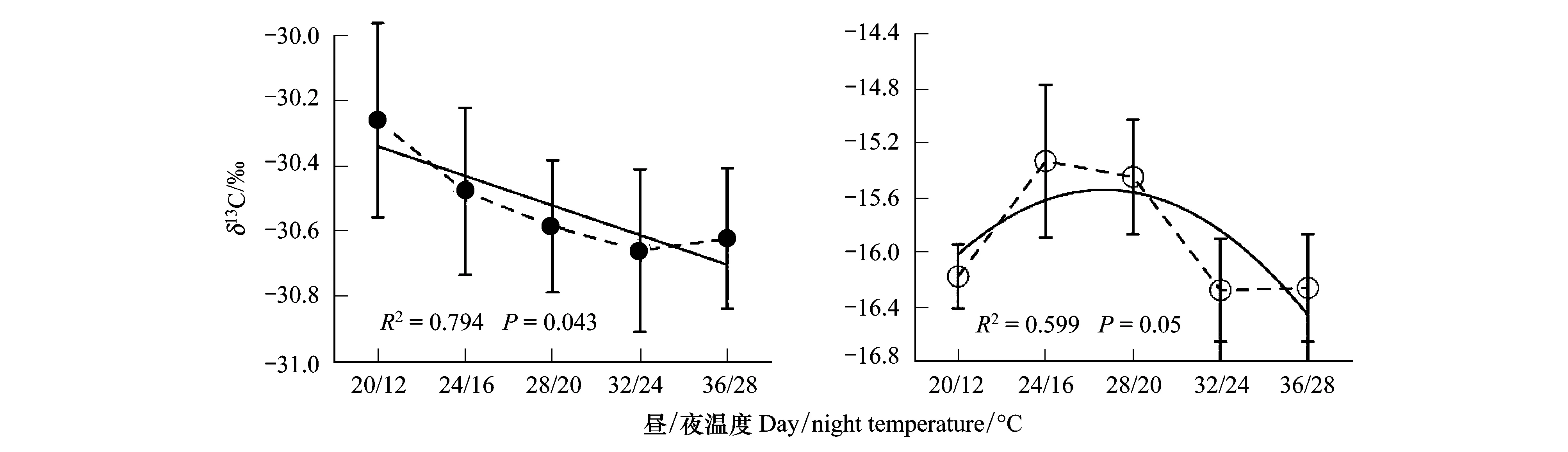
图2 C3、C4草本植物δ13C与温度的关系
图2显示,在所设计的温度范围内,总体C3、C4植物样品的碳同位素平均值均随温度升高表现出变轻的趋势,但变化程度不同。C3植物随着温度的升高,所有植物样品δ13C的平均值呈显著下降趋势,δ13C值从最低温度处理(20/12℃)下的-30.3‰下降至32/24℃时的-30.7‰,相关系数达-0.891,二者表现出显著的负相关关系,但在32/24℃—36/28℃范围内,植物δ13C有增大趋势。对于C4植物,其总体样品δ13C平均值随温度变化较C3植物要复杂得多,在20/12℃—32/24℃温度范围内,总体样本δ13C平均值表现为先增加后减小,最大值(-15.3‰)出现在24/16℃温度处,最小值(-16.6‰)出现在32/24℃温度处,自温度32/24℃处植物13C又有轻微富集,但总体δ13C平均值与处理温度并未达显著负相关(图2)。
就单个植物种而言,不同植物叶片δ13C值随温度变化表现出不同的变化特征(图3)。回归分析表明,茄子、高粱的δ13C值随温度增加呈下降趋势,其中茄子接近显著负相关(P= 0.065)。除茄子、高粱2种植物外,其它所有植物种的δ13C组成与温度均呈非线性关系,δ13C值随温度升高表现出先上升后下降的趋势。用二次曲线分别对油菜、大豆、玉米、谷子4种植物的δ13C值与温度进行非线性拟合,发现油菜δ13C值与温度达显著水平,而大豆、玉米、谷子的δ13C值与温度的二次曲线拟合均未通过95%置信水平下的显著性检验(图3)。这可能与不同植物种具有不同的光合最适温度以及植物δ13C分馏对温度变化的敏感程度不同有关(图3)。
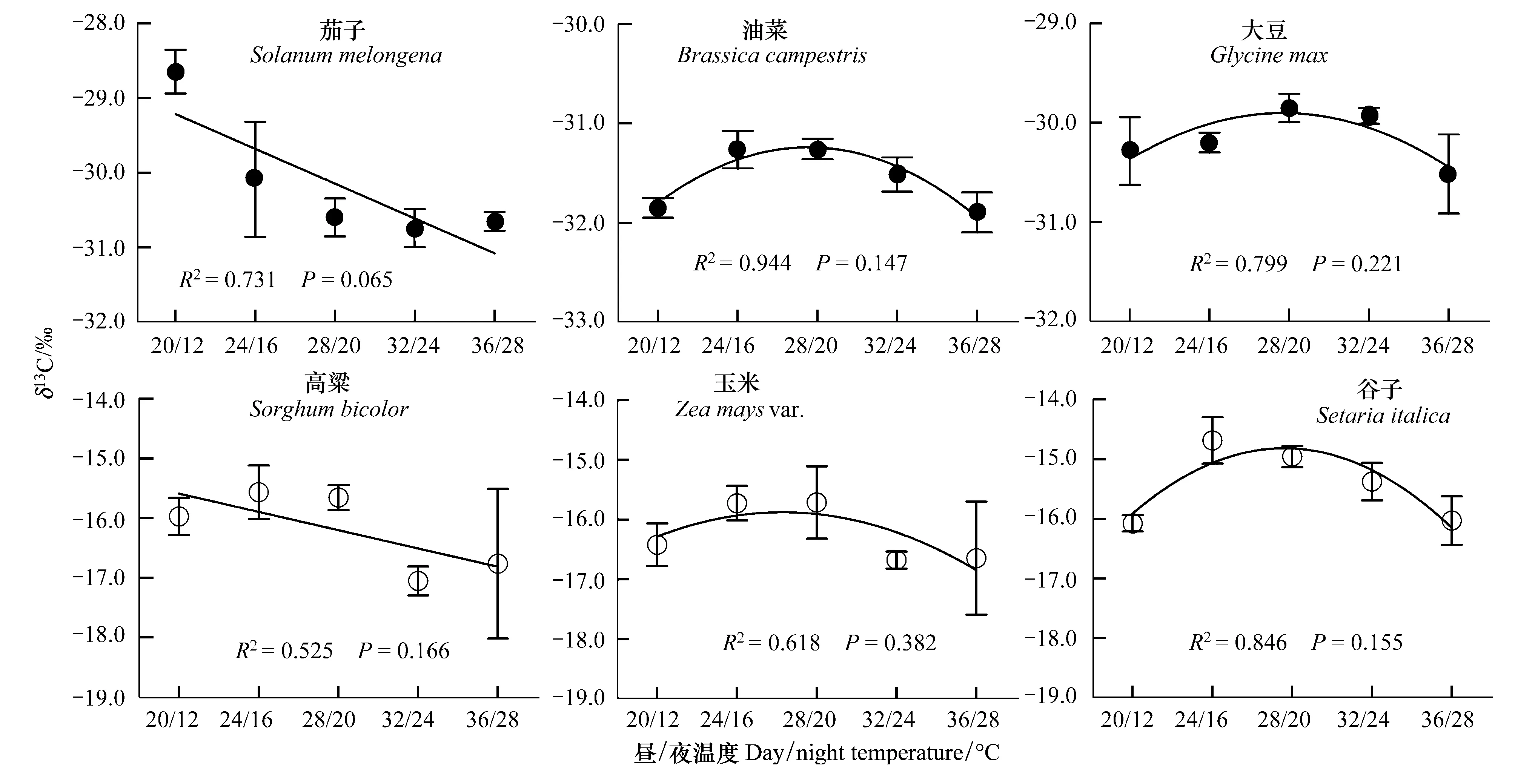
图3 单个C3、C4植物叶片δ13C随温度的变化
3 讨论
3.1 温度与植物δ13C
温度是影响植物δ13C分馏的重要因素。一些研究认为,温度与植物δ13C之间存在负相关关系,而较多的研究则显示二者之间存在正相关关系。本研究结果显示,整体C3植物的δ13C均值与温度呈显著线性负相关关系(图2),δ13C值随温度升高明显变低,δ13C与温度的线性拟合系数为-0.023‰/℃。由于整体C3植物的碳同位素组成对温度响应较为强烈,因而它们的δ13C值可以考虑作为温度的替代性指标。Smith等[18]曾对大麦、油菜、豌豆3种C3草本植物进行了人工控制实验,设定的昼/夜温度指标分别为13/4℃、18/10℃、24/16℃、29/21℃和35/27℃,其他环境条件都恒定。结果发现,这3种植物在低温下的碳同位素组成基本上都比高温下的要高,但总体上同位素组成与温度不存在线性关系。Troughton和Card[19]的控温实验(设定的温度范围为14—40℃,温度无昼/夜转换处理)也发现,6种C3植物δ13C组成的平均值与温度没有明显的关系,即温度的变化对植物碳同位素组成几乎没有影响。本研究结果与Leavitt和Long[20]、Sheu和Chiu[21]的结论一致,即C3植物δ13C组成与温度呈线性显著负相关,随温度升高而降低。导致上述不同结果的原因可能与控制实验设定的温度范围、参与实验的植物种以及实验恒定的其它环境条件有关。至于本研究中的C4植物,其平均δ13C值与温度呈二次抛物线关系,这与Troughton和Card[19]对5种C4植物进行的控温实验结果一致。C4植物δ13C值与温度的这种抛物线性关系除了其碳同位素分馏模式较C3植物复杂外,还可能与最低温度处理(20/12℃)下的植物碳同位素值对回归结果产生了较大影响有关。如果去掉图中最低温度点(20/12℃)对应的碳同位素值,再重新对测定数据进行线性拟合,则在24/16℃—36/28℃温度范围内,植物δ13C与温度亦表现出显著的线性负相关关系,R2系数达0.840 (P< 0.05)。
对于单个植物种而言,相同光合型的不同植物种的δ13C随温度变化也存在差异。在本研究的3种C3植物中(图3),茄子的δ13C与温度呈近似的显著负相关,与Morecroft和Woodward[22]、Guillemette和Stephen[23]对C3植物进行的控温实验结果一致,而其它2种C3植物却表现为抛物线型的非线性关系,3种C4植物也具有与上述3种C3植物类似的变化特性。尽管有的植物种的δ13C组成随温度变化表现出一致的趋势,但变化幅度有差别(图3),表明不同植物种的δ13C组成对温度变化响应的程度不同。这是因为植物的δ13C除了受气候环境因素的影响外,在很大程度上还受植物本身各种生理因素以及遗传特性的控制[24]。本研究中,油菜、大豆、玉米和谷子4种植物的δ13C组成随温度变化呈抛物线关系,这可能与植物具有不同的光合最适温度有关,植物在最佳生长温度点会有最大的CO2同化速率和最大的碳同位素分馏[25]。Francey和Farquhar[26]认为,温度对植物δ13C的影响依赖于它是否高于或低于植物本身的最佳生长温度。由于不同植物种的最佳生长温度不同,因此温度对植物δ13C的影响取决于植物的种类和适宜生长温度的范围。Schleser等[1]也提出了类似的观点,认为植物δ13C与温度是一种非线性的抛物型关系,抛物线的拐点对应着植物的最佳生长温度点,如果温度低于最佳生长温度,δ13C-T则为正相关,反之则为负相关。尽管我们并不能确定本研究中供试植物的最佳生长温度点,但上述学者的观点能够解释油菜、大豆2种植物δ13C对温度变化的响应,因为它们的δ13C值随温度升高表现为先增大后减小的趋势。但从C3植物δ13C的平均值以及植物种茄子碳同位素对温度的响应来看(图2、图3),这一解释似乎并不完全令人信服。因为C3植物的适宜生长温度通常在20—30℃,根据Schleser等的观点,茄子的δ13C值应该在20/12℃—32/24℃范围内达到最大,而我们的结果却与之相反。同样,对于C4植物,尽管δ13C平均值和单个植物种玉米、谷子的δ13C值随温度升高均表现出先增大、后减小的抛物线模式,但与Schleser等提出的植物δ13C与温度呈抛物线关系的观点并不完全吻合。C4植物通常是喜高温植物,其适宜生长的温度大约在30—35℃,在本实验设定的温度范围内,C4植物的δ13C值应该随温度的升高变大,而我们的结果并未证实这一假说。这可能和控制实验与自然环境条件差别太大,以及温度对植物δ13C的影响还和其前期的温度胁迫有关。Battaglia等认为[27],当环境温度较长时间偏离植物生长的最适温度时,植物光合作用和呼吸作用都会对温度的变化产生适应,高温环境可使光合最适温度提高,低温环境使光合最适温度降低。
3.2 比叶面积(SLA)与植物δ13C
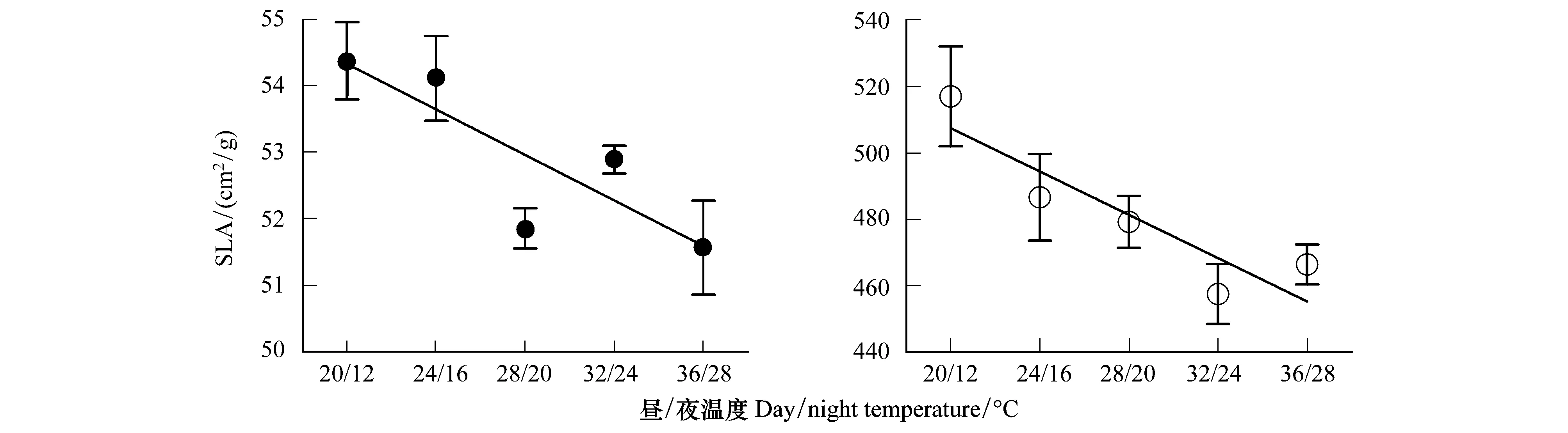
图4 植物SLA随温度的变化
关于植物叶片δ13C对温度变化的响应也可以从植物SLA随温度的变化得到说明。图4显示,C3、C4草本植物SLA随温度升高而降低,与植物δ13C对温度变化的响应趋势一致,从而导致C3、C4植物的平均δ13C值与SLA呈正相关(图5)。这只是一种表象,控温条件下植物叶片δ13C与SLA呈正相关的结果可能与两个方面的原因有关:1) 据报道,SLA较小的植物通常会提高叶片的羧化效率和光合作用能力[28- 29],有可能导致叶片气孔导度增大,进入叶片中的CO2增多,从而使叶片胞间CO2浓度(ci)上升,ci/ca值增大,导致植物δ13C降低[30- 31];2) 植物碳同位素分馏还受植物生长状况的影响[32]。在本研究中,发现生长较快的植株,其叶片通常较薄,而生长缓慢但正常的植物,其叶片则相对肥厚(即SLA较小)。根据Smith等[18]的研究,植物对重同位素(13C)的识别随生长速率的降低有增大的趋势,即具有肥厚叶片生长缓慢的植株,其碳同位素值更为偏负。单个植物种的分析也显示,大豆、茄子和玉米等3种植物δ13C随SLA的增大而偏正,但变化幅度不同,其余3种植物δ13C与SLA相关性不明显(图6),表明不同植物种对SLA变化的响应程度不同。
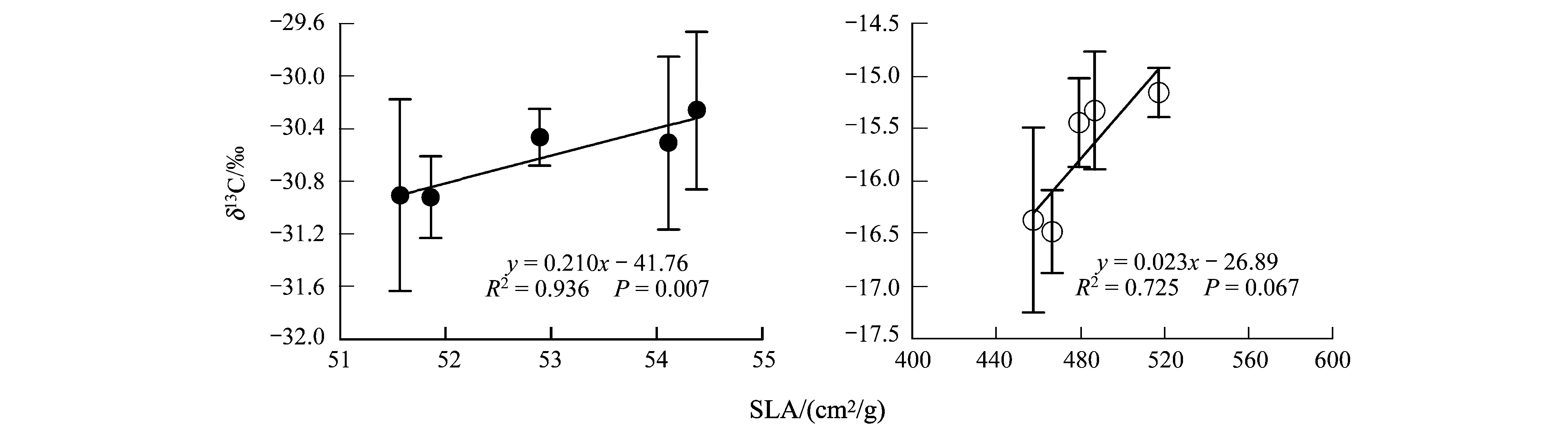
图5 植物碳同位素组成与SLA的关系
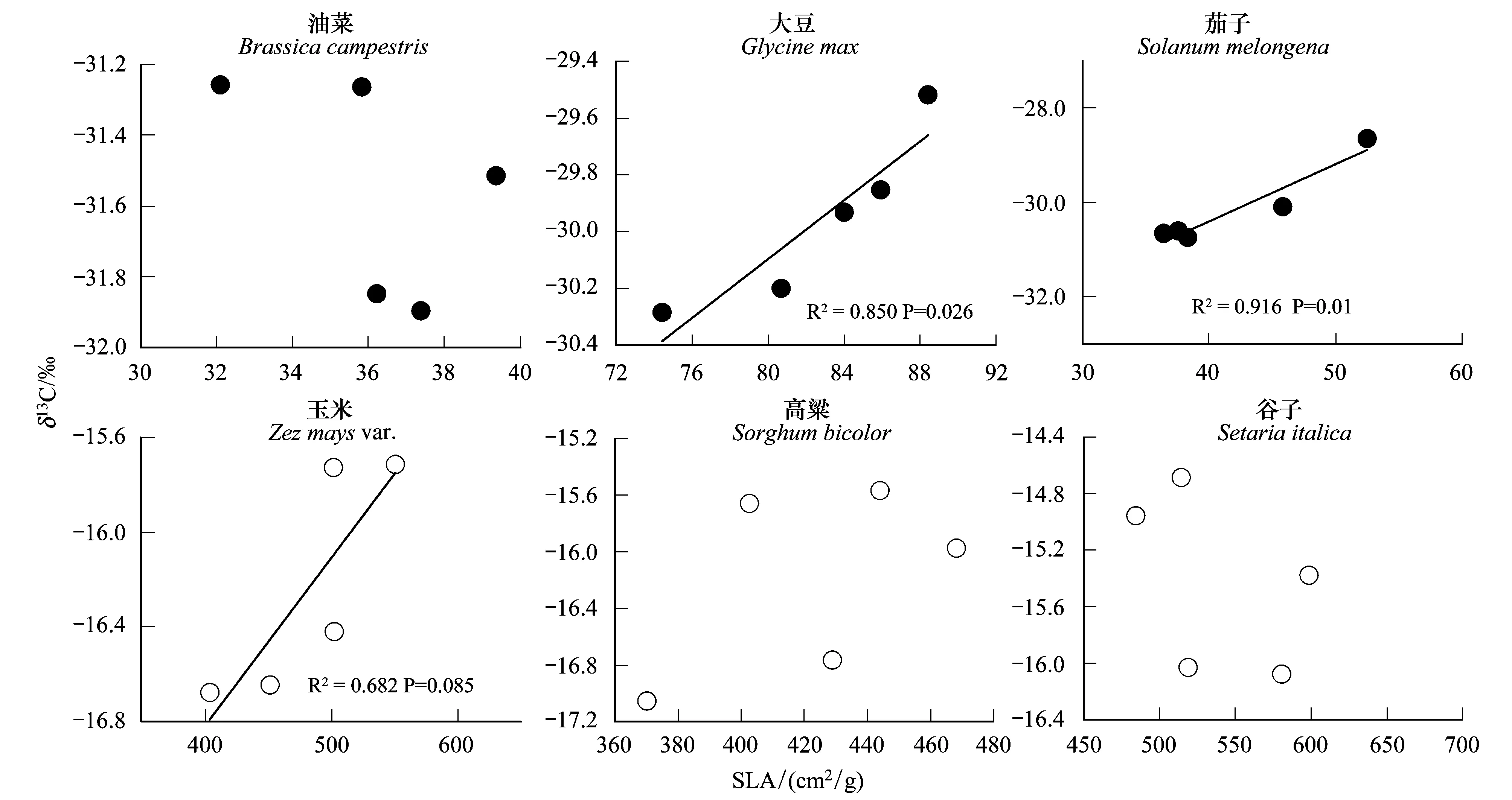
图6 单个植物种碳同位素组成与SLA的关系
3.3 光合参数与植物δ13C
由于植物体内碳同位素的分馏主要发生在光合作用过程中,因而对光合过程的分析和光合参数的解读可以有效地理解植物δ13C随温度的变化。从光合参数ci/ca的比值来看,C3植物δ13C均值与ci/ca比值呈负的线性关系(图7)。这可能是在实验温度范围内,随着温度的升高,参与光合作用的酶的活性增强,较高的光合作用能力引起气孔导度增大,导致ci/ca比值随温度增加而上升(图8),碳同位素分馏增大,从而使植物δ13C值随温度升高而变负(图2),与Farquhar等[24]提出的C3植物碳同位素分馏模式相吻合。至于C3植物δ13C与ci/ca比值关系不显著可能与实验周期短、ci/ca值测量次数少等因素有关。
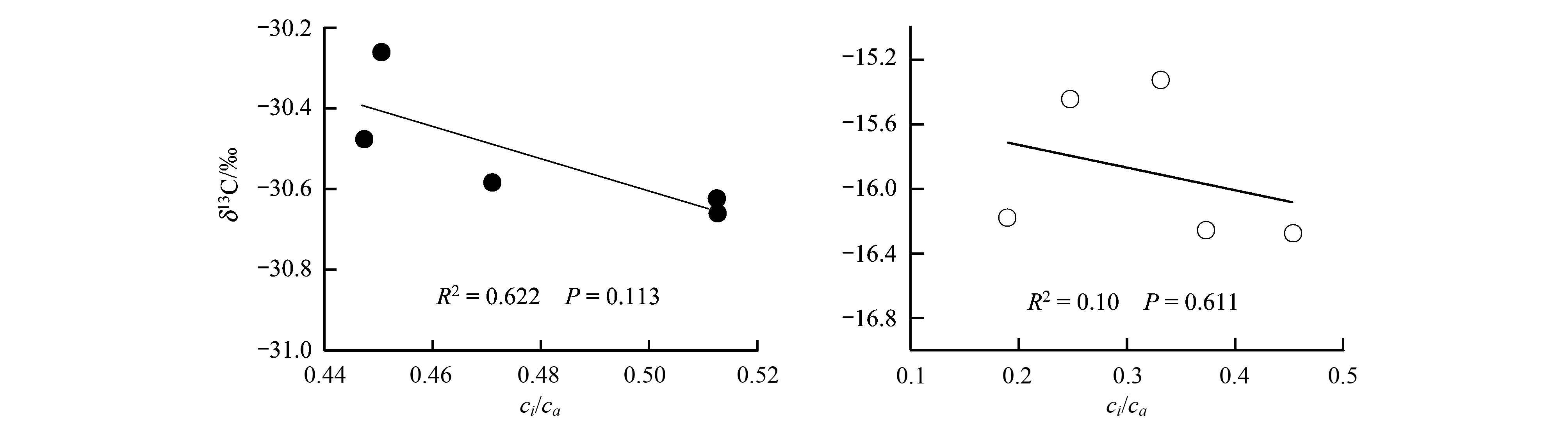
图7 植物碳同位素组成与ci/ca比值的关系
碳同化速率是植物光合作用过程中的又一重要参数,它可以用植物净光合速率(Pn)与细胞间隙CO2浓度(ci)间的关系曲线的初始斜率来表征,并通过温度影响参与光合作用酶的活性来控制植物叶片内部的ci,从而影响植物的碳同位素分馏。本研究中,Pn/ci与温度呈线性负相关关系(图8),而与植物的δ13C平均值呈显著正相关关系(图9)。Farquhar等[34]认为,植物光合作用的限制主要来自光限制和CO2限制(CO2扩散限制和CO2同化限制)。在本实验中,气候箱内光照强度为10000lx,属于强光照,因而不存在光限制的问题。因此,当温度由低温向适温增加时,CO2的限制将逐渐缩小。原因是适温下温度的增加一方面使气孔开度迅速增大,CO2扩散速率加快,ci值增加,δ13C降低;另一方面,温度的增加使碳同化过程中酶促反应(包括羧化反应及RuBP再生)的速率提高,CO2同化加速,但由于在适温范围,空气饱和差对气孔的限制作用较小,Pn对气孔开放的促进作用仍占主导地位,ci值迅速增加,从而导致本研究中Pn/ci与温度呈负相关,而与植物δ13C呈正相关。表明在一定的温度条件下,植物的碳同化能力也是影响植物δ13C分馏的重要原因。
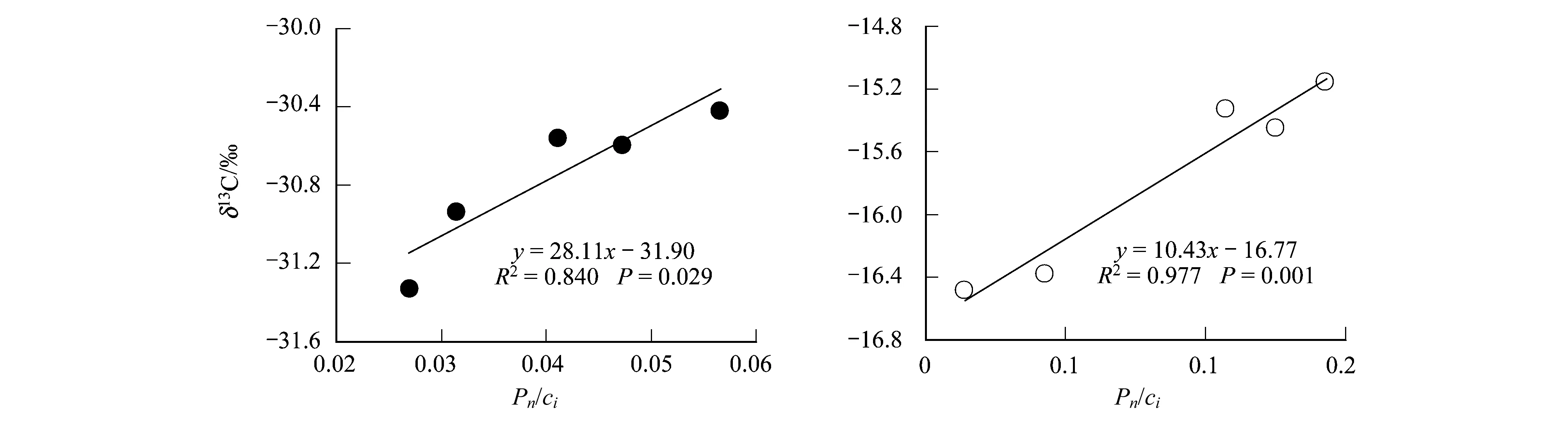
图9 植物叶片碳同位素组成与Pn/ci值的关系
4 结论
本研究基于控温实验,分析了6种草本植物δ13C对温度变化的响应。(1)在控温范围内(20/12℃—36/28℃),3种C3植物和3种C4植物的δ13C值分别变化在-28.3‰—-32.1‰和-14.4‰— -17.6‰;C3植物的δ13C平均值随温度增加而显著变低,C4植物的平均δ13C值随温度增加表现为先增大后减小的抛物型关系。上述结果与Smith等[20]报道的相吻合,而与Troughton和Card[21]、林清[13]报道的结果明显不同。(2)单个植物种的δ13C组成对温度变化的响应不同。茄子、高粱的δ13C值与温度呈线性负相关,其它4种植物均与温度呈抛物线关系。此外,还探讨了控温条件下C3、C4植物δ13C与SLA、ci/ca和Pn/ci等光合生长指标的关系。
尽管控制实验可以区分单个因子对植物δ13C的影响,但也存在一些不足。一是控制实验涉及的植物种不可能太多,其结果可能存在是否具有代表性的问题;二是需要昂贵的大型控温实验室。但另一方面,在复杂自然环境下研究植物δ13C与环境因子的关系又往往存在多个因子的交互作用,要想真正量化不同环境因子对植物δ13C的影响还存在一定难度。因此,加强野外调查与控制实验相结合的方法,以便相互补充和验证。
[1] Schleser G H, Helle G, Lücke A, Vos H. Isotope signals as climate proxies: the role of transfer functions in the study of terrestrial archives. Quaternary Science Reviews, 1999, 18(7): 927- 943.
[2] Diefendorf A F, Mueller K E, Wing S L, Koch P L, Freeman K H. Global patterns in leaf13C discrimination and implications for studies of past and future climate. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(13): 5738- 5743.
[3] Hemming D L, Switsur V R, Waterhouse J S, Heaton T H E, Carter A H C. Climate variation and the stable carbon isotope composition of tree ring cellulose: an intercomparison ofQuercusrobur,FagussylvaticaandPinussilvestris. Tellus B, 1998, 50(1): 25- 33.
[4] Kohn M J. Carbon isotope compositions of terrestrial C3 plants as indicators of (paleo)ecology and (paleo)climate. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(46): 19691- 19695.
[5] Terwilliger V J, Eshetu Z, Colman A, Bekele T, Gezahgne A, Fogel M L. Reconstructing palaeoenvironment from δ13C and δ15N values of soil organic matter: A calibration from arid and wetter elevation transects in Ethiopia. Geoderma, 2008, 147(3/5): 197- 210.
[6] Wang G A, Li J Z, Liu X Z, Li X Y. Variations in carbon isotope ratios of plants across a temperature gradient along the 400 mm isoline of mean annual precipitation in north China and their relevance to paleovegetation reconstruction. Quaternary Science Reviews, 2013, 63: 83- 90.
[7] Körner C H, Farquhar G D, Wong S C. Carbon isotope discrimination by plants follows latitudinal and altitudinal trends. Oecologia, 1991, 88(1): 30- 40.
[8] Li J Z, Wang G A, Liu X Z, Han J M, Liu M, Liu X J. Variations in carbon isotope ratios of C3plants and distribution of C4plants along an altitudinal transect on the eastern slope of Mount Gongga. Science in China Series D: Earth Sciences, 2009, 52(11): 1714- 1723.
[9] Körner C H, Farquhar G D, Roksandic Z. A global survey of carbon isotope discrimination in plants from high altitude. Oecologia, 1988, 74(4): 623- 632.
[10] 李善家, 张有福, 陈拓. 西北油松叶片δ13C特征与环境因子和叶片矿质元素的关系. 植物生态学报, 2011, 35(6): 596- 604.
[11] 宁有丰, 刘卫国, 曹蕴宁. 植物生长过程中碳同位素分馏对气候的响应. 海洋地质与第四纪地质, 2002, 22(3): 105- 108.
[12] 王国安, 韩家懋, 周力平. 中国北方C3植物碳同位素组成与年均温度关系. 中国地质, 2002, 29(1): 55- 57.
[13] 林清. 温度和无机碳浓度对龙须眼子菜(Potamogetonpectinatus)碳同位素分馏的影响. 生态学报, 2008, 28(2): 570- 576.
[14] Ramesh R, Bhattacharya S K, Gopalan K. Climatic correlations in the stable isotope records of silver fir (Abiespindrow) trees from Kashmir, India. Earth and Planetary Science Letters, 1986, 79(1/2): 66- 74.
[15] 李相博, 陈践发, 张平中, 刘光琇. 青藏高原(东北部)现代植物碳同位素组成特征及其气候信息. 沉积学报, 1999, 17(2): 325- 329.
[16] 刘贤赵, 王国安, 李嘉竹, 王文文, 赵丽丽, 李宝江. 中国北方农牧交错带C3草本植物δ13C与温度的关系及其对水分利用效率的指示. 生态学报, 2011, 31(1): 123- 136.
[17] Gebrekirstos A, Worbes M, Teketay D, Fetene M, Mitlöhner R. Stable carbon isotope ratios in tree rings of co-occurring species from semi-arid tropics in Africa: Patterns and climatic signals. Global and Planetary Change, 2009, 66(3/4): 253- 260.
[18] Smith B N, Herath H M W, Chase J B. Effect of growth temperature on carbon isotopic ratios in barley, pea and rape. Plant and Cell Physiology, 1973, 14(1): 177- 181.
[19] Troughton J H, Card K A. Temperature effects on the carbon-isotope ratio of C3, C4and Crassulacean-acid-metabolism (CAM) Plants. Planta, 1975, 123(2): 185- 190.
[20] Leavitt S W, Long A. Possible climatic response of δ13C in leaf cellulose of Pinyon pine in Arizona, USA. Isotope Geoscience, 1983, 1: 169- 198.
[21] Sheu D D, Chiu C H. Evaluation of cellulose extraction procedures for stable carbon isotope measurement in tree ring research. International Journal of Environmental Analytical Chemistry, 1995, 59(1): 59- 67.
[22] Morecroft M D, Woodward F I. Experimental investigations on the environmental determination of δ13C at different altitudes. Journal of Experimental Botany, 1990, 41(10): 1303- 1308.
[23] Ménot G, Burns S J. Carbon isotopes inOmbrogenicpeat bog plants as climatic indicators: calibration from an altitudinal transect in Switzerland. Organic Geochemistry, 2001, 32(2): 233- 245.
[24] Farquhar G D, Ehleringer J R, Hubick K T. Carbon isotope discrimination and photosynthesis. Annual Review of Plant Physiology and Plant Molecular Biology, 1989, 40: 503- 537.
[25] Beerling D J. Carbon isotope discrimination and stomatal responses of maturePinussylvestrisL. trees exposed in situ for three years to elevated CO2and temperature. Acta Oecologica, 1997, 18(6): 697- 712.
[26] Francey R J, Farquhar G D. An explanation of13C/12C variations in tree rings. Nature, 1982, 297(5861): 28- 31.
[27] Battaglia M, Beadle C, Loughhead S. Photosynthetic temperature responses ofEucalyptusglobulusandEucalyptusnitens. Tree Physiology, 1996, 16(1/2): 81- 89.
[28] Taub D R, Lerdau M T. Relationship between leaf nitrogen and photosynthetic rate for three NAD-ME and three NADP-ME C4 grasses. American Journal of Botany, 2000, 87(3): 412- 417.
[29] Vitousek P M, Field C B, Matson P A. Variation in foliarδ13C in HawaiianMetrosiderospolymorpha: a case of internal resistance? Oecologia, 1990, 84(3): 362- 370.
[30] Qiang W Y, Wang X L, Chen T, Feng H Y, An L Z, He Y Q, Wang G. Variations of stomatal density and carbon isotope values ofPiceacrassifoliaat different altitudes in the Qilian Mountains. Trees, 2003, 17(3): 258- 262.
[31] Takashima T, Hikosaka K, Hirose T. Photosynthesis or persistence: nitrogen allocation in leaves of evergreen and deciduous Quercus species. Plant, Cell & Environment, 2004, 27(8): 1047- 1054.
[32] Morecroft M D, Woodward F I, Marrs R H. Altitudinal trends in leaf nutrient contents, leaf size and δ13C ofAlchemillaalpina. Functional Ecology, 1992, 6(6): 730- 740.
[33] Evan J R, Sharkey E T, Berry J A, Farquhar G D. Carbon isotope discrimination measured concurrently with gas exchange to investigate CO2diffusion in leaves of higher plants. Australian Journal of Plant Physiology, 1986, 13(2): 281- 292.
[34] Farquhar G D, O’Leary M H, Berry J A. On the relationship between carbon isotope discrimination and the intercellular carbon dioxide concentration in leaves. Australian Journal of Plant Physiology, 1982, 9(2): 121- 137.
Responses of carbon isotopic composition of C3 and C4 herbaceous plants to temperature under controlled temperature conditions
LIU Xianzhao1,2,3,*, SU Qing3, LI Jiazhu1, QUAN Bin3, LI Chaokui3, ZHANG Yong3, WANG Zhiqiang3, WANG Guoan4
1CollegeofGeographyandPlanning,LudongUniversity,Yantai264025,China2StateKeyLaboratoryofSoilErosionandDrylandFarmingontheLoessPlateau,InstituteofWaterandSoilConservation,ChineseAcademyofSciences,Yangling712100,China3CollegeofArchitectureandUrbanPlanning,HunanUniversityofScienceandTechnology,Xiangtan411201,China4CollegeofResourcesandEnvironmentalSciences,ChinaAgriculturalUniversity,Beijing100193,China
The stable carbon isotope ratios (δ13C) of the six herbaceous plants (including 3 C3 species and 3 C4 species) and their responses to temperature change were explored in artificial controlled environments at day/night temperatures ranging from 20/12 to 36/28℃. The correlations between plantsδ13C values and the growth and photosynthetic indexes, such as specific leaf area (SLA), the ratio of intercellular CO2concentration (ci) to environmental CO2concentration (ca), and carbon assimilation rate (net photosynthetic ratePn/ci) were also analyzed in order to investigate the temperature effects on carbon-isotope ratio of C3 and C4 herbs. The results showed that, theδ13C values of C3 and C4 plants ranged between -28.3 ‰ to -32.1 ‰, and between -14.4 ‰ to -17.6 ‰, respectively. In the three C3 species, rape (Brassicacampestris) had the most concentrated distribution ofδ13C values, with an range of -31.1 ‰ to -32.1 ‰; and theδ13C value distribution for millet (Setariaitalica) was the narrowest in the three C4 plants. In the experimental temperature range, the meanδ13C values of three C3 plants significantly decreased with increasing temperature, while a parabolic relationship showing an increase first and then decrease existed between the averageδ13C values of three C4 plants and temperature, however, the linear regression result was not significant (P>0.05). Theδ13C values of individual species responded differently to temperature. Theδ13C values in eggplant (Solanummelongena) and sorghum (Sorghumbicolor) negatively correlated with temperature, and theδ13C values of other four species all showed a quadratic parabola relationship with temperature, which may be associated with different plant species that have different optimum photosynthesis temperature and carbon isotope fractionation capacities to temperature.
herbaceous plant; carbon isotope; temperature; control experiments
国家自然科学基金资助项目(41171158); 山东省自然科学基金项目(ZR2011DM007); 国家重点实验室基金项目(10501- 1202)
2013- 07- 05;
2014- 05- 30
10.5846/stxb201307051840
*通讯作者Corresponding author.E-mail: xianzhaoliu@sina.com
刘贤赵, 宿庆, 李嘉竹, 全斌, 李朝奎, 张勇, 王志强, 王国安.控温条件下C3、C4草本植物碳同位素组成对温度的响应.生态学报,2015,35(10):3278- 3287.
Liu X Z, Su Q, Li J Z, Quan B, Li C K, Zhang Y, Wang Z Q, Wang G A.Responses of carbon isotopic composition of C3 and C4 herbaceous plants to temperature under controlled temperature conditions.Acta Ecologica Sinica,2015,35(10):3278- 3287.

