多器官功能障碍综合征患者肠道菌群多样性研究
徐文秀,张 谦
(江苏省苏州市中医医院,江苏 苏州 215000)
临床研究
多器官功能障碍综合征患者肠道菌群多样性研究
徐文秀,张 谦
(江苏省苏州市中医医院,江苏 苏州 215000)
目的应用PCR-DGGE技术对多器官功能障碍(MODS)患者肠道菌群多样性进行研究,分析其与疾病的关系。方法收集15例MODS患者和15例正常对照人群的粪便样本,提取样本细菌总基因组DNA。根据MODS评分分成低分组(<5分)、中分组(5~10分)、高分组(≥10分)。然后对细菌总基因组DNA的16SrRNA的V3区进行PCR扩增,进行DGGE图谱及多样性分析,分析MODS患者及对照人群肠道菌群的相似性,并通过Shannon-Weaver(H')指数来分析样本的条带数、均匀度指数、多样性指数、丰富度指数和优势度指数。结果低分组及高分组与对照组菌群结构差异显著;低分组肠道菌群结构的种类及数量、优势菌种类及相对含量均明显低于中分组。中分组与高分组肠道菌群结构比较差异无统计学意义。高分组肠道菌群的种类多于低分组,但是数量差异不大;优势菌相对含量及种类差异显著。结论MODS患者肠道中独有的细菌与疾病有关,它们与MODS的关系尚需进一步探索。
PCR-DGGE;多器官功能障碍综合征;肠道菌群
多器官功能障碍综合征(MODS)是危重病患者的常见并发症。Mayr等[1]对ICU危重患者死亡原因及危险因素进行分析显示,急性MODS引起的死亡占ICU总死亡人数的47%,远远超过单个器官衰竭和突发的心搏骤停而居ICU死亡原因的首位。目前国内外最常用的是加拿大Marshall等[2]的MODS评分和1995年全国危重病急救医学学术会议[3]上提出并通过的MODS诊断标准,1986年Carrico等[4]首先提出肠道是发生MODS的原动力,肠道参与创伤、烧伤和感染后的各种应激反应,是MODS的始动器官。其主要损伤肠道黏膜屏障,影响肠道动力。近年随着分子生物学的发展,PCR-DGGE技术应用于肠道微生物的研究[5]。本研究应用PCR-DGGE技术对MODS患者肠道菌群多样性进行了观察,现报道如下。
1 临床资料
1.1一般资料 收集2010年10月—2012年3月苏州市中医医院重症医学科及苏州大学附属第二医院重症医学科15例符合标准MODS患者的粪便标本作为MODS组,同时采集15例同期健康体检者粪便标本作为对照组。MODS诊断符合相关诊断标准,且存在2个或2个以上系统或器官功能障碍,年龄大于18周岁,以感染为诱因。MODS组年龄(74.82±14.69)岁,对照组年龄(81.40±10.49)岁,2组年龄比较差异无统计学意义(P>0.05)。MODS组又根据MODS评分分成3组:低分组(<5分)6例,中分组(5~10分)5例,高分组(≥10分)4例。
1.2主要实验仪器和设备 Eppendorf 5804R低温高速离心机;Vortex-2 Genie旋涡振荡器;DK-8D型电热恒温水槽;PTC-225 Peltier Thermal Cycler PCR仪;PAC3000水平电泳仪;Syngene凝胶成像系统;Nanophotometer仪;垂直流超净工作台;DGGE仪(The DCode TM Universal Mutation Detection System);GS-800灰度扫描仪。
1.3肠道粪便样本采集 采样前,将30 mL粪便收集塑料杯高压灭菌烘干备用。用无菌塑料杯收集每个个体新鲜粪便的中后端部分。标本采集完成后用蜡膜将塑料杯杯口封闭。同时对每个个体胃肠道问题信息进行采集。采集的样本先于冰箱冻存,并立即转运回实验室-70 ℃保存备用。
1.4PCR-DGGE分析 16S rRNA 基因V3高变区通用引物[6]V3F:5’-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG GCC TAC GGG AGG CAG CAG-3’;V3R:5’- ATT ACC GCG GCT GCT GG-3’,其中CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG G为GC夹。采用Touch-down程序,94 ℃,3 min预变性;94 ℃,1 min 变性;65 ℃,1 min退火;72 ℃,1 min 延伸,之后每2个循环退火温度就下降 1 ℃,直到退火温度降到 55 ℃,再以此为退火温度循环4次;72 ℃,5 min延伸;4 ℃,10 min。随后通过对PCR产物进行Recon-condition PCR去除嵌合体以及异源双链的影响。扩增产物检验:将扩增产物上样于2%琼脂糖凝胶,Gel Red染色,于0.5×TAE缓冲液中150 V电泳30 min,以50 bp DNA ladder为Marker,使用凝胶成像系统Syngene进行检验。之后进行DGGE凝胶制备,220 V,电泳10 min。随后150 V,电泳5 h,电泳结束后对凝胶进行Gel-Red染色15 min,使用Bio-Rad凝胶成像仪拍照。并通过QuantityOne软件对DGGE分子指纹图谱进行相关分析。
2 结 果
2.1MODS患者肠道状况分析 15例MODS样本大部分是直接从直肠部位吸取而来,呈水样或粥样,部分样本带有少量食物残渣、膜状物质等。临床体检听诊肠鸣音结果发现肠鸣音减弱的共有5例,其中低分组为0例,中分组3例,高分组2例。15例患者中大便隐血阳性3例,低分组0例,中分组2例,高分组1例(便隐血,并出现呕血现象)。
2.2低分组与对照组DGGE图谱分析 低分组和对照组条带数、均匀度指数、多样性指数、丰富度指数和优势度指数比较差异均有统计学意义(P均<0.05)。低分组多样性指数与丰富度指数均低于对照组,说明对照组肠道菌群种类及数量较大;均匀度指数与优势度指数均低于对照组,说明二者肠道优势菌种种类及相对含量差异也较大。见表1和图1。
2.3中分组和对照组DGGE图谱分析 中分组和对照组条带数、均匀度指数、多样性指数、优势度指数和丰富度指数比较差异均无统计学意义。提示中分组与对照组在细菌的种类和数量以及优势菌的种类和相对含量各方面差异不明显。见表2和图2。
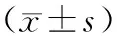
表1 低分组与对照组DGGE图谱分析
注:①与对照组比较,P<0.05。
图1 低分组和对照组电泳图
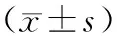
表2 中分组与对照组DGGE图谱分析
图2 中分组和对照组电泳图
2.4高分组和对照组DGGE图谱分析 高分组和对照组条带数、优势度指数和丰富度指数比较差异均有统计学意义(P均<0.05),而均匀度指数、多样性指数比较差异无统计学意义。提示高分组样本和对照组肠道菌群在种类上有明显差异,优势菌的种类和相对含量较丰富。见表3和图3。
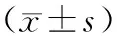
表3 高分组与对照组DGGE图谱分析
注:①与对照组比较,P<0.05。
2.5特异性条带克隆测序分析 选择8条具有代表性的DGGE条带进行切胶回收、PCR扩增、克隆和测序,测序后所得的序列和数据库GenBank和RDP中的16SrRNA序列进行比对。显示相似性最高的分别是类杆菌属、不动杆菌属、肠球菌属和大肠杆菌。这提示MODS患者肠道中类杆菌属、不动杆菌属、肠球菌属和大肠杆菌含量相对较高。见图4。

图3 高分组和对照组电泳图
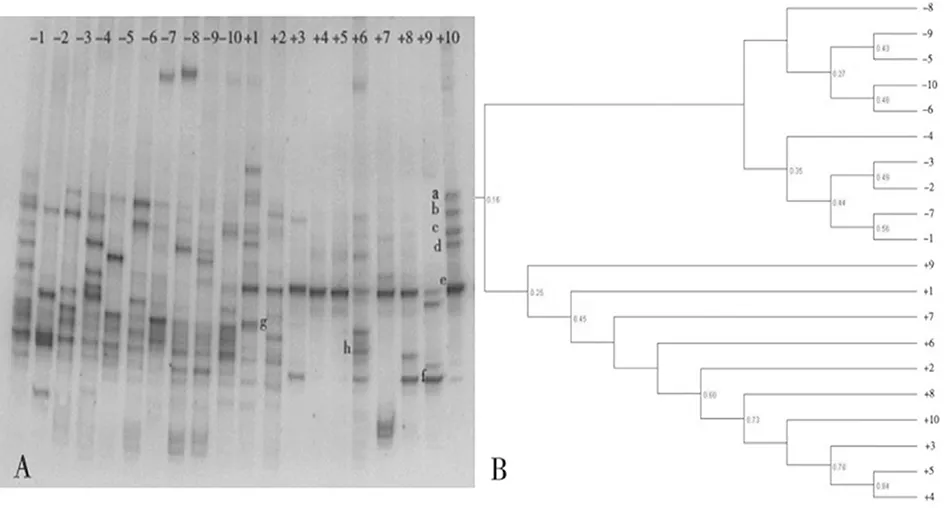
图4 MODS各组与对照组电泳图
3 讨 论
肠道菌群与MODS的发生发展有着密切联系。早在1988年,就有学者发现ICU患者大肠杆菌、脆弱拟杆菌、肠球菌普遍存在,而表皮葡萄球菌、念珠菌、假单胞菌对MOF高分有影响[7]。Marshall等[8]1993年采用含血的琼脂和Macconkey琼脂培养需氧菌、血琼脂和苯乙醇琼脂培养厌氧菌对患者胃肠道提取物进行定量培养,通过API20E系统进行定量和定性分析。该研究揭示了肠道细菌与远距离器官感染之间的关系。研究发现,器官功能障碍的患者上消化道内容物经培养后,出现一些与上呼吸道感染有关并有时会造成尿路感染的病原微生物,如念珠菌、粪链球菌、假单胞菌和表皮葡萄球菌。
本研究中,16S rRNA V3区的PCR-DGGE图谱能够对人体肠道主要菌群组成进行区分。所有粪便标本的DGGE图谱显示高度的多态性,而且不同标本间的带型均存在很大的差异。MODS低分组患者样本与对照组以及高分组相比,在菌群组成和数量以及优势菌的种类及相对含量各方面具有显著差异。中分组与对照组及高分组和低分组相比,菌群结构的差异不是很明显。这可能的原因是样本量较小,尚不能取得更详尽的信息。也可能提示MODS评分标准与肠道菌群结构有一定的联系。
本研究还针对DGGE图谱上显示的,在MODS患者中亮度较高(即相对含量较高)以及在MODS患者中特异存在的条带做了切胶回收克隆测序的实验,显示MODS患者肠道类杆菌属、不动杆菌属、肠球菌属和大肠杆菌含量相对较高。提示这些菌属在MODS患者疾病的发生发展上起到一定作用。不动杆菌属是一种毒力较低的机会致病菌,当机体由于疾病导致免疫力低下的时候,便可引起感染,引发炎症反应,如果控制不及时造成SIRS进而导致MODS。有研究显示不动杆菌在肺炎、血液传染病、脓胸等患者体内浓度很高[9]。肠球菌属为椭圆形或圆形链状排列的革兰阳性球菌,是人和动物肠道正常菌群的一部分。毒力较低,只有在一定条件下如必须在宿主组织定植、并能抵抗机体的免疫防御机制后才能引起组织病理改变,导致感染。Hung等[10]从肾脓肿患者的体液中培养出大量大肠杆菌以及肠球菌,也提示这2种菌属与SIRS及MODS的发生有关。通过合理使用抗生素以及饮食调节肠道菌群的组成,有可能减轻MODS患者的临床症状,对于MODS患者的预防、治疗和转归都有着重要的作用。
MODS是一类发病机制复杂的综合征,对患者、家庭和整个社会都导致了严重的伤害。过去对MODS病因的研究主要集中在对炎症反应的控制上,虽然也认识到肠道菌群的重要作用,但是多数也是通过培养法针对某些细菌做的定量、定性分析,而从总体上分析肠道菌群结构的研究并不多。前期学者多集中于益生菌对肠道菌群调节作用的研究上,而本文是从肠道菌群总体结构上的探索。再者,以人的肠道为研究对象,每个人的饮食、生活环境和宿主基因等都会影响肠道菌群结构的组成,因此本研究结果与他们的研究结果均有一定的差异。
[1] Mayr VD,Dünser MW,Greil V,et al. Causes of death and determinants of outcome in critically ill patients[J]. Critical Care,2006,10(6):R154
[2] Marshall JC,Cook DJ,Christou NV,et al. Multiple organ dysfunction score:a reliable descriptor of a complex clinical outcome[J]. Crit Care Med,1995,23(10):1638-1652
[3] 王今达,王宝恩. 多脏器功能失常综合征病情分期诊断及严重程度评分标准(经庐山'95全国危重病急救医学学术会讨论通过)[J]. 中国危重病急救医学,1995,7(6):346-347
[4] Carrico CJ,Meakins JL,Marshall JC,et al. Multiple-organ-failure syndrome[J]. Arch Surg,1986,121(2):196-208
[5] 杨晓军,王晓红,梁志娟. 16S rDNA测序在呼吸机相关性肺炎痰液细菌多样性分析中的应用[J]. 中华危重病急救医学,2014,26(5):294-299
[6] Hill JM. Vasoactive intestinal peptide in neurodevelopmental disorders:therapeutic potential[J]. Curr Pharm Des,2007,13(11):1079-1089
[7] Marshall JC,Christou NV,Horn R,et al. The microbiology of multiple organ failure:the proximal gastrointestinal tract as an occult reservoir of pathogens[J]. Archives of Surgery,1988,123(3):309-315
[8] Marshall JC,Christou NV,Meakins JL. The gastrointestinal tract. The “undrained abscess” of multiple organ failure[J]. Ann Surg,1993,218(2):111-119
[9] Jajoo M,Kumar V,Jain M,et al. Intravenous colistin administration in neonates[J]. Pediatric Infectious Disease Journal,2011,30(3):218-221
[10] Hung CH,Liou JD,Yan MY,et al. Immediate percutaneous drainage compared with surgical drainage of renal abscess[J]. Int Urol Nephrol,2007,39(1):51-55
Study on the intestinal microbial flora diversity in the patients with MODS
XU Wenxiu, ZHANG Qian
(Suzhou Hospital of Traditional Chinese Medicine, Suzhou 215000, Jiangsu, China)
Objective It is to study the intestinal microbial flora diversity in the patients with MODS by PCR-DGGE technology, and to analyze its relationship with the disease. Methods The stool samples of 15 patients with MODS and 15 healthy people were collected and the genomic NDA of the microbial flora was extracted. According to MODS scores, the patients were divided into low score group (<5), medium score group (5-10), high score group (>=10). V3 area of 16S rRNA of total genomic DNA of bacteria was chosen for PCR amplification to do DGGE profiles and diversity analysis, intestinal flora similarity was analyzed between MODS patients and control group, and through the Shannon-Weaver (H ') index the sample number of bands, evenness index, diversity index, richness index and dominance index were analyzed. Results The differences in the microorganism community structure between low score group, high score group and control group were significant. Sample amount and type of structure of intestinal flora, kind and relative content of advantage strains in low score group was significantly lower than that in medium score group, but there was no significant difference in the microorganism community structure between low score group and high score group. The kinds of intestinal flora in high score group was more than that in low score group, but the difference in quantity was not significant. The difference in kind and relative content of advantage strains was significant. Conclusion Unique intestinal microbial flora in MODS patients is related to the disease, but their relationship with the MODS remains to be further explored.
PCR-DGGE; MODS: intestinal microbial flora
10.3969/j.issn.1008-8849.2015.28.009
R0541.64
B
1008-8849(2015)28-3104-04
2014-12-30

