水田改果园后土壤性质的变化及其特征
杨东伟, 章明奎
浙江大学环境与资源学院, 杭州 310058
水田改果园后土壤性质的变化及其特征
杨东伟, 章明奎*
浙江大学环境与资源学院, 杭州 310058
近年来,水田改作经济林地,在我国南方地区非常普遍。为深入了解这一转变对土壤质量的影响,以浙江省典型水稻土(青粉泥田)及其改果园不同年限的系列表层土壤(0—15 cm)为研究对象,应用磷脂脂肪酸生物标记等方法,研究了水田改果园后土壤理化性质和微生物群落结构等性质的变化以及它们之间的关系。结果表明,水田改果园后,土壤中大于0.25 mm水稳定性团聚体、盐基饱和度、pH值、有机质、全氮和碱解氮等随着改果园年限的延长而显著降低(P<0.05)。土壤微生物生物量碳氮、微生物商和土壤呼吸强度随改果园年限增加而显著下降(P<0.01)。土壤微生物群落结构也发生明显变化:磷脂脂肪酸总量显著降低(P<0.01),微生物种类减少,原生动物在土壤微生物中所占比例增加,革兰氏阴性细菌与革兰氏阳性细菌比值降低(P<0.01),好氧细菌/厌氧细菌和甲烷氧化菌/细菌增加(P<0.01),表征养分胁迫的环丙基脂肪酸/前体物和异式脂肪酸/反异支链脂肪酸显著增加(P<0.01)。冗余分析表明,土壤含水率、有机质和碱解氮是决定水田和果园土壤微生物群落结构差异的最重要因子(P<0.01);改果园后,土壤微生物群落结构发生了阶段性变化,不同利用方式对微生物群落结构的影响程度要大于同一利用方式耕作不同年限对微生物群落结构的影响。研究表明,水田改果园后土壤理化性质以及生物学性质发生退化,土壤质量下降;而水田中微生物数量和种类都比较丰富,因而认为水田是土壤(地)可持续利用的一种有效方式。
土地利用方式; 土壤性质; 微生物群落结构; 磷脂脂肪酸; 土壤质量
水稻田不仅是我国主粮(稻谷)的生产基地, 也是我国重要的人工湿地生态系统[1],其在区域生态(水/热/生物)平衡、物质循环等方面具有非常积极的意义。近年来我国水稻播种面积呈下降趋势,2011年全国水稻种植面积为3005.7万hm2,比1997年减少170.8万hm2[2]。浙江素有“鱼米之乡”之称,水田面积常年占粮食播种面积的70%以上。近来浙江省水稻播种面积连年减少,2011年水稻播种面积为89.5万hm2,比1997年减少119.1万hm2,除双季稻改单季稻原因外,由于改种其它作物或用作其它用途致使水稻播种面积减少89.6万hm2[3]。另外,统计显示1997年至2007年间,浙江省有3.1万hm2耕地改为林、桑、茶、果园[3]。农户追求更高经济效益或缺水是水田改为果园等经济林的主要动因。
土地利用方式变化是影响土壤质量最普遍、最直接、最深刻的因素[4],近年来不合理的土地利用所引起的土壤质量问题日益突出。随着人们对土壤健康质量的重视,一些学者对水田转变为其它利用方式后土壤性质的变化进行了研究,发现水田改旱作后土壤pH值、有机质、微生物生物量碳氮及活性下降[5- 9]。20世纪 70年代末80年代初,磷脂脂肪酸(phospholipid fatty acid,PLFA)谱图分析技术被用于对微生物群落结构的定量分析[10- 11]。Bossio等应用PLFA生物标记法研究发现土壤类型、土地利用方式及利用年限都会对土壤微生物结构产生重要影响[12- 13]。Xue等采用PLFA谱图分析技术等方法对比了不同利用方式和同一利用方式不同利用年限对微生物群落结构的影响,结果表明前者会对微生物群落结构产生更显著影响[14]。Bossio等采用PLFA生物标记法研究发现土壤微生物群落结构对土壤淹水的反应非常敏感[15]。然而,姚槐应等应用PLFA生物标记法研究发现稻田土壤经常处于淹水的条件下,一些厌养微生物特征脂肪酸与其它土壤并没有太大的差异,表明水田土壤的微生物群落与其它土壤差别不大,他们认为水田中微生物可能对淹水这类环境胁迫有一定的抗性[16]。
目前有关土地利用方式的研究主要集中在土壤基本性质的差异方面,而在利用方式改变后土壤质量随着时间的演变规律,土壤微生物群落对土壤环境因子变化的响应机制及其动态变化过程方面尚缺乏系统研究。本文以浙江水网平原为研究区,选取典型水稻土及其改果园后的系列土壤为研究对象,采用时空互代法,研究了水田转变为果园以及果园不同利用年限对土壤环境因子和微生物群落结构的影响,以期揭示利用方式改变后土壤质量演变过程及微生物群落结构对土壤环境因子变化的响应规律,并希望利用土壤微生物的预警作用正确评价土壤肥力状况的变化,为防止土壤退化和促进土壤(地)资源的可持续利用提供理论依据。
1 材料与方法
1.1 采样点基本情况
研究区位于浙江省杭州市余杭区瓶窑镇窑北村,地理坐标位于30°24′21″—30°24′27″N,119°56′15″ —119°56′26″ E之间,海拔3 m,属于杭嘉湖平原,质地为粉粘壤土[17],样品采集在15.0 hm2的范围内进行。研究区内地势平坦,地貌类型单一,土壤发育于均一的湖相沉积物之上。据对研究区内5个剖面土壤(平均深度130 cm,2个水田土壤剖面,3个果园土壤剖面)调查,表明研究区内土壤母质和发生层组成相当一致,它们的土壤剖面形态特征、发生层组合及分布与土壤质地的深度分布接近。研究区目前土地利用方式主要为水田和果园,果树种植前土地利用方式也为水田,即研究区土地背景和土壤类型一致,研究区内土壤性状的变化主要是利用方式改变后水分管理和施肥水平等方面差异引起的。因作物生长需要,水田土壤中水分含量较高,另外,平均每亩单季稻要施用尿素15 kg,过磷酸钙30 kg,氯化钾8 kg,以及复合肥15 kg;桃园中沟渠纵横有于排水,为桃树提供了干燥的生长环境,在其生长期内平均1—2个月使用1次除草剂和杀虫剂,施肥方式以桃树周围环状沟施为主,平均每亩施用尿素20 kg,过磷酸钙65 kg,氯化钾30 kg,复合肥80 kg,以及鸡粪1200 kg。总体上,研究区内同一种利用方式(水田或果园),土地管理方式相似;不同利用方式相比较,果园较水田施肥量大,灌溉量小,农药用量大。
1.2 样品采集与处理
于2012年9月中旬在研究区内选择了18块代表性农田,采集了18个混合土样(每一田块采集1个混合样)。其中,水田样品2个,不同园龄果园土壤样品16个。水田样品采集时,水稻尚未收获,表面有少量积水。每一样品采用梅花状布点采样法由多点采样混合而成,每一田块分样点数在5个以上,采集深度为0—15 cm。将采集的土壤样品置于塑料袋内,用冰块冷藏带回实验室,去除可见的根系等动植物残体和石块,混匀分成3份,取1份原状土壤沿自然破碎面轻轻将大块掰开,自然风干,测定土壤水稳定性团聚体,余下部分分别过2 mm、1 mm和0.15 mm孔径筛,测定其它理化指标;另一份新鲜土样过2 mm筛,放4 ℃冰箱后1周内完成土壤微生物量、土壤呼吸强度等指标测定;第3份土样冷冻干燥,放-80 ℃冰箱保存,测定土壤微生物磷脂脂肪酸含量。其它土壤样品信息详见表1。
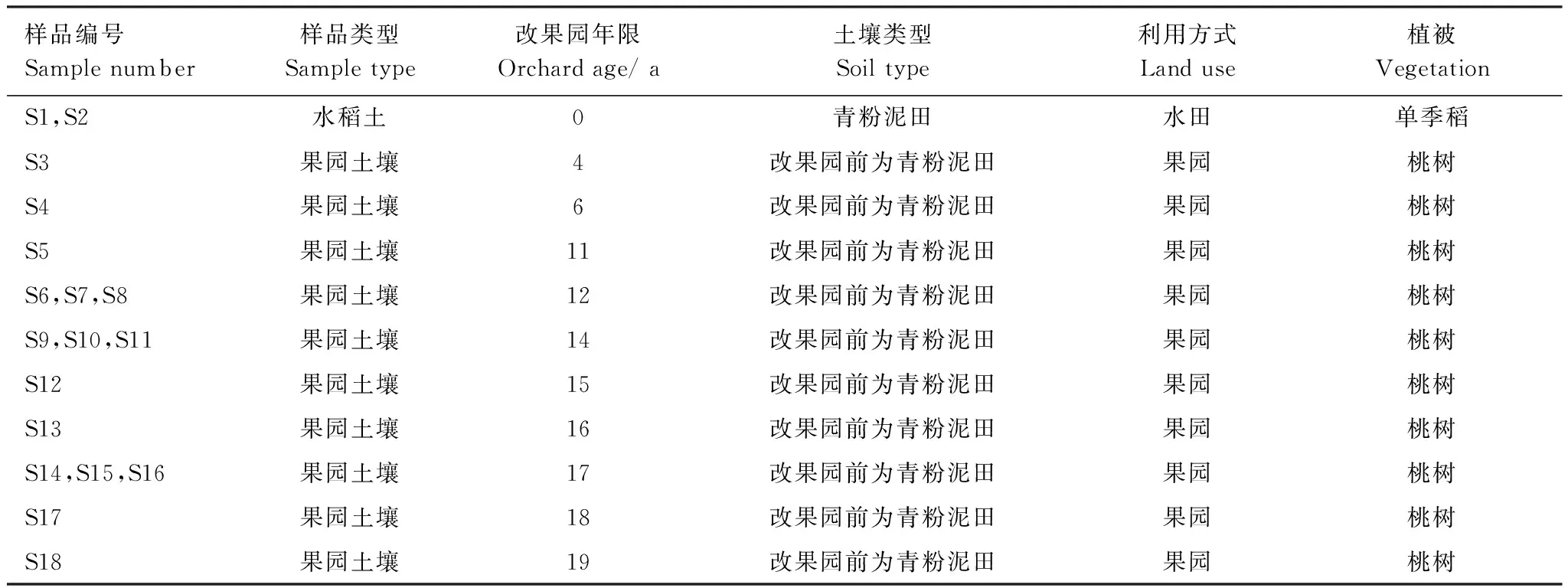
表1 土壤样品信息
1.3 土壤理化性质分析
土壤颗粒组成采用吸管法;质地采用国际制;水稳定性团聚体采用湿筛法;pH值采用土液比1∶2.5水浸提法;有机质含量采用重铬酸钾-硫酸外加热法;交换性盐基采用原子吸收光谱法;全氮采用凯氏定氮法;碱解氮采用碱解扩散法;全磷采用NaOH熔融-钼锑抗比色法;速效磷采用0.05 mol/L HCl和0.0125 mol/L H2SO4提取-钼锑抗比色法;全钾采用NaOH熔融-火焰光度法;速效钾采用NH4OAc浸提-光焰光度计法,具体分析方法详见文献[18]。
1.4 土壤生物学性质分析
土壤微生物生物量碳氮采用氯仿熏蒸-K2SO4浸提,TOC自动分析仪测定;土壤呼吸量采用静态气室法,具体分析方法详见文献[18]。土壤微生物磷脂脂肪酸测定方法:称取3 g冷冻干燥后的土壤样品于特氟龙管内,用氯仿-甲醇-柠檬酸盐缓冲液提取总脂类,通过硅胶柱层析法分离得到磷脂脂肪酸,然后经碱性甲酯化后用气相色谱分析土壤微生物磷脂脂肪酸的含量,气相色谱分析仪为Agilent 6890N气相色谱仪(FID检测器),结合MIDI Sherlock 微生物鉴定系统(Version 4.5)对各成分脂肪酸进行鉴定,内标为正十九烷酸甲酯(19:0)[19]。
本研究采用一种或多种特征脂肪酸之和表示土壤微生物的绝对含量和相对丰度,如用12:00、i14:0、14:00、a15:0、15:00、i15:0、15:0 2OH、15:0 3OH、a16:0、16:1 ω9c、16:1ω5c、16:00、16:0 N alcohol、17:00、a17:0、cy 17:0、18:00、18:1 ω7c、18:1 ω5c、17:0 ISO 3OH、i19:0和cy19:0 ω8c表征细菌的特征脂肪酸[20- 25];用18:2 ω6c、18:3 ω6c (6,9,12)和20:1 ω9c来表征真菌的特征脂肪酸;用16:0 (10Me)、17:0 (10Me)、18:0 (10Me)和19:0 (10Me)表征放线菌的特征脂肪酸;用20:4 ω6,9,12,15c来表征原生动物的特征脂肪酸;16:1 ω5c、17:1 ω8c、18:1 ω5c、18:1 ω7c和cy17:0表征革兰氏阴性细菌的特征脂肪酸;用i14:0、a15:0、i15:0、a16:0、i16:0、a17:0、i17:0和a18:0表征革兰氏阳性细菌的特征脂肪酸;用a15:0、i15:0、15:0、i16:0、a17:0、i17:0和17:0表征好氧细菌的特征脂肪酸;用18:1 ω7c表征厌氧细菌的特征脂肪酸[20- 25]。用16:1ω5c表征甲烷氧化菌的特征脂肪酸[23,26];用16:0 (10Me)表征硫酸盐还原菌[22- 23];用环丙烷脂肪酸和其单体之比[(cy17:0+cy19:0ω8c): (16:1ω9c+18:1ω7c+18:1ω9c)]及异构PLFAs:反异构PLFAs [(i14:0+i15:0+i16:0+i17:0): (a14:0+a15:0+a16:0+a17:0)]表征微生物对养分胁迫的响应[20- 21]。
1.5 数据处理
采用Microsoft Excel 2003软件处理数据并作图;采用 SPSS 17.0 软件进行相关性分析(Pearson法)和方差分析(LSD法);采用Canoco 4.5软件进行冗余分析后Origin 8.0制图。
2 结果与分析
为使分析结果更加清晰明了,本文在对土壤理化性质和部分生物学性质进行分析时,先依据下文冗余分析的结果,将果园土壤分为新果园土壤(S3—S11, ≤14a)和老果园土壤(S12—S18, >14a)两个阶段,进而与水田土壤进行对比(表2)。
2.1 土壤理化性质
如表2所示,水田改果园后,随着改果园年限的延长,土壤中大于0.25 mm的水稳定性团聚体逐渐下降,并与园龄呈极显著负相关(r=-0.69,P<0.01,n=18);土壤有机质呈现先降低后小幅增加的趋势,与园龄呈极显著负相关(r=-0.69,P<0.01,n=18);土壤pH值和盐基饱和度呈降低趋势,并与园龄呈显著负相关(r分别为-0.49、-0.53,P<0.05,n=18)。
果园土壤中全磷含量随着改果园年限的延长而逐渐增加,而土壤全氮含量逐渐降低(表2),并与园龄呈极显著相关(r分别为 0.70、-0.72,P<0.01,n=18);水田土壤和果园土壤中全钾含量差异不明显(表2),与园龄未达到显著水平(r=0.20,P>0.05,n=18)。两种利用方式相对比,有效态养分的变化非常明显,果园土壤中有效磷和有效钾含量明显高于水田,而碱解氮含量明显低于水田(表2),并与园龄相关性达到极显著水平(r分别为 0.87、0.77、-0.69,P<0.01,n=18)。
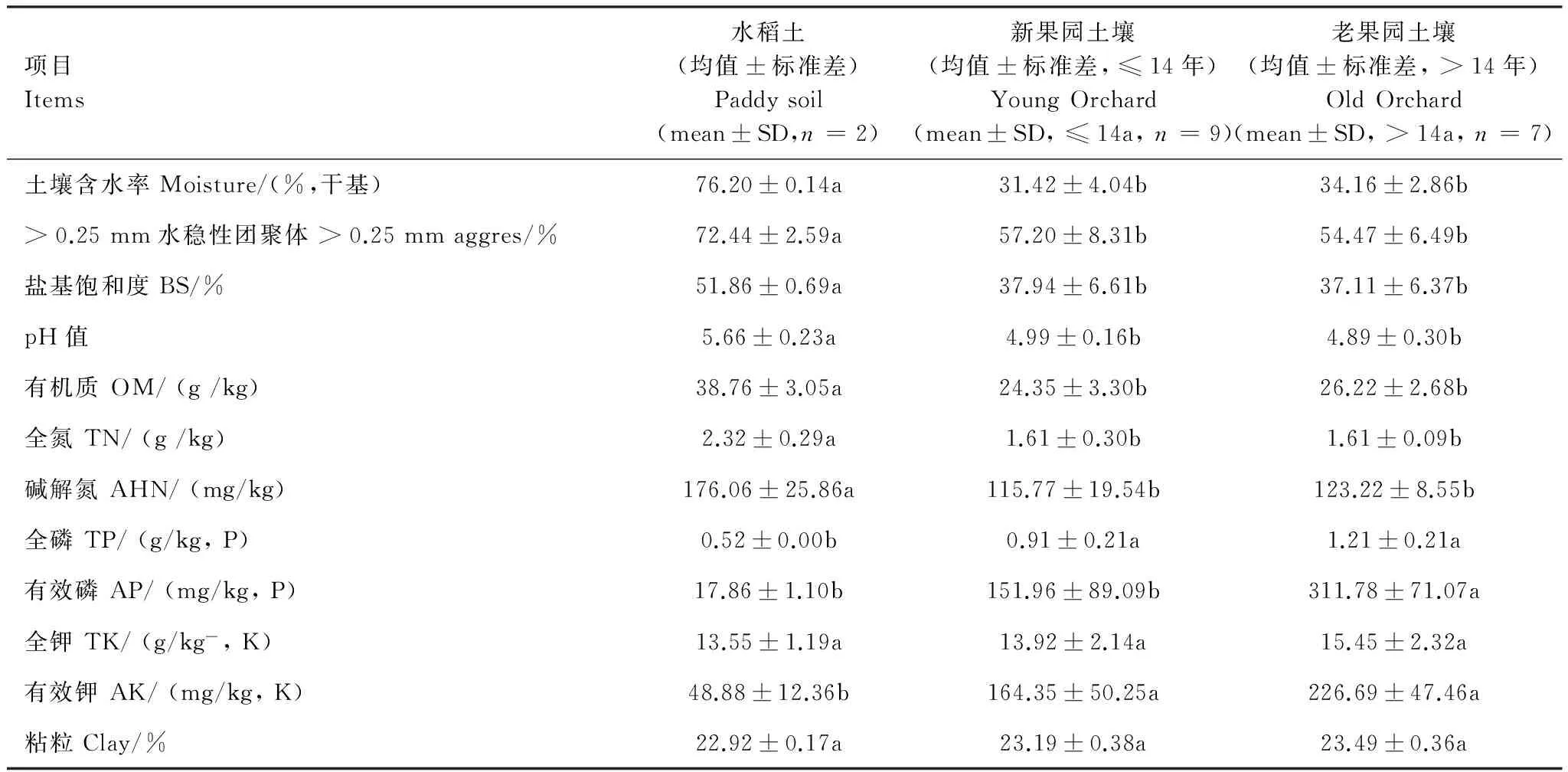
表2 土壤理化性质(均值±标准差)
2.2 土壤微生物生物量和土壤呼吸强度
水田改果园后,土壤微生物生物量碳氮和土壤呼吸强度都随着改果园年限的延长而逐渐降低,并与园龄呈极显著负相关(图1和图2),此外,土壤呼吸强度与土壤微生物生物量碳呈极显著正相关(r=0.81,P<0.01,n=18),以上结果与李忠佩等[27]关于不同利用方式下微生物量及土壤呼吸强度差异性的结论基本一致。水田中微生物商在4.1%—4.5%之间,果园中微生物商在1.4%—3.7%之间,其值随着改果园年限的延长而逐渐降低,并与园龄呈极显著负相关(r=-0.84,P< 0.01,n=18)。
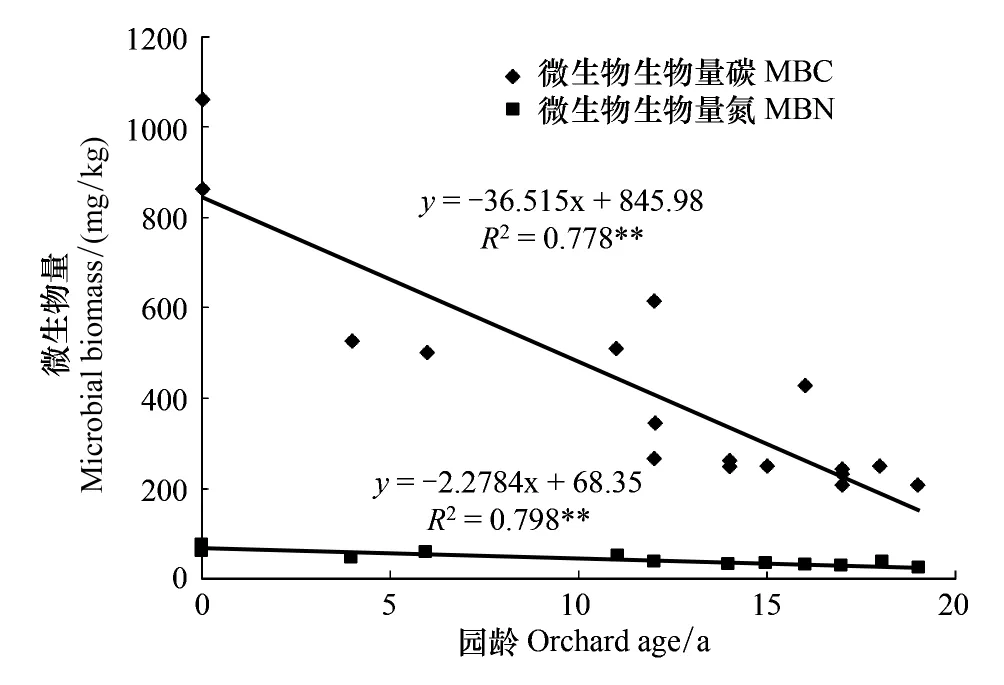
图1 土壤微生物生物量碳氮与园龄的关系
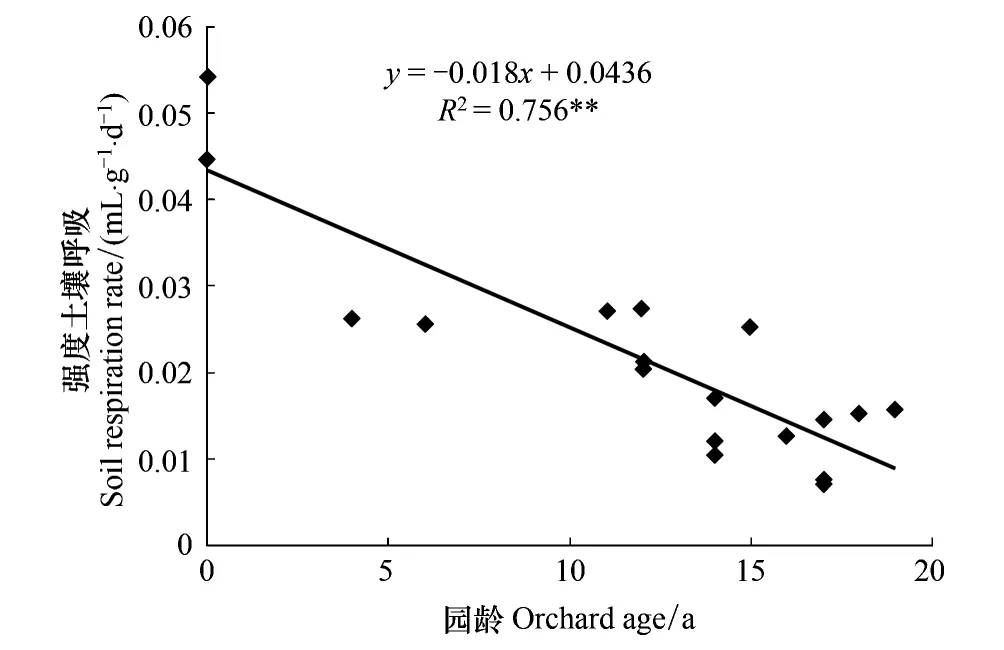
图2 土壤呼吸强度与园龄的关系
2.3 土壤微生物磷脂脂肪酸
磷脂脂肪酸存在于所有活体细胞膜中且随菌体死亡而迅速降解,因此被广泛作为土壤微生物群落的生物标记[22]。本研究采用PLFA生物标记法分析水田改果园后土壤微生物多样性和微生物群落结构的变化。如图3所示,改果园后,受土壤中微生物主要营养物质水分、碳源和氮源下降等因素的影响,土壤微生物总PLFAs含量呈降低趋势,并与园龄呈极显著负相关(r=-0.81,P<0.01,n=18),与微生物生物量碳呈极显著正相关(r=0.90,P<0.01,n=18)。同时,土壤中细菌、真菌、放线菌的含量减少;真菌在土壤微生物中所占比例降低(图3)。革兰氏阴性细菌/革兰氏阳性细菌(Gram negative bacteria/Gram positive bacteria, G-/G+)呈现降低的趋势(图4),并与园龄呈极显著负相关(r=-0.68,P<0.01,n=18)。此外,水稻土样品中平均检测到57种PLFAs,果园土壤样品中平均检测到47种PLFAs,说明水田改果园后,土壤微生物PLFAs种类减少。水田改果园后,受土壤通气性增强等因素的影响,土壤微生物群落结构发生变化。由于绝大多数原生动物和放线菌是好氧微生物[28],因而,水田改果园后原生动物和放线菌在土壤微生物中所占比例增加(图3);另外,在水田土壤中甲烷氧化菌占细菌比例约为3.0%,在老果园土壤中增加到4.6%,并且该比率与园龄呈极显著正相关(r=0.74,P<0.01,n=18);好氧细菌/厌氧细菌(Aerobic bacteria/ Anaerobic bacteria, Aerobic/Anaerobic)显著增加(图4),并与园龄呈极显著正相关(r=0.62,P<0.01,n=18)。受土壤通气性增强等因素的影响,在水田土壤中硫酸盐还原菌占细菌比例约为14.6%,在老果园土壤减少到12.3%。

图3 水田、新果园和老果园土壤中不同种群微生物的比例和土壤微生物总磷脂脂肪酸
在饥饿压力下,革兰氏阴性菌会把某些单烯PLFA转化为环丙基脂肪酸,因此环丙基脂肪酸和前体物的比值(cyclo/precurso, Cy/Pre)可以用来指示微生物所处的压力状态[20]。本研究中,表征养分胁迫的Cy /Pre呈增加趋势(图4),并与园龄呈极显著正相关(r=0.59,P<0.01,n=18),与PLFAs总量呈显著负相关(r= -0.55,P<0.05,n=18)。另外,有研究表明,用异式脂肪酸(Iso fatty acids, Iso)和反异支链脂肪酸(Anteiso fatty acids, Anteiso)比值可以表征养分胁迫[20- 21],本研究中Iso/Anteiso增加(图4),与园龄呈极显著正相关(r=0.68,P< 0.01,n=18),与PLFA总量呈极显著负相关(r=-0.79,P< 0.01,n=18)。以上结果说明,水田改果园后,养分对微生物的胁迫增加,并引起土壤微生物数量的减少。
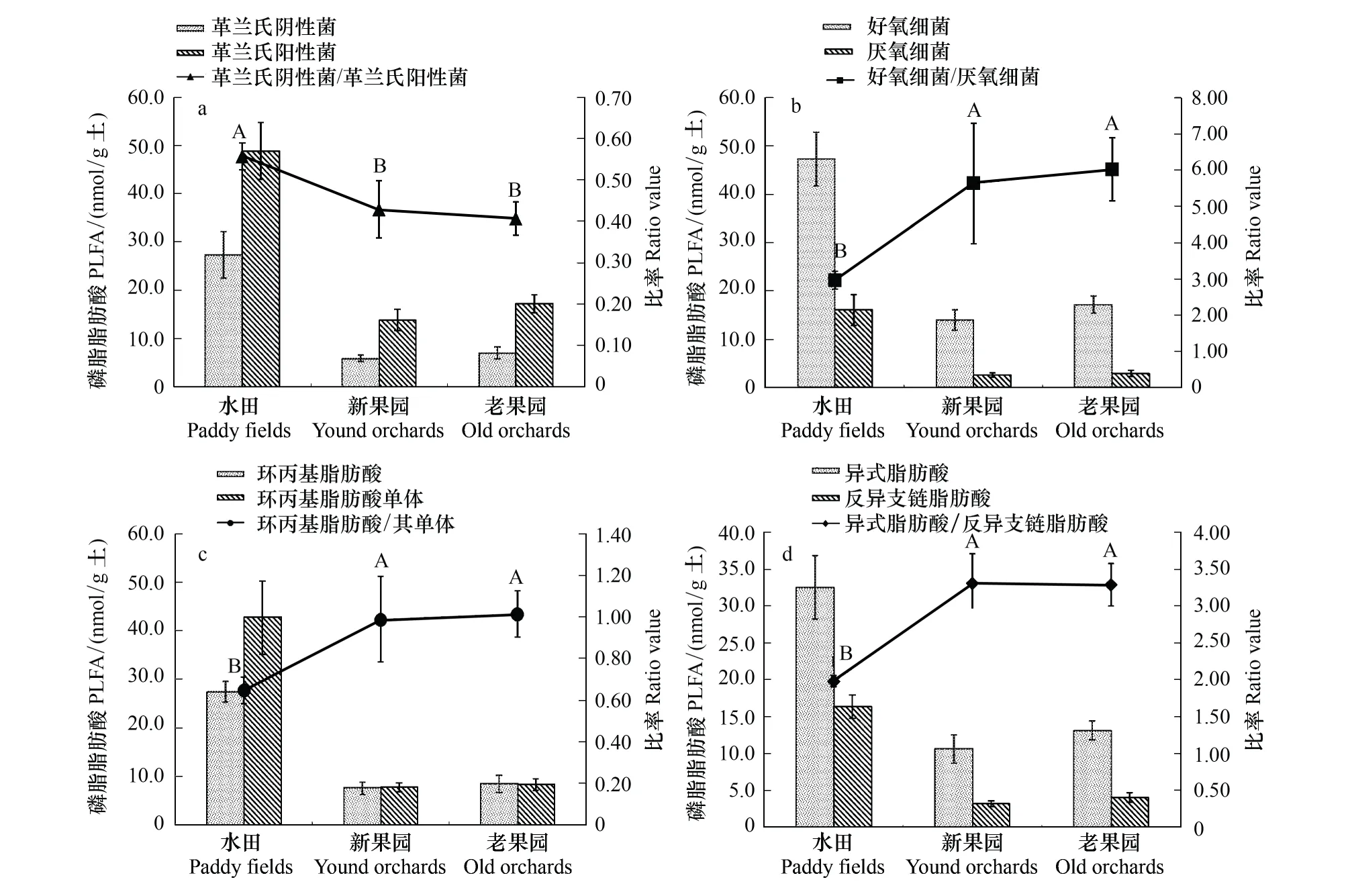
图4 水田、新果园和老果园土壤中不同类型微生物脂肪酸绝对含量和其相对比例
2.4 土壤理化性质与微生物学指标的相关性分析
以表征土壤微生物种类(以下简称物种)的PLFA和环境因子矩阵为基础数据,应用冗余分析(Redundancy Analysis, RDA)方法分别对土壤样品中74种PLFAs进行二维排序,得到RDA二维排序图(图5)。在二维排序图中,物种之间或样本之间连线,表示它们之间亲疏或相似关系,在某一区域内物种之间或样品之间距离较短,说明在这些区域内部物种或样品差异性较小,相似性较大;样本与物种之间连线表示物种在样品内相对多度的变化,越短表示样本中含有该物种越多。环境因子与排序轴之间夹角余弦值或环境因子之间夹角余弦值表示它们之间相关性大小,箭头所指的方向表示该环境因子的变化趋势。
由于土壤样品中微生物群落结构的差异,水田和改果园不同年限样本分别在α、β和γ阴影区聚集,不同物种分别在A、B和C区域聚集,并明显区分开,说明改果园后土壤微生物群落结构发生了阶段性变化。依据水田改果园不同年限土壤样本在RDA排序图中分布的结果(图5),将水田改果园≤14a土壤(S3—S11,β区域)划分为新果园土壤,>14a改果园土壤(S12—S18,γ区域)划分为老果园土壤,那么区域α、β、γ和A、B、C分别代表对照(水田)、新果园土壤、老果园土壤样本和该类样本中最适物种。本研究中表征厌氧细菌的特征脂肪酸18:1 ω7c和硫酸盐还原菌的特征脂肪酸16:0(10Me)分布在Group A区域中(图5),表明厌氧细菌和硫酸盐还原菌适宜于在水田厌氧环境下生存;表征原生动物特征脂肪酸的20:2 ω6,9c和20:4 ω6,9,12,15c分别分布在Group B和Group C区域中(图5),表明原生动物更适宜在果园土壤中生存。
RDA分析结果显示,第一排序轴解释了样本中93.1%的变异,第二排序轴解释了样本中 1.4%的变异,前4个排序轴共同解释了土壤微生物群落结构演替中95.6%的变异(表3)。前两个排序轴的物种-环境相关系数均达到0.97以上(表3),说明土壤微生物区系与土壤环境因子之间有很强关联性,土壤环境因子改变是影响土壤微生物群落结构的主要原因。另外,如表4所示,第一排序轴与土壤含水率、大于0.25 mm水稳定性团聚体、盐基饱和度、pH值、有机质、全氮、碱解氮和有效钾都呈显著(P<0.05)或极显著(P< 0.01)相关,第二排序轴与全磷和有效磷呈极显著负相关(P< 0.01)。
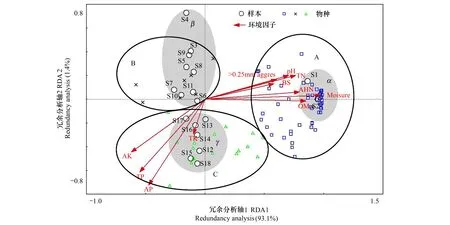
图5 土壤微生物磷脂脂肪酸RDA排序图
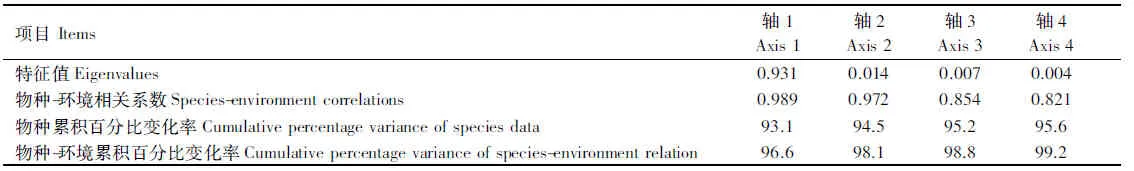
表3 冗余分析结果

表4 排序轴与环境因子的相关系数矩阵
3 讨论
3.1 水田改果园土壤理化性质的变化过程及特征
近年来,不合理的土地利用所引起的土壤退化问题逐渐受到人们的关注。土壤退化包括有机质的分解或含量下降、土壤养分的消耗(包括养分供应比例失调)、土壤酸化、微生物量和微生物商下降、生物活性降低、不合理的耕作管理(如连作)引起有害生物(如病原菌)的增加等[29- 30]。
水田改果园后,土壤环境状况和土地耕作制度等发生改变,其中土壤水分状况和施肥量的变化对土壤性质产生的影响最为显著。人为滞水水分状况消失后,土壤通气性增强,有机碳矿化速度加快,加之进入土壤的植物残体减少,引起土壤有机质含量下降,土壤固碳能力减弱;随着果园耕作年限的延长,枯枝落叶等有机物料在土壤中积累的速度超过土壤有机碳矿化的速度,使得土壤中有机质的含量有小幅回升。随着土壤有机质等胶结物质减少,水稳性团聚体减少,土壤结构变差,部分果树幼苗出现扎根不稳情况;土壤有机质含量降低还引起土壤全氮的降低,硝化作用增强致使碱解氮减少,最终导致土壤中氮素及其有效性降低。大量化肥的施用,引起土壤磷素和钾素全量及其有效态含量的增加(由于桃树对钾素需求量较大[31],因而改桃园后全钾含量变化幅度不大,未达到显著水平)。另外,由于酸性肥料的大量施用,硝化作用增强等原因使致酸H+增加,土壤逐渐酸化。整体而言,水田改果园后,土壤理化性质发生退化,并对土壤的健康发展和可持续利用产生不利影响。
3.2 水田改果园土壤微生物性质的变化过程及特征
土壤微生物能够直接参与土壤中碳、氮等营养元素循环和能量流动,与土壤的肥力水平和环境状况关系密切,对土壤退化具有预警作用[32]。水田改果园后,土壤中微生物生长需要的主要营养物质土壤水分、碳源和氮源减少,土壤酸化,加之大量除草剂和杀虫剂的使用,致使土壤微生物繁殖代谢受到抑制,微生物数量减少,微生物生物量碳氮和微生物商降低,表征微生物整体活性的土壤呼吸强度减弱。本研究中,土壤微生物生物量碳与土壤含水率、土壤有机质、全氮、碱解氮、pH值呈极显著正相关(r分别为0.82、0.83、0.86、0.82、0.60,P< 0.01,n=18)。
土壤微生物群落结构(包括各主要土壤微生物类群的数量以及相对丰度)[33]与土壤环境因子密切相关,一方面由于土壤环境的改变能够影响土壤微生物的群落结构和功能;另一方面土壤微生物群落结构和功能也会影响土壤中各种养分的循环转化过程,从而影响土壤养分等环境因子的形态和数量。水田改为果园后,人为滞水水分状况消失,土壤中微生物生长需要的主要营养物质土壤水分、碳源和氮源减少,加之其它土壤环境因子的变化,使土壤微生物群落结构发生演变。RDA分析表明,前两个排序轴的物种-环境相关系数均达到0.97以上,说明土壤微生物区系与土壤环境因子之间关系非常密切(表3);前4个排序轴共同解释了土壤微生物群落结构演替中95.6%的变异,说明文中11种土壤环境因子的改变是引起土壤微生物群落结构演变的主要原因。土壤环境因子中土壤含水率、有机质和碱解氮与第一排序轴(解释了样本中93.1%的变异)正方向夹角最小,夹角余弦值最大,线段较长,且与第一排序轴相关性最大,呈极显著正相关(P< 0.01),因而这3种因子是决定水田和果园微生物群落结构差异的最重要因子。此外,这3种环境因子沿水田样本聚集方向(α区域)增加最明显,这说明它们与水田微生物群落关系最密切,即在A区域出现的土壤微生物对水分、碳素和氮素依赖性较强。>0.25 mm水稳性团聚体、pH值、全氮和盐基饱和度也在水田样本方向增加,但方向略微向新果园土壤(β区域)方向偏移,说明这四种环境因子与水田和新果园土壤微生物关系相对密切,这与水田和新果园土壤含较多水稳性团聚体可能会促进土壤中水气平衡,有利于B区域微生物生长[34],相对较高的pH值对微生物活性抑制较小,较高含量氮素和盐基离子为B区域微生物提供了更多生长需要的营养元素等因素有关。钾素和磷素在老果园土壤(γ和C区域)积累较明显,说明C区域的微生物更适合在磷素和钾素含量较高的生境中生长。硫酸盐还原菌、厌氧细菌和原生动物在RDA排序图的特定区域出现,表明它们在水田和不同园龄果园中各自存在不同的最适生境。另外,水田改果园后表征养分胁迫的Cy/Pre和Iso/Anteiso增加,表明由于土壤有机质和氮素含量降低等原因,致使养分胁迫增强。然而,关于A、B、C区域中不同最适微生物对不同元素生态过程的相关功能方面还需要进一步深入研究。
RDA分析表明,水田与改果园不同阶段的土壤样本在排序图中不同区域聚集,并明显区分开,说明水田改果园后土壤微生物群落结构发生了阶段性变化,水田土壤微生物群落与改果园不同阶段土壤差异明显,改果园同一阶段土壤微生物群落结构相似性很高。果园不同阶段样本聚集区域β、γ距离较近,而它们与水田样本聚集区α相隔较远,说明不同利用方式对微生物群落结构的影响,要大于同一利用方式不同耕作时间对微生物群落结构的影响,这与Xue等关于不同利用方式和不同利用年限对微生物群落结构的影响的结论一致[14]。
4 结论
本研究表明,水田改果园后,土壤含水率、水稳定性团聚体(>0.25 mm)、pH值、有机质、全氮、碱解氮、土壤微生物量碳氮及土壤呼吸强度等土壤理化指标和生物学指标随着改果园年限的延长而显著降低,并引起土壤酸化,土壤结构变差,碳汇作用减弱,土壤综合肥力下降,从而对土壤的健康发展和可持续利用产生不利影响。
研究表明,土壤微生物群落结构不仅受土壤环境因子影响,同时也对土壤土壤环境因子产生重要影响。供试土壤环境因子的改变是引起土壤微生物群落结构变化的主要原因,其中土壤含水率、有机质和碱解氮是决定水田和果园微生物群落结构差异的最重要因子。随着改果园年限的延长,土壤微生物群落结构发生了阶段性变化,但不同利用方式与同一利用方式不同耕作年限相比,土壤微生物群落结构对前者的响应程度更强。改果园后,土壤微生物磷脂脂肪酸总量和种类减少,微生物群落结构发生改变,养分胁迫增强。因而,监测土壤微生物群落结构的变化是评价土地利用变化及土壤可持续利用的一种有效方法。结果表明,水田中土壤微生物群落的种类和数量更加丰富,亦表明,水田是土壤(地)可持续利用的一种有效方式。
致谢:英国洛桑试验站(Rothamsted Research)Philip C. Brookes教授润色英文摘要,特此致谢。
[1] 崔保山, 杨志峰. 湿地生态系统健康评价指标体系 I. 理论. 生态学报, 2002, 22(7):1005- 1011.
[2] 国家统计局. 中国统计年鉴 (2012). 北京:中国统计出版社, 2012.
[3] 浙江统计局. 浙江统计年鉴 (1999—2012). 北京:中国统计出版社, 1999- 2012.
[4] 张玉斌, 曹宁, 苏晓光, 许晓鸿, 闫飞, 杨振明. 吉林省低山丘陵区水土保持措施对土壤性质的影响. 水土保持通报, 2009, 29(5):226- 227.
[5] 黄锦法, 曹志洪, 李艾芬, 张蚕生. 稻麦轮作田改为保护地菜田土壤肥力质量的演变. 植物营养与肥料学报, 2003, 9(1):19- 25.
[6] 张华勇, 尹睿, 黄锦法, 林先贵, 曹志洪, 王俊华. 稻麦轮作田改为菜地后生化指标的变化. 土壤, 2005, 37(2):182- 186.
[7] Cao Z H, Huang J F, Zhang C S, Li A F. Soil quality evolution after land use change from paddy soil to vegetable land. Environmental Geochemistry and Health, 2004, 26(2):97- 103.
[8] 李太魁, 朱波, 王小国, 杨小林. 土地利用方式对土壤活性有机碳含量影响的初步研究. 土壤通报, 2013, 44(1):46- 51.
[9] 尹睿, 张华勇, 黄锦法, 林先贵, 王俊华, 曹志洪. 保护地菜田与稻麦轮作田土壤微生物学特征的比较. 植物营养与肥料, 2004, 10(1):57- 62.
[10] White D C, Davis W M, Nickels J S, King J D, Bobbie R J. Determination of the sedimentary microbial biomass by extractible lipid phosphate. Oecologia, 1979, 40(1):51- 62.
[11] Tunlid A, Baird B H, Trexler M B, Olsson S, Findlay R H, Odham G, White D C. Determination of phospholipid ester-linked fatty acids and poly β-hydroxybutyrate for the estimation of bacterial biomass and activity in the rhizosphere of the rape plantBrassicanapus(L.). Canadian Journal of Microbiology, 1985, 31(12):1113- 1119.
[12] Bossio D A, Girvan M S, Verchot L, Bullimore J, Borelli T, Albrecht A, Scow K M, Ball A S, Pretty J N, Osborn A M. Soil microbial community response to land use change in an agricultural landscape of western Kenya. Microbial Ecology, 2005, 49(1):50- 62.
[13] Yao H, He Z, Wilson M J, Campbell C D. Microbial biomass and community structure in a sequence of soils with increasing fertility and changing land use. Microbial Ecology, 2000, 40(3):223- 237.
[14] Xue D, Yao H Y, Ge D Y, Huang C Y. Soil microbial community structure in diverse land use systems:a comparative study using biolog, DGGE, and PLFA analyses. Pedosphere, 2008, 18(5):653- 663.
[15] Bossio D A, Scow K M. Impacts of carbon and flooding on soil microbial communities:Phospholipid fatty acid profiles and substrate utilization patterns. Microbial Ecology, 1998, 35(3/4):265- 278.
[16] 姚槐应, 何振立, 黄昌勇. 不同土地利用方式对红壤微生物多样性的影响. 水土保持学报, 2003, 17(2):51- 54.
[17] 杭州市土壤普查办公室. 杭州土壤. 杭州:浙江科学技术出版社, 1991.
[18] 鲁如坤. 土壤农业化学分析方法. 北京:中国农业科技出版社, 2000.
[19] Wu Y P, Ding N, Wang G, Xu J M, Wu J J, Brookes P C. Effects of different soil weights, storage times and extraction methods on soil phospholipid fatty acid analyses. Geoderma, 2009, 150(1/2):171- 178.
[20] 陈振翔, 于鑫, 夏明芳, 戴朝霞, 孙成. 磷脂脂肪酸分析方法在微生物生态学中的应用. 生态学杂志, 2005, 24(7):828- 832.
[21] McKinley V L, Peacockb A D, White D C. Microbial community PLFA and PHB responses to ecosystem restoration in tallgrass prairie soils. Soil Biology & Biochemistry, 2005, 37(10):1946- 1958.
[22] 钟文辉, 蔡祖聪. 土壤微生物多样性研究方法. 应用生态学报, 2004, 15(5):899- 904.
[23] 颜慧, 蔡祖聪, 钟文辉. 磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用. 土壤学报, 2006, 43(5):851- 859.
[24] Frostegård Å, Bååth E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil. Biology and Fertility of Soils, 1996, 22(1/2):59- 65.
[25] Liang C, da Jesus E C, Duncan D S, Jackson R D, Tiedje J M, Balser T C. Soil microbial communities under model biofuel cropping systems in southern Wisconsin, USA:Impact of crop species and soil properties. Applied Soil Ecology, 2012, 54:24- 31.
[26] Kaur A, Chaudhary A, Kaur A, Choudhary R, Kaushik R. Phospholipid fatty acid-A bioindicator of environment monitoring and assessment in soil ecosystem. Current Science-Bangalore. 2005, 89(7):1102- 1112.
[27] 李忠佩, 吴晓晨, 陈碧云. 不同利用方式下土壤有机碳转化及微生物群落功能多样性变化. 中国农业科学, 2007, 40(8):1712- 1721.
[28] Weaver R W. Pt. 2:Microbiological and biochemical properties. Madison:Soil Science society of America, 1994.
[29] 张桃林, 李忠佩, 王兴祥. 高度集约农业利用导致的土壤退化及其生态环境效应. 土壤学报, 2006, 43(5):843- 850.
[30] 刘苑秋. 亚热带红壤区生态退化及生态恢复研究综述. 南京林业大学学报:自然科学版, 2000, 24 (z1):53- 58.
[31] 陈防, 陶勇, 万开元, 陈树森, 王 利. 桃树养分管理研究进展与展望. 北方园艺, 2009 (1):115- 118.
[32] 章家恩, 刘文高, 胡刚. 不同土地利用方式下土壤微生物数量与土壤肥力的关系. 土壤与环境, 2002, 11(2):140- 143.
[33] Fierer N, Schimel J P, Holden P A. Variations in microbial community composition through two soil depth profiles. Soil Biology and Biochemistry, 2003, 35(1):167- 176.
[34] Blevins R L, Thomas G W, Smith M S, Frye W W, Cornelius P L. Changes in soil properties after 10 years continuous non-tilled and conventionally tilled corn. Soil and Tillage Research, 1983, 3(2):135- 146.
Effects of land-use change from paddy field to orchard farm on soil property shift processes and their characteristics
YANG Dongwei, ZHANG Mingkui*
CollegeofEnvironmentalandResourceSciencesofZhejiangUniversity,Hangzhou310058,China
Studies of the effects of land-use change on soil physicochemical properties, microbial community structure and other biological properties are important for understanding changes in soil quality in agricultural soils. A diverse soil microbial community is an important measure of sustainable land use, and soil microbial community structure and diversity are sensitive indicators of soil quality. In recent years, land-use change from paddy field to economic forest land has been very common in the south of China. In order to recognize the effects of this land-use change on soil quality, a study was conducted, in Zhejiang province, on paddy and orchard surface soil (0—15 cm). Multivariate analyses including phospholipid Fatty Acids (PLFAs) were employed to determine the changes in soil environmental factors, microbial community structure and their relationships after land-use change from paddy fields to orchard farms. Water-stable aggregates (>0.25 mm), pH, organic matter (OM), base saturation (BS), total nitrogen (TN), Alkali-hydrolysable nitrogen (AHN) decreased after land-use change from paddy to orchard soils, and they had significant negative correlations with orchard age (P<0.05). Enhancement of organic carbon mineralization and reductions in plant residues in the soil caused the decline in soil organic matter content which resulted in a reduction in water-stable aggregates (>0.25 mm) and total nitrogen. The increase in nitrification also led to a reduction in alkali hydrolyisable nitrogen. The extensive application of acidic fertilizer and enhancement of nitrification increased soil acidification (caused by H+). Microbial biomass carbon (MBC), microbial quotient (qMB) and soil respiration (Resp) decreased, and had significant negative correlations with orchard ages (P< 0.01). The changes in biological properties could be due to decreased soil moisture, OM and other soil characteristics. During the change from paddy field to orchard farm, soil microbial community structure changed: total phospholipid fatty acids (TPLFAs), PLFAs of bacteria, fungi, actinomycetes, protozoa, and specific microbial lipids decreased. Possibly because of enhancement of soil aeration, the ratio of protozoa to bacteria slightly increased. The ratios of Gram positive bacteria to Gram negative bacteria decreased significantly (P<0.01). In contrast, aerobic bacteria to anaerobic bacteria and methanotrophic bacteria to total bacterial ratios increased significantly (P< 0.01). The ratios of fatty acids Iso to Anteiso and fatty acids cyclo to precurso increased significantly (P< 0.01), which implied that nutrient stress on soil microorganisms enhanced. Redundancy analysis (RDA) showed that the first 4 axes explained 95.6% of the cumulative variation of soil microbial community structure, which indicated that the 11 kinds of soil environmental factors were the main factors affecting the structure of the soil microbial community. Soil moisture, OM and AHN were the most important environmental factors to determine the differences in soil microbial community structure between paddy and orchard soils (P<0.01). The analysis also indicated that land-use change had a greater effect on soil microbial community structure than orchard age. Our study concludes that after land-use change from paddy fields to orchard farms, soil physicochemical and biological properties degraded, and thus soil quality decreased. In contrast, a diverse soil microbial community was achieved and maintained in paddy soil systems, hence we predict that paddy fields are an effective way to maintain soil sustainability.
land use; soil properties; microbial community structure; phospholipid fatty acid; soil quality
国家自然科学基金项目(41071145)
2013- 09- 21;
2014- 08- 22
10.5846/stxb201309212319
*通讯作者Corresponding author.E-mail: mkzhang@zju.edu.cn
杨东伟, 章明奎.水田改果园后土壤性质的变化及其特征.生态学报,2015,35(11):3825- 3835.
Yang D W, Zhang M K.Effects of land-use change from paddy field to orchard farm on soil property shift processes and their characteristics.Acta Ecologica Sinica,2015,35(11):3825- 3835.

