胰腺癌术后肝转移的临床病理学特点
高威,盛伟伟,董明,周建平
(中国医科大学附属第一医院普通外科,沈阳 110001)
·论著·
胰腺癌术后肝转移的临床病理学特点
高威,盛伟伟,董明,周建平
(中国医科大学附属第一医院普通外科,沈阳 110001)
目的探讨胰腺癌术后肝转移发生率、临床病理学特点及对胰腺癌预后的影响。方法回顾性分析2007年1月至2012年12月期间我院可切除性胰腺癌83例的临床资料。结果83例胰腺癌患者中,术后出现肝转移31例,转移率为37.3%。术后肝转移与胰腺癌肿瘤大小(χ2=9.606,P=0.002)、有无血管浸润(χ2=4.794,P=0.029)及UICC分期(χ2=5.318,P=0.021)呈正相关。单因素分析结果显示:术后伴肝转移的胰腺癌患者预后极差(χ2=9.967,P=0.002),伴肝转移者与无肝转移者术后中位生存时间分别为858 d和320 d。多因素分析结果显示:术后肝转移能够作为判断胰腺癌患者预后的独立危险因素(P=0.001)。结论胰腺癌术后肝转移发生率高,可作为胰腺癌预后的独立危险因素,肿瘤大小、血管浸润及UICC分期是影响胰腺癌术后发生肝转移的高危因素。
胰腺癌;肝转移
胰腺癌恶性程度极高,5年生存率始终低于5%[1]。可切除性胰腺癌患者术后依旧面临25%~50%的远处转移率,其中肝转移最为多见。目前对于胰腺癌肝转移的特点尚缺少相关病理学研究。因此,本研究拟回顾性分析2007年1月至2012年12月期间我院可切除性胰腺癌83例的临床资料,旨在探讨胰腺癌术后肝转移发生率、临床病理学特点及对胰腺癌预后的影响。
1 材料与方法
1.1 一般资料
回顾性研究2007年1月至2012年12月我院具有完整资料的可切除性胰腺癌病例83例。为达到R0切除,纳入标准如下:术前影像学检查(包括全腹CT或PET-CT)证实肿瘤与肠系膜上血管及腹腔动脉分界清楚,无明显血管受压表现(但不包括脾动脉,胰体尾癌侵入脾动脉,予以胰体尾脾联合切除,此时肿瘤向周围侵袭程度归为T4);无肝脏及周围脏器转移;结合临床表现,有手术适应证,无手术禁忌证;术中探查进一步明确肿瘤未侵犯以上血管,无需行联合血管的肿瘤切除(但不包括肿瘤与血管侧壁粘连,能够予以剥离);无腹腔转移;未针对肝转移癌再次行内外科治疗。
手术方式包括:(1)胰十二指肠切除术(pancreatoduodenectomy,PD):包括标准的PD术及扩大的PD术,83例患者中,实施此术者61例;(2)胰体尾切除术:包括标准胰体尾切除术、胰体尾联合脾切除术及伴有部分胃、结肠或肾上腺的胰体尾切除术,实施此术者22例。术后病理均证实为胰腺导管腺癌。
83例患者具体临床资料见表1。其中黄疸判定标准:术前均为梗阻性黄疸,血清胆红素浓度(间接胆红素)>34.2 μmol/L(2 mg/dL),同时,巩膜、皮肤、黏膜以及其他组织和体液出现黄染。

表1 83例可切除的胰腺癌患者临床资料Tab.1 Clinical characteristics of the 83 pancreatic cancer patients
1.2 胰腺癌术后肝转移诊断标准
根据Park等[2]的诊断方法,胰腺癌患者术后每隔3个月进行1次随访。随访常规肝功能、血清肿瘤标记物检测,超声或全腹CT/PET影像学检查。虽然针刺活检能最终确诊肝脏病灶的性质,但作为有创检查,易出现胰漏及肿瘤播散的风险,不作为常规检查手段。结合患者病史及临床表现的同时,如果CT/PET或超声结合血清学检查发现肝脏肿瘤灶,且无任何证据是其他部位肿瘤来源的转移灶,即判定为胰腺癌术后复发引起的肝脏转移。
1.3 统计学分析
采用SPSS13.0统计学软件进行统计学分析。采用χ2检验分析胰腺癌术后肝转移与患者临床病理学参数的相关性。采用Kaplan-Meier计算累积生存率,Log-Rank进行生存时间差异检验,Cox多因素分析评估影响预后的因素。P<0.05为差异有统计学意义。
2 结果
2.1 胰腺癌术后肝转移的临床病理学特点
83例胰腺癌患者中,有31例出现了术后肝转移,转移率为37.3%。发生时间为术后3个月~2年。术后肝转移与胰腺癌肿瘤大小(χ2=9.606,P= 0.002)、UICC分期(χ2=5.318,P=0.021)及有无血管肿瘤浸润(χ2=4.794,P=0.029)呈正相关;与分化程度(χ2=2.817,P=0.093)、T分期(χ2=2.735,P= 0.098)及淋巴结转移(χ2=2.988,P=0.084)的相关性接近统计学意义;但与患者年龄(χ2=0.445,P= 0.505)、性别(χ2=0.002,P=0.967)、肿瘤部位(χ2= 0.840,P=0.359)、神经浸润(χ2=0.078,P=0.475)、
CA19-9水平(χ2=0.576,P=0.448)及黄疸(χ2=0.907,P=0.341)无明显相关性。见表2。
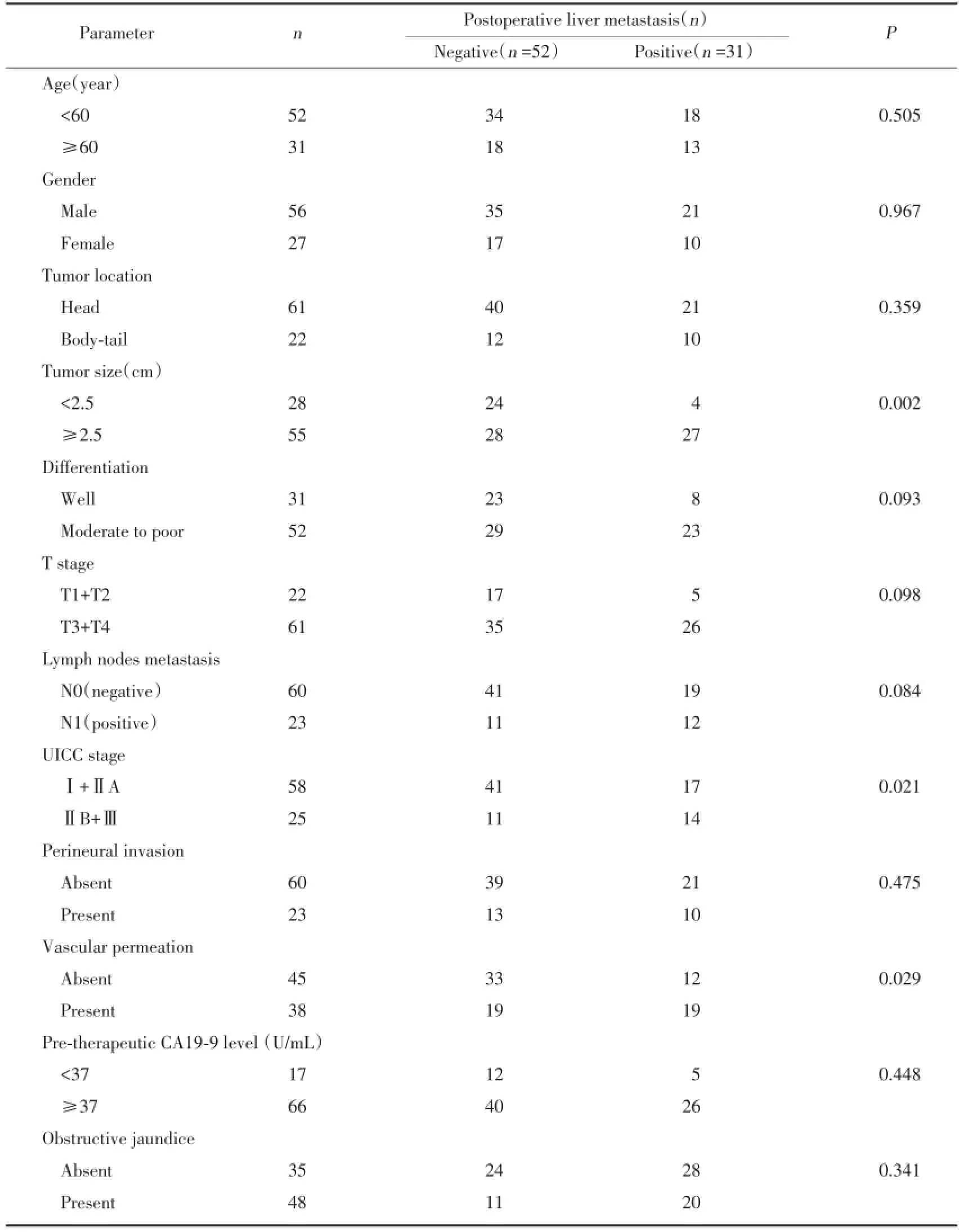
表2 胰腺癌术后肝转移的临床病理学意义Tab.2 Association of postoperative liver metastasis with clinicopathological characteristics
2.2 胰腺癌术后肝转移与患者预后的关系
单因素分析结果发现:术后伴肝转移的胰腺癌患者预后极差(χ2=9.967,P=0.002;肝转移者与无肝转移者术后中位生存时间分别为858 d和320 d),见图1,表3;其他临床病理学参数,如肿瘤大小(P= 0.025)、UICC分期(P=0.019)、淋巴结转移(P= 0.032)及血管浸润(P=0.001)均与患者预后明显相关。肿瘤分化程度及T分期与患者预后相关性接近统计学意义(P=0.081,P=0.095);而年龄、性别、肿瘤部位、神经浸润、术前CA19-9水平与胰腺癌患者预后无明显相关性(P>0.05)。多因素分析结果发现:术后肝转移及血管浸润能够作为判断胰腺癌患者预后的独立危险因素(P=0.001,P=0.006),见表3。

图1 胰腺癌术后肝转移与患者预后的关系Fig.1 Kaplan-Meier analysis of overall survival of pancreatic cancer patients with postoperative liver metastasis
3 讨论
胰腺癌伴肝转移的病理学特点及治疗已成为当前的研究热点。全身化疗是胰腺癌伴肝转移的主要治疗方式。根据每个患者的病情特点,是否行肝、胰腺癌肿瘤同步切除或者联合动脉灌注化疗栓塞及射频消融等治疗,仍有待进一步临床研究[3,4]。但针对可手术切除的胰腺癌患者,术后肿瘤复发引起肝转移的相关临床病理学特点及预后因素研究国内外鲜有报道。
本研究结果发现83例胰腺癌患者术后有31例出现肝转移,转移率为37.3%,同时伴肝转移的胰腺癌术后患者预后极差,且术后肝转移及血管浸润能够作为评估患者预后的独立危险因素。Hayashibe等[5]研究发现,未经任何放化疗的11例胰腺癌术后患者中,7例(54%)出现并死于肝转移。Inoue等[6]通过对28例经病理证实根治性切除的胰腺癌患者术后随访发现,有13例(46%)患者最终死于肝转移。胰腺癌术后高肝脏转移率是患者预后不良的重要原因。

表3 单因素及多因素分析Tab.3 Univariate and multivariate analysis for prognostic factors of patients who underwent pancreatectomy for PC
研究胰腺癌术后出现肝转移的高危因素是当前医学界的一个棘手问题。本研究发现,术后肝转移与切除肿瘤的大小、UICC分期及肿瘤有无血管浸润呈正相关。Fujioka等[8]对胰腺癌术后发生肝转移的相关因素进行研究后发现,低分化腺癌、肿瘤的血管浸润和术后CA19-9水平能够作为胰腺癌术后肝转移的预测指标。无以上因素的肝转移患者术后2年生存率为82%,但出现上述因素中1个、2个或3个影响因素者2年生存率分别降至35%、33%及0%。Inoue等[6]深入研究发现11例术后肝转移者中10例伴随CA19-9水平出现直线式上升,这种直线式上升与肝转移患者预后密切相关。笔者认为CA19-9用于评估患者预后的同时,也可作为胰腺癌术后肝转移发生的预测指标。本研究中,术后未实时监测CA19-9的水平,但发现术前CA19-9水平不能作为胰腺癌术后肝转移诊断及预后的评估指标。目前影响胰腺癌术后肝转移的因素还没有统一定论,可能与纳入的研究对象标准、样本量大小(如此次研究发现胰腺癌术后肝转移与肿瘤分化程度、T分期及淋巴结转移相关性接近统计学意义)、临床病理特点分类及统计方法不同有关。
胰腺癌患者出现黄疸往往预后不良[8]。但本研究发现,术前有无梗阻性黄疸与胰腺癌患者术后肝转移发生及预后无关。其主要原因是纳入本研究的胰腺癌患者所出现的黄疸均为胰头癌引起的梗阻性黄疸,因样本量不足,本研究将胰体尾癌(一般不引起梗阻性黄疸)也纳入研究中,故最终统计的结果可能存在偏倚。后期研究将增加样本量,仅在胰头癌患者中探讨梗阻性黄疸与胰腺癌患者术后肝转移及预后的关系。Hayashibe等[5]对9例胰腺癌术后患者行常规顺铂联合5-氟尿嘧啶化疗,而对另外13例患者无任何治疗措施。经过随访发现,化疗组患者最终出现肝转移3例(33%),未处理组出现肝转移7例(54%);化疗组平均中位生存时间为15.8个月,而对照组平均中位生存时间为13.4个月,因此,认为胰腺癌术后常规化疗能够一定程度上抑制肝转移的发生,改善患者预后。本研究认为对于肿瘤直径>2.5 cm、伴血管浸润、UICC分期为ⅡB期以上的患者是术后出现肝转移的高危人群,应常规进行化疗等综合治疗。
综上所述,肝转移是胰腺癌预后的独立危险因素,而肿瘤大小、血管浸润及UICC分期与胰腺癌术后肝转移的发生密切相关。结合患者临床病理学特点,术后密切随访,及早进行综合治疗,可能在一定程度上抑制胰腺癌术后肝转移发生,最终改善患者预后。
[1]盛伟伟,董明,周建平,等.Gli1在胰腺癌中表达的临床意义[J].中华外科杂志,2013,51(10):916-921.
[2]Park JB,Kim YH,Kim J,et al.Radiofrequency ablation of liver metastasis in patients with locally controlled pancreatic ductal adenocarcinoma[J].J Vasc Interv Radiol,2012,23(5):635-641.
[3]欧阳华强,潘战宇.胰腺癌肝转移治疗进展[J].中国肿瘤临床,2013,40(22):1-4.
[4]Michalski CW,Erkan M,Hüser N,et al.Resection of primary pancreatic cancer and liver metastasis:a systematic review[J].Dig Surg,2008,25(6):473-480.
[5]Hayashibe A,Kameyama M,Shinbo M,et al.Clinical results on intraarterial adjuvant chemotherapy for prevention of liver metastasis following curative resection of pancreatic cancer[J].Ann Surg Oncol,2007,14(1):190-194.
[6]Inoue K,Hiraoka T,Kanemitsu K,et al.Onset of liver metastasis after histologically curative resection of pancreatic cancer[J].Surg Today,2006,36(3):252-256.
[7]Fujioka S,Misawa T,Okamoto T,et al.Predictors for postoperative liver metastasis in patients with resectable pancreatic cancer[J].Int Surg,2008,93(6):324-330.
[8]Sperti C,Frison L,Liessi G,et al.The management of obstructive jaundice in pancreatic cancer[J].Ann Ital Chir,2007,78(6):469-474.
(编辑 王又冬)
ClinicopathologicalCharacteristicsofPostoperative Hepatic Metastasisfrom Pancreatic Cancer
GAOWei,SHENGWei-wei,DONGMing,ZHOUJian-ping
(DepartmentofGeneralSurgery,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo investigate the incidence of postoperative hepatic metastasis,clinicolpathological characteristics and the prognosis for pancreatic cancer.MethodsTotally 83 cases with pancreatic cancer admitted in our hospital during January 2007 to September 2012 was retrospectively analyzed according to clinicolpathological data.ResultsPostoperative liver metastasis occurred in 31 cases with a metastatic rate of 37.3%.The size(χ2=9.606;P=0.002),vascularinvasion(χ2=4.794,P=0.029)and UICC stage(χ2=5.318,P=0.021)were correlated with hepatic metastasis.Univariate analysis revealed the poorprognosis in pancreatic cancerpatientwith hepatic metastasis(χ2=9.967,P=0.002).Cox regression analysis revealed hepatic metastasis as an independent prognostic factor(P=0.001).ConclusionPancreatic cancer has a high possibility of hepatic metastasis.Postoperative hepatic metastasis was one of the independent factors for the prognosis of pancreatic cancer.Tumor size,vascular invasion and UICCstageswere risk factorsforpostoperative livermetastasis ofpancreatic cancer.
pancreatic cancer;hepatic metastasis
R735.9
A
0258-4646(2015)07-0644-05
高威(1982-),男,医师,硕士.
周建平,E-mail:zjphama@163.com
2015-03-24
网络出版时间:

