荒漠草原不同植物根际与非根际土壤养分及微生物量分布特征
杨 阳, 刘秉儒
宁夏大学, 西北退化生态系统恢复与重建教育部重点实验室, 银川 750021
荒漠草原不同植物根际与非根际土壤养分及微生物量分布特征
杨 阳, 刘秉儒*
宁夏大学, 西北退化生态系统恢复与重建教育部重点实验室, 银川 750021
通过对宁夏荒漠草原6种地带性优势物种长芒草、蒙古冰草、甘草、牛心朴子、黑沙蒿和苦豆子植物根际与非根际土壤养分和微生物量分布特征进行研究,探讨不同植物根际养分的富集的相关性和差异性。研究结果表明:6种植物根际土壤养分和微生物量均表现出明显的富集效应,根际富集率大小依次为菊科(黑沙蒿)>豆科(苦豆子、甘草)>禾本科(长芒草、蒙古冰草)>萝藦科(牛心朴子);全磷(TP)在根际和非根际中无显著差异(P>0.05),其它土壤养分及理化指标在根际中均表现出显著富集(P<0.05),土壤养分中以有机碳(SOC)的富集作用最为明显;土壤有效态养分较全量养分对植物根际微小的变化响应更为灵敏;不同荒漠植物根际与非根际SOC与全氮(TN)呈极显著线性关系(P< 0. 01),TN与碱解氮之间呈极显著线性关系(P<0.01),TP与有效磷(AP)没有显著的相关性(P>0.05)。荒漠植物土壤有效养分在根际存在一定的富集,灌木和豆科植物的根际效应的大于禾本科植物,它们通过降低根际pH值可以提高根际养分,有利于在脆弱环境下对土壤养分的有效利用。
荒漠草原;植物根际;土壤养分;土壤微生物量;空间分布
德国微生物学家Lorenz Hiltner将根际土(Rhizosphere Soil)定义为根系周围、受根系生长影响并且能够从微环境中吸收大量养分的土体[1- 3]。根际土是围绕根系进行生物地球化学循环最活跃的区域,是土壤-植物根系-微生物三者相互作用的场所和各种物质循环和能量流动的门户,对生态系统养分动态分布与循环、植物种间作用等发挥重要作用[3- 6],根系诱导产生根际土壤养分的变化已被证实[1- 3]。由于根际是土壤-植物根系-微生物生态系统物质交换的活跃界面,其分泌物、微生物活动以及水分的差异具有较大差异,根际过程对于认识植物对土壤中养分的利用及适应显得非常重要。
荒漠区土壤养分含量较贫瘠,这一区域植物“根际效应”及根际对养分的截留效应较为明显[7- 9]。荒漠植物根际土壤特征可能是有效吸收、利用土壤养分和适应脆弱环境的最直接表征之一,而荒漠根际土壤特征及对环境的适应中所起的作用等科学问题尚未得到充分的认识[10- 12]。国内对根际的研究开始于80年代初,大部分集中在农作物和森林等生态系统和对农作物和树木的根际养分、毒害离子、根际微生物、根际分泌物、簇根等方面,而对于干旱、养分贫瘠、气候脆弱的荒漠植物根际土壤养分、微生物量以及根际在土壤-根际-植物系统中的作用还少见报道[13- 15]。研究荒漠草原不同植物根际与非根际土壤养分分布特征与动态变化及其根际养分的富集作用,对于揭示荒漠植物对土壤养分的保护、有效利用机制及其演替、恢复、重建等具有重要生态学意义[1,5- 7,13- 15]。鉴于此,本文研究了荒漠草原6种不同植物根际土壤养分、理化因子和微生物量等指标,旨在探明荒漠植物根际养分的差异性以及对土壤养分利用对策和保护效应,以期揭示荒漠植物对干旱、贫瘠、脆弱环境的适应机理和策略及其在土壤-植物恢复中的作用。
1 材料与方法
1.1 研究区自然概况
研究区位于宁夏中东部盐池县毛乌素沙地南缘和黄土高原过渡带之间,属干中温带半干旱区、欧亚草原区、中部草原区的过度地带,是典型的鄂尔多斯台地,该区属于典型的大陆性气候,热量丰富,年降水量在150—450 mm之间,主要集中7—9月,约占全年的60%以上,年蒸发量在1221.9—2086.5 mm。土壤类型主要是灰钙土,其次是风沙土、黄绵土,腐殖质层较薄,土壤结构松散,肥力低下,多风沙,植被成分比较单一,主要由禾本科、菊科、百合科、藜科、蒺藜科、豆科、十字花科和鸢尾科等植物组成;植被以旱生多年生草本植物为主,以长芒草(Stipabungeana)、蒙古冰草(AgropyronmongolicumKeng)、甘草(GlycyrrhizauralensisFisch.)、牛心朴子(CynanchumkomaroviiAl.)、黑沙蒿(Artemisiaordosica)和苦豆子(Sophoraalopecuroides)植物为主要建群种的天然草地类型(典型无干扰情况下),具有典型和代表性,占该区域草地面积的80%以上。
1.2 样地设置与样品采集
于2013年8月中旬对每种类型的草地在3个不同的区域布设面积为100 m×100 m的样地,作为3个重复,在每个样地内随机选取典型植物,按照其长势依次分为大、中、小各3株共27株,采样植物的形态特征和生长状况列于表1。
不同植物根际土壤样品采集采用Riley和Barber的抖落法[16- 17]。在上述所选的典型样地内挖取具有完整根系的土体(根系主要分布的范围),先轻轻抖落大块不含根系的土壤,用小刀取下附在根系周围的土壤为非根际土(S),装入塑料袋内混匀,然后用刷子刷下粘附在根围的土壤(距离根围0—5 mm)作为根际土(R),取根际土尽量减少损害植物根系,对于混杂于根际土中的根系要彻底去除。每个样地各分别随机采集3株大、中、小植物根际、非根际土壤(排除植物个体大小对根际的影响),每种植物采集27株,总共采集到植物162株和324个土样(根际和非根际土),刚采集的新鲜土样塑封袋盛装在保温箱内4℃保存以测定土壤微生物量及含水量,然后风干去除有机碎片,过2 mm筛用以测定土壤理化指标及养分。

表1 荒漠草原不同植物生长特点Table 1 The basic characteristics of different plants and environmental condition in desert steppe
1.3 测定方法
1.3.1 土壤理化性质的测定
土壤含水量采用烘干法测定;土壤pH采用电极电位法测定(1∶2.5土水比浸提液);电导率EC采样P4多功能测定仪(Multiline P4 Universal Meter, WTM公司,Germany)测定;土样研磨过0.5 mm筛用于SOC、TN和TP的分析,SOC采用重铬酸钾氧化-外加热法测定;TP采用NaOH碱溶-钼锑抗比色法测定(日产UV-1601分光光度计);有效磷采用NaHCO3浸提-钼锑抗比色法测定;TN采用半微量凯氏定氮法测定(意大利产DK6,UDK140分析仪);碱解氮采用NaOH-H3BO3法测定[18-19]。
1.3.2 土壤微生物量碳、氮的测定
土壤微生物量碳、氮采用氯仿熏蒸-K2SO4浸提法,其中氯仿熏蒸杀死的微生物体中的碳、氮被浸提出来的比例分别为0. 38、0. 45[20]。
1.4 数据处理
采用SPSS 18.00进行方差分析;Excel 2003.00进行绘图;多重比较采用LSD法;单因素方差检验根际与非根际土壤是否存在显著差异;所有数据为3次重复的平均值,Pearson相关分析讨论土壤理化因子与微生物量之间的相关关系。
根际富集率E(Enrichment ratio)反映养分的富集程度,E值的大小反映土壤性状值在植物根际的富集程度,同时也反映了植物根际效应的强弱,计算公式如下[14- 15,21]:
E=[(根际含量-非根际含量)/非根际含量 ]×100%
2 结果与分析
2.1 荒漠草原植物根际与非根际土壤养分平均值和富集率
荒漠草原植物根系不断从外界环境吸收养分,不同的吸收速率使根际养分出现亏缺和富集。从表2可以看出,荒漠草原植物根际与非根际土壤微生物量碳、微生物量氮、有机碳、全氮、碱解氮、有效磷、含水量及pH呈现出显著的差异(P<0.05),而土壤全磷和电导率没有明显的差异(P>0.05)。相对于非根际土壤,根际MBC平均高出30.3%,MBN平均高出72.8%,SOC平均高出43.6%,TN平均高出63.3%,TP平均高出45.7%,TP平均高出41.3%,碱解氮平均高出68.1%,电导率平均高出3.4%,含水量平均高出25.0%,由于根系呼吸释放CO2、分泌有机酸、微生物活动产生有机酸和CO2等作用导致根际酸化,而根际pH值的降低能够提高多种矿质养分的有效性和促进养分有效性的转化和活化,从而保证了其对微量元素的吸收和自身的生长;综合来看,荒漠植物根际对土壤养分表现出明显的富集和截存效应。

表2 荒漠草原植物根际与非根际土壤养分平均值和富集率Table 2 Contents of nutrients and enrichment ratio in rhizosphere and non-rhizosphere soil of different desert plant
2.2 荒漠草原植物根际和非根际土壤养分含量变化
荒漠草原6种植物根际SOC富集率大小表现为:黑沙蒿>甘草>苦豆子>牛心朴子>长芒草>蒙古冰草,受豆科固氮作用影响,土壤TN富集率大小表现为:甘草>黑沙蒿>苦豆子>牛心朴子>蒙古冰草>长芒草,土壤TP富集率大小表现为:甘草>黑沙蒿>蒙古冰草>牛心朴子>长芒草>苦豆子,整体上来看(表3),灌丛(黑沙蒿)和豆科植物(苦豆子、甘草)对土壤各养分的富集率均显著高于禾本科植物(长芒草、蒙古冰草)。
土壤有效成分中,黑沙蒿、苦豆子、甘草和牛心朴子根际中有效磷显著富集,而在长芒草和蒙古冰草根际中有效磷含量亏缺显著;除了牛心朴子根际土壤碱解氮含量低于非根际,其他5种植物根际土均表现明显的富集效应,黑沙蒿、苦豆子和甘草根际土壤碱解氮富集率明显高于长芒草和蒙古冰草;6种荒漠植物根际土壤pH值均小于非根际,其降低幅度在0.10—0.82个单位之间,降低幅度大小顺序为:黑沙蒿>苦豆子>牛心朴子>甘草>长芒草>蒙古冰草,其中黑沙蒿根际pH值最小并且下降幅度最大,达0.82个单位,这说明黑沙蒿比草本植物更容易引起根际土壤 pH值的降低;长芒草、蒙古冰草、甘草和牛心朴子根际电导率显著富集, 而黑沙蒿和苦豆子根际中电导率亏缺,亏缺率为12.79%和6.52%;含水量在6种荒漠植物中显著富集,并且黑沙蒿、苦豆子和甘草富集率均显著高于其他3种植物。
由图1可知,6种植物根际MBC和MBN含量均高于非根际,其中黑沙蒿、苦豆子和甘草根际MBC极显著富集(P<0.01),长芒草根际MBC显著富集(P<0.05),蒙古冰草和牛心朴子根际MBC并没有达到显著富集(P>0.05);除了长芒草根际MBN没有达到显著富集(P>0.05),其他5种植物根际MBN均达到极显著富集(P<0.01)。综合来看,黑沙蒿、苦豆子和甘草根际各成分富集率显著高于其他3种植物。
2.3 荒漠草原植物根际与非根际土壤养分、微生物量相关分析
由表4可知,土壤根际MBC与MBN、SOC、TN和含水量呈显著或极显著正相关(P<0.01),与电导率呈极显著负相关(P<0.01);MBN与SOC、TN和含水量呈极显著正相关(P<0.01),与电导率呈显著负相关(P<0.05);SOC与TN和含水量呈极显著正相关(P<0.01),与电导率呈极显著负相关(P<0.01);TN与TP、碱

图1 荒漠草原不同植物根际和非根际土壤微生物量Fig.1 Contents of soil microbial biomass in rhizosphere and non-rhizosphere soil of different desert plant

表3 荒漠草原植物根际和非根际土壤养分含量变化Table 3 Contents of soil nutrients in rhizosphere and non-rhizosphere soil of different desert plant
解氮和含水量呈极显著正相关(P<0.01),与有效磷呈极显著负相关(P<0.01);TP与碱解氮、pH呈极显著正相关(P<0.01),与含水量呈显著正相关(P<0.05);碱解氮与电导率呈显著正相关(P<0.05);pH与电导率呈显著正相关(P<0.05);以上结果显示了根际SOC和TN在荒漠生态系统中相互影响和制约。
由表5可知,土壤非根际MBC与MBN、SOC、TP和含水量呈显著或极显著正相关,与电导率呈极显著负相关(P<0.01);MBN与SOC、TN、含水量和有效磷呈显著或极显著正相关,与电导率极显著负相关(P<0.05);SOC与TN和含水量呈极显著正相关(P<0.01),与电导率呈显著负相关(P<0.05);TN与TP、碱解氮和含水量呈极显著正相关(P<0.01);TP与碱解氮、pH和含水量呈正相关;碱解氮与电导率和含水量呈显著正相关(P<0.01);以上结果显示了根际与非根际土壤养分、微生物量变化规律、影响因子之间的相关性。

表4 荒漠草原植物根际土壤养分影响因子Pearson相关性分析Table 4 Pearson′s correlation coefficients among soil nutrient factors in rhizosphere soil of different desert plant
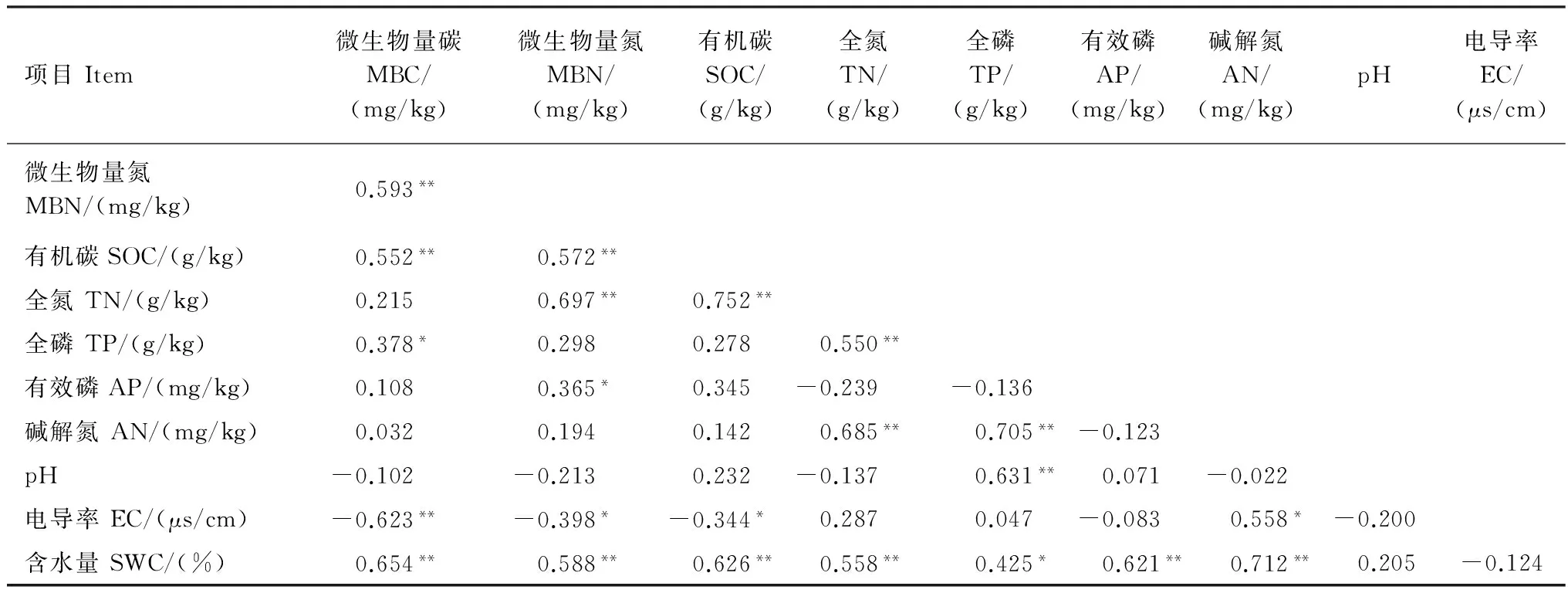
表5 荒漠草原植物非根际土壤养分影响因子Pearson相关性分析Table 5 Pearson’s correlation coefficients among soil nutrient factors in non-rhizosphere soil of different desert plant
由原始数据拟合得到的回归关系经统计学检验得到拟合度参数R2,并在P<0.05水平检验相关系数的显著性,F检验结果表明,下表中的线性回归关系均达到极显著水平,各回归关系成立,得以下结果。由表6可知,荒漠草原植物根际和非根际SOC与TN均呈极显著线性相关(P<0.01);TN与碱解氮在根际与非根际呈显著线性相关(P<0.01);而TP与有效磷在根际和非根际没有显著相关性(P<0.01);MBC与MBN在根际与非根际呈显著线性相关(P<0.01)。TP和有效磷之间并没有表现出相关性(P<0.01),说明在荒漠植物凋落物归还的P不足以维持植物需求,土壤磷库中P素不断转移到地上植物体内。

表6 荒漠草原植物根际养分与非根际养分的线性回归关系Table 6 The relations of linear regression in rhizosphere and non-rhizosphere soil nutrients of different desert plants
3 讨论与结论
3.1 荒漠植物根际与非根际土壤养分和富集率分析
植物根际研究文献表明,各种元素含量在根际与非根际土壤中存在较大差异[22- 24]。本研究中不同荒漠植物根际与非根际土壤养分、微生物量及理化性质等均存在明显差异(表2),主要是由于植物根系不断从外界摄取养分及其分泌物向根表的迁移,使得根际微区域内的养分形态、浓度和分布等方面较为复杂[13- 15,21,25],这充分体现了荒漠植物在定居和发育过程中对养分的需求变化[21,26]。由表1和2可知,以黑沙蒿根际对土壤各养分的富集率最大,苦豆子和甘草次之,黑沙蒿灌丛适应脆弱环境需要更多的营养维持根系的生长和发育,因而出现更多的根系沉淀和养分富集[13- 15,21,25- 26];甘草和苦豆子为豆科植物,根瘤菌有利于根系吸收营养物质,因此根际养分含量相对偏高;蒙古冰草和牛心朴子属于矮小草本植物,根系及枯落物对土壤养分的吸收贡献较小。综合比较可知,黑沙蒿(灌丛)根际富集率明显优于其他草本植物,依次表现为菊科(黑沙蒿)>豆科(苦豆子、甘草)>禾本科(长芒草、蒙古冰草)>萝藦科(牛心朴子),主要是由于黑沙蒿灌丛根系发达、生物量大、枯落物丰富,伴有养分富集的“肥岛效应”和种内营养补偿效应[27- 29],促进了根际微生物的旺盛生长,因此表现出较为明显的根际效应[7- 9,13- 15,21,30]。从该结果可以看出,黑沙蒿灌丛可作为改良土壤、防风固沙及退化荒漠生态区植物恢复与重建关键物种。
3.2 不同荒漠植物根际与非根际养分比较分析
表1和表2表明6种荒漠植物根际养分均表现明显的富集作用,其中以SOC的富集作用最为明显,黑沙蒿灌丛根际对SOC的富集作用远高于其他草本植物,可能是由于黑沙蒿灌丛对土壤风蚀物质、降尘和凋落物的截获,通过发达根系以根际沉积的形式显著聚集于根际[13- 15,21],此外,植物根系可通过一系列措施来减少根际碳损失、缓解环境的胁迫,也能通过地下根系的可塑性分配适应土壤养分有效性的改变[30- 31]。碱解氮在牛心朴子根际亏缺可能是由于牛心朴子生长对N素的消耗、以及根系生理代谢功能强、根际微生物活动旺盛等促进了N素向碱解氮的转化,这种现象是荒漠植物对N素缺乏的一种特殊适应策略;其他5种植物N素营养利用上不同于牛心朴子,以苦豆子和甘草的根际N素富集作用最大,其根系与根瘤菌共生可能促进了N素的固定和营养的吸收。而土壤TP在根际和非根际中差异并不显著,但黑沙蒿灌丛的根际富集效果较为明显,说明其根系具有较强的吸附P素能力,由表4可知荒漠植物根际TP与pH呈极显著的正相关关系(P<0.01),表明根系分泌的有机酸对难溶性P起到一定的活化作用[4,32- 33],pH值的降低能够提高P素的转化与活化,以此抵御脆弱环境和土壤养分贫瘠等[1- 3,5- 7]。由于黑沙蒿强大根系呼吸释放CO2、分泌有机酸能力,造成其根际土壤pH值均低于其他草本植物。综上所述,本研究初步表明荒漠植物土壤有效养分在根际存在一定的富集,它们通过降低根际pH值可以提高根际养分,有利于在脆弱环境下对土壤养分的有效利用。
由于根系分泌物种类和数量繁多、影响因素相对复杂,不同分泌物之间可能存在相互替代和拮抗作用等,使得植物根系分泌物对土壤养分有效性有多重影响[34- 36]。本研究荒漠植物根际土壤有效养分(碱解氮和速效磷)的变化幅度高于全量养分,说明荒漠植物在土壤养分循环和吸收过程中,有效态养分较全量养分对植物根际微小的变化响应更为灵敏。其中长芒草和蒙古冰草有效磷在根际中亏缺可能是由于二者生长过程中对P素的需求量大,并且对P素的吸附和缓冲能力较弱等。因此,保持土壤中较低的有效磷可能是土壤P素持续利用的有效对策。
3.3 不同荒漠植物根际与非根际微生物量比较分析
荒漠植物根际MBC和MBN均比非根际高,根系较为庞大的植物,其土壤微生物量也较高。由图2可知,黑沙蒿、苦豆子和甘草深根系植物根际微生物量富集作用高于蒙古冰草、长芒草和牛心朴子浅根系植物,与前人的研究结果一致[37- 39],蒙古冰草、长芒草和牛心朴子土壤微生物量较低,原因可能与它们发育阶段的物质分配有关,地上积累的物质大多用于发育繁殖器官,地下生物量表现负累积。虽然MBC和MBN只占SOC、TN的3%左右,但它们是植物养分转化、SOC代谢及降解的驱动力。此外,MBC和MBN差异主要与植物种群、生物学特性、土壤理化特性、凋落物质量和数量以及生长节律有关,是各种因素综合作用的结果,还存在较多的不确定性因素[37- 39]。
3.4 荒漠草原植物根际与非根际土壤养分、微生物量的相关分析
由表4和5可知,荒漠植物根际、非根际MBC与MBN之间达到显著或极显著相关性,MBC、MBN与SOC、TN、碱解氮和有效磷等土壤养分之间相关性也达到显著或极显著水平,表明MBC和MBN具有协同性并且可以作为判断荒漠草原土壤肥力性状的生物学指标,这与许多学者的研究结果基本一致[37- 39]。SOC主要来源于根系分泌物和凋落物等,N素除微生物固氮或少量大气沉降外,大多来源于植物凋落物的返还、死亡的细根和根系分泌的有机物[1- 3,13- 15],因此根际和非根际土壤TN与SOC之间呈现出极显著相关性;本研究表明荒漠植物根际和非根际土壤养分、微生物量变化趋势基本保持一致,它们的主导控制因子也基本相同。荒漠植物根际沉积不仅为根际微生物提供了丰富的C源,还对根际土壤养分产生重大影响[13- 15,21,25- 26,30]。因此,认识和调控根际沉积及养分的流量和方向对于建立根际环境中养分的合理分配模式具有重要作用。
致谢:以色列巴伊兰大学刘任涛博士帮助写作,宋乃平教授、杨新国副教授在数据测试过程中提供帮助,特此致谢。
[1] Ma B, Zhou Z Y, Zhang C P, Li X R. The character of phosphorus concentrations in rhizosphere soil of super-xerophytic shrubs. Acta Prataculturae Sinica, 2005, 14(3): 106- 110.
[2] Barth R C, Klemmedson J O. Shrub-induced spatial patterns of dry matter, nitrogen, and organic carbon. Soil Science Society of America Journal, 1978, 42(5): 804- 809.
[3] Curl E A, Truelove B. The Rhizosphere. Berlin-Heidelberg: Springer-Verlag, 1986.
[4] Jones D L. Organic acids in the rhizosphere-a critical review. Plant and Soil, 1998, 205(1): 25- 44.
[5] Weller D M. Biological control of soilborne plant pathogens in the rhizosphere with bacteria. Annual Review of Phytopathology, 1988, 26(1): 379- 407.
[6] Van Loon L C, Bakker P A H M, Pieterse C M J. Systemic resistance induced by rhizosphere bacteria. Annual Review of Phytopathology, 1998, 36(1): 453- 483.
[7] 弋良朋, 马健, 李彦. 荒漠盐生植物根际土壤盐分和养分特征. 生态学报, 2007, 27(9):3564- 3571.
[8] 董利苹, 曹靖, 李先婷, 代立兰, 苏怡兵. 苏怡兵不同耐盐植物根际土壤盐分的动态变化. 生态学报, 2011, 31(10): 2813- 2821.
[9] 詹媛媛, 薛梓瑜, 任伟, 周志宇. 干旱荒漠区不同灌木根际与非根际土壤氮素的含量特征. 生态学报, 2009, 29(1): 59- 66.
[10] 李国辉, 陈庆芳, 黄懿梅, 安韶山, 郑粉莉, 陈利顶. 黄土高原典型植物根际对土壤微生物生物量碳、氮、磷和基础呼吸的影响. 生态学报, 2010, 30(4): 976- 983.
[11] 谢添, 李恋卿, 潘根兴, 杜有新. 不同退化程度喀斯特生态系统根际土壤的养分分布特 征. 生态环境学报, 2011, 20(2): 276- 280.
[12] 陈立新, 段文标, 乔璐. 落叶松人工林根际与非根际土壤养分特征及酸度研究. 水土保持学报, 2011, 25(3): 131- 135.
[13] 李从娟, 马健, 李彦. 五种沙生植物根际土壤的盐分状况. 生态学报, 2009, 29(9):4549- 4655.
[14] 李从娟, 李彦, 马健, 范连连, 王吉利. 干旱区植物根际土壤养分状况的对比研究. 干旱区地理, 2011, 34(2): 222- 228.
[15] 王卫霞, 罗明, 潘存德. 塔里木河下游几种荒漠植物根际土壤微生物及其活性. 中国 沙漠, 2010, 30(3): 571- 576.
[16] Riley D, Barber S A. Bicarbonate accumulation and pH changes at the soybean (Glycinemax(L.) Merr.) root-soil interface. Soil Science Society of America Journal, 1969, 33(6): 905- 908.
[17] Riley D, Barber S A. Salt accumulation at the soybean (Glycinemax. (L.) Merr.) root-soil interface. Soil Science Society of America Journal, 1970, 34(1): 154- 155.
[18] Barber S A. Soil Nutrient Bioavailability: a Mechanistic Approach. New York: John Wiley & Sons, 1995.
[19] Cleveland C C, Townsend A R, Taylor P, Alvarez-Clare S, Bustamante M M C, Chuyong G, Dobrowski S Z, Grierson P, Harms K E, Houlton B Z, Marklein A, Parton W, Porder S, Reed S C, Sierra C A, Silver W L, Tanner E V J, Wieder, W R. Relationships among net primary productivity, nutrients and climate in tropical rain forest: a pan-tropical analysis. Ecology Letters, 2011, 14(9): 939- 947.
[20] Brookes P C, Landman A, Pruden G, Jenkinson D S. Chloroform fumigation and the release of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen in soil. Soil Biology and Biochemistry, 1985, 17(6): 837-842.
[21] Rovira A D. Plant root excretions in relation to the rhizosphere effect. Plant and Soil, 1956, 7(2): 178- 194.
[22] Ruan J, Ma L F, Shi Y Z, Zhang F S. Effects of litter incorporation and nitrogen fertilization on the contents of extractable aluminium in the rhizosphere soil of tea plant (Camalliasinensis(L.) O. Kuntze). Plant and Soil, 2004, 263(1): 283- 296.
[23] Dieffenbach A, Matzner E. Insitusoil solution chemistry in the rhizosphere of mature Norway spruce (Piceaabies[L.]Karst.) trees. Plant and Soil, 2000, 222(1- 2): 149- 161.
[24] Shi W M, Wang X C, Yan W D. Distribution patterns of available P and K in rape rhizosphere in relation to genotypic difference. Plant and Soil, 2004, 261(1- 2): 11- 16.
[25] Rouatt J W, Katznelson H, Payne T M B. Statistical evaluation of the rhizosphere effect. Soil Science Society of America Journal, 1960, 24(4): 271- 273.
[26] Valiela I, Foreman K, LaMontagne M, Hersh D, Costa J, Peckol P, DeMeo-Andreson B, D’Avanzo C, Babione M, Sham C H, Brawley J, Lajtha K. Couplings of watersheds and coastal waters: sources and consequences of nutrient enrichment in Waquoit Bay, Massachusetts. Estuaries and Coasts, 1992, 15(4): 443- 457.
[27] Li J, Zhao C, Zhu H, Li Y, Wang F. Effect of plant species on shrub fertile island at an oasis-desert ecotone in the South Junggar Basin, China. Journal of Arid Environments, 2007, 71(4): 350- 361.
[28] Smith S D, Huxman T E, Zitzer S F, Charlet T N, Housman D C, Coleman J S, Fenstermaker L K, Seemann J R, Nowak R S. Elevated CO2increases productivity and invasive species success in an arid ecosystem. Nature, 2000, 408(6808): 79- 82.
[29] Wezel A, Rajot J L, Herbrig C. Influence of shrubs on soil characteristics and their function in Sahelian agro-ecosystems in semi-arid Niger. Journal of Arid Environments, 2000, 44(4): 383- 398.
[30] Bell D L, Sultan S E. Dynamic phenotypic plasticity for root growth in Polygonum: a comparative study. American Journal of Botany, 1999, 86(6): 807- 819.
[31] Dinkelaker B, Römheld V, Marschner H. Citric acid excretion and precipitation of calcium citrate in the rhizosphere of white lupin (LupinusalbusL.). Plant, Cell & Environment, 1989, 12(3): 285- 292.
[32] Marschner P, Neumann G, Kania A, Weiskopf L, Lieberei R. Spatial and temporal dynamics of the microbial community structure in the rhizosphere of cluster roots of white lupin (LupinusalbusL.). Plant and Soil, 2002, 246(2): 167- 174.
[33] Bowen G D, Rovira A D. The rhizosphere: the hidden half of the hidden half// Waisel Y, Eshel A, Kafkafi U. Plant Roots: The Hidden Half. New York, USA: Marcel Dekker, 1991: 641- 669.
[34] Itai C, Vaadia Y. Kinetin-like activity in root exudate of water-stressed sunflower plants. Physiologia Plantarum, 1965, 18(4): 941- 944.
[35] Neumann G, Römheld V. Root excretion of carboxylic acids and protons in phosphorus-deficient plants. Plant and Soil, 1999, 211(1): 121- 130.
[36] Dong J, Mao W H, Zhang G P, Wu F B, Cai Y. Root excretion and plant tolerance to cadmium toxicity-a review. Plant Soil and Environment, 2007, 53(5): 193- 200.
[37] Kraffczyk I, Trolldenier G, Beringer H. Soluble root exudates of maize: influence of potassium supply and rhizosphere microorganisms. Soil Biology and Biochemistry, 1984, 16(4): 315- 322.
[38] Shaw L J, Morris P, Hooker J E, Joner E. Perception and modification of plant flavonoid signals by rhizosphere microorganisms. Environmental Microbiology, 2006, 8(11): 1867- 1880.
[39] Chaudhry Q, Blom-Zandstra M, Gupta S K, Joner E J. Utilising the synergy between plants and rhizosphere microorganisms to enhance breakdown of organic pollutants in the environment (15 pp). Environmental Science and Pollution Research, 2005, 12(1): 34- 48.
Distribution of soil nutrient and microbial biomass in rhizosphereversusnon-rhizosphere area of different plant species in desertified steppe
YANG Yang, LIU Bingru*
KeyLaboratoryofRestorationandReconstructionofDegradedEcosysteminNorthwestChinaofMinistryofEducation,NingxiaUniversity,Yinchuan750021,China
Six plant species,Stipabungeana,AgropyronmongolicumKeng,GlycyrrhizauralensisFisch.,CynanchumkomaroviiAl.,Artemisiaordosica, andSophoraalopecuroidesdominate the desertified steppe ecosystems in Ningxia, northern China. However, the distribution of soil nutrients and microbial biomass in the rhizosphere and non-rhizosphere areas of these six plant species in this region has been largely unknown. This study investigated soil nutrients, microbial biomass, and soil physicochemical properties in the rhizosphere and non-rhizosphere areas of these six desert plant species, together with soil physicochemical properties. The results showed that rhizosphere enrichment followed the order shrub (A.ordosica) > Leguminosae (S.alopecuroides,G.uralensisFisch.) > Gramineae (S.bungeana,A.mongolicum) >Compositae(C.komaroviiAl.). In the rhizosphere area, a significant enrichment effect (P< 0.05) was found on the soil nutrients and microbial biomass, but not on the total phosphorus (TP) (P> 0.05). The rhizosphere enrichment effect on soil organic carbon (SOC) was more pronounced than the other indices (i.e., soil nutrients and physicochemical properties), and soil nutrient availability was more sensitive to the changes in the rhizosphere among plant species. In the rhizosphere and non-rhizosphere soil of different desert plant species, a significant linear correlation was observed (P< 0.01) between SOC and total nitrogen (TN) and a significant linear correlation between TN and alkaline hydrolysis nitrogen (P< 0.01), but no significant correlation was observed between TP and available phosphorus (AP) (P> 0.05). The results suggested that the rhizosphere enrichment effect occurred for many desert plant species. Shrubs and leguminous plants had a significantly higher rhizosphere effect than the other herbaceous species. Rhizosphere enrichment effect was found to increase soil nutrients by reducing soil pH, and this was beneficial for the efficient utilization of soil nutrients in the susceptible desertified steppe ecosystems.
desertified steppe; plant rhizosphere; soil nutrients; soil microbial biomass; spatial distribution
宁夏自然科学基金项目(NZ14015)
2014- 03- 13;
日期:2015- 04- 20
10.5846/stxb201403130440
*通讯作者Corresponding author.E-mail: bingru.liu@163.com
杨阳, 刘秉儒.荒漠草原不同植物根际与非根际土壤养分及微生物量分布特征.生态学报,2015,35(22):7562- 7570.
Yang Y, Liu B R.Distribution of soil nutrient and microbial biomass in rhizosphereversusnon-rhizosphere area of different plant species in desertified steppe.Acta Ecologica Sinica,2015,35(22):7562- 7570.

