无瓣海桑与乡土红树植物混交对林地大型底栖动物的影响
唐以杰,方展强,何 清,吴映明,陆 棣,李燕妮,谭莉君,杨学彬,陈思敏
1 广东第二师范学院生物系, 广州 510303 2 华南师范大学生命科学学院,广东省高等学校生态与环境科学重点实验室, 广州 510631
无瓣海桑与乡土红树植物混交对林地大型底栖动物的影响
唐以杰1,方展强2,*,何 清1,吴映明1,陆 棣1,李燕妮1,谭莉君1,杨学彬1,陈思敏1
1 广东第二师范学院生物系, 广州 510303 2 华南师范大学生命科学学院,广东省高等学校生态与环境科学重点实验室, 广州 510631
选择广东省雷州市附城镇和珠海市淇澳岛沿海1年生无瓣海桑人工林,分别在林下混种乡土红树植物红海榄或木榄幼苗,对混交林和无瓣海桑纯林林地大型底栖动物群落进行比较,探讨无瓣海桑与乡土红树植物混交对林地大型底栖动物的影响。结果显示,混交林和无瓣海桑纯林之间大型底栖动物群落的优势种存在差异;相似性分析检验(One-Way ANOSIM)、等级聚类和非参数多变量标序结果均表明1年无瓣海桑+红海榄混交林、1年无瓣海桑+木榄混交林和1年无瓣海桑纯林之间大型底栖动物群落结构差异显著。研究还发现在无瓣海桑人工林林下混交红海榄或木榄这两种乡土红树植物,可提高林地底栖动物的生物量和物种多样性。BIOENV分析说明大型底栖动物分布与红海榄或木榄这两种混交的乡土树种的凋落物量密切相关,这进一步证实了混交乡土红树植物对林地底栖动物多样性和分布的影响。两个研究地实验结果均显示,在无瓣海桑林下种植木榄的效果要优于红海榄,表现在木榄的平均苗高、凋落物量、凋落物量占群落凋落物总量百分比和幼苗成活率均高于红海榄,其对提高林地大型底栖动物生物量和物种多样性的效果也明显优于红海榄。
无瓣海桑;木榄;红海榄;大型底栖动物;物种多样性
无瓣海桑(Sonneratiaapetala)从1985年自孟加拉引种我国海南岛,90年代从海南引种到广东、广西、福建等地。由于该树种适应性强、生长迅速,近年已成为我国华南沿海滩涂红树林造林的重要树种[1],无瓣海桑的引种扩大了我国红树林的种质资源,促进了红树林的恢复与发展,而且在控制滩涂互花米草的滋生蔓延方面取得了良好效果。然而,目前无瓣海桑引种后多形成了单种纯林,可能是导致乡土红树植物难以在其间定居生长的重要原因,同时纯林的生物多样性低、生态系统稳定性差、易发生病虫害[2]。调查发现,无瓣海桑人工林林地大型底栖动物生物多样性明显低于同林龄乡土红树植物人工林[3- 4],其中一个重要原因是无瓣海桑凋落物的营养水平(如C/N 比)和单宁含量明显不同于乡土红树植物,本地一些底栖动物对这种食物源“不适应”或“不喜欢”[5]。因此,有学者建议逐步对现有无瓣海桑纯林进行改造,修枝后在林下种植适宜的乡土树种以形成混交结构[1]。然而,利用乡土红树植物与无瓣海桑混交,对林地底栖动物群落会有怎样的生态影响?未见报道。实际上,在红树林生态系统中,大型底栖动物作为红树林生态系统中物质循环、能量流动积极的消费者和转移者,对红树林生态系统的生态功能有重要意义,研究大型底栖动物的多样性和丰度对人工恢复红树林的生境变化均具有潜在的生物、生态指示作用[6]。鉴于此,本研究选择湛江雷州市附城镇和珠海市淇澳岛两地同为1年林龄的无瓣海桑纯林各一片,分别在林下种植木榄或红海榄幼苗,比较混交后的无瓣海桑+木榄、无瓣海桑+红海榄混交林与无瓣海桑纯林林地间大型底栖动物群落的差异,探讨无瓣海桑与乡土红树植物混交后大型底栖动物群落的生态响应,以及影响大型底栖动物群落结构和物种多样性的主要环境因子。
1 材料与方法
1.1 研究区域概况
研究地位于广东省湛江市雷州市附城镇和珠海市淇澳岛两地的人工红树林区,其中雷州市人工红树林区东经为110°09′—110°10′,北纬20°52′—20°56′,属北热带和南亚热带季风气候区,年均气温22.8—23.4 ℃,年均水温25—27 ℃,年均太阳总辐射4 500—5 600 MJ/m2,年均降水量1 534.6 mm,潮汐属不正规半日潮,土壤多为滨海沙土和滨海盐土[7]。另外一个研究地珠海市淇澳岛红树林自然保护区东经为113°36′40′′—113°39′15′′,北纬为22°23′40′′—22°27′38′′,属于低纬度亚热带季风区,日照充足,年平均气温22.4 ℃,最冷月1月的平均气温15.3 ℃,最热月7月的平均气温28.3 ℃;年平均降雨量1 700—2 200 mm,东风为常向风,空气年平均相对湿度为79%。潮汐属不正规半日潮,平均高潮位0.17 m,平均低潮位-0.14 m,水质比较清洁;土壤属于滨海盐渍草甸沼泽土[8]。
1.2 采样方法及样品处理
分别在雷州市附城镇沿海红树林区和珠海市淇澳岛红树林自然保护区,选择1年林龄的无瓣海桑人工纯林;其中附城镇纯林面积约为3500 m2,自陆缘向海的林带宽度约为50 m,无瓣海桑林的种植密度为2 m × 2 m;珠海市淇澳岛纯林面积约为4900 m2,自陆缘向海的林带宽度约为70 m,无瓣海桑林的种植密度也为2 m × 2 m。实验时,将纯林分为大致相等的3部分,中间相隔5 m,左边部分不进行混交,以作对照;中间部分在林下种植红海榄幼苗,右边部分在林下种植木榄幼苗,种植前,对于郁闭度大于0.6的无瓣海桑林分,进行砍枝处理;对于郁闭度不足0.6林分,对林下的互花米草或杂草、杂灌清除干净;接着选择无病虫害的健壮红海榄或木榄袋苗进行种植,种植规格为行距×株距=0.6 m×0.6 m。最后对种植后的红海榄或木榄苗木进行抚育管理,即清除种植幼苗周围互花米草以及杂草、杂灌和垃圾。混交3个月后,分别于2013年5、8、11月和2014年2月进行相关调查。大型底栖动物的调查是自陆缘向海,将每种人工林按林带宽度分为等距离的4处,每处布设1个站点。其中,雷州市附城镇1年无瓣海桑纯林、1年无瓣海桑+红海榄混交林和1年无瓣海桑+木榄混交林的4个站点分别标记为A1—A4、B1—B4和C1—C4;珠海市淇澳岛1年无瓣海桑纯林、1年无瓣海桑+红海榄混交林和1年无瓣海桑+木榄混交林的4个站点分别标记为D1—D4、 E1—E4和F1—F4。每个站点均与陆缘平行方向上取4个50 cm × 50 cm的定量样框,先捡出框内底表动物,再挖至30 cm深的土壤,用0.5 mm孔径筛子分选出底内动物,所获样品用5%的甲醛溶液现场固定,于实验室内分析鉴定。在进行大型底栖动物调查的同时,每个站点布设一个10 m × 5 m的样方,对样方内所有植物进行全面调查,测定各样方内无瓣海桑的平均树高和郁闭度,红海榄或木榄苗高和成活率;每个站点在动物取样样方的右侧,与动物取样样方相隔5 m,用孔径1.5 mm玻璃纤维网布设置3个围网,每个围网所圈的地面面积为1 m2,每5天收集围网内的凋落物,仔细辨别凋落物,按无瓣海桑、红海榄或木榄分开,每月月末将收集的凋落物集中测定各种红树植物的凋落物量。同时,在每个测量无瓣海桑平均树高等指标的10 m × 5 m的样方中,按对角线随机选5个样点,挖取0—30 cm层的底泥,均匀混合,取1 kg左右的混合土壤作为测试样品。土壤粒径组成、盐分和有机质含量分别用比重计法、重量法和重铬酸钾法测定,土壤pH值用电位法,每个样品3次重复,各样林生境理化因子水平取全年的平均值。
1.3 大型底栖动物数据分析
1.3.1 物种数和物种优势度指数(Y)[9]
Y=Pi×fi
(1)
式中,Pi为研究区种i的个体数占总个体数的比例,fi为种i在研究区内各站位出现的频率,当Y>0.02时,该种为优势种。物种数和物种优势度指数计算的数据取各人工林4个站点的全年平均值。
1.3.2 栖息密度和生物量差异显著性分析
以季节和生境为因素,用Excel 2010对不同林分湿地中大型底栖动物群落的平均栖息密度和平均生物量进行无重复双因素方差分析。
1.3.3 多样性测度
采用Margalef物种丰富度指数(d)、Shannon-Wiener多样性指数(H′) 以及Pielou均匀度指数(J′)。
Margalef物种丰富度指数
d=(S-1)/log2N
(2)
Shannon-Wiener指数
(3)
Pielou均匀度指数
(4)
式中,S为总种类数,N为总个体数,Pi为第i种的个体数与样品中的总个数的比值。
1.3.4 动物群落结构的分析
大型底栖动物群落结构的多变量分析采用非参数多变量群落结构分析方法,对各站点的丰度数据先进行全年平均处理,为了减少机会种对群落结构的干扰,删除在总体中相对丰度 < 1%的种类,但保留其中任一站点相对丰度>3%的种类。根据各站点中累计占89%的大型底栖动物种类丰度(经平方根转化)为基础构建Bray-Curtis相似性矩阵,再进一步进行类平均法站点等级CLUSTER聚类和非参数多变量排序(MDS),同样,利用上述的Bray-Curtis相似性矩阵,用One-Way ANOSIM分析来检验不同生境之间群落结构的差异;用SIMPER分析鉴定对各生境动物群落划分起主要作用的种;利用BIOENV分析各生境中大型动物群落与对应环境因子的相关系数,分析和选择能够解释动物群落结构的最佳环境因子组合。用RELATE检验揭示大型底栖动物群落和环境(非)相似性矩阵之间相关性,然后利用PRIMER软件包中的图形分析和多变量分析等方法对群落结构进行研究[10]。
2 结果与分析
2.1 各站点环境理化因子水平
从表1可以看出,两个研究地均显示在无瓣海桑纯林下种植木榄幼苗,其平均苗高、凋落物量、凋落物量占群落凋落物总量百分比和成活率都高于红海榄,单因素方差分析显示下木层的这4个因子水平差异极显著(P< 0.01),这说明在无瓣海桑纯林下种植木榄的效果要优于红海榄。雷州市3种人工林上木层无瓣海桑的树高和凋落物量差异不显著(P> 0.05),郁闭度差异显著(P< 0.05)。珠海市3种人工林上木层无瓣海桑的树高、凋落物量和郁闭度差异均不显著(P> 0.05)。从表1还可以看出不管是雷州还是珠海,同一研究地3种类型人工林的土壤理化因子水平差异都不显著(P> 0.05)。
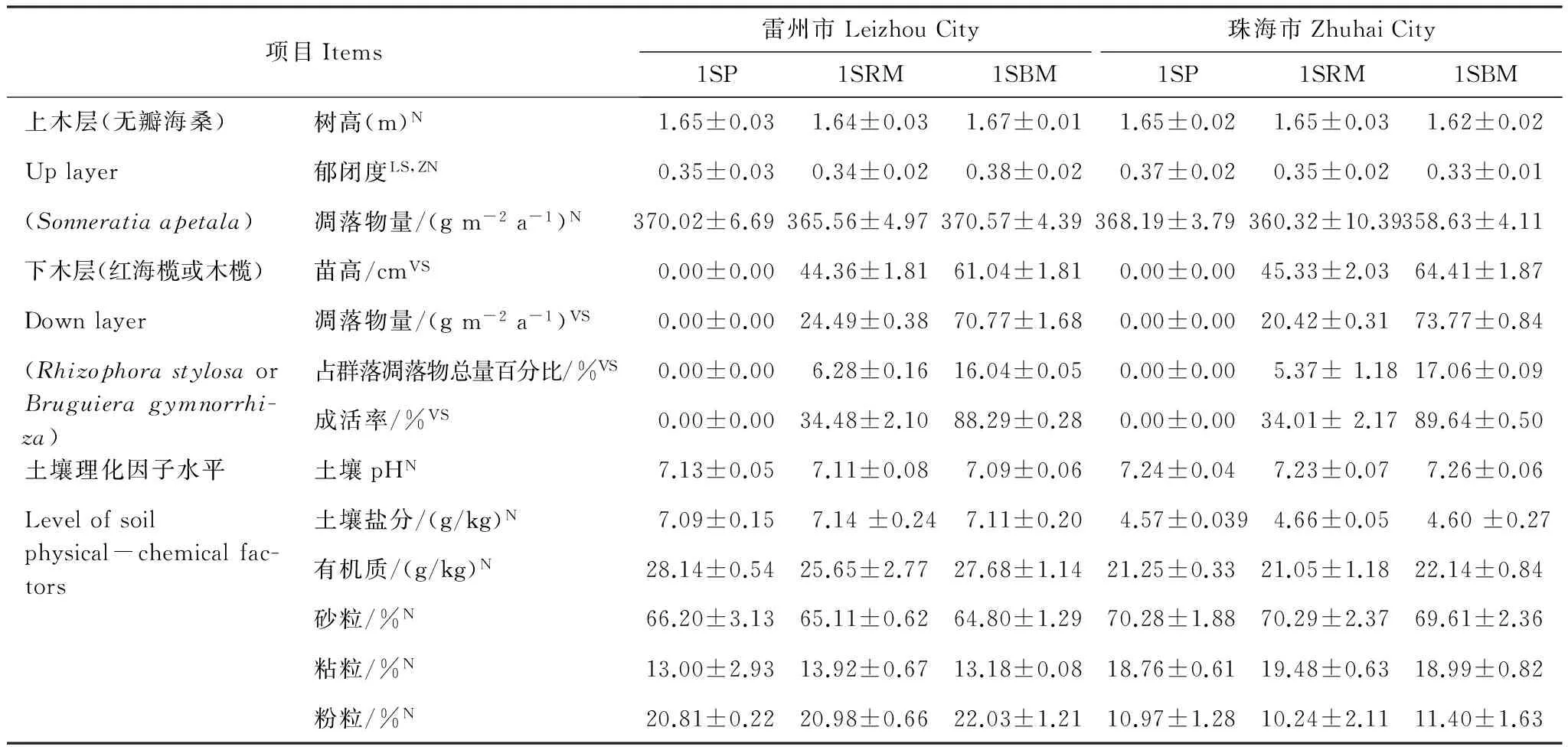
表1 两个研究地3种人工林的理化因子水平 (平均值±标准差)Table 1 Level of physical-chemical factors of the three kinds of plantations at the two research sites (Average ± S.D.)
2.2 两个研究地3种人工林大型底栖动物种类组成和优势种
调查发现,雷州市3种红树人工林的底栖动物以甲壳类居多,其次为腹足类;而珠海市3种红树人工林以腹足类居多,其次为甲壳类。无论雷州市还是珠海市,1年无瓣海桑+木榄混交林的大型底栖动物物种数明显高于1年无瓣海桑纯林和1年无瓣海桑+红海榄混交林。雷州市1年无瓣海桑+红海榄混交林物种数明显高于1年无瓣海桑纯林,而珠海市1年无瓣海桑+红海榄混交林物种数略低于1年无瓣海桑纯林(表2)。
从表3可见,同一地点不同类型人工林大型底栖动物的优势种存在差异,不同地点同一类型人工林大型底栖动物的优势种也存在差异。无论雷州市还是珠海市,两个地点均是1年无瓣海桑+木榄混交林优势种种数高于1年无瓣海桑纯林和1年无瓣海桑+红海榄混交林。

表2 两个研究地3种人工林大型底栖动物物种分布Table 2 Species distribution of macrofauna of the three kinds of plantations at the two research sites

表3 两个研究地3种人工林大型底栖动物优势种Table 3 Dominant species of macrofauna of the three kinds of plantations at the two research sites
2.3 两个研究地3种人工林大型底栖动物密度和生物量
两个研究地不同类型人工林大型底栖动物群落密度和生物量的季节变化见表4,以季节和人工林类型为因素的密度和生物量无重复双因素方差分析显示雷州市附城红树林区大型底栖动物密度在3种人工林间差异极显著(F=766.10,P< 0.01),季节间差异也显著(F=89.84,P< 0.01);生物量在3种人工林间差异显著(F=456.50,P< 0.01),季节间差异也显著(F=56.35,P< 0.01)。珠海市淇澳岛红树林区大型底栖动物密度在3种人工林间差异不显著(F=4.38,P> 0.05),季节间差异显著(F=9.66,P< 0.01);生物量在3种人工林间差异显著(F=9.41,P< 0.01),季节间差异也显著(F=8.12,P< 0.05)。两个研究地均显示混交林林地大型底栖动物生物量要比同林龄的无瓣海桑纯林高,尤其是1年无瓣海桑+木榄混交林底栖动物生物量最高。
2.4 两个研究地3种人工林大型底栖动物物种多样性
两个研究地3种类型人工林大型底栖动物群落物种多样性指数的变化见表5,以季节和人工林类型为因素的多样性指数无重复双因素方差分析显示大型底栖动物Shannon-Wiener多样性指数在雷州市附城红树林区3种人工林间差异极显著(F=1179.02,P< 0.01),季节间差异也显著(F=7.96,P< 0.05);Pielou均匀度指数不同人工林间差异极显著(F=311.47,P< 0.01),季节间差异不显著(F=2.42,P> 0.05);Margalef丰富度指数不同人工林间差异极显著(F=83.89,P< 0.01),季节间差异不显著(F=0.39,P> 0.05)。分析显示大型底栖动物Shannon-Wiener多样性指数在珠海市淇澳岛红树林区3种人工林间差异极显著(F=35.30,P< 0.01),季节间差异也显著(F=0.03,P< 0.05);Pielou均匀度指数不同人工林间差异极显著(F=17.54,P< 0.01),季节间差异不显著(F=0.10,P> 0.05);Margalef丰富度指数不同人工林间差异极显著(F=27.28,P< 0.01),季节间差异不显著(F=0.37,P> 0.05)。两个研究地点的3种人工林中,1年无瓣海桑+木榄混交林和1年无瓣海桑+红海榄混交林的Shannon-Wiener多样性指数、Margalef丰富度指数和Pielou均匀度指数均大于同林龄无瓣海桑纯林;而且均是1年无瓣海桑+木榄混交林的这3个物种多样性指数最大,可见,在1年无瓣海桑林下混交木榄可最大幅度地增加林地大型底栖动物的物种多样性。

表4 两个研究地点3种人工林大型底栖动物群落不同季节的密度和生物量Table 4 Density and biomass of the macrofauna communities in the three kinds of plantations across seasons in the two research sites
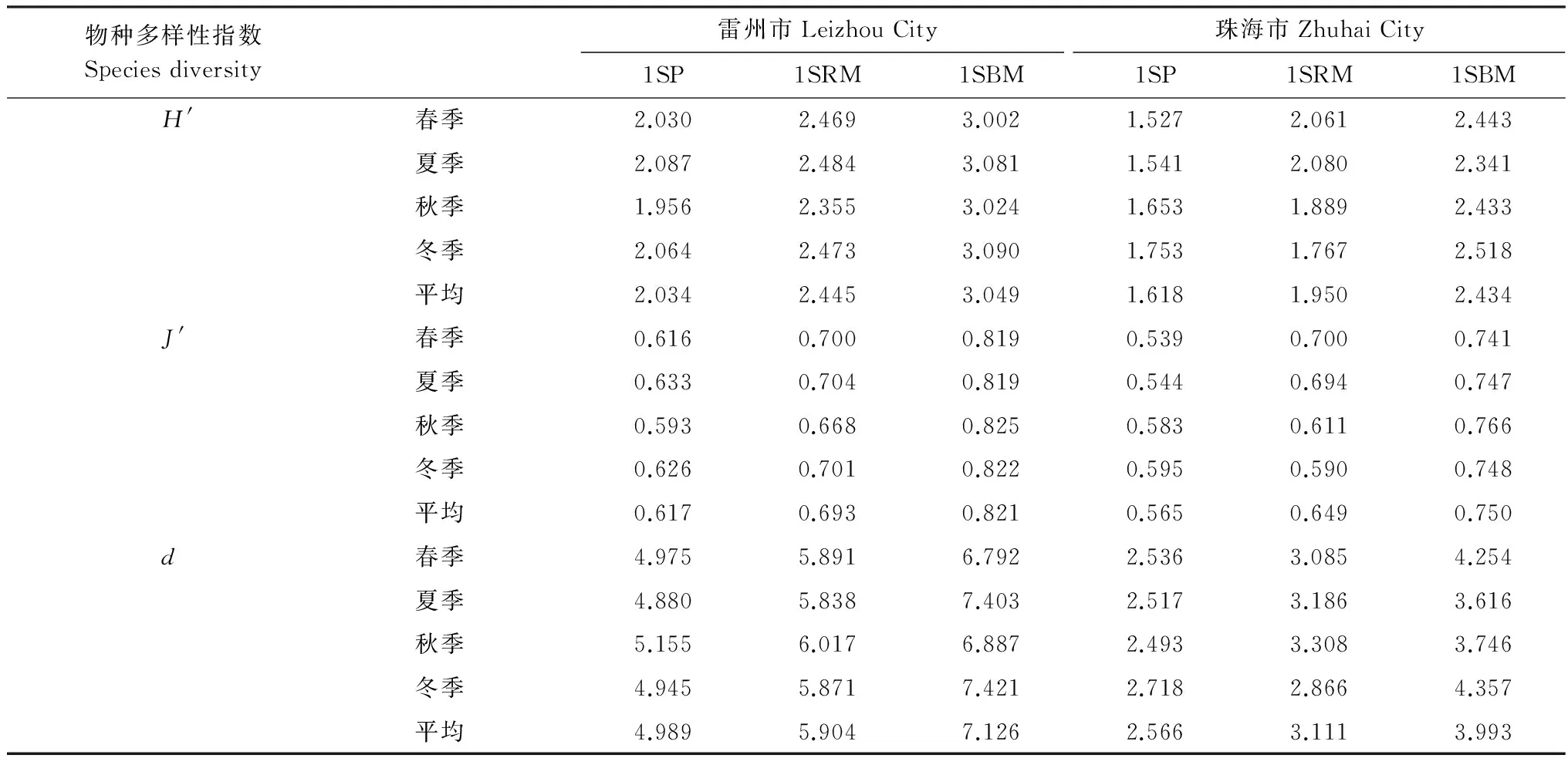
表5 两个研究地点3种人工林大型底栖动物群落不同季节的物种多样性指数Table 5 Species diversity indices of the macrofauna communities in the three kinds of plantations across seasons in the two research sites
2.5 两个研究地3种人工林大型底栖动物群落结构
图1中站点A1到C4取自雷州市附城镇沿海红树林区,D1到F4取自珠海市淇澳岛红树林自然保护区。聚类分析结果显示:两个研究地点各自的12个站点均分成了3个不同的组,可见,同一研究地点的3种人工林的大型底栖动物群落可以区分开来,说明不管是雷州市还是珠海市,在1年无瓣海桑林下混交红海榄或木榄均会改变大型底栖动物群落结构。

图1 各站点大型底栖动物群落系统聚类图Fig.1 Hierarchical cluster dendrogram of the macrofauna communities at the different sampling plots
两个研究地各站点排序分析结果如图2所示:雷州市的压力系数(stress)=0.01,珠海市的压力系数=0.07,两个研究地的压力系数均<0.1,说明两个结果均支持聚类分析结果。这进一步证明了在1年无瓣海桑林下混交红海榄或木榄可改变大型底栖动物群落的结构。
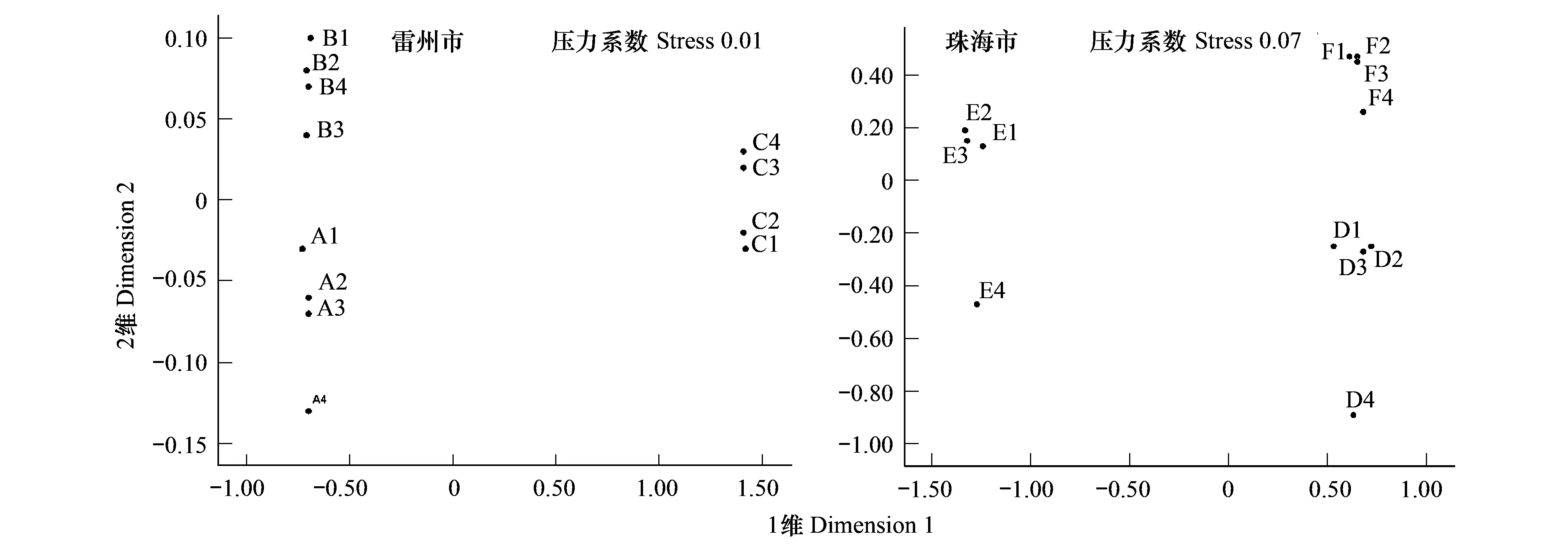
图2 各站点大型底栖动物群落的非参数多变量标序Fig.2 MDS ordination of the macrofauna communities at the different sampling plots in the Leizhou City or Zhuhai City
用One-way ANOSIM检验雷州市附城红树林区3种人工林间底栖动物群落结构的差异,结果显示差异极显著(GlobalR=0.97,P=0.001)。用One-Way ANOSIM分别检验每2种人工林间动物群落结构的差异性,结果显示:1年无瓣海桑纯林和1年无瓣海桑+红海榄混交林(GlobalR=0.87,P=0.029)、1年无瓣海桑纯林和1年无瓣海桑+木榄混交林(GlobalR=1.00,P=0.029)、1年无瓣海桑+红海榄混交林和1年无瓣海桑+木榄混交林(GlobalR=1.00,P=0.029)之间群落结构均有显著的差异。采用群落之间相似性百分比分析(SIMPER)来了解表征群落和造成群落差异的物种,结果表明造成1年无瓣海桑纯林和1年无瓣海桑+红海榄混交林间群落结构差异的主要种(Contribution rate>3%)为:扁平拟闭口蟹、黑口拟滨螺、琵琶拟沼螺、紫游螺、蝼姑虾、褶痕相守蟹、短角围沙蚕、宽身闭口蟹、等齿角沙蚕、瘤拟黑螺,它们对平均非度量系数(Bray-Curtis)不相似性的贡献分别为:9.09%、9.00%、4.15%、4.08%、3.79%、3.65%、3.33%、3.24%、3.04%、3.00%;造成1年无瓣海桑纯林和1年无瓣海桑+木榄混交林间动物群落结构差异的主要种(Contribution rate>3%)为:黑口拟滨螺、节织纹螺、悦目大眼蟹、厥目革囊星虫、琵琶拟沼螺、珠带拟蟹守螺、中国绿螂、胆形织纹螺、豆形短眼蟹,它们对平均非度量系数(Bray-Curtis)不相似性的贡献分别为:5.45%、5.12%、4.46%、4.15%、3.74%、3.31%、3.18%、3.17%、3.03%;造成1年无瓣海桑+红海榄混交林和1年无瓣海桑+木榄混交林间动物群落结构差异的主要种(Contribution rate>3%)为:节织纹螺、胆形织纹螺、扁平拟闭口蟹、宽身闭口蟹、珠带拟蟹守螺、悦目大眼蟹、红树蚬,它们对平均非度量系数(Bray-Curtis)不相似性的贡献分别为:4.62%、4.44%、3.80%、3.49%、3.43%、3.32%、3.04%。
同样,用One-way ANOSIM检验珠海市淇澳岛红树林区3种人工林间底栖动物群落结构的差异,结果显示差异极显著(GlobalR=0.944,P=0.001)。用One-Way ANOSIM分别检验每2种人工林间动物群落结构的差异性,结果显示:1年无瓣海桑纯林和1年无瓣海桑+红海榄混交林(GlobalR=1.00,P=0.029)、1年无瓣海桑纯林和1年无瓣海桑+木榄混交林(GlobalR=0.88,P=0.029)、1年无瓣海桑+红海榄混交林和1年无瓣海桑+木榄混交林(GlobalR=1.00,P=0.029)之间群落结构均有显著的差异。采用群落之间相似性百分比分析(SIMPER)来了解表征群落和造成群落差异的物种,结果表明造成1年无瓣海桑纯林和1年无瓣海桑+红海榄混交林间群落结构差异的主要种(Contribution rate>3%)为:悦目大眼蟹、双齿相守蟹、小头虫、光滑狭口螺、短角围沙蚕、德氏狭口螺、泥泞拟钉螺、无齿相守蟹、尖锥虫,它们对平均非度量系数(Bray-Curtis)不相似性的贡献分别为:9.43%、8.52%、7.21%、5.95%、5.89%、4.51%、4.48%、3.98%、3.13%;造成1年无瓣海桑纯林和1年无瓣海桑+木榄混交林间动物群落结构差异的主要种(Contribution rate>3%)为:光滑狭口螺、细螯原足虫、光滑河蓝蛤、德氏狭口螺、双齿相守蟹、褶痕相守蟹、日本刺沙蚕、长角涵螺,它们对平均非度量系数(Bray-Curtis)不相似性的贡献分别为:22.76%、7.43%、5.31%、5.06%、4.48%、4.00%、3.86%、3.75%;造成1年无瓣海桑+红海榄混交林和1年无瓣海桑+木榄混交林间动物群落结构差异的主要种(Contribution rate>3%)为:光滑狭口螺、悦目大眼蟹、小头虫、短角围沙蚕、双齿相守蟹、细螯原足虫、泥泞拟钉螺、无齿相守蟹、德氏狭口螺、尖锥虫,它们对平均非度量系数(Bray-Curtis)不相似性的贡献分别为:11.39%、10.51%、7.28%、5.97%、5.04%、4.66%、4.60%、4.13%、3.50%、3.12%。可见,两个研究地的3种人工林间底栖动物群落结构均存在差异。
2.6 两个研究地大型底栖动物同环境各理化因子的关系
利用BIOENV分析,找出与各站点大型底栖动物丰度最为匹配的环境理化因子,结果见表6,不管是雷州还是珠海,1年无瓣海桑纯林与1年无瓣海桑+红海榄混交林的动物丰度均与红海榄凋落物量、红海榄幼苗成活率、红海榄凋落物量占群落凋落物总量百分比相关;1年无瓣海桑纯林与1年无瓣海桑+木榄混交林的动物丰度均与木榄凋落物量、木榄凋落物量占群落凋落物总量百分比、木榄幼苗成活率相关;而1年无瓣海桑+红海榄混交林与1年无瓣海桑+木榄混交林的动物丰度均与木榄幼苗成活率、红海榄幼苗成活率相关;RELATE检验结果均为显著。

表6 大型底栖动物群落的丰度与环境理化因子的匹配关系Table 6 Multivariate correlation analysis of the relationship between the abundance of macrofauna communities and environmental parameters
3 讨论
3.1 无瓣海桑与乡土红树植物混交对林地大型底栖动物群落的影响
从本研究结果来看,不管是雷州市附城镇还是珠海市淇澳岛,3种人工林间大型底栖动物群落结构差异显著(结果2.5),说明在1年无瓣海桑纯林下种植红海榄或木榄这2种乡土红树植物,可改变林地大型底栖动物的群落结构。有研究证明红树林中的底栖动物优势物种分布与红树林植被有密切关系[11],从表3可以看出,两个研究地实验结果均显示无瓣海桑与这2种乡土红树植物混交后,林地大型底栖动物优势种明显发生变化,而且,纯林中物种优势度指数最大的数值,在混交林中明显下降,尤其是在1年无瓣海桑+木榄混交林中下降幅度最大。比如雷州市附城镇1年无瓣海桑纯林中,琵琶拟沼螺的物种优势度指数最大,高达0.54,而在1年无瓣海桑+红海榄混交林中其物种优势度指数下降为0.27,到了1年无瓣海桑+木榄混交林则下降为0.21;珠海市淇澳岛1年无瓣海桑纯林中,光滑狭口螺的物种优势度指数高达0.53,而在1年无瓣海桑+红海榄混交林中其物种优势度指数下降为0.42,到了1年无瓣海桑+木榄混交林物种优势度指数已经不是最大了,而是细螯原足虫,其物种优势度指数为0.18。可见,在1年无瓣海桑纯林下种植红海榄或木榄这2种乡土红树植物,在改变林地底栖动物群落结构的同时,还可降低林地最大物种优势度指数数值,这是混交林大型底栖动物群落Pielou均匀度指数大于同林龄无瓣海桑纯林的主要原因(表5)。
两个研究地各站点大型底栖动物群落系统聚类结构均显示按红树群落类型进行聚类。比如在雷州市附城镇,取样于1年无瓣海桑纯林的 A1—C4聚为一组,而取样于1年无瓣海桑+红海榄混交林的B1—B4、取样于1年无瓣海桑+木榄混交林的C1—C4也分别聚为一组。同样,取样于珠海市淇澳岛红树林区1年无瓣海桑纯林的 D1—D4、取样于1年无瓣海桑+红海榄混交林的E1—E4、取样于1年无瓣海桑+木榄混交林的F1—F4都分别聚为一组(图1)。两个研究地各站点大型底栖动物群落的非参数多变量标序结果也显示,取样于不同人工林的站点可辨别开来,而且其压力系数stress小于 0.1,说明标序结果支持聚类分析结果。这进一步证明了在1年无瓣海桑林下混交红海榄或木榄可改变大型底栖动物群落的结构(图2)。
影响大型底栖动物分布的环境因素包括海水盐度、潮位和土壤特性等,但在小范围区域,林内动物的分布更多地与红树林植被特性和潮位有关[12]。从表1可以看出,每个研究地的3种人工林间土壤理化因子差异不显著,并且林地的上层木均为1年生的无瓣海桑,这说明大型底栖动物群落结构与红海榄或木榄这些乡土树种的种植密切相关。有研究发现在泰国Ronang红树林中,相手蟹属蟹类的分布与红树林土壤类型没有密切的相关性[13],而与红树林植被的类型则有明显的关系[14]。根据本研究结果,利用BIOENV分析找出与1年无瓣海桑纯林和1年无瓣海桑+红海榄混交林中大型底栖动物丰度最为匹配的环境理化因子,两个研究地均包含红海榄凋落物量、红海榄凋落物量占群落凋落物总量百分比这2个因子;同样分析1年无瓣海桑纯林与1年无瓣海桑+木榄混交林中大型底栖动物丰度最为匹配的环境理化因子中,两个研究地均包含木榄凋落物量、木榄凋落物量占群落凋落物总量百分比这2个因子;RELATE检验结果也均为显著(表6)。这进一步说明大型底栖动物分布与红海榄或木榄这些乡土树种的凋落物量密切相关。这也进一步证实了红树种植种类对红树林底栖动物的多样性和分布的重要作用[3- 4,14- 19]。实际上,红树林除了为底栖动物提供栖息繁育场所外[20],还有一个重要的作用,就是直接或间接为其提供食物[21],而不同动物对不同红树植物残体尤其是落叶啃食作用可能不同,即具有选择性[18]。在香港米埔红树林的调查表明,两个相距很近的秋茄林和白骨壤林内相手蟹的种类和数量有很大差异[14]。这可能是由于不同的蟹对不同红树植物凋落腐解叶在啃食上有不同的“选择性”。最近国外的研究表明,某些蟹类和螺类对红树植物叶片的取食具有很强的选择性,方蟹科种类Aratuspisonni对3种红树植物即大红树(Rhizophoramangle)、亮叶白骨壤(Avicenniagerminans)和假红树(Lagunculariaracemosa)叶片啃食的偏爱程度也不同[22]。螺类通过嗅觉感受到残缺叶片所散发的气味而摄食红树植物,不同种类和状态的叶片因散发的气味的差异而被螺类选择性摄食[23]。国内李旭林等通过设置室内模拟饲喂实验,研究了华南沿海红树林大型底栖动物的常见种无齿相手蟹(Sesarmadehaani)和双齿相手蟹(S.bidens)对外来红树植物无瓣海桑和乡土红树植物秋茄、桐花树凋落叶片的取食特性。结果表明,两种相手蟹种间的取食特性差异不显著,但对不同树种的取食上却存在显著差异,其原因是不同红树植物不同状态的叶片在营养水平(如C/N比)和单宁含量上有差异[24]。从本研究结果来看,在无瓣海桑纯林下种植红海榄或木榄这些乡土树种,推测是增加了乡土红树植物凋落物等“食物源”,促进了一些“偏好”乡土红树植物凋落物的本地大型底栖动物的迁入、繁育和生长,改变了林地底栖动物优势种,以及提高了底栖动物生物量和物种多样性。
3.2 在无瓣海桑人工林下混交红海榄或木榄的效果比较
两个研究地的研究结果均显示在无瓣海桑林下种植木榄的效果明显优于红海榄,表现在木榄的平均苗高、凋落物量、凋落物量占群落凋落物总量百分比和幼苗成活率均高于红海榄(表1)。而且,1年无瓣海桑+木榄人工林中大型底栖动物生物量和物种多样性明显高于1年无瓣海桑+红海榄人工林(表5)。利用BIOENV分析,找出与1年无瓣海桑+红海榄混交林和1年无瓣海桑+木榄混交林中大型底栖动物丰度最为匹配的环境理化因子中,两个研究地均包含木榄幼苗成活率、红海榄幼苗成活率这两个因子,而幼苗成活率高低直接关系到凋落物量的多少,这说明在1年无瓣海桑林下种植木榄的效果要优于红海榄,推测是由于木榄幼苗成活率明显高于红海榄,从而为本地大型底栖动物提供了更多在营养成份、粗纤维和单宁含量以及 C/N 比等性质方面都“适合”的凋落物“食物源”[24]。至于红海榄幼苗成活率低,可能与红海榄不耐荫有关[25];还可能与无瓣海桑对红海榄幼苗的化感作用有关。李玫等以外来种无瓣海桑为供体,通过室内栽培实验探讨了无瓣海桑各器官水浸液的不同浓度对我国4个乡土红树植物的化感作用,结果表明无瓣海桑对各乡土红树植物均存在化感作用,所有水浸液均表现出高浓度下抑制幼苗生长,而且对不同受体红树植物的幼苗生长抑制强度不同[26]。是否无瓣海桑对红海榄化感作用强于木榄,这种化感作用强度是否能导致红海榄无法与无瓣海桑混交及长期效应研究都有待深入研究。
[1] 廖宝文, 李玫, 郑松发, 陈玉军, 郑馨仁. 外来种无瓣海桑种内、种间竞争关系研究. 林业科学研究, 2003, 16(4): 418- 422.
[2] 彭友贵, 徐正春, 刘敏超. 外来红树植物无瓣海桑引种及其生态影响. 生态学报, 2012, 32(7): 2259- 2270.
[3] Tang Y J, Fang Z Q, Chen K, Zhang Z W, Zhong Y T, An D, Yang X B, Liao B W. Ecological influence of exotic plants ofSonneratiaapetalaon understory macrofauna. Acta Oceanologica Sinica, 2012, 31(5): 115- 125.
[4] 唐以杰, 方展强, 钟燕婷, 张再旺, 陈康, 安东, 杨雄邦, 廖宝文. 不同生态恢复阶段无瓣海桑人工林湿地中大型底栖动物群落的演替. 生态学报, 2012, 32(10): 3160- 3169.
[5] Ashton E C. Mangrove sesarmid crab feeding experiments inPeninsularmalaysia. Journal of Experimental and Marine Biology and Ecology, 2002, 273: 97- 119.
[6] Lee S Y.Tropical mangrove ecology: physical and biotic factors influencing ecosystem structure and function.Australian Journal of Ecology, 1999, 24(4): 355- 366.
[7] 许方宏, 吴晓东, 陈粤超, 潘伟生, 刘一鸣, 张苇. 雷州半岛前沿恶劣潮间滩涂红树林造林树种的选择. 防护林科技, 2013, (6): 7- 9.
[8] 管伟, 廖宝文, 邱凤英, 谷兴华, 韩静, 田广红, 杨雄邦. 利用无瓣海桑控制入侵种互花米草的初步研究. 林业科学研究, 2009, 22(4): 603- 607.
[9] 廖一波, 寿鹿, 曾江宁, 高爱根, 江志兵. 象山港不同养殖类型海域大型底栖动物群落比较研究. 生态学报, 2011, 31(3): 646- 653.
[10] Clarke K R, Gorley R N. PRIMER v5: User Manual/Tutorial. Plymouth: PRIMER-E Ltd., 2001: 91- 91.
[11] Nobbs M. Effects of vegetation differ among three species of fiddler crabs (Ucaspp.). Journal of Experimental Marine Biology and Ecology, 2003, 284(1- 2): 41- 50.
[12] 陈光程, 余丹, 叶勇, 陈彬. 红树林植被对大型底栖动物群落的影响. 生态学报, 2013, 33(2): 327- 336.
[13] Macnae W. A general account of the fauna and flora of mangrove swamps and forests in the Indo-West-Pacific region. Advance in Marine Biology, 1969, 6: 73-103, 104a-104a, 104b-104b, 105- 270.
[14] Lee C Y, Kwok P W. The importance of mangrove species association to the population biology of sesarmine crabsParasesarmaaffinisandPerisesarmabidens. Wetlands Ecology and Management, 2002, 10(3): 215- 226.
[15] 唐以杰, 余世孝. 广东湛江红树林保护区大型底栖动物群落的空间分带. 生态学报, 2007, 27(5): 1703- 1714.
[16] Lee S Y. The ecological role of grapsid crabs in mangrove ecosystems: implications for conservation. Marine and Freshwater Research, 1998, 49(4): 335- 343.
[17] Roach A C, Lim R P. Variation in the population dynamics of the intertidal pulmonate gastropodSalinatorsolidaMartens (Gastropoda: Amphibolidae) at Towra Point, NSW, Australia. Wetlands Ecology and Management, 2000, 8(1): 53- 69.
[18] 叶勇, 翁劲, 卢昌义, 陈光程. 红树林生物多样性恢复. 生态学报, 2006, 26(4): 1243- 1250.
[19] 魏德重, 项长友, 鲍毅新, 李良峰, 章书声. 红树林种植对大型底栖动物群落结构及功能群的影响. 浙江师范大学学报: 自然科学版, 2012, 35(2): 195- 202.
[20] Robertson A I, Duke N C. Mangroves as nursery sites: comparisons of the abundance of fish and crustaceans in the mangroves and other nearshore habitats in tropical Australia. Marine Biology, 1987, 96(2): 193- 205.
[21] Lee S Y. Potential trophic importance of the faecal material of the mangrove Sesarmine crabSesarmamessa. Marine Ecology Progress Series, 1997, 159: 275- 284.
[22] Erickson A A, Saltis M, Bell S S, Dawes C J. Herbivore feeding preferences as measured by leaf damage and stomatal ingestion: a mangrove crab example. Journal of Experimental and Marine Biology and Ecology, 2003, 289(1): 123- 138.
[23] Fratini S, Cannicci S, Vannini M. Feeding clusters and olfaction in the mangrove snailTerebraliapalustris(Linnaeus) (Potamididae: Gastropoda). Journal of Experimental and Marine Biology and Ecology, 2001, 261(2): 173- 183.
[24] 李旭林, 彭逸生, 万如, 伍卡兰, 陈桂珠. 两种相手蟹对不同红树植物叶片取食的偏好性. 生态学报, 2010, 30(14): 3752- 3759.
[25] 曾雯珺, 廖宝文, 陈先仁, 粟娟, 马苏全, 管伟. 无瓣海桑与三种乡土红树植物混交的生态效应. 生态科学, 2008, 27(1): 31- 37.
[26] 李玫, 廖宝文, 郑松发, 陈玉军. 外来种无瓣海桑化感作用研究初报. 生态科学, 2002, 21(3): 197- 200.
Effects of mixed plantations ofSonneratiaapetalaand indigenous mangrove species on understory macrofauna
TANG Yijie1, FANG Zhanqiang2,*, HE Qing1, WU Yingmin1, LU Di1, LI Yanni1, TAN Lijun1, YANG Xuebin1, CHEN Siming1
1DepartmentofBiology,GuangdongUniversityofEducation,Guangzhou510303,China2CollegeofLifeSciences,SouthChinaNormalUniversity,KeyLaboratoryofEcologyandEnvironmentalScienceinGuangdongHigherEducation,Guangzhou510631,China
Sonneratiaapetalawas introduced to China′s Hainan Island from Bangladesh in 1985. In recent years, because of its adaptability and rapid growth,S.apetalahas become the most important species to ensure the forestation of mangroves that are imported to the coastal and intertidal regions of South China. This study was conducted to explore the ecological responses of understory macrofauna communities during the transformation of a pureS.apetalaplantation and the major environmental factors affecting them. Two pure plantations of 1-year-oldS.apetalawere chosen as the study sites: one was at Zhanjiang Island Mangrove Nature Reserve in Leizhou, and the other was at Qi′ao Island Mangrove Nature Reserve in Zhuhai, Guangdong Province, China. Indigenous mangrove seedlings ofRhizophorastylosaorBruguieragymnorrhizawere mixed withS.apetalaby underwood planting. The macrofauna communities of the transformed 1-year-oldS.apetala+R.stylosaand 1-year-oldS.apetala+B.gymnorrhizamixed plantations were compared with those of a similarly aged pureS.apetalaplantation. The results showed differences in the dominant species among the macrofauna communities in the 1-year-old pureS.apetalaplantation and the 1-year-oldS.apetala+R.stylosaand 1-year-oldS.apetala+B.gymnorrhizamixed plantations. The results of a one-way analysis of similarity, hierarchical clustering, and nonmetric multidimensional scaling all showed significant structural differences among the macrofauna communities of the pure plantations and mixed plantations, which had similar forest ages. In addition, the results showed that transforming pureS.apetalaplantations by underwood planting with seedlings ofR.stylosaorB.gymnorrhizamay improve the biomass and species diversity of the understory macrofauna. BIOENV analysis showed that macrofauna distribution was closely related to the amount of indigenous mangrove plant litter ofR.stylosaorB.gymnorrhiza, which further confirmed that underwood planting with indigenous mangrove species played an important role in the distribution and species diversity of the understory macrofauna. Because the levels of the physicochemical factors in the soil in the three forest types were not significantly different and the upper canopy of these forests was entirely comprised ofS.apetala, it can be speculated that underwood planting withR.stylosaorB.gymnorrhizaincreased the understory indigenous mangrove plant litter, the nutrient levels (such as the C/N ratio), and the tannin content that may be adaptive or preferred by indigenous macrofauna. Furthermore, some mobile mollusks and crustaceans move to mangrove habitats that are more suitable for survival, leading to a rise in the biomass and species diversity of understory macrofauna in mixed plantations. However, experimental results from the two research sites showed that the effect of underwood planting in pureS.apetalaplantations withB.gymnorrhizawas superior to that withR.stylosabecause the average seedling height, litter production, percentage of litter production accounting for the communities′ total litter production, and the survival rate of seedlings were all greater for underwood planting withB.gymnorrhizathan withR.stylosa. This also resulted in a higher biomass increase and species diversity of macrofauna in the underwood planting withB.gymnorrhizathan withR.stylosa. This experiment was conducted 3 months after underwood planting withR.stylosaorB.gymnorrhizain the pureS.apetalaplantations. Since the total research period was only 1 year, this study only explored the short-term effects of the experiment; therefore, future studies on its long-term effects are required.
Sonneratiaapetala;Bruguieragymnorrhiza;Rhizophorastylosa;macrofauna;species diversity
广东省科技计划项目(NO.2009B030600006); 国家科技支撑计划项目(NO.2009BADB2B0401-02); 国家星火计划(2013GA780019); 广东第二师范学院大学生创新创业训练计划项目(1427813116)(142781429); 广东第二师范学院校级科研项目(2013yjxm03)
2014- 03- 23;
日期:2015- 04- 20
10.5846/stxb201403230515
*通讯作者Corresponding author.E-mail: fangzhq@scnu.edu.cn
唐以杰,方展强,何清,吴映明,陆棣,李燕妮,谭莉君,杨学彬,陈思敏.无瓣海桑与乡土红树植物混交对林地大型底栖动物的影响.生态学报,2015,35(22):7355- 7366.
Tang Y J, Fang Z Q, He Q, Wu Y M, Lu D, Li Y N, Tan L J, Yang X B, Chen S M.Effects of mixed plantations ofSonneratiaapetalaand indigenous mangrove species on understory macrofauna.Acta Ecologica Sinica,2015,35(22):7355- 7366.

