1-氨丙基-3-甲基咪唑溴水溶液中二氧化碳水合物的生成特性
毕 崟,李 松,郭开华
(中山大学-BP液化天然气教育培训与研究中心,中山大学 工学院,广东 广州 510006)
1-氨丙基-3-甲基咪唑溴水溶液中二氧化碳水合物的生成特性
毕崟,李松,郭开华
(中山大学-BP液化天然气教育培训与研究中心,中山大学工学院,广东广州510006)
在可视化高压低温测试系统中,研究了吸收CO2的功能型离子液体1-氨丙基-3-甲基咪唑溴([APMim][Br])水溶液中CO2水合物的生成特性,在273.15~283.15 K、1.0~4.5 MPa下,获得了不同含量的[APMim][Br]水溶液中CO2水合物-[APMim][Br]水溶液-CO2气体三相和CO2水合物-[APMim][Br]水溶液-CO2气体-液态CO2四相相平衡数据。实验结果表明,当[APMim][Br]水溶液中[APMim][Br]含量达35%(w)时,CO2水合物仍可生成,形成[APMim][Br]吸收CO2和气体水合物固定CO2的双重体系。与纯水相比,[APMim][Br]水溶液中CO2水合物生成的温度较低、生成压力较高,说明[APMim][Br]对CO2水合物的生成有一定抑制作用。基于离子液体水溶液缔合特性的活度系数模型理论,对[APMim][Br]水溶液中CO2水合物的相平衡特性进行了计算,实验值和计算值有很好的一致性,平均相对误差为1.6%。
离子液体;二氧化碳水合物;相平衡
能源和环境的挑战日益严峻,采取有效措施控制CO2排放,减缓温室效应势在必行。研究开发新的CO2捕集和分离技术及相关理论已成为当今的热点之一,有效的CO2捕获和储存技术尤为重要。离子液体在催化、提取、分离和吸收等过程中有广泛的应用前景[1-2]。经过结构设计的功能型离子液体对CO2有很强的吸收潜力[3-6]。Bates等[7]将—NH2引入到离子液体的阳离子中,合成了1-氨丙烯基-3-丁基咪唑四氟硼酸盐([NH2p-Bim]・[BF4]),1 mol[NH2p-Bim][BF4]可吸收近0.5 mol CO2。Zhang等[8]在离子液体的阴阳离子中同时引入—NH2,1 mol离子液体可吸收近1 mol CO2。阳涛等[9]发现,使用功能型离子液体1-氨丙基-3-甲基咪唑溴([APMim][Br])时,水含量的增加能大幅提高CO2吸收率。另一种降低大气中CO2含量的方案是水合物封存法。Ohgaki等[10]提出了用CO2置换海底水合物矿层中的甲烷,同时捕获CO2生产甲烷的方法。McGrail等[11]研究了将CO2-水混合微乳液注入天然气水合物层开采甲烷的方法。毕崟等[12]研究了CO2-CH4混合水合物的较高四相状态并确定了它的范围。在水中添加对CO2选择性吸收的离子液体,以水溶液形式吸收CO2的同时可生成水合物。如氨丙基功能型离子液体水溶液,在合适的温度压力下可大量溶入CO2并生成水合物,双重捕获能强化整个体系的CO2捕获效果。
本工作研究了[APMim][Br]水溶液吸收CO2同时生成水合物的相平衡特性。利用可视高压反应釜测试CO2水合物-[APMim][Br]水溶液-CO2气体(H-S-V)共存的三相平衡状态和CO2水合物-[APMim][Br]水溶液-CO2气体-液态CO2(H-SV-L)共存的四相平衡状态,揭示了[APMim][Br]水溶液体系中的气体水合物生成特性,获得相平衡温度和压力条件以及可生成水合物的区域,验证了水合物-离子液体体系对CO2双重捕获的可行性。
1 实验部分
1.1实验材料
[APMim][Br]:中国科学院兰州化学物理研究所提供,纯度99.5%(w);CO2:广州气体厂,纯度99.99%(χ);去离子水:实验室制备,电导率小于1 μs/cm。在氮气保护下,采用山东海诺仪器公司SFY-3A型卡尔费休滴定仪测定[APMim][Br]中残余的水量为(4 540±300)×10-6(w)。
1.2实验装置
实验装置的示意图见图1。装置的主要部分是一个体积为59.8 mL的透明石英玻璃高压反应釜,底部有一个由磁力搅拌器驱动的搅拌子用来促进反应的进行。反应釜顶部接有一个滴定管,用来向反应釜中加入去离子水。反应釜安置于一个透明玻璃水槽中,由高精度水浴控制反应釜的温度。整个系统装在一个可控温的空气箱内。水浴、空气浴和反应釜的温度都由温度传感器测量,以确保得到稳定的相平衡温度。测试系统还包括连接阀、管道和一个真空泵。测试系统的压力由高精度压力传感器测得,测量不确定度小于0.01 MPa。测量相平衡温度的传感器(Pt 100)经过校准,不确定度为 ±0.01 K。实验中的温度和压力数据通过计算机数据采集系统获得。
CO2定量加注系统由活塞容器和高精度手泵组成。通过手泵向活塞容器中注入水将活塞向上推来改变活塞容器的容积。活塞容器的可移动容积为200 mL,手泵精度为0.01 mL。反应釜顶部20 mL 的玻璃滴定管的读取精度为0.01 mL。反应釜内[APMim][Br]水溶液中水和[APMim][Br]的初始质量由电子天平测得,量程0~220 g,精度±0.1 mg。

图1 实验装置的示意图Fig.1 Schematic diagram of experimental installation.
1.3实验步骤
首先根据预设的[APMim][Br]水溶液中[APMim][Br]的含量,用高精度电子天平称量一定质量的[APMim][Br],然后向[APMim][Br]中加入一定质量的去离子水并称量体系的总质量,两者混合均匀后将其加入到反应釜中,并将反应釜的法兰拧紧密封。[APMim][Br]水溶液封入反应釜后将整个系统抽真空,其间可抽走的水量标定为(0.03±0.001)g。反应釜中[APMim][Br]水溶液的水含量是加入水与[APMim][Br]中残留水量之和再扣除抽走水量,由此确定溶液中水和[APMim][Br]的含量,其不确定度小于±0.04%(w)。开动磁力搅拌器使溶液进一步混合均匀,并设定水浴和空气浴的温度,使反应釜保持恒定温度。用手泵将CO2气体注入反应釜,使溶液吸收CO2并逐步达到稳定,在高出预计压力0.5 MPa左右保持溶液吸收CO2并形成水合物。随着CO2水合物在[APMim][Br]水溶液中的生成,反应釜内的压力会下降。待CO2水合物充分生成,反应釜内即为是H-S-V三相共存状态。CO2在[APMim][Br]水溶液中生成水合物的形态见图2。

图2 CO2在[APMim][Br]水溶液中生成水合物的形态Fig.2 Morphology of the CO2hydrate formation in 1-aminopropyl-3-methyl-imidazolium bromide([APMim][Br])aqueous solution.IL:ionic liquid.
因CO2水合物的生成消耗了溶液中的水,使溶液中[APMim][Br]的含量比初始含量高。要得到初始含量下的三相平衡点,就要使溶液中水合物的量尽可能地少。在水合物大量生成后,通过移动活塞手泵来逐渐降低反应釜内的压力,每次降幅小于0.05 MPa,使得生成的水合物逐步融化分解,直到只剩下少许水合物没有融化。在此温度压力下,维持稳定存在少许水合物达2 h以上,并继续降压,每次降低0.05 MPa左右的压力保持0.5 h,直到水合物完全分解。到水合物完全分解时则认为此次降低0.05 MPa前的压力就是该初始含量下的一个H-S-V三相平衡点。完成一个三相点测试后,对系统再次注入CO2,加压使水合物再次充分生成,然后升高系统温度到下一个测试点,用同样的方法获得下一个温度下的三相平衡点。这样就得到了同一初始含量下一系列三相平衡点,并构成一条三相平衡线。
当三相状态的温度和压力升至CO2的气液相平衡温度压力时,液态CO2会与其他三相共存,这就是四相平衡状态。为了精确获得水合物的四相平衡点,要在水合物生成的状态下,将反应釜的温度和压力逐步升到预计的四相平衡温度和压力附近,稳定0.5 h后再缓慢地每次将温度升高0.01 K来使水合物融化,并出现液态CO2。该状态稳定1 h以上,即可确定为H-S-V-L四相平衡点。四相平衡点也是H-S-V三相线和CO2气液两相线的交点。
完成一个水溶液含量下CO2气体水合物生成的三相平衡测试后,重新配置下一个含量的[APMim][Br]水溶液,重复以上过程进行气体水合物生成和三相平衡以及四相平衡点的测试。
2 结果与讨论
2.1实验结果
实验在273.15~283.15 K和1.0~4.5 MPa范围内进行,共测得[APMim][Br]含量(w)为5.07%,9.64%,15.2%,24.85%,35.27%的5个[APMim][Br]水溶液中的三相平衡线和四相平衡点的数据。当[APMim][Br]含量达40%(w)时,在273.15 K以上的溶液中不能生成CO2水合物。实验测试数据见表1,[APMim][Br]水溶液中CO2水合物的H-S-V三相和H-S-V-L四相相平衡特性见图3。
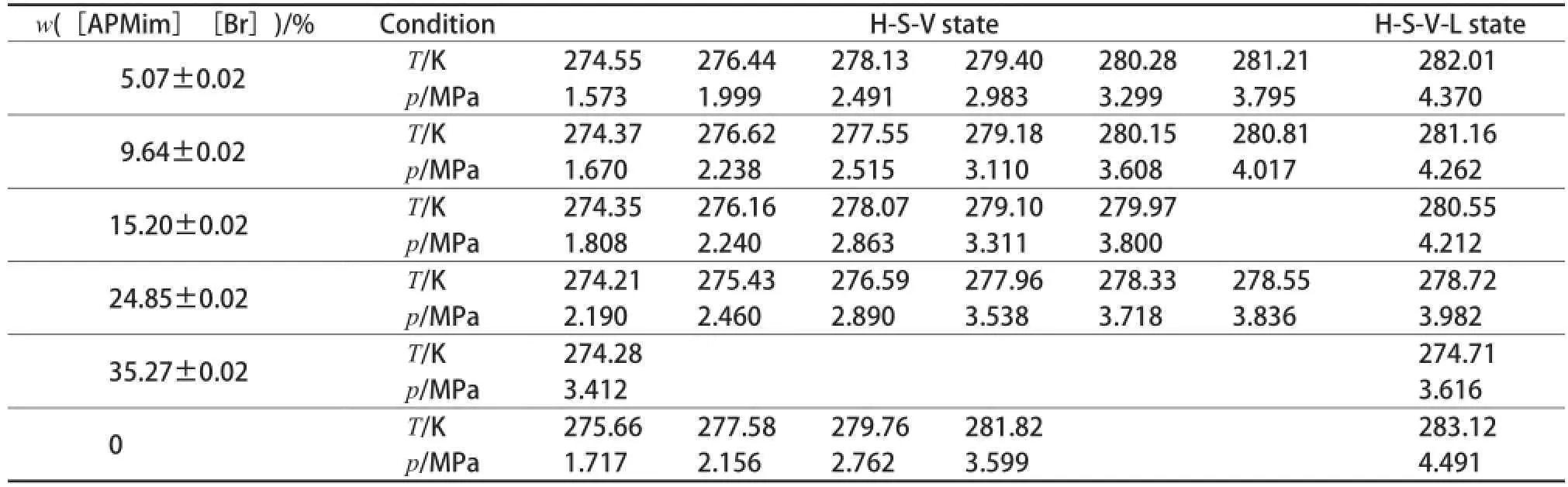
表1 [APMim][Br]水溶液中CO2水合物的相平衡数据Table 1 Phase equilibrium data of the CO2hydrate in[APMim][Br]aqueous solutions
2.2[APMim][Br]水溶液中CO2水合物相平衡特性的计算
CO2的气液相平衡特性及气相逸度采用Peng-Robinson方程预测。CO2水合物的化学势采用经过Du 等[13]优化的Holder-John模型[14]估算。CO2水合物相平衡的计算采用van der Waals-Platteeuw统计热力学模型[15]。其中,水合物结构中水的化学势的偏差可表示为:
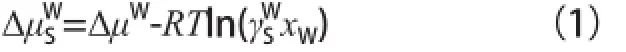
式中,μW表示水的化学势,J/mol,γW表示活度系数;下标“s”代表在离子液体水溶液中;χW表示离子液体水溶液中水的摩尔分数;R表示气体常数;T表示温度,K。溶液中水的活度系数γW可由文献[16-17]的亲水性离子液体水溶液的缔合特性活度系数模型和对[APMim][Br]水溶液的测试结果来确定。

式中,β表示离子液体聚合效应的惰性因子[16];A12表示水溶液中离子液体和水分子间的相互作用系数。考虑到溶解于水溶液中的CO2对水活度的影响,A12与文献[17]获得的数值应有所不同,可通过实验数据拟合得到。根据上述模型计算得到的相平衡结果如图3中的实线所示。由图3可见,实验值和计算值有很好的一致性,平均相对误差为1.6%。
图3同时给出了在纯水中生成CO2水合物的三相平衡线以及不同含量的[APMim][Br]水溶液中形成CO2水合物的三相平衡线。由图3可看出,在273.15 K以上,CO2水合物在[APMim][Br]水溶液中的生成区域是在CO2气液相平衡线和在纯水中生成CO2水合物的三相平衡线之间。在此区域中,溶液中[APMim][Br]含量越高,水合物生成所要求的温度越低、压力越高。当[APMim][Br]含量大于35%(w)时,水合物的生成条件已接近极限,在273.15 K以上难以形成。由于随[APMim][Br]含量的增加,水合物的H-S-V三相线高移,相同温度下水合物的生成压力升高,说明[APMim][Br]含量增加对水合物生成的抑制作用加强。这是由于[APMim][Br]的强亲水性使得溶液中水的活度显著降低,[APMim][Br]水溶液与水合物争夺水分子,使得水分子形成水合物“笼子”的难度增大,要在更高的压力或更低的温度下才能形成稳定的包含CO2分子的笼状结构。实验溶液体系中[APMim][Br]含量高达35%(w)时,水合物仍可生成,这说明在[APMim][Br]含量不高于35%(w)的水溶液中,在适当的温度压力条件下,[APMim][Br]和水合物可同时捕集CO2,形成[APMim][Br]吸收CO2和气体水合物固定CO2的双重体系。

图3 [APMim][Br]水溶液中CO2水合物的H-S-V三相和H-S-V-L四相相平衡特性Fig.3 p-T diagram of H-S-V phase equilibrium and upper-quadruple H-S-V-L phase equilibrium for the CO2hydrates in the[APMim][Br]aqueous solutions.
3 结论
1)当[APMim][Br]水溶液中[APMim][Br]含量达35%(w)时,CO2水合物仍可生成,形成[APMim][Br]吸收CO2和气体水合物固定CO2的双重体系。与纯水相比,[APMim][Br]水溶液对CO2水合物的生成有一定抑制作用。当[APMim][Br]含量大于35%(w)时,CO2水合物的生成条件已接近极限,在273.15 K以上难以形成;当低于该含量时,可在适当的温度和压力下生成CO2水合物,从而确定了[APMim][Br]水溶液中CO2水合物生成区域的边界。
2)结合离子液体水溶液的缔合特性活度系数模型和气体水合物相平衡模型理论,可较好地预测[APMim][Br]水溶液中CO2水合物的相平衡特性,通过对实验数据进行拟合,获得了满意的计算结果,与测试值相比,平均相对误差为1.6%。
[1]Seddon K R,Stark A,Torres M J.Influence of Chloride,Water,and Organic Solvents on the Physical Properties of Ionic Liquids[J].Pure Appl Chem,2000,72(12):2275-2287.
[2]Marsh K N,Boxall J A,Lichtenthaler R.Room Temperature Ionic Liquids and Their Mixtures:A Review[J].Fluid PhaseEquilib,2004,219(1):93-98.
[3]Karadas F,Atilhan M,Aparicio S.Review on the Use of Ionic Liquids(ILs)as Alternative Fluids for CO2Capture and Natural Gas Sweetening[J].Energy Fuels,2010,24(11):5817-5828.
[4]Zhang Suojiang,Chen Yuhan,Li Fuwei,et al.Fixation and Conversion of CO2Using Ionic Liquids[J].Catal Today,2006,115(1/4):61-69.
[5]Guo Liying,Shi Tiejun,Li Zhong,et al.Solubility of Two Kinds of Imidazolium Ionic Liquids for Fir Powder[J].J Chem Eng,2008,59(5):1299-1304.
[6]Blanchard L A,Hancu D,Beckman E J,et al.Green Process Using Ionic Liquids and CO2[J].Nature,1999,399(6734):28-29.
[7]Bates E D,Maton R D,Ntai I,et al.CO2Capture by a Task-Specific Ionic Liquid[J].J Am Chem Soc,2002,124(6):926-927.
[8]Zhang Yanqiang,Zhang Suojiang,Lu Xingmei,et al.Dual Amino-Functionalized Phosphonium Ionic Liquids for CO2Capture[J].J Chem Eur,2009,15(12):3003-3011.
[9]阳涛,毕崟,郭开华.1-氨丙基-3-甲基咪唑溴功能型离子液体对CO2的吸收性能[J].化工学报,2012,63(10):3152-3157.
[10]Ohgaki K,Takano K,Sangawa H,et al.Methane Exploitation by Cabon Dioxide from Gas Hydrates-Phase Equilibria for CO2-CH4Mixed Hydrate System[J].J Chem Eng Jpn, 1996,29(3):478-483.
[11]McGrail B P,Zhu T,Hunter R B,et al.A New Method for Enhanced Production of Gas Hydrates with CO2[EB/OL].[2015-03-20].http://www.searchanddiscovery.com/documents/abstracts/2004hedberg_vancouver/extended/mcgrail/ mcgrail.htm.
[12]毕崟,阳涛,郭开华.二氧化碳-甲烷混合气体水合物四相区实验研究[J].工程热物理学报,2012,33(5):739-742.
[13]Du Y H,Guo T M.Prediction for Formation of Natural Gas Hydrates:Ⅰ.System Without Forbidden Substances[J].J Petrol,1988,3(3):82-92.
[14]John V T,Papadopoulos K D,Holder G D.A Generalized Model for Predicting Equilibrium Conditions for Gas Hydrates[J].AIChE J,1985,31(2):252-259.
[15]van der Waals J H,Platteeuw J C.Clathrate Solutions[J].Adv Chem Phys,1959,2(1):1-57.
[16]Guo Kaihua,Bi Yin,Sun Li,et al.Experiment and Correlation of Vapor-Liquid Equilibrium of Aqueous Solutions of Hydrophilic Ionic Liquids:1-Ethyl-3-Methylimidazolium Acetate and 1-Hexyl-3-Methylimidazolium Chloride[J].J Chem Eng Data,2012,57(8):2243-2251.
[17]粟航,郭开华,吴雅倩,等.1-氨丙基-3-甲基咪唑溴盐水溶液气液相平衡实验研究[J].化工学报,2013,64(3):993-999.
(编辑王萍)
Properties of Formation of Carbon Dioxide Hydrate in 1-Aminopropyl-3-Methyl-Imidazolium Bromide Aqueous Solutions
Bi Yin,Li Song,Guo Kaihua
(SYSU-BP Center for LNG Education,Training and Research,School of Engineering, Sun Yat-Sen University,Guangzhou Guangdong 510006,China)
1-Aminopropyl-3-methyl-imidazolium bromide([APMim][Br]) exhibits a good selectivity for CO2absorption and its aqueous solutions have a great prospect for CO2capture.The formation of CO2hydrate in the aqueous solutions of[APMim][Br]was researched.In the temperature range of 273.15-283.15 K,the three phase equilibrium and four phase equilibrium in the formation of CO2hydrate in the[APMim][Br]aqueous solutions with different water mass fraction were investigated in a high-pressure quartz glass reactor.The results showed that CO2hydrate could form in 35%(w)[APMim][Br]aqueous solution, and there were two systems,namely the capture of CO2in the hydrate and the absorption of CO2in the[APMim][Br]aqueous solutions.Compared with the formation of CO2hydrate in water,in the[APMim][Br]aqueous solutions,the temperature for the formation of CO2hydrate was low but the pressure was high.An activity coefficient model based on the ionic liquid aqueous solutions was applied to calculate the phase equilibrium and CO2solubility in the ionic liquid aqueous solution,and the average relative error was 1.6%.
ionic liquid;carbon dioxide hydrate;phase equilibrium
1000-8144(2015)09-1061-05
TQ 026
A
2015-03-24;[修改稿日期]2015-06-10。
毕崟(1987—),男,湖北省十堰市人,博士生,电话 020-39332892,电邮 biyin23@qq.com。联系人:郭开华,电话 020-39332895,电邮 guokaih@mail.sysu.edu.cn。
国家自然科学基金资助项目(51076169);广东省自然科学基金重点项目(9251027501000001)。

