新型析氧电催化剂IrO2/ATO的高效制备及性能
王 盼,郭建钊,王宇新
(天津大学化工学院,化学工程联合国家重点实验室,天津300072)
SPE(solid polymer electrolyte)水电解有高效、紧凑和产物纯度高等优点,被认为是未来比碱性水电解更有优势的制氢技术。但目前SPE水电解同样有能耗高的问题,这主要在于阳极析氧反应较高的过电位。贵金属氧化物IrO2的耐蚀性能优良,对析氧反应有较高催化活性,适宜在SPE水电解中应用[1]。然而IrO2高昂的价格却提升了水电解工艺的成本。选择合适的物质来掺杂或负载催化剂可有效降低贵金属的用量,而且可提高电极的耐蚀性能[2]。
Comninellis等[3]发现 IrO2(70%)-Ta2O5涂层尺寸稳定阳极(DSA)在酸性介质中析氧活性及稳定性较好。Iwakura等[4]报道了 RuO2中添加 SnO2能显著提高 DSA的寿命。Marshall等[5]和邵志刚等[6]制备出了 IrxSn1-xO2纳米颗粒催化剂。与纯IrO2和Ir相比,SnO2的掺杂使得 IrO2活性点的利用率和催化剂的稳定性都有提升。王新东等[7]采用SnO2为载体,研究了IrO2/SnO2纳米颗粒的SPE水电解性能,并考察了不同 n(Ir)/n(Sn)对析氧性能的影响。在燃料电池领域 Tseung等[8]及 Sung等[9]首先采用锑掺杂的氧化锡(ATO)作为铂催化剂的载体,因为锑掺杂可有效降低纯 SnO2的电阻率。以ATO(Antimony tin oxide)为载体的IrO2析氧催化剂研究尚未见有报道。
本研究介绍了以ATO为载体的IrO2催化剂的制备方法,较前人的报道[10-11]更为简单高效。对所得IrO2/ATO进行了相关物相表征。对其在电双层充电电位范围内的表面物质转化和电化学析氧性能进行了表征,同时采用计时电流法研究了该催化剂在酸性介质和高电位析氧环境下的稳定性。
1 实验材料与方法
1.1 IrO 2/ATO催化剂的制备
分别称取60 mg的ATO纳米颗粒[质量分数为99.5%, m(Sb2O5)∶m(SnO2) =15∶85, Alfa Aesar]和78.68 mg的(NH4)2IrCl6粉末(质量分数为99.994%,Alfa Aesar),加入由 50 mL异丙醇和50 mL去离子水混合成的分散剂中,在80℃下机械搅拌并回流30 min,可观察到分散剂中出现大量黑色絮状悬浮物,即为所需催化剂前驱体。将所得悬浮液离心分离,收集絮状沉淀,用去离子水洗涤3次以去除残留的氯离子,继续离心分离得到黑色固体沉淀物。将黑色固体沉淀在80℃下干燥3 h,用玛瑙研钵研磨至细粉,随后转移入瓷舟并置于高温箱式马弗炉中,以5℃·min-1升温速率升温至400℃保持2 h,其后随炉冷却至室温即得到所需IrO2/ATO纳米颗粒,IrO2的质量分数为40%。
1.2 催化剂的物相表征
采用荷兰PHILIPS公司的Philips XL 30扫描电子显微镜(SEM)和TECNAIG2F20高分辨透射电子显微镜(HRTEM)对所制备的IrO2/ATO催化剂材料及载体ATO的纳米结构进行观察。X射线衍射谱图分析采用的是日本理学的Rigaku TTR III型X-射线衍射仪,Cu-Kα作为 X射线源,管电压40 kV,管电流200 mA,入射光波长0.154 nm,扫描角度2θ范围为 3°~90°,扫描速度为 2(°)·min-1。 X射线光电子能谱(XPS)表征采用美国 Perkin Elmer的 PHI 1600 ESCA SYSTEM型X光电子能谱仪,Mg靶输出功率为250 W,样品室真空度为266×10-8Pa,扫描时全扫描通能187.85 eV,步长0.8 eV·s-1,窄扫描通能 29.35 eV,步长 0.25 eV·s-1。
1.3 催化剂的电化学性能测量
电化学表征采用标准三电极电解池装置。电解液为氮气保护的0.5 mol·L-1H2SO4溶液,水浴稳定至25℃。辅助电极为铂片电极(3 cm×3 cm),饱和氯化银参比电极通过鲁金毛细管与研究电极连通。催化剂负载于玻碳电极表面构成研究电极。为此,将 IrO2/ATO催化剂和微量 Nafion乳液加入无水乙醇液中,超声分散30 min,然后用微量进样器将其逐滴滴加到玻碳电极镜面上自然晾干。
循环伏安扫速为 20 mV·s-1,扫描范围为0.20~1.45 V。极化曲线扫速为5 mV·s-1,扫描范围为开路电位至1.6 V。阻抗测量采用1.55 V偏置电位,10 mV正弦扰动电压,扫描频率范围为100 kHz~50 mHz。本研究中电极电位是相对于常规氢电极(NHE)而言。
2 结果与讨论
2.1 IrO 2/ATO纳米颗粒的SEM和TEM图
图1为IrO2/ATO的SEM图。
从图1可以观察到,所制备的IrO2/ATO催化剂为一维颗粒状结构,粒径主要集中在30 nm左右。
图2为ATO与IrO2/ATO的TEM图。
由图2a)可以看到,ATO轮廓比较清晰,形状较为规则,粒径主要集中在15~25 nm之间。图2b)显示由于IrO2活性物质的负载,导致催化剂形貌变得粗糙,说明该负载催化剂具有较大的表面积。

图1 IrO 2/ATO催化剂的SEM图Fig.1 SEMof IrO 2/ATO

图 2 ATO a)与 IrO 2/ATO b)的 TEM图Fig.2 TEMs of ATO a)and IrO 2/ATO b)
2.2 IrO 2/ATO催化剂的XRD分析
ATO与IrO2/ATO的XRD谱图如图3所示。为便于比较,图3中还示出了相应材料的标准 XRD图谱。

图3 ATO与IrO 2/ATO的XRD谱图Fig.3 XRD patterns of ATO and IrO 2/ATO
从图3可知,ATO与 IrO2/ATO的特征衍射峰位置基本相同,都出现了位于 2θ=27.54°、36.06°,41.32°和54.28°附近对应于金红石结构的(110)、(101)、(200)和(211)晶面衍射峰。 载体 ATO的衍射峰窄而尖表明晶体结构的完整性。两者衍射峰的位置基本一致,且IrO2/ATO催化剂样品中未发现其它明显的衍射峰,表明 IrO2/ATO催化剂样品也是以四方晶系的金红石结构为主。
此外,与ATO相比,IrO2/ATO的特征峰位置向高角度方向有一定偏移,这表示ATO的晶格参数由于Ir的渗入而减小。此变化说明催化剂的制备不是使Ir接触性地负载于ATO上,而是使两者之间产生了原子的渗透掺杂。这有利于催化剂活性物质与载体材料之间结合强度的提高,促进催化剂固熔体结构的形成,从而提高其稳定性。固熔体结构的形成使得IrO2/ATO与ATO的主要特征峰位置基本相同(图3),这是因为Ir的原子半径与载体中Sn及Sb的原子半径很接近。从晶体结构学的角度来说,原子半径相近金属的氧化物也容易形成固熔体。
通过与 JCPDS标准图谱卡片对照,可以看出ATO的所有衍射峰与 Oxide-Sn.918Sb.109O2(JCPDS 88-2348)标准卡完全吻合。对于IrO2/ATO而言,虽然IrO2的主要衍射峰大部分与ATO高强度的衍射峰重叠而不易观察到,但与 JCPDS标准卡对比可知,其衍射图谱与 Iridium(IV)Oxide-IrO2(JCPDS 86-0330)相对应。
样品的晶粒尺寸也可以通过XRD谱图进行简单分析,具体是通过选取样品对应于(101)晶面衍射峰的半峰宽,根据Debye-Scherrer公式进行:

式(1)中,Dhkl为材料晶粒尺寸;λ为入射光波长;βhkl为衍射峰的半峰宽;θ为衍射峰的峰位置;khkl为波形参数。
计算可知,ATO的平均晶粒尺寸为25.4 nm,IrO2/ATO为32 nm左右,表明IrO2壳层的平均厚度约为4.6 nm。
图4为对 IrO2/ATO对应于(110)和(101)晶面衍射峰进行拟合分峰处理结果。

图4 IrO 2/ATO衍射峰的拟合分峰图Fig.4 The p rofile fitting of IrO 2/ATO
从图4中可以看到,实验所得衍射峰与 IrO2(JCPDS 86-0330)和 Sn.918Sb.109O2(JCPDS 88-2348)直接相关,基本上可以认为是两者衍射峰的重叠。但拟合峰位置与IrO2(JCPDS 86-0330)和Sn.918Sb.109O2(JCPDS 88-2348)峰位置尚有一定偏离,说明 IrO2/ATO催化剂物质并非是两种氧化物材料衍射峰的简单叠加,而是IrO2与ATO之间形成了固熔体。此外,IrO2的峰型扁平宽化,这种“馒头峰”的出现,表示IrO2的结晶性不良好,形成非晶态结构[10,12]。最近有研究表明,金属氧化物催化剂材料的非晶态结构同样可以使其得到更高的电化学催化析氧活性[13]。
2.3 IrO 2/ATO纳米颗粒的XPS分析
图5为IrO2/ATO的XPS谱图。
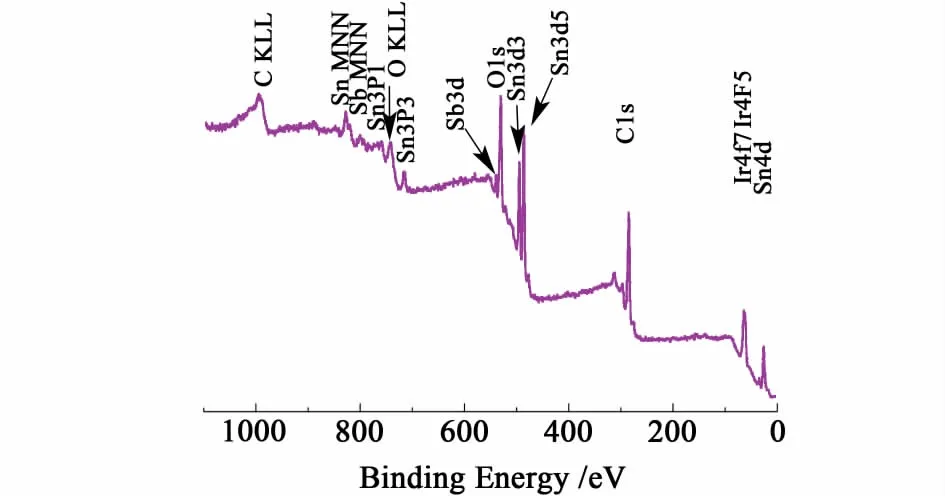
图5 IrO 2/ATO催化剂的全扫描能谱图Fig.5 Typical XPS survey spectrumof IrO 2/ATO
从图5中可以看到催化剂表层所含的元素除ATO中的Sn,Sb,O等,还出现了1对铱元素的主峰(Ir 4f7/2,Ir 4f5/2),从而明确说明铱被负载到了ATO上。
为分析铱的价态和结合形式,我们采用曲线拟合分峰技术对结合能位于56.9~76.9 eV的1对Ir4 f峰(7/2和5/2)进行了数学处理。对样品 XPS谱图的拟合应用XPS Peak 4.1软件中的Gaussian-Lorentzian混合曲线进行,在拟合之前用Shirley公式去除掉曲线背景,并使用C1s峰(B.E.=284.6 eV)做参考结合能。所得拟合结果如图6所示。
从图6中可以看出,Ir 4 f区包含2个主峰,分别为Ir 4 f7/2和Ir 4 f5/2。60.7 eV处的分峰为金属单质铱Ir(0)的峰,61.3 eV处的分峰为铱的氧化物 Ir(II)的峰,62.0 eV处的分峰为铱的氧化物 Ir(III)的峰,63.5 eV处的分峰为铱的氧化物Ir(IV)的峰。另外,在68.0 eV处出现了1个附加的屏蔽效应(screening effects)峰[14]。由图6中所显示的拟合分峰处理谱图,我们根据代表不同价态铱元素的拟合分峰曲线的峰面积可计算出其各自的相对含量。各物种百分比含量列于表1中。

图6 IrO 2/ATO的XPS曲线拟合分峰图Fig.6 Typical Ir 4 f region of IrO 2/ATO

表1 由XPS谱图分析所得IrO2/ATO中不同价态Ir的原子比Table 1 Relative atomic percentages of different valence states for Ir element in IrO 2/ATO samp les by XPS analysis
2.4 IrO 2/ATO催化剂电化学析氧性能
不同催化剂载量电极的循环伏安曲线如图7所示。由催化剂载量0.5 mg·cm-2电极的 CV曲线可见,电势扫描范围内其阳极分支出现2个氧化电流峰。这2个氧化电流峰分别为电极表面IrIII/IrIV(0.95 V)和 IrIV/IrVI(1.25 V)的物质转化过程[15-16]。

图7 不同表面催化剂载量电极的循环伏安曲线Fig.7 Cyclic voltammograms of electrodes with the different loading of catalysts
图7显示IrO2/ATO材料有比较优良的电容性。该电容由两方面构成,包括电极电双层的充放电电容和电解质吸脱附的法拉第赝电容。法拉第赝电容发生在与电解质溶液相接处的催化剂表面活性点上。因此,循环伏安曲线的积分电量或者电容性的大小与其电化学活性表面积或者活性点数量直接相关。由图7可知,电极电化学活性随着电极表面催化剂载量的增加而不断增大。
图8为ATO和玻碳电极的循环伏安曲线。

图8 ATO和玻碳电极的循环伏安曲线Fig.8 Cyclic voltammograms of ATO and glassy carbon electrode
如图8所示,玻碳电极的积分电量很小,说明其表面光滑。并且玻碳电极没有表现任何析氧活性。载体ATO在电位扫描范围内出现了一对氧化还原峰,但在阳极分支1.4 V附近处依旧没有表现出任何析氧电流,说明ATO对于析氧反应也是惰性的。

图9 不同催化剂载量电极的准稳态极化曲线图Fig.9 Steady-State polarization curves of electrodes with the differen t loading of catalysts
从准稳态极化曲线(图9)可知,各样品的电流密度均随电极电位向正方向扫描而增大,表明氧气析出速率增大。实验中可以观察到研究电极表面气泡析出的速率增大。同时,催化剂载量对电极的催化析氧活性影响较大。提高催化剂的载量可以提高电极的催化析氧性能。该催化剂的析氧起始电位与文献值一致[6],约在1.45 V。其在相同电位下可以达到的电流密度却高于或相当于新近文献值[6],尽管载量更低。
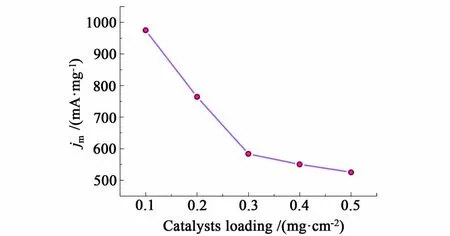
图10 1.6 V时单位质量IrO 2催化剂的电流Fig.10 The cu rrent of IrO 2 with unit mass at 1.6 V
从图10中可以看出,低催化剂载量电极的单位质量IrO2电流密度最高,且随催化剂载量的增加而降低,继续增加催化剂载量则渐趋稳定。因此需合理选择催化剂载量,载量太低不利于析氧活性的提高,载量太高不利于催化剂使用效率的提高。
图11为各样品的EIS曲线。

图11 不同催化剂载量电极的阻抗复平面图Fig.11 EIS p lots of electrodes with different loading of catalysts
各样品的EIS曲线中均有容抗弧出现,该容抗弧的大小反映了催化剂电化学析氧反应阻抗的高低。当催化剂的载量较低时,反应阻抗较大,不利于催化析氧反应的进行。提高催化剂的载量能有效降低催化剂的析氧阻抗。
SPE水电解阳极催化剂在酸性介质和高电位析氧反应下的稳定性极其重要。本研究采用CA曲线对其析氧稳定性进行了表征,并对曲线进行了线性拟合。结果如图12所示。
从图12中可以看出,所得IrO2/ATO催化剂在1.5 V下进行10 h的电解析氧反应并未使其电流密度发生明显衰减。通过对CA曲线进行线性拟合分析可知其衰减速率为 1.687×10-2(mA·cm-2)·h-1。说明本研究所制备的IrO2/ATO催化剂材料在高过电位下的酸性电解析氧反应中的稳定性良好,在酸性介质中的耐蚀性较好。

图12 1.5 V下0.5 mg·cm-2载量IrO2/ATO的计时电流曲线Fig.12 The chronoamperometry curve of IrO 2/ATO with the loading of 0.5 mg·cm-2 at 1.5 V
3 结论
采用简单高效的方法制得IrO2/ATO纳米颗粒状析氧催化剂。所得IrO2/ATO催化析氧性能良好,催化剂的析氧起始电位约在1.45 V,且1.6 V时的析氧电流密度为105 mA·cm-2。通过计时电流曲线对催化剂的稳定进行表征,发现1.5 V下催化剂的析氧电流密度衰减速率为 1.687×10-2(mA·cm-2)·h-1,说明本研究所得催化剂材料在高过电位下的酸性电解析氧过程中的稳定性良好。催化剂的载量对电极性能影响显著,循环伏安曲线的积分电量与析氧反应表观电流密度均随电极表面载量提高,但单位质量IrO2的电流会随之有所降低。
[1]Cheng J,Zhang H,Ma H,et al.Study of carbon-supported IrO2and RuO2for use in the hydrogen evolution reaction in a solid polymer electrolyte electrolyzer[J].Electrochimica Acta, 2010, 55(5): 1 855-1 861
[2]Zhou X,Ye Z,Hua X,et al.Electrocatalytic activity and stability of Ti/IrO2+MnO2anode in 0.5 MNaCl solution[J].Journal of Solid State Electrochemistry,2010, 14(7): 1 213-1 219
[3]Comninellis C,Vercesi G.Characterization of DSA®-type oxygen evolving electrodes:Choice of a coating[J].Journal of Applied Electrochemistry, 1991, 21(4): 335-345
[4]Iwakura C,Sakamoto K.Effect of active layer composition on the service life of(SnO2and RuO2)-coated Ti electrodes in sulfuric acid solution[J].Journal of the Electrochemical Society, 1985, 132(10): 2 420-2 423
[5]Marshall A, Børresen B, Hagen G, et al.Preparation and characterisation of nanocrystalline IrxSn1-xO2electrocatalytic powders[J].Materials Chemistry and Physics, 2005, 94(2/3): 226-232
[6]Li G,Yu H,Wang X,et al.Highly effective IrxSn1-xO2electrocatalysts for oxygen evolution reaction in the solid polymer electrolyte water electrolyser[J].Physical Chemistry Chemical Physics, 2013,15(8): 2 858-2 866
[7]Xu J, Liu G, Li J, et al.The electrocatalytic properties of an IrO2/SnO2catalyst using SnO2as a support and an assisting reagent for the oxygen evolution reaction[J].Electrochimica Acta, 2012, 59: 105-112
[8]Tseung A,Dhara S.Loss of surface area by platinumand supported platinumblack electrocatalyst[J].Electrochimica Acta, 1975, 20(9): 681-683
[9]Lee K S,Park IS,Cho Y H,et al.Electrocatalytic activity and stability of Pt supported on Sb-doped SnO2nanoparticles for direct alcohol fuel cells[J].Journal of Catalysis, 2008, 258(1): 143-152
[10]Marshall A T,Haverkamp R G.Electrocatalytic activity of IrO2-RuO2supported on Sb-doped SnO2nanoparticles[J].Electrochimica Acta, 2010, 55(6):1 978-1 984
[11]Wu X,Scott K.RuO2supported on Sb-doped SnO2nanoparticles for polymer electrolyte membrane water electrolysers[J].International Journal of Hydrogen Energy,2011, 36(10):5 806-5 810
[12]Cruz J, Baglio V, Siracusano S, et al.Nanosized IrO2electrocatalysts for oxygen evolution reaction in an SPE electrolyzer[J].Journal of Nanoparticle Research,2011, 13(4):1 639-1 646
[13]Smith R D, Prévot MS, Fagan R D, et al.Photochemical route for accessing amorphous metal oxide materials for water oxidation catalysis[J].Science, 2013, 340(6 128):60-63
[14]Labou D, Slavcheva E, Schnakenberg U, et al.Performance of laboratory polymer electrolytemembrane hydrogen generator with sputtered iridiumoxide anode[J].Journal of Power Sources, 2008, 185(2):1 073-1 078
[15]Foti G,Mousty C,Reid V,et al.Characterization of DSA type electrodes prepared by rapid thermal decomposition of the metal precursor[J].Electrochimica Acta,1998, 44(5):813-818
[16]Mousty C,Foti G,Comninellis C,et al.Electrochemical behaviour of DSA type electrodes prepared by induction heating[J].Electrochimica Acta, 1999, 45(3):451-456

