UV-B辐射和干旱对丹参生长和叶片中酚酸类成分的影响
刘景玲, 齐志鸿, 郝文芳, 张辰露, 刘峰华, 梁宗锁,*, 刘文婷
1 西北农林科技大学, 生命学院, 杨凌 712100 2 天津天士力现代中药资源公司, 天津 300402 3 陕西理工学院, 生物科学与工程学院, 汉中 723001
UV-B辐射和干旱对丹参生长和叶片中酚酸类成分的影响
刘景玲1, 齐志鸿2, 郝文芳1, 张辰露3, 刘峰华2, 梁宗锁1,*, 刘文婷1
1 西北农林科技大学, 生命学院, 杨凌 712100 2 天津天士力现代中药资源公司, 天津 300402 3 陕西理工学院, 生物科学与工程学院, 汉中 723001
在3种UV-B辐射强度以及3种干旱的单因子以及复合作用下,采用盆栽法对丹参植株生物量、叶面积、株高等形态指标和光合参数以及叶片中丹酚酸B、迷迭香酸、咖啡酸和丹参素含量的变化进行研究。旨在探索西北干旱、半干旱地区强光和干旱对丹参生物量和叶片中酚酸类含量的影响,为丹参的深入开发利用提供依据。结果表明:干旱和UV-B辐射单因子作用均对丹参生长指标有抑制作用,而对酚酸积累有促进作用;相比于干旱,UV-B辐射的影响更加显著。UV-B辐射显著引起植株矮化、叶面积减小、生物量降低、净光合速率降低以及叶片中酚酸类物质含量增加,两种因子复合作用对酚酸类物质积累的效果表现为复杂的加强或交互抗性作用。两种因子单独和复合作用处理下,适宜水分和重度UV-B辐射复合处理(75%T2)最有利于丹参叶片中酚酸类物质积累。
丹参; UV-B; 干旱; 形态; 丹酚酸B
近些年来,由于大气平流层臭氧衰减导致到达地表的紫外线(主要是280—320 nm的B区,简称UV-B)增强,其通过作用于蛋白质、DNA、膜系统以及光系统Ⅱ,对植物初生和次生代谢产生显著影响[1-2]。植物叶片作为主要光合器官直接受到UV-B 辐射,故UV-B 辐射对叶片以及整个生态系统的影响引起各国科学家的普遍关注[3-5]。干旱是影响植物生长和发育的主要因子[6-7]。在中国西北干旱半干旱地区强光和干旱是常见胁迫因子且常同时发生,这两种因子的复合作用对植物的影响成为研究的热点[7-8]。
丹参(SalviamiltiorrhizaBunge),唇形科草本植物,作为传统大宗中药材,对心脑血管疾病治疗具有明显功效。其活性成分包括以二萜醌类为主的脂溶性化学成分和以酚酸类为主的水溶性化学成分两大类[9]。丹参根长期作为药用部位使用,而生物量占整个植株很大比例的丹参叶片被当作废料丢弃。但是,近年来丹参叶片中水溶性酚酸类物质的抗氧化效果研究逐步引起人们的关注[10-12],研究表明丹参药用水溶性指标成分丹酚酸B的抗氧化活性强于维生素C(Vc)和维生素E(VE)[11,13],且酚酸类物质在紫外波段(280—350 nm)具有强吸收峰,因此,UV-B增强会导致植物叶片中的酚酸类物质含量显著增加[14-15]。干旱下植物通过增加具有抗氧化活性的酚酸类物质含量而适应环境变化[6-7,16]。而关于UV-B和干旱复合作用对植物体内酚酸类物质含量影响的研究也因实验条件和物种差异而未形成一致结论[17-18]。目前为止,以丹参叶片为材料,探究其在环境因子作用下生长和次生代谢物质含量变化的研究甚少。本文通过整个生长季对盆栽丹参进行UV-B辐射和干旱处理,以期揭示两种因子单独和复合作用对丹参生长以及叶片中四种酚酸类物质积累的影响,为有效开发利用丹参叶片提供理论依据。
1 材料与处理方法1.1 材料培养
本研究于2011年3月15日到11月20日在中国陕西杨凌水土保持研究所(34°20′N, 108°24′E)遮光棚下开展(透光率为33%)。2011年春,将来自陕西天士力植物药业有限公司药源基地(33°2′ N,108°34′ E)的丹参5月龄幼苗种植在塑料桶中,塑料桶高30 cm,上口径35 cm,下口径23 cm 。桶中装过0.5 cm筛混合均匀的垆土、沙子和蚯蚓粪,三者比例为3∶1∶1。混合培养基质的田间持水量采用环刀法测定为27%,常规管理保持水分充足。丹参苗生长53 d后(5月10日)间去长势不一致的幼苗,每桶保留3株用于研究。
1.2 UV-B 处理和干旱处理
1.2.1 UV-B处理方法
设3个UV-B辐射处理,辐射强度参考Madronich[19]计算方法标准化为300 nm的植物响应有效紫外光谱(UV-BBE),分别为对照CK(0 kJ/m2)、低强度UV-B辐射T1(2.60 kJ/m2)和高强度UV-B辐射T2(4.10 kJ/m2), T1和T2两个处理强度分别相当于西安地区夏至日晴天臭氧层减少16%和26%[19](西安夏至日晴天的紫外有效辐射强度UV-BBE为8.05 kJ/m2)。
UV-B辐射由悬挂在植株垂直上方的紫外灯管产生(36 W,中心波长 313 nm,北京电光源研究所),UV-B辐射处理每天6 h(10:00—16:00)。对照上方也悬挂灯管,但不通电,保证3组有相同的光照条件。灯管缠绕0.13 mm醋酸纤维素薄膜(CA)过滤280 nm以下光线;用紫外辐射测定仪(北京师范大学仪器厂生产)测297 nm 处的紫外辐射强度(以植株顶层计)。紫外灯管的位置每半月调整1次高度确保距离植株顶层的距离不变,植物位置每2 d随机变换1次以便植物接受均匀的UV-B辐射。处理期间只晴天进行UV-B辐射,阴天不开紫外灯。
1.2.2 干旱处理方法
设3个水分梯度:适宜水分、中度干旱、和重度干旱(分别是田间持水量的75%、55%和40%);土壤含水量采用电子秤称重控制在设定范围内(载量30 kg,感量5 g)。每隔1 d称重补充蒸发的水分,塑料桶每周称重3.5次。
1.2.3 单因子和复合处理
UV-B辐射单因子处理 75%CK、75%T1和75%T2(适宜水分条件)。
干旱单因子处理:75%CK、55%CK和40%CK(无UV-B辐射)。
UV-B辐射和干旱复合处理 55%T1:低强度UV-B辐射和中度干旱;40%T1:低强度UV-B辐射和重度干旱;55%T2:高强度UV-B辐射和中度干旱;40%T2:高强度UV-B辐射和重度干旱;每个处理重复3桶,共计9株丹参。
1.3 取样方法
从2011年5月10日到11月20日共计处理194 d,UV-B辐射处理82 d。收获时将丹参整株收获,测定株高;随机选取植株顶层完全展开的功能叶片9片测量叶面积;并将其50℃烘干后室温干燥处保存用于酚酸类物质含量测定;丹参植株地上和地下部分开,烘至恒重用于其它指标的测定。
1.4 指标测定
1.4.1 酚酸类成分含量测定
精密称取烘干、粉碎并过100目筛的丹参叶片和根的粉末0.1000 g,加入70%甲醇水溶液 10 mL,保鲜膜覆盖,静止提取7 h 。然后用超声波提取45 min,10 000 r/min 离心 10 min,上清液经0.45 μm 的微孔滤膜过滤,待检测。
色谱条件:Waters 1525 二元梯度液相色谱仪; Waters Sunfire-C18 色谱柱(4.6 mm×250 mm,5 μm);数据采集系统为 Empower 工作站。流动相为乙腈(B)-0.02% 磷酸水溶液(A);流动相使用前进行过滤和脱气处理;流动相流速1.0 mL/min;柱温30 ℃;进样量10 μL。检测波长200—400 nm,丹参素;(DSS 3,4-trihydroxybenzenepropanoic acid)、咖啡酸(CA Caffeic acid)、迷迭香酸(RA Rosmarinic acid)、丹酚酸B (SAB Salvianolic acid B)的检测波长为288 nm;保留时间依次为8.7、14.1、23.8、33.5 min。
1.4.2 形态学指标测定
植株高度是指地上部分基部到主干顶端的高度;叶面积用Yaxin-1241叶面积仪测量;用0.001 g感量电子秤称量地上和地下部生物量;每个处理下形态学指标测量重复9次。
1.4.3 光合参数测定
光合参数:净光合速率(Pn)、气孔导读(Gs)、蒸腾速率(Tr)和胞间二氧化碳浓度(Ci)使用LCPRO+ 光合作用测定仪测定。选择丹参植株顶层完全展开的功能叶片标记后用于光合参数测定,每个处理重复9次。分别选择3个丹参生长特殊时期:快速生长期 Ⅰ(2011年7月24日)、根系膨大期 Ⅱ(9月18日)和收获期 Ⅲ (11月13日)的晴朗天气,9:00开始进行光合参数测定。光合测定前,被测叶片在1500 μmol m-2s-1光强下适应 5 min,设定仪器控制叶面温度为30 ℃。
1.5 数据处理
数据利用统计分析软件Statistic Package for Social Science (SPSS 21.0) 进行双因素方差分析(UNIANOVA),各处理之间的差异性多重比较采用最小显著差异法Least Significant Difference (LSD)分析。所有图片均在Excel(2003) 软件系统下完成。
2 结果与分析
2.1 UV-B和干旱对丹参植株形态的影响

图1 UV-B辐射和干旱单因子或复合处理对丹参植株高度、叶面积、根冠比、地上部干重、根干重和总干重的影响
在3种水分梯度下,株高均随UV-B辐射梯度降低,低强度辐射对株高的抑制作用不显著,但是高强度UV-B辐射对株高抑制达到显著水平,两种因子之间存在交互作用(图1)。重度干旱和高强度UV-B辐射(40%T2)复合处理下丹参株高达到最低值,比对照75%CK显著降低47.82%。在干旱单因子作用下株高下降但是未达到显著水平,UV-辐射增强干旱对株高的抑制作用,且只在高强度UV-B辐射下达到显著水平。
干旱和UV-B辐射单因子作用显著导致叶面积减小40.22%和71.51%(图1),后者作用更大。叶面积在适宜水分和高强度UV-B辐射(75%T2)处理下达到最小值。干旱对叶面积的抑制作用在UV-B辐射复合作用下得到增强,且具有剂量效应,在3种水分条件下高强度UV-B辐射导致的叶面积减小均达到显著水平。
植株根冠比在不同水分条件下均呈明显的降低趋势 (图1),丹参植株根冠比最大值出现在中度干旱无UV-B辐射条件下;而最小值出现在适宜水分低强度UV-B辐射(75%T1)下。
地上部分、地下部分和总生物量在两种因子单独和复合作用下变化趋势相同(图1)。干旱单因子作用下生物量积累呈现倒U形变化;均在中度干旱下生物量积累最多,重度干旱下生物量积累最少;且相比于地上部分(20.59%),地下部分在中度干旱下干重增加更多(27.07%),达到差异显著水平(P<0.05),表明地下部分生物量积累对干旱更加敏感。而在3个水分梯度下,UV-B辐射引起丹参地下部分、地上部分和总生物量梯度降低,尤其是高强度UV-B辐射导致总生物量分别减少88.69%、85.92%和88.99%,高强度UV-B辐射和重度干旱(40%T2)复合处理下生物量积累最少。
2.2 UV-B辐射和干旱对丹参光合参数的影响
分别在丹参快速生长期 Ⅰ(7月24日),根系膨大期 Ⅱ(9月18日)和收获期 Ⅲ(11月13日)进行丹参植株光合参数测定(表1)。3次测定的结果均表明:在不同水分条件下,UV-B处理引起Pn显著下降,Pn在丹参快速生长期75%CK条件下达到最大值14.81 μmol m-2s-1;收获期40%T2处理下最小2.06 μmol m-2s-1。Tr和Gs的变化趋势基本与Pn相同,Ci与Pn的变化趋势相反,在3个生长时期不同水分梯度下均为随辐射强度增加Ci值显著增加,Ci在快速生长期55%T1处理下达到最大值406 μmol/mol;在根系膨大期75%CK下达到最小值238.2 μmol/mol。
表1 UV-B辐射和干旱单因子或者复合处理对丹参净光合速率Pn、气孔导读Gs、胞间二氧化碳浓度Ci、蒸腾速率Tr的影响
Table 1 The alteration ofPn,Gs,Ci,Trof theSalviaunder different treatments of UV-B radiation and drought individually or combined
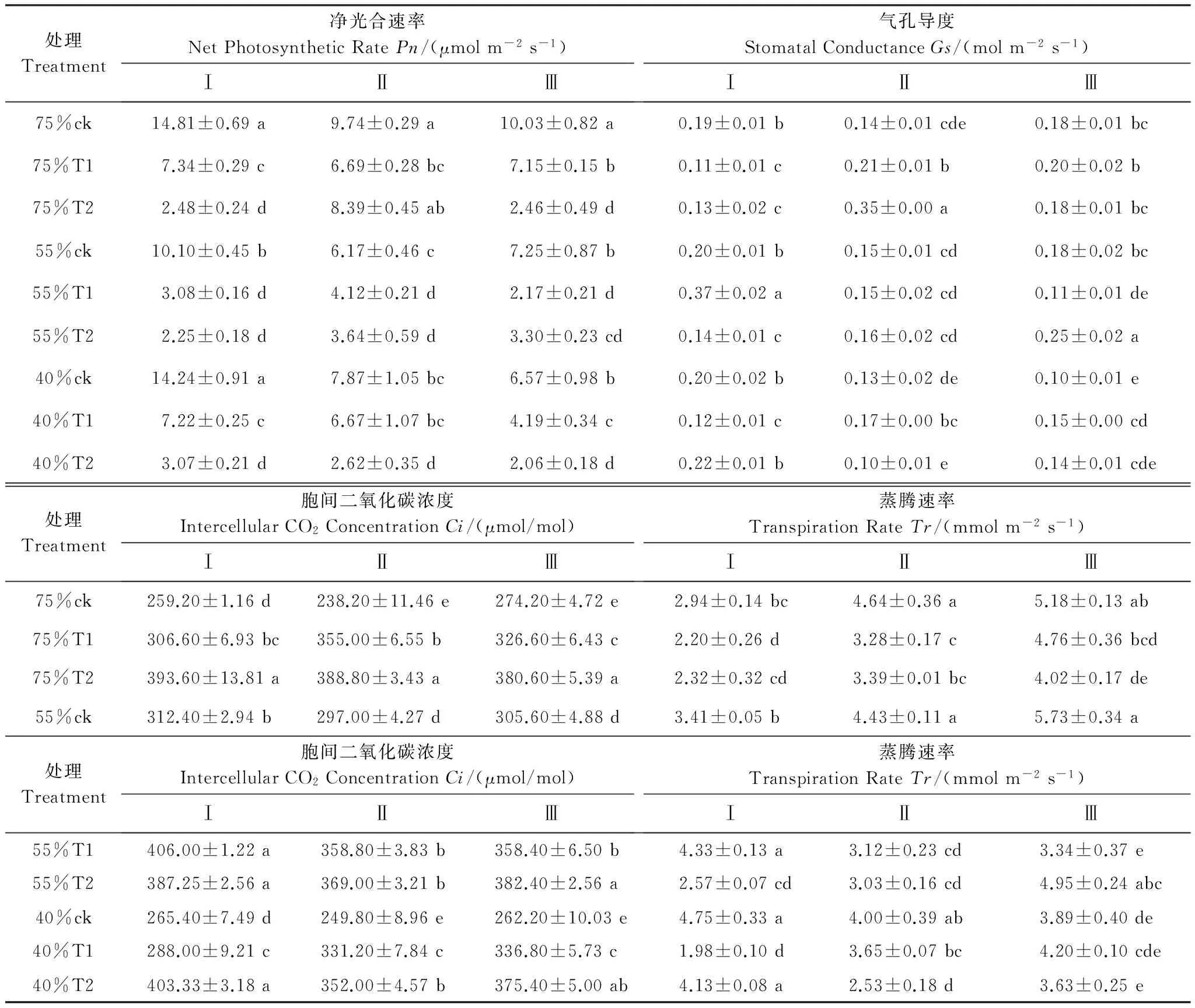
Ⅰ、Ⅱ和Ⅲ分别表示丹参快速生长期(7-24)、根系膨大期(9-18)和收获期(11-13)
2.3 UV-B辐射和干旱对丹参叶片中4种酚酸类物质含量的影响
由表 2可知,以适宜水分无UV-B辐射(75%CK)处理为对照,丹参叶片中SAB、RA含量显著高于CA和DSS的。在不同水分梯度下,UV-B辐射均显著增加叶片中四种酚酸类物质的含量。其中SAB和RA含量均在75%T2处理下含量最高,达到4.75 μg/g和3.15 μg/g,比根中SAB和RA最高含量增加69.64%和556.25%。
表2 UV-B和干旱对丹参叶片和根中酚酸类物质含量的影响
Table 2 Influence of the UV-B radiation and the drought individually or combined to the phenolic compounds in the leaves and roots of theSalvia

结果采用平均值±标准误差表示(n=3);*,**分别表示处理组与对照组差异显著(P<0.05)或极显著(P<0.01)
干旱单因子作用下,SAB和DSS含量随干旱梯度显著增加。RA和CA含量也显著增加,但最大值出现在中度干旱下。且在适宜水分下UV-B单因子处理引起的SAB和RA含量增加倍数是427.78%和800.00%,显著高于干旱单因子作用下的增加倍数112.22%和151.43%。
两种因子单独作用均能显著增加丹参叶片中4种酚酸的含量,但是二者复合作用下变化各异,统计分析表明两种处理因子之间存在显著交互作用。在适宜水分条件下,UV-B辐射导致SAB含量显著增加,且存在剂量效应,75%T1和75%T2分别比75%CK增加217.78%和427.78%;而55%T1和55%T2分别比55%CK的值增加3.65%和75.18%,40%T1和40%T2分别比40%CK的值降低61.26%和增加73.82%,这表明干旱抑制UV-B的作用效果,且随水分含量降低抑制作用增强。干旱单因子作用促进酚酸类积累,SAB含量在55%CK和40%CK处理下比 75%CK分别增加52.22%和112.22%,而增加低强度UV-B辐射后55%T1和40%T1分别比75%CK显著增加了57.78%和降低17.78%,表明低强度UV-B辐射在重度干旱下抵消了干旱对SAB积累的效果,而对中度干旱下SAB积累的影响不显著。高强度UV-B处理下55%T2 和40%T2比75%CK分别增加166.67%和268.89%,表明高强度UV-B辐射显著增强了干旱对SAB的累积效应。RA和DSS含量与SAB有相似的变化规律;DSS含量在40%T2处理下含量最高;CA变化规律不同于其它3种酚酸的变化,其最大值出现在75%T1处理下。
3 讨论与结论
本研究结果表明:干旱和UV-B辐射显著引起植株矮化、叶面积减小和生物量降低。该结论与已有的研究结果相符[8,14,20]。干旱单因子作用下丹参叶面积显著降低,株高降低但没有达到显著水平。而生物量在中度干旱下达到最大值,这与刘大会[16]研究结论一致,刘红云[6]认为随水分胁迫加剧丹参植株生物量显著下降。UV-B辐射单因子处理下,株高、叶面积和生物量均显著大幅度降低(图1),这表明相比于干旱,UV-B辐射对丹参形态学指标的影响更加显著。在UV-B辐射处理下植株矮化的可能原因与UV-B诱导的过氧化物酶氧化的吲哚乙酸 Indole acetic acid (IAA)活性有关,它参与了植株茎干的伸长过程[21]。另外,植株矮化可能是植物对UV-B辐射胁迫的主动响应,植株矮化可减少其直接受到UV-B辐射的面积对植株进行保护[3]。两种环境因子对丹参植株根冠比的影响表明两种因子单独和复合作用对光合产物在地上和地下部分的分配比例有显著影响,UV-B辐射导致更多的光合产物分配到直接受到UV-B辐射的地上部分,有利于植物抵御辐射伤害。有文献表明:叶面积在UV-B辐射下减小是由于叶片细胞分裂和生长受到UV-B的抑制[22],叶片厚度增大,也是植物主动抵御辐射伤害的策略,其有利于阻挡UV-B进入叶肉深层,对细胞产生更大伤害[23]。而UV-B辐射对生物量影响也没有一致结论,大量研究表明UV-B辐射导致植物生物量下降,但也有研究表明UV-B辐射对生物量积累有促进作用或没有显著影响[14,24]。补充UV-B辐射对生物量影响结论不一致的原因除了实验条件和物种抗性差异之外,其它环境因子对UV-B辐射效果的影响不可忽视。Eva[2]认为:自然条件下UV-B辐射不是必然导致植物遭受不利的胁迫,通常是其它不利环境因子增强了植物对UV-B胁迫的敏感性。
生物量与光合速率的相关性已有文献报道[25-26],本研究表明,丹参在3个生长期的不同水分梯度下,植物叶片Pn均随UV-B辐射增强呈降低趋势(表1),这与生物量变化趋势一致,Gs和Tr与其变化趋势相同,而Ci呈现相反的变化趋势,表明引起光合速率下降的是非气孔因素,可能是由于UV-B辐射对细胞中的DNA、蛋白质、光合器官损坏引起光合速率下降;且叶面积的减小可能也是导致光合产物积累减少的原因[22,27]。UV-B辐射导致植物光合速率降低的研究结果已有大量报道,可能的原因是UV-B导致植物光系统Ⅱ功能降低;光化学产量降低以及光合色素损伤[22,25]。然而,也有UV-B辐射对植物光合速率影响不显著的报道[23-24,28]。
植物对UV-B辐射最一致的反应就是酚酸类物质积累[29],其导致植物中总酚酸、对香豆酸、槲皮素等含量增加[30-32]。干旱处理也引起植物体内酚酸类物质积累[8,33-34]。本研究结果表明:UV-B辐射和干旱单因子或者复合作用均显著引起丹参叶片中SAB、RA、CA和DSS的积累(表2)。但是,UV-B单因子处理引起的SAB和RA含量增加倍数(427.78%和800.00%)数倍高于干旱单因子作用引起的增加(112.22%和151.43%),表明UV-B辐射对丹参叶片中酚酸类成分含量积累的促进作用强于干旱的。Sheng[35]认为酚酸类物质具有紫外吸收和抗氧化的双重特点,因此,UV-B辐射比干旱对酚酸类积累的促进作用更加明显。但有研究表明干旱对酚酸类物质积累作用更加明显:Hanna[17]研究发现在UV-B辐射和干旱分别处理3 d 的时候干旱更加显著引起大麦(HordeumvulgareL. cv. Granal)叶片中水杨酸含量的积累。但是随着时间延长到9 d,两种胁迫对植物叶片中水杨酸积累的影响消失。该结论不一致性的可能原因是不同处理条件或者物种对胁迫的敏感性不同导致的。
在自然条件下,环境胁迫因子常并非单独作用。中国西北干旱半干旱地区,伴随高强度的UV-B辐射的干旱胁迫时常发生,干旱胁迫常与UV-B辐射复合作用影响植物生长和次生物质积累,进而对植物以及生态系统造成显著影响。研究认为其它环境因子的复合作用使植物对UV-B诱导的不利胁迫更加敏感[2]。如黄瓜 (Cucumissativus)在受到干旱和UV-B复合作用时候抗氧化防御协同上调[18]。UV-B辐射能够减轻大豆[35](GlycinemaxL.)和松树(Pinuspinea)[36]幼苗因干旱受到的伤害,两种因子之间存在交叉抗性。因此,UV-B和干旱复合作用可能导致不利胁迫的增强或者抵消作用,两种因子复合作用对植物的影响因植物种类和胁迫强度而异。本研究表明:对于四种酚酸类物质积累,干旱对UV-B处理的效果有明显抑制作用,且随干旱加剧抑制作用增强;可能的原因是一方面UV-B辐射导致丹参叶片中增加的SAB作为抗氧化物质,可能用于消除干旱诱导产生的多余活性氧;另一方面:酚酸类物质作为抗氧化物质和植物体内的其它抗氧化系统共同抵御胁迫,有研究认为酚酸类物质先于抗氧化酶对胁迫作出响应[37],随着胁迫持续,酚酸含量降低而其它抗氧化酶或抗氧化物质代替酚酸类发挥作用。低强度UV-B抑制干旱的效果;而高强度UV-B辐射增强干旱的效应,研究表明不同强度的UV-B辐射对植物的作用不同[2],酚酸类在抵御UV-B胁迫过程中的双重作用与辐射强度的关系还需要进一步研究。目前,干旱和UV-B复合作用对酚酸类物质影响的叠加或交互抗性作用机制尚不明确,可能与活性氧积累及相应的信号传递过程中的交互作用有关[8,38]。
酚酸类物质因其紫外吸收和抗氧化的双重特点,在药品、食品和化妆品生产中被广泛应用[39-40]。通过施加适当强度的干旱或者UV-B处理增加植物体内酚酸类物质含量可能成为获取天然抗氧化物质的有效途径[3]。传统大宗药材丹参,除了药典中规定的入药部位-根,丹参叶片中也含有大量的酚酸类物质,近年有研究表明其抗氧化特性不仅在治疗心脑血管病中发挥重要作用,而且在糖尿病和脑梗治疗中也有很好的疗效[41]。通过适当处理提高丹参叶片中酚酸类物质含量的研究已经取得一定的进展[11,42-43],本研究结果表明水分适宜条件下高强度UV-B辐射(75%T2)能最大程度促进丹参叶片中酚酸类积累,其中SAB含量比根中的增加了69.64%,RA含量增加了556.25%;这表明作为废料的中药丹参叶片在适宜条件下可作为天然抗氧化物质来源,具有巨大开发利用价值。
[1] Johnston H S. Reduction of stratospheric ozone by nitrogen oxide catalysts from supersonic transport exhaust. Science, 1971, 173(3996): 517-522.
[2] Eva H, Marcel J, Ake S. UV-B exposure, ROS, and stress: inseparable companions or loosely linked associates? Trends in Plant Science, 2013, 18(2): 107-115.
[3] Wargent J J, Jordan B R. From ozone depletion to agriculture: understanding the role of UV radiation in sustainable crop production. New Phytologist, 2013, 197(4): 1058-1076.
[4] Wargent J J, Moore1 J P, Ennos A R, Paul N D. Ultraviolet radiation as a limiting factor in leaf expansion and development. Photochemistry and Photobiology, 2009, 85(1): 275-286.
[5] Dolors V, Laura L, Meritxell B, Jordi B. Photomorphogenic effects of UVB and UVA radiation on leaves of six Mediterranean sclerophyllous woody species subjected to two different watering regimes at the seedling stage. Environmental and Experimental Botany, 2012, 79: 66-75.
[6] Liu H Y, Wang X D, Wang D H, Zou Z R, Liang Z S. Effect of drought stress on growth and accumulation of active constituents inSalviamiltiorrhizaBunge. Industrial Crops and Products, 2011, 33(1): 84-88.
[7] Dirk S, Maik K. Influencing the product quality by deliberately applying drought stress during the cultivation of medicinal plants. Industrial Crops and Products, 2013, 42: 558-566.
[8] David C, Ana W, Dylan G J. Acclimation and interaction between drought and elevated UV-B inA.thaliana: Differences in response over treatment, recovery and reproduction. Ecology and Evolution, 2012, 2(11): 2695-2709.
[9] 中国药典编委会. 中华人民共和国药典. 北京: 中国医药科技出版社, 2010.
[10] Salem B I, Fekih S, Sghaier H, Bousselmi M, Saidi M, Landoulsi A, Fattouch S. Effect of ionising radiation on polyphenolic content and antioxidant potential of parathion-treated sage (Salviaofficinalis) leaves. Food Chemistry, 2013, 141(2): 1398-1405.
[11] Zhang Y, Li X, Wang Z Z. Antioxidant activities of leaf extract ofSalviamiltiorrhizaBunge and related phenolic constituents. Food and Chemical Toxicology, 2010, 48(10): 2656-2662.
[12] Akram E, Maryam E. Antidiabetic effects of sage (SalviaofficinalisL.) leaves in normal antreptozotocin-induced diabetic rats. Diabetes & Metabolic Syndrome: Clinical Research & Reviews, 2009, 3(1): 40-44.
[13] Adam M, Sylwia Z, Jan O, Eliza L Z. Antioxidant activity of extracts from leaves and roots ofSalviamiltiorrhizaBunge,S.przewalskiiMaxim., andS.verticillataL. Bioresource Technology, 2008, 99(16): 7892-7896.
[14] Artur M. Effects of PAR and UV-B radiation on herbal yield, bioactive compounds and their antioxidant capacity of some medicinal plant under controlled enviornmental conditions. Photochemistry and Photobiology, 2013, 89(2): 406-414.
[15] Luis J C, Pérez R M, González F V. UV-B radiation effects on foliar concentrations of rosmarinic and carnosic acids in rosemary plants. Food Chemistry, 2007, 101(3): 1211-1215.
[16] 刘大会, 郭兰萍, 黄璐琦, 金航, 吴丽华, 曾燕, 张霁, 杨雁. 土壤水分含量对丹参幼苗生长及有效成分的影响. 中国中药杂志, 2011, 36(3): 321-325.
[17] Hanna B, Magorzata C. The interactive effect of water deficit and UV-B radiation on salicylic acid accumulation in barley roots and leaves. Environmental and Experimental Botany, 2012, 25: 1-10.
[18] Kubis′ J, Rybus-Zając M. Drought and excess UV-B irradiation differentially alter the antioxidant system in cucumber leaves. Acta Biologica Cracoviensia Series Botanica, 2008, 50: 35-41.
[19] Madronich S, McKenzie R L, Björn L O, Caldwell M M. Changes in biologically active ultraviolet radiation reaching the Earth′s surface. Journal of Photochemistry and Photobiology B: Biology, 1998, 46(1-3): 5-19.
[20] Liu Q, Yao S Q, Zhao C Z, Cheng X Y. Effects of enhanced UV-B radiation on growth and photosynthetic responses of four species of seedlings in subalpine forests of the eastern Tibet plateau. Environmental and Experimental Botany, 2011, 74: 151-156.
[21] Ros J, Tevini M. UV-radiation and indole-3-acetic-acid: interactions during growth of seedlings and hypocotyl segments of sunflower. Journal of Plant Physiology, 1995, 146(3): 295-305.
[22] Salvador N, Damian J A, James I L M, Neil R B. Ultraviolet-B radiation effects on water relations, leaf development, and photosynthesis in droughted pea plants. Plant Physiology, 1998, 117(1): 173-181.
[23] Shi S B, Zhu W Y, Li H M, Zhou D W, Han F, Zhao X Q, Tang Y H. Photosynthesis ofSaussureasuperbaandGentianastramineais not reduced after long-term enhancement of UV-B radiation. Environmental and Experimental Botany, 2004, 51(1): 75-83.
[24] Riitta T, Riitta J T, Pedroj A. The effects of long-term elevated UV-B on the growth and phenolics of eld-grown silver birch (Betulapendula). Global Change Biology, 2001, 7(7): 839-848.
[25] Kulandaivelu G, Maragatham S, Nedunchezhian N. On the possible control of ultraviolet-B induced response in growth and photosynthetic activities in higher plants. Physiologia Plantarum, 1989, 76(3): 398-404.
[26] Amy M B, Craig R Y, Sun J D, Courtney P L, Randall L N, Donald R O, Elizabeth A A. Ozone exposure response for US soybean cultivars: linear reductions in photosynthetic potential, biomass, and yield. Plant Physiology, 2012, 160(4): 1827-1839.
[27] Sullivan J H, Teramura A H, Ziska L H. Variation in UV-B sensitivity in plants from a 3000 m elevation gradient in Hawaii. American Journal of Botany, 1992, 79(7): 737-743.
[28] Fiscus E L, Booker F L. Is increased UV-B a threat to crop photosynthesis and productivity?. Photosynthesis Research, 1995, 43(2): 81-92.
[29] Ines E, Susanne H K, Ariane K, Detlef U, Lothar W K, Sascha R. UV-B-induced changes of volatile metabolites and phenolic compounds in blueberries (VacciniumcorymbosumL). Food Chemistry, 2011, 126(1): 60-64.
[30] Roque I, Mariana R, Cecilia B, Nievaa J A, Gonzálezb M H, Fernando E P. Effects of low UV-B doses on the accumulation of UV-B absorbing compounds and total phenolics and carbohydrate metabolism in the peel of harvested lemons. Environmental and Experimental Botany, 2011, 70(2-3): 204-211.
[31] Clarke L J, Robinson S A. Cell wall-bound ultraviolet screening compounds explain the high ultraviolet tolerance of the Antarctic moss,Ceratodonpurpureus. New Phytologist, 2008, 179(3): 776-783.
[32] Hanna B, Magorzata P B, Magorzata C. Response of barley seedlings to water deficit and enhanced UV-B irradiation acting alone and in combination. Acta Physiologiae Plantarum, 2012, 34(1): 161-171.
[33] Iness B, Ibtissem H S, Soumaya B, Ferid L, Brahim M. Drought effects on polyphenol composition and antioxidant activities in aerial parts ofSalviaofficinalisL. Acta Physiologiae Plantarum, 2011, 33(4): 1103-1111.
[34] Antonios P, Ioannis T, Georgios S, Stefanos K, Anastasia G. Effect of water deficit on leaf phenolic composition, gas exchange, oxidative damage and antioxidant activity of four Greek olive (OleaeuropaeaL.) cultivars. Plant Physiology and Biochemistry, 2012, 60: 1-11.
[35] Sheng X F, Zhou Y Y, Duan L S, Li Z H, Eneji A E, Li J M. Silicon effects on photosynthesis and antioxidant parameters of soybean seedlings under drought and ultraviolet-B radiation. Journal of Plant Physiology, 2010, 167(15): 1248-1252.
[36] Yiannis M, Yiola P, Kostas S, Dimostenis N, Efi L, George P, George K. Beneficial effects of enhanced UV-B radiation under field conditions: improvement of needle water relations and survival capacity ofPinuspineaL. seedlings during the dry Mediterranean summer. Plant Ecology, 1997, 128(1-2): 101-108.
[37] Kondo N, Kawashima M. Enhancement of the tolerance to oxidative stress in cucumber (CucumissativusL.) seedlings by UV-B irradiation: Possible involvement of phenolic compounds and antioxidative enzymes. Journal of Plant Research, 2000, 113(3): 311-317.
[38] Manzer H S, Mohamed H A, Mohammed O B. Role of nitric oxide in tolerance of plants to abiotic stress. Protoplasma, 2011, 248(3): 447-455.
[39] Dong J E, Ma X H, Wei Q, Peng S B, Zhang S C. Effects of growing location on the contents of secondary metabolites in leaves of four selected superior clones ofEucommiaulmoides. Industrial Crops and Products, 2011, 34(3): 1607-1614.
[40] Taarit M B, Msaada K, Hosni K, Marzouk B. Fatty acids, phenolic changes and antioxidant acitivity of clary sage (SalviasclareaL) rosette leaves growth under saline conditions. Industrial Crops and Products, 2012, 38: 58-63.
[41] 王明乐. 丹参注射液对 2 型糖尿病下肢血管病变患者 CRP, IL-6 水平的影响. 中国实验方剂学杂志, 2013, 19(6): 323-325.
[42] Bruneton J. Pharmacognosy, Phytochemistry, Medicinal Plants. 2nd ed. Paris: Lavoisier Publishing, 1999.
[43] Bettaieb I, Zakhama N, Wannes W A, Kchouk M E, Marzouk B. Water deficit effects onSalviaofficinalisfatty acids and essential oils composition. Scientia Horticulturae, 2009, 120(2): 271-275.
The effects of drought and UV-B radiation on the growth and the phenolic compounds of theSalviamiltiorrhizaBunge leaf
LIU Jingling1, QI Zhihong2, HAO Wenfang1, ZHANG Chenlu3, LIU Fenghua2, LIANG Zongsuo1,*, LIU Wenting1
1NorthwestAgricultureandForestryUniversity,CollegeofLifeSciences,Yangling712100,China2TianjinTASLYModernTCMResourcesCo.,Ltd,Tianjin300402,China3ShaanxiUniversityofTechnology,SchoolofBiologicalScience&Engineering,Hanzhong723001,China
Ultraviolet B and drought stress are common environmental stresses in arid and semi-arid regions of northwestern China. A pot experiment was conducted to investigate the separate and combined effects of UV-B radiation and drought stress on physiological characteristics ofSalviamiltiorrhizaBunge in this region, and on the accumulation of phenolic compounds in its leaves. In this experiment, the UV-B radiation was performed with two intensities, 2.60 kJ/m2(T1) and 4.10 kJ/m2(T2), meanwhile, three gradual drought stress treatments were carried out with field water capacity ranging from 40% to 75%. The involved physiological characteristics included plant height, leaf area index, shoot biomass, root biomass, total biomass, root: shoot ratio, and those photosynthetic indices, such as net photosynthetic rate (Pn), transpiration rate (Tr), stomatal conductance (Gs) and intercellular CO2concentration (Ci). The phenolic compounds detected in leaves contained salvianolic acid B (SAB), rosmarinic acid (RA), caffeic acid (CA)and 3,4-trihydroxybenzenepropanoic acid(DSS). The results showed that both UV-B radiation and drought stress had cross-talk on the growth ofS.miltiorrhiza, and the least plant height was found in the combined treatment (40%T2), which significantly decreased 47.82%. Drought stress and UV-B radiation reduced leaf area 40.22% and 71.51%, respectively, and the least value occurred in the combined treatment 75%T2. Similarly, the least root: shoot ratio also happened in combined treatment 75%T1 and the least total plant biomass did in 40%T2. In terms of the effects of UV-B and drought stress on photosynthetic indices, similar tendency was observed amongPn,TrandGs, butCihad reverse trend with these three indices. The three indices were found reaching the largest at growth season, but decreased to the lowest at harvest period in the combined 40%T2 treatment. Both UV-B and drought stress could promote the accumulation of four phenolic compounds, in which the former had more prominent influence. Both contents of SAB and RA increased 4.28 and 8 folds, respectively, under UV-B radiation, which were significantly higher than 1.12 and 1.51 folds in drought stress treatment. The SAB andRAaccumulation reached the highest level (4.75 and 3.15 μg/g, respectively) in the combined treatment 75%T2. Statistical data also exhibited that there was a cross-talk in accumulation of phenolic compounds between UV-B and drought stress. The SAB content increased 4.28 folds in T2 radiation intensity, while only 2.18 folds were observed in T1. The content increased 1.12 and 0.52 folds in drought stress treatment with 40% and 55% field water capacity, respectively. If combined UV-B radiation and drought stress, the SAB content would increased 2.69 and 1.67 folds in 40%T2 and 55%T2 treatments, respectively. In conclusion, there was a cross-talk between UV-B radiation and drought stress, which had combined effects on the growth ofS.miltiorrhizaand accumulation of phenolic compounds in leaves. Relatively, UV-B radiation had stronger influence than drought stress. Either UV-B radiation or drought stress had negative effect on plant growth. The higher UV-B radiation intensity (T2, 4.10 kJ/m2) was helpful to accumulation of SAB, but the amount of accumulation would be decreased with the increase of drought stress intensity.
SalviamiltiorrhizaBunge; UV-B; drought; morphology; salvianolic acid B
国家自然科学基金项目(81373908); 陕西省科技统筹项目(2012KTCL02-07); 陕西省科技计划项目(2012K19-02-02)
2013-11-15;
2014-09-09
10.5846/stxb201311152735
*通讯作者Corresponding author.E-mail: liangzs@ms.iswc.ac.cn
刘景玲, 齐志鸿, 郝文芳, 张辰露, 刘峰华, 梁宗锁, 刘文婷.UV-B辐射和干旱对丹参生长和叶片中酚酸类成分的影响.生态学报,2015,35(14):4642-4650.
Liu J L, Qi Z H, Hao W F, Zhang C L, Liu F H, Liang Z S, Liu W T.The effects of drought and UV-B radiation on the growth and the phenolic compounds of theSalviamiltiorrhizaBunge leaf.Acta Ecologica Sinica,2015,35(14):4642-4650.

