腹膜后巨大分化良好型脂肪肉瘤1例
马海龙,梁顺华,严建宇,宫 磊
腹膜后巨大分化良好型脂肪肉瘤1例
马海龙,梁顺华,严建宇,宫 磊
报告1例腹膜后巨大分化良好型脂肪肉瘤患者的临床和病理资料,及其治疗转归。总结经验:腹膜后分化良好型脂肪肉瘤有较高的复发率,其诊断主要依靠组织病理学,外科手术切除是主要的治疗手段。
腹膜后分化良好型脂肪肉瘤;病理诊断;外科手术
腹膜后脂肪肉瘤(retroperitoneal liposarcoma,RPLS)是临床上比较少见的一类疾病,其发病率占恶性肿瘤的1%以下[1]。其中,分化良好型脂肪肉瘤(well differentiated liposarcoma,WDL)是较常见的一类软组织肿瘤,临床将大于5 kg的腹膜后肿瘤称为巨大肿瘤。现报道1例腹膜后巨大分化良好型脂肪肉瘤患者的临床资料,并对其诊断及治疗进行探讨。
1 临床资料
1.1 一般资料 患者,男,31岁。因“持续性腹胀1年,加重4 d”入院。患者于1年前无明显诱因感有腹胀,进食后稍明显,起初未留意,后症状进行性加重。2015-01-16于笔者所在医院门诊就医,行B型超声检查提示:腹腔内巨大肿物,诊断为:巨大脂肪肉瘤待查,遂收入普外科。
1.2 入院检查 神志清,精神可;消瘦,皮肤黏膜无黄染,全身体表淋巴结未触及肿大;心肺正常;右中下腹部高度膨隆,自右侧肋缘下至耻骨联合上可扪及一巨大包块,表面光滑,质较硬,活动度差,边界尚清,无明显压痛。
1.3 实验室检查 血、尿、粪常规、肝肾功能、电解质未见异常,胸片及心电图未见明显异常。腹部计算机X线断层扫描(Computed Tomography,CT)及增强检查示:腹腔内自右膈下至盆腔巨大实性占位,大小约60 cm×42 cm×38 cm,呈脂肪密度,CT值约49 Hu,未见明显强化;肝、右肾及结肠等脏作器均向左移位,考虑为腹膜后巨大脂肪肉瘤(图1),考虑可能来源于右肾包膜。
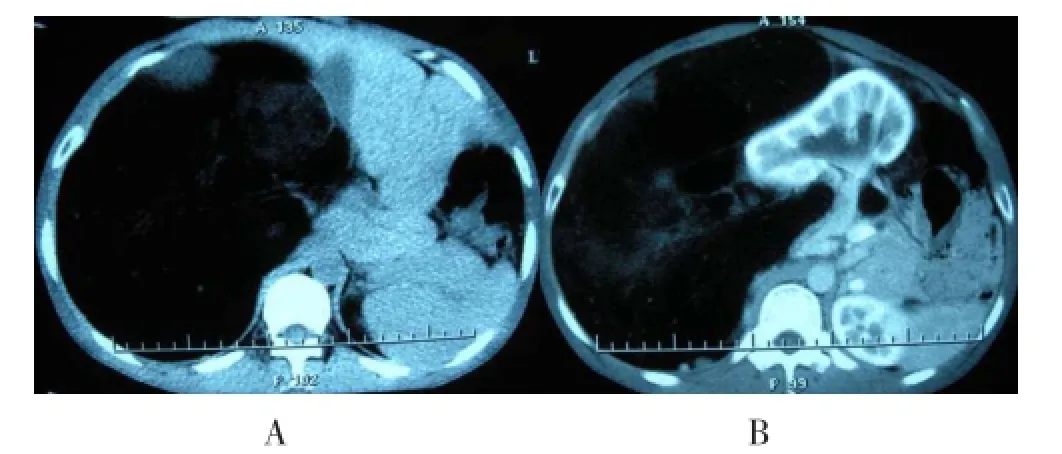
图1 腹部CT检查结果A.挤压右肾至偏左侧;B.挤压肝脏至左侧
1.4 治疗 患者入院后经检查基本明确诊断,无手术禁忌,并确定无远处转移后,于2015-01-21行手术切除。自腹部正中切开入腹,入腹即见巨大肿瘤,质硬。探查发现肿瘤向上起自膈下肝右侧,将肝脏、横结肠及结肠肝曲推挤至左侧,并将结肠中动脉推移至左下腹,右肾位于腹腔中部;向下探查见肿瘤与右肾脂肪囊粘连,下极至盆腔上缘,上极挤压第一肝门后,紧贴腔静脉;右侧紧贴于右侧腹壁。切开被顶起的腹膜至肿瘤被膜,沿肿瘤壁仔细游离覆盖的被膜,间隙较明显,拟将肿瘤完整切除,游离至右肾时,发现肿瘤与肾被膜有一蒂相连,并与右输尿管粘连紧密,为减少肿瘤复发概率,遂切除右肾及输尿管。在保证下腔静脉、门静脉、腹主动脉、髂外动静脉及对侧肾动静脉完好情况下,将肿瘤完整切除,清扫肝门部及手术视野内可见淋巴结,切除肿瘤包被被膜,在肿瘤蒂周围均匀涂撒中人氟安(植入用缓释氟尿嘧啶)行局部化疗。切除的两个肿瘤大小分别为:32 cm×24 cm×23 cm和26 cm×26 cm×21 cm,总重量约10.87 kg。大体观:表面光滑,有完整包膜,质韧;切面呈黄色,有分叶,似脂肪瘤样。
1.5 病理检查 标本经10%中性福尔马林液固定,常规脱水,石蜡包埋,4 μm切片,苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,光镜观察。镜检:瘤细胞形态多样,主要由分化成熟的脂肪瘤样细胞组成,以出现脂肪母细胞为特点,胞质内可见多少不等,大小不一脂质空泡(图2)。病理诊断:分化良好型脂肪肉瘤(脂肪瘤样型)。

图2 切除肿瘤组织病理学观察(HE,×300)
1.6 结果 患者于术后第8天切口拆线出院,截至目前B超
随访6个月余,未见肿瘤复发。
2 讨 论
脂肪肉瘤多发于腹膜后、大腿内侧、腋窝等脂肪含量较多区域,也罕见于胃和四肢。基于脂肪肉瘤的形态学和细胞学的异常,按病理学分类[2],将其分为分化型、去分化型、粘液性、多形性和圆形细胞型四种类型。其中,WDL最为常见,约占脂肪肉瘤的40%~45%[3],属中间性局部侵袭性肿瘤,易复发,不易转移,却有进展为高度恶性的去分化脂肪肉瘤(dedifferentiated liposarcoma,DDL)的可能,继而具有转移能力,导致患者愈后较差。因WDL在组织学上与良性脂肪瘤鉴别困难,且病程进展缓慢,在临床恶性肿瘤中发生率又较低,造成部分临床医师对其缺乏足够认识,因此,有必要对该病的诊断及外科治疗做深入的研究。
本例患者因腹腔内肿物生长相对较缓慢,早期未引起足够的重视,导致病情持续约1年才就诊。B超初步检查提示:腹腔占位,腹部增强CT检查基本明确诊断,并推测其可能来源于右肾包膜。术后经病理证实为:分化良好型脂肪肉瘤(脂肪瘤样型)。目前,治疗该病的唯一有效方法是外科手术切除[4],而完全切除至关重要,这是减少术后复发的关键[5]。笔者认为,即使完全切除肉眼可见的肿瘤结节,也可能会遗留肉眼无法看见的微小肿瘤灶,这可能是造成肿瘤术后复发的主要原因。因此,局部行化疗治疗对预防肿瘤复发具有重要作用。本例患者术中切除肿瘤后在局部手术创面及与肿瘤粘连紧密组织处行中人氟安(植入用缓释氟尿嘧啶)局部化疗,术后至今,行B超随访已6个月(患者因经济条件原因,拒绝行CT复查),尚未发现肿瘤复发和转移,但其远期效果,尚需继续密切观察随访或长期对照研究证实。
鉴于WDL有进展为高度恶性的DDL及术后原位复发倾向,术前的影像学检查及术中病理诊断对判断肿瘤的性质及决定手术方式至关重要[6],并且由于腹膜后肿瘤一般体积较大,病理取材应多点采样,以免遗漏恶性组织。Serio等[7]在1989年首先提出了完全切除肉眼可见肿瘤的概念,后续研究相继发现,镜下手术切缘是否无肿瘤细胞残余对患者生存期并无影响,但肉眼下肿瘤是否切除干净,对生存期影响显著[8-10]。另外,针对侵犯周围临近组织器官,如肾脏、输尿管、胃肠道、脾脏等,造成根治性切除较为困难的腹膜后脂肪肉瘤,Lee等[11]认为,联合脏器切除对控制肿瘤局部复发及患者生存率非常必要。对于术中有肿瘤残留,是否需要放、化疗等辅助治疗,学术界观点不一。目前尚无证据表明,辅助放、化疗能延长此类患者生存期,而其复发与是否有肿瘤残留相关性不高,主要与肿瘤的病理类型相关。因此对于腹膜后巨大分化良好型脂肪肉瘤患者,术前需行B超、CT检查以尽早明确诊断,治疗以最大限度完全切除肿瘤为原则,对于侵犯重要脏器者,如确实无法切除,也可行姑息性手术,术后结合病理分型密切随访,CT和MRI检查有助于鉴别手术疤痕或小的复发肿瘤[12],早发现早切除,可改善患者愈后。另外,近期对WDL的基因治疗研究值得临床医师密切关注[13]。
综上所述,腹膜后巨大分化良好型脂肪肉瘤是一种涉及到腹部外科、肿瘤内科、影像科、病理科等多个学科,因此,术前进行肿瘤多学科综合治疗协作(multidisciplinary team,MDT),可能会对该病的规范化治疗带来好处。
[1]Dalton R R, Donohue J H, Mucha P Jr, et al. Management of retroperitoneal sarcomas [J]. Surgery, 1989, 106(4): 725-732.
[2]Suster S, Morrison C. Sclerosing poorly differentiated liposarcoma: Clinicopathological, immunohistochemical and molecular analysis of a distinct morphological subtype of lipomatous tumour of soft tissue [J]. Histopathology, 2008, 52(2): 283-293.
[3]向 华, 王 坚, 朱雄增. 脂肪肉瘤的细胞和分子遗传学研究[J]. 中华病理学杂志, 2003, 32(2): 165-167.
[4]苗海港, 邱法波, 李赞滨, 等. 原发性腹膜后脂肪肉瘤36例临床分析[J]. 青岛大学医学院学报, 2015, 0(1): 110-112.
[5]吴德全. 复发性腹膜后脂肪肉瘤诊治分析[J]. 中国实用外科杂志, 2014, 34(4): 336-338.
[6]杨志勇, 高 兵. 原发性腹膜后脂肪肉瘤的CT诊断[J]. 中国医药导刊, 2014, 16(6): 1080-1081.
[7]Serio G, Tenchini P, Nifosi F, et al. Surgical strategy in primary retroperitoneal tumours [J]. Br J Surg, 1989, 76(4): 385-389.
[8]Singer S, Antonescu C R, Riedel E, et al. Histologic subtype and margin ofresection predict pattern of recurrence and survival for retroperitoneal liposarcoma [J]. Ann Surg, 2003, 238(3): 358-370.
[9]Neuhaus S J, Barry P, Clark M A, et al. Surgical management of primaryand recurrent retroperitoneal liposarcoma [J]. Br J Surg, 2005, 92(2): 246-252.
[10]Strauss D C, Hayes A J, Thway K, et al. Surgical management of primary retroperitoneal sarcoma [J]. Br J Surg, 2010, 97(5): 698-706.
[11]Lee S Y, Goh B K, Teo M C, et al. Retroperitoneal liposarcomas: The experience of a tertiary Asian center [J]. World J Surg Oncol, 2011, 9: 12.
[12]张 鹏, 陶凯雄, 陈俊华. 原发性腹膜后脂肪肉瘤的诊断与治疗[J]. 腹部外科, 2014, 27(1):15-18.
[13]李伟民, 李 霄, 周景师, 等. 应用基因芯片技术研究原发性腹膜后脂肪肉瘤组织特异性候选基因[J]. 现代生物医学进展, 2013, 13(7): 1205-1209.
(2015-06-03收稿 2015-08-17修回)
(责任编辑 付 辉)
1 case of large retroperitoneal well-differentiated liposarcoma
MA Hailong, LIANG Shunhua, YAN Jianyu, and GONG Lei. Department of General Surgery, Xinjiang Provincial Corps Hospital, Chinese People’s Armed Police Forces, Urumqi 830091, China
This paper reported clinical and pathological data of 1 case of large retroperitoneal well-differentiated liposarcoma, and its treatment outcome. The experience was summarized: large retroperitoneal well-differentiated liposarcoma had a high recurrence rate, and its diagnosis mainly depended on histopathology, surgical resection was the main therapatic method.
retroperitoneal well-differentiated liposarcoma; pathology diagnosis; surgery
R735.4
10.13919/j.issn.2095-6274.2015.10.018
马海龙,博士研究生在读,副主任医师,
E-mail: mhl1049@sina.com
830091 乌鲁木齐,武警新疆总队医院普外科

