HPLC测定柿叶提取物中芦丁在大鼠体内的血药浓度及药动学研究
陈杨芳
HPLC测定柿叶提取物中芦丁在大鼠体内的血药浓度及药动学研究
陈杨芳
目的建立高效液相色谱法(high performance liquid chromatography,HPLC)测定柿叶提取物中芦丁在大鼠体内的血药浓度,并探讨其在大鼠体内药物代谢动力学(以下简称药动学)特征。方法SD大鼠给予柿叶提取物灌胃,在不同时间点眼后静脉丛取血,预处理后测定血浆中芦丁的浓度,经3P97软件处理数据。结果柿叶提取物中芦丁在大鼠体内的药动学符合二房室模型,芦丁在体内较快地被吸收,给药后1 h即达到峰浓度,峰浓度Cmax为(1.658±0.184) mg/L,其他主要药动学参数吸收速率常数Ka=(2.436±0.883)/h、分布速率常数α=(1.002±0.372)/h、消除速率常数β=(0.083±0.067)/h、消除半衰期t1/2β=(9.418±7.256)h、药-时曲线下面积AUC0-12=(9.628±2.281)mg·h/L。结论高效液相色谱法测定血浆中芦丁浓度准确、简便,适用于柿叶提取物中芦丁的药动学研究。
芦丁;柿叶提取物;药动学;高效液相色谱法
柿叶为柿树科(Ebenaceae)柿树属Diospyros L.植物柿Diospyros kaki Thunb.的树叶[1],具有清热解毒、润肺强心、镇咳止血、抗癌防癌等作用[2,3]。柿叶作为药用始载于明朝《滇南本草》,曰“经霜叶敷臁疮”;《本草再新》记载用于“治咳嗽吐血,止渴生津”;以后诸家本草及医(药)书也多有收载。黄酮类化合物是柿叶中主要的化学成分,已发现的黄酮类化合物有黄芪苷、槲皮素、异槲皮素、芦丁、山萘酚3-O-β-D-葡萄糖苷、山萘酚、杨梅树皮苷等[4]。芦丁是其主要黄酮成分之一,有关芦丁单体及柿叶总黄酮中芦丁的药动学研究已有相关报道[5,6],但均为静脉给予动物柿叶总黄酮后芦丁在其体内的药动学过程。本实验通过研究大鼠给予柿叶提取物芦丁灌胃后体内的药动学,旨在揭示其在动物体内的动态变化特征,为开发心血管类药品及保健食品奠定基础。
1 材料与方法
1.1 材料 日本岛津LC-10AT高效液相色谱仪(包括SPD-10A紫外检测器,N2000色谱工作站);高速离心机(美国Sigma公司);快速混匀器(江苏金坛医疗仪器厂);梅特勒AL204分析天平(梅特勒仪器有限公司);微量移液器(大龙仪器公司)。
芦丁对照品(中国食品药品检定研究院,批号:100080-201409);柿叶提取物(自制,HPLC法测得芦丁含量为9.317 mg/g);甲醇、乙腈(色谱纯,美国TEDIA公司);娃哈哈纯净水(杭州娃哈哈集团),其余试剂均为分析纯。
雄性SD大鼠[江苏大学动物实验中心,合格证号:SCXK(苏)2009-0002]5只,体重(250±20)g。
1.2 方法
1.2.1 色谱条件 色谱柱:Kromasil C18(250×4.6 mm,5 µm);流动相:甲醇-0.2%醋酸溶液=45∶55;流速:1 ml/min;紫外检测波长:360 nm;柱温30 ℃;进样20 µl。
1.2.2 柿叶提取物的制备 称取干燥的柿叶粉末适量,置烧瓶中,分别加入10、8倍量60%乙醇加热回流提取2次,每次1 h,过滤,滤渣用60%乙醇润洗,合并滤液,浓缩除乙醇并冷冻干燥即得,经HPLC测得提取物中芦丁含量为9.317 mg/g。
1.2.3 对照品溶液的配制 精密称取芦丁对照品适量置10 ml容量瓶中,加甲醇溶解并稀释至刻度,制得含芦丁81.6 mg/L的对照品溶液。
1.2.4 血浆样品预处理 大鼠眼眶后静脉丛取血0.3 ml置于已肝素化的离心管中,高速离心(13 000 r/min)5 min,分离得血浆。精密吸取血浆0.1 ml,加0.2 ml甲醇沉淀蛋白,涡流振荡1 min,高速离心(13 000 r/min)5 min,取上清0.45 μm微孔滤膜滤过即得。
1.2.5 方法学考察
1.2.5.1 方法的专属性 将空白血浆、空白血浆中加入芦丁对照品、灌胃柿叶提取物血浆样品按1.2.1色谱条件下进样,考察芦丁主峰的特异性,是否与其他峰分离度良好。
1.2.5.2 线性范围及检测限 精密吸取芦丁对照品溶液适量,置于1 ml离心管中,加入大鼠空白血浆100 µl,配制成芦丁浓度为0.204、0.408、0.816、2.040、4.080、8.160 mg/L的血浆样本,并进行色谱分析,以峰面积Y对血药浓度X进行线性回归。
1.2.5.3 准确度和精密度 配制含芦丁0.204、0.816、4.080 mg/L的低、中、高浓度的血浆样品,各浓度测5次,连续测定3 d,计算芦丁的含量,计算方法的准确度和精密度。
1.2.5.4 提取回收率 配制含芦丁0.204、0.816、4.080 mg/L的低、中、高浓度的血浆样品各5份,进样20 μl,测定得到峰面积(5次测定的平均值)A1;以同时配制等浓度的对照品溶液进样得到的峰面积(5次测定的平均值)A2作为对照,计算得低、中、高3个质量浓度的血浆样品中芦丁的提取回收率(R=A1 /A2×100%)。
1.2.5.5 稳定性考察 配制含芦丁的低、中、高3个浓度0.204、0.816、4.080 mg/L的血浆样品,考察室温放置稳定性、临时储存稳定性及长期储存稳定性。
1.2.6 药动学研究 大鼠给药前禁食不禁水,给予柿叶提取物4 g/kg(给药剂量按芦丁算为37.268 mg/kg)灌胃,以0.5%的羧甲基纤维素钠制成混悬液灌胃,并于给药前和给药后0.083、0.25、0.5、0.75、1、1.5、2、3、4、6、8、12 h眼眶后静脉丛取血,置于肝素化离心管中,分离血浆,-20 ℃保存。再按“1.2.4血浆样品预处理”项步骤操作。
1.3 统计学处理 数据均表示为,血浆中芦丁的峰浓度Cmax及达峰时间Tmax由实测数据直接得出,其他药动学参数由血药浓度数据采用3P97软件处理。
2 结 果
2.1 方法的专属性 空白血浆、空白血浆中加入芦丁对照品、灌胃柿叶提取物血浆样品色谱图见图1,芦丁与其他干扰组分分离效果良好,无杂质峰干扰。
2.2 线性范围及检测限 线性方程为Y=7729.5X+803.75(R2=0.9996),血浆中芦丁在0.204~8.160 mg/L线性关系良好,血浆中检测限为0.0408 mg/L。
2.3 准确度和精密度 该检测方法的准确度及精密度结果见表1。
2.4 提取回收率 低、中、高3个浓度的血浆样品中芦丁的提取回收率分别为82.5%、80.7%、83.3%,平均提取回收率为82.2%,符合药动学实验要求。
2.5 稳定性考察 血浆样品预处理后室温下放置24 h稳定;样品经4 ℃冰箱储存3 d保持稳定;样品在-20℃冰冻保存3周稳定。
2.6 药动学结果 血药浓度数据见表2,用3P97药动学程序对血药浓度数据拟合计算,结果表明柿叶提取物中的芦丁在大鼠体内的药动学符合二房室模型,主要的药动学参数见表3,其平均药-时曲线见图2。
表1 血浆样品中芦丁的准确度和精密度 (n=5; )
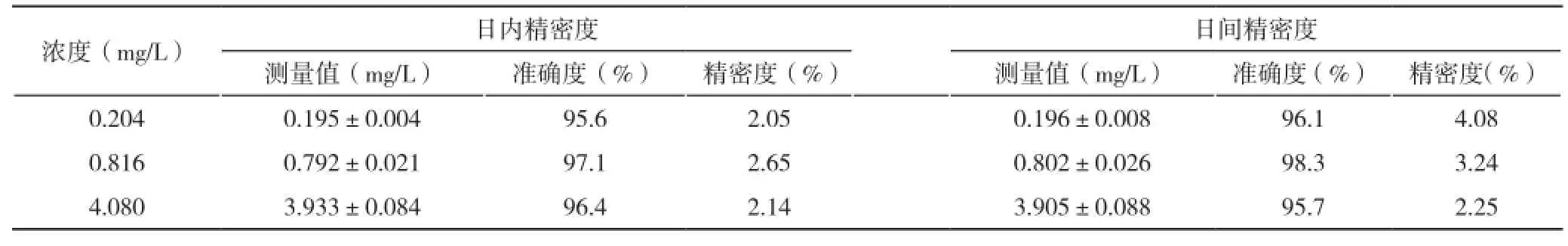
表1 血浆样品中芦丁的准确度和精密度 (n=5; )
浓度(mg/L) 日内精密度 日间精密度测量值(mg/L) 准确度(%) 精密度(%) 测量值(mg/L) 准确度(%) 精密度(%)0.204 0.195±0.004 95.6 2.05 0.196±0.008 96.1 4.08 0.816 0.792±0.021 97.1 2.65 0.802±0.026 98.3 3.24 4.080 3.933±0.084 96.4 2.14 3.905±0.088 95.7 2.25

表2 5只雄性SD大鼠不同时间血药浓度数据 (mg/L)
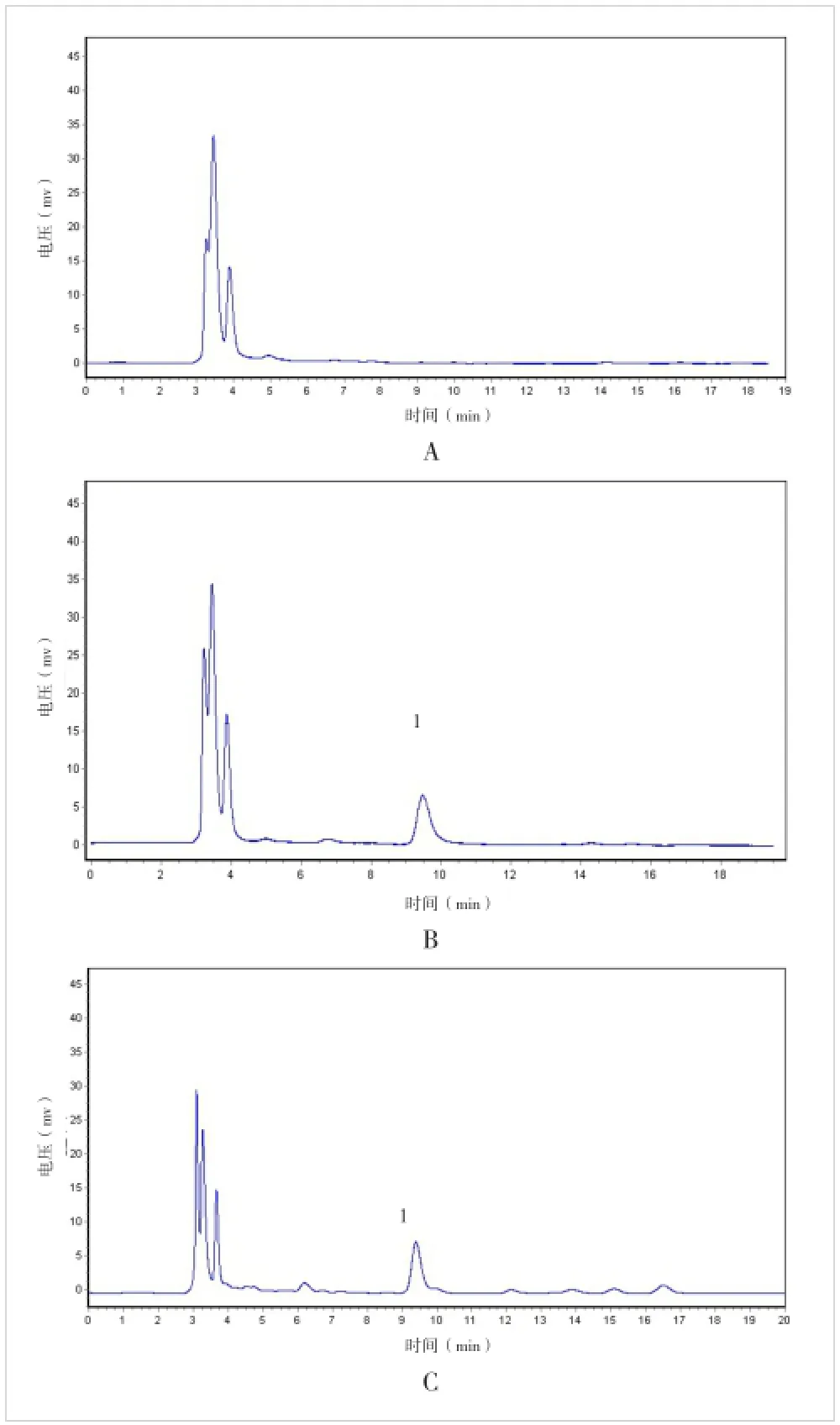
图1 大鼠血浆样品中芦丁的HPLC色谱A.空白血浆;B.空白血浆加芦丁对照品;C.灌胃柿叶提取物后的血浆样品;1:芦丁(保留时间约9.5 min)
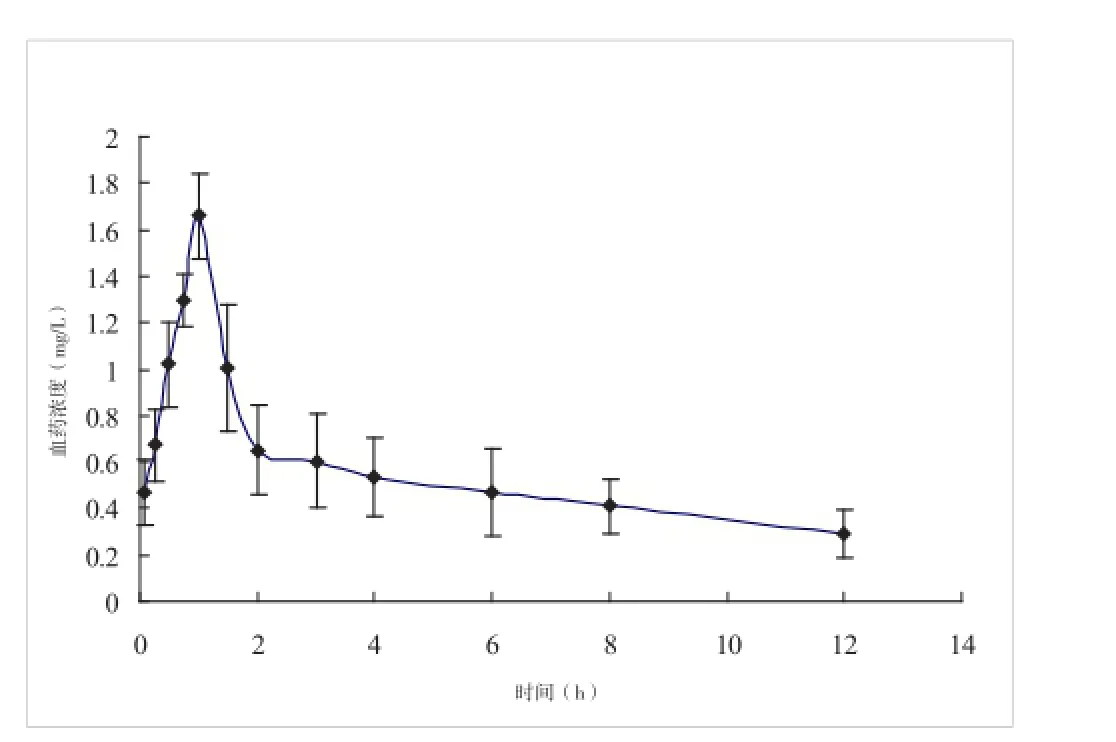
图2 柿叶提取物中芦丁在大鼠体内的平均药-时曲线(n=5; )

表3 主要药动学参数
3 讨 论
本研究对血浆样品处理方法进行了一系列筛选,尝试了固相萃取法及有机溶剂蛋白沉淀法。通过比较发现固相萃取法提取回收率较低,且操作较蛋白沉淀法繁琐,所以选定有机溶剂蛋白沉淀法。其中分别比较了甲醇、乙腈、6%高氯酸、三氯乙酸等有机溶剂,通过综合比较杂质干扰及提取回收率因素,发现甲醇沉淀蛋白效果最好。同时考察了不同体积比的血浆-甲醇(1∶2,1∶3,1∶4)对芦丁测定的影响,结果随着甲醇体积比的加大,血浆杂质峰并无明显减少,且随着甲醇量的增大,样品相应的稀释倍数加大,不利于样品的测定,故选定以血浆-甲醇(1∶2)作为沉淀蛋白条件。
试验中对芦丁进行了全波长扫描,发现芦丁有3个特征吸收峰:分别为208、260和360 nm。208 nm近末端吸收,不利于样品的检测;检测波长在260 nm处杂质峰较360 nm处强,故选择360 nm作为芦丁的检测波长。
本研究表明大鼠灌胃柿叶提取物后芦丁在大鼠体内药动学过程符合二房室模型。通过吸收速率常数Ka=(2.436±0.883)/h,表明芦丁在胃肠道能较快地被吸收,且灌胃后大鼠血浆中的芦丁在1 h即达峰值Cmax=(1.658±0.184)mg/L,且分布速率常数α=(1.002±0.372)/h表明芦丁进入大鼠体循环后能迅速地分布,从而迅速发挥药效。另外,消除速率常数β=(0.083±0.067)/h和消除半衰期t1/2β=(9.418±7.256)h表明,芦丁在体循环中消除较慢,这也提示在开发保健食品或者药品时应合理设计服用间隔时间。
由于本研究对象为柿叶提取物,为柿叶中某一系列化合物的混合物,各个化学成分之间的相互作用都有可能导致芦丁的吸收、分布及代谢等发生变化。文献[5]报道芦丁单体化合物静脉注射后芦丁在大鼠体内符合二室模型,与本研究一致,但其消除半衰期t1/2β为1.21 h,远小于本研究的消除半衰期t1/2β的(9.418±7.256)h,可能原因在于由于其为单体化合物,而本研究对象为一系列复杂化合物的混合物,与芦丁单体化合物相比,一方面混合物中的某些化合物可能会延缓芦丁在体内的代谢过程,另一方面可能为混合物中的槲皮素类苷元在体内经过一系列变化转化为芦丁,从而导致其在体内的消除半衰期延长。本研究结果为柿叶的新药开发及后续临床给药方案研究提供了实验依据。
[1]国家中医药管理局《中华本草》编委会. 中华本草[M].上海:上海科学技术出版社,1999: 140-141.
[2]周鑫堂, 王丽莉, 韩 璐, 等. 柿叶化学成分和药理作用研究进展[J]. 中草药,2014, 45(21): 3195-3203.
[3]辛 宁, 丰 杰, 姚 波. 柿叶黄酮类提取分离及药理作用研究概况[J]. 中医药学报, 2007, 35(2): 49-51.
[4]王 燕. 柿叶中黄酮类化合物的研究进展[J].亚太传统医药, 2011, 7(4): 173-174.
[5]杨子华. HPLC法检测大鼠血浆中芦丁浓度及其药物动力学[J]. 中国药师, 2012, 15(6): 853-855.
(2015-08-04收稿 2015-09-02修回)
(责任编辑 付 辉)
Study on plasma concentration of rutin in extract of persimmon leaves in rats by HPLC and its pharmacokinetics
CHEN Yangfang. Institute for Drug Control of Yangzhong, Zhenjiang 212200, China
ObjectiveTo establish a high performance liquid chromatography (HPLC) method for measuring the concentration of rutin in extract of persimmon leaves in rats, and to study its pharmacokinetics.MethodsBlood sample were collected through venous plexus in rat eye at different time after oral administration of the extract of persimmon leaves. After liquid extraction with methanol, the concentration of rutin in plasma was measured. Then pharmacokinetics parameters were calculated by 3P97 program.ResultsThe results showed that plasma concentration-time curve of rutin in rats was coincided with two-compartment model, rutin was absorbed fast in rats. Peak concentration (Cmax) of rutin in rat plasma was (1.658±0.184) mg/L one hour after oral administration. The other main pharmacokinetic parameters were as follows: absorption rate constant (Ka) was (2.436±0.883)/h, distribution rate constant (α) was(1.002±0.372)/h, elimination rate constant (β) was (0.083±0.067)/h, elimination half time (t1/2β) was (9.418±7.256) h, area under the concentration-versus-time curve (AUC0-12) was (9.628±2.281) mg·h/L.ConclusionsHPLC method is accurate and sensitive, it is suitable for the pharmacokinetic study of rutin in extract of persimmon leaves in rats.
rutin; extract of persimmon leaves; pharmacokinetics; HPLC
R74
10.13919/j.issn.2095-6274.2015.10.009
陈杨芳,硕士,工程师,E-mail: 408785385@qq.com
212200 镇江,江苏省扬中市药品检验所

