经导管肾交感神经去神经化的临床应用现况与前景
李洪仕,万征
· 专家论坛 ·
经导管肾交感神经去神经化的临床应用现况与前景
李洪仕,万征

万征 教授
肾交感神经去神经化(RDN)在当前备受争议。上世纪初,RDN在高血压外科治疗领域逐步兴起并取得长足进步(表1),多数患者血压可以得到理想控制,但由于存在多种副作用和并发症,在20世纪中逐渐被口服降压药所取代。然而,顽固性高血压(RH)又成为药物治疗的瓶颈。2009年,Krum等[1]率先应用经导管RDN技术治疗RH取得初步成效。随后,SYMPLICITY HTN-2(表1)结果表明[2],RDN对于部分RH患者具有安全持久的降压作用。同期小型研究显示,经导管RDN对于轻中度RH、心律失常和心力衰竭等涉及交感神经活性增加的疾病也具有良好效果,例如一项20例轻度RH患者(平均60.6岁,基础血压148.4/83.0 mmHg,1 mmHg=0.133kPa)的研究显示,经导管RDN后6个月患者血压下降13/5 mmHg[3]。在上述背景下,SYMPLICITY系列研究陆续展开(表2)。
然而,SYMPLICITY HTN-3的阴性结果却冲淡了应用RDN治疗RH的热情。这是一项多中心、前瞻性的随机对照研究,分为治疗组(n=364,用Symplicity消融导管系统行RDN)和对照组(n=171,仅做肾动脉造影检查)。随访6月,治疗组比对照组在降低收缩压方面没有获益[9]。于是,Medtronic公司暂停SYMPLICITY HTN 4和其在日本及印度进行的HTN临床入组工作(表2)。RDN该何去何从,本文就此展开分析。
1 关于RDN的两种不同观点
1.1 反对RDN的主要观点
1.1.2 RDN治疗RH的最初研究SYMPLICITYHTN-1和HTN-2试验在临床设计上存在明显缺陷,其结论难以让人信服[5]SYMPLICITY HTN-1未设对照组,且均未试用可乐定等中枢交感神经抑制剂;SYMPLICITY HTN-2是由非假手术组作为对照,不排除心理因素对诊室血压的影响。同时,在这些暗示“RDN有效”研究中也存在着15%~50%的“无应答者”[11]。此外,肾交感神经末稍存在再生现象,Rippy等在对猪行实验研究时发现,射频消融6个月后肾动脉壁内交感神经元可再生[12],因此RDN的远期疗效受到质疑,这也从侧面解释SYMPLICITY HTN-3的结果为阴性缘由。

表1 RDN与高血压治疗的历史沿革

表2 SYMPLICITY系列研究[9]
1.1.3 SYMPLICITY HTN-3试验四大优势①试验规模更大:样本量是前两项SYMPLICITY试验的5倍。②入选标准严格:初筛患者,要求18~80岁、收缩压(SBP)≥160 mmHg(一次就诊坐位测量3次血压,取均值作为诊室血压),接受≥3种最大耐受量的抗高血压药,其中包括一种最大耐受量的利尿剂。入选前4周,抗高血压药物治疗2周,再由患者在家中以日记形式记录早、晚血压,作为服药的家庭血压,最终以此标准,SBP≥160 mmHg,且24 h动态血压监测SBP≥135 mmHg的患者入选。排除标准是,继发性高血压和前一年因高血压急症不止1次住院的患者。同时还加入解剖学排除标准,即肾动脉狭窄超过50%、肾动脉瘤、既往肾动脉介入治疗、多重肾动脉、肾动脉直径小于4 mm或肾动脉可治疗段的长度小于20 mm[8]。③应用动态血压进行评估,最大限度减少白大衣效应。④真正随机双盲试验,其假手术设计值得称赞。因此,SYMPLICITY HTN-3的结果令人信服,并且已回答了核心问题,即在控制RH方面,“RDN没有效果”。
1.2 支持RDN的观点
1.2.1 RDN通过特异性阻断肾脏传出和传入神经达到控制血压的目的[7]肾交感神经是血压调节的重要环节,其传入纤维可通过中枢调节全身的交感神经张力,其传出纤维可在肾脏水平调节肾素-血管紧张素系统,这是RDN的理论基础,已经近一个世纪的基础实验和外科实践所证实,只是某些细节尚待研究。
1.2.2 SYMPLICITY HTN-2将106例RH患者随机分为RDN组(RDN+药物治疗,n=52)和对照组(单纯药物治疗,n=54) 尽管没有在对照组中实施“假手术”,随访6个月后,37例对照组患者转而接受RDN,结果是其中30例患者在继续随访30个月时血压有效下降,SBP和舒张压(DBP)分别下降34 mmHg和13 mmHg,而初始入RDN组的40例患者在持续随访36个月时仍有效,SBP和DBP分别下降33 mmHg和14 mmHg。因此,长期随访结果显示,经导管RDN可产生持续的降压效果,而无严重安全隐患[13]。
1.2.3 因SYMPLICITY HTN-1和HTN-2的缺陷而“完美”设计SYMPLICITY HTN-3,但实施中却存在诸多缺陷[11]①许多无实际RDN操作经验的医生与医学中心参与了此次试验。②手术监督人为公司职员,而非有经验的医师。③肾脏神经在肾动脉远端更近血管内膜,而该试验却优选肾动脉近端消融。④对所有储存的血管造影和手术记录进行回顾性分析显示,74%患者未行充分的双肾动脉消融(即依次螺旋消融肾动脉截面的不同位点);相比按照试验方案消融双侧肾动脉的患者,其血压下降幅度与之前的SYMPLICITY试验相似。Esler教授指出,RDN的本质是一项高血压的神经科学试验,涉及RH起因的神经科学理论、神经解剖学知识和神经消融设备的工程学基础,而这些在SYMPLICITY HTN-3的实施中并未全面关注,故其结论难以令人信服。
三是专业人才培养课程体系的改革问题。课程体系安排,直接决定了学生能力发展方向和专业知识积累水平。传统专业的课程设置,以专业课教学为主,忽略学生实践动手、创新创业、思维能力等方面的课程设置,进而使学生主动适应社会竞争的意识相对落后,与人沟通、谈判能力相对欠缺,特别是在新时代背景下的综合竞争力显著滞后。
1.2.4 来源于真实临床实践的研究数据更具临床可信性和实用性人们设计了大样本“全球SYMPLICITY注册研究”。2014年,华盛顿ACC科学会议公布了其初步1000例数据的分析结果[14],与基线相比RDN显著降低患者的诊室血压和动态血压。6个月时,随访的751例患者诊室收缩压平均下降值为11.9 mmHg;其中基础SBP≥160 mmHg的亚组患者,平均下降值为21.4 mmHg。进行动态血压监测的404例患者动态血压平均下降值为7.9 mmHg。这与SYMPLICITY HTN-3试验结果恰恰相反。2013年ACC共识曾指出,RDN应在有足够经验的专业化医学中心进行[7],SYMPLICITY HTN-3恰恰忽略了这一点。而参与的医生至少已有30例RDN经验,他们大多参加过SYMPLICITY HTN-1和HTN-2研究,因此,“全球SYMPLICITY注册研究”克服了HTN-3术者经验过少的缺陷,经导管RDN仍有望成为RH治疗的一种手段。
1.3 理性的思考——矛盾的统一回顾历史,从早期的外科手术到当今的导管消融,RDN的影响已非常广泛(表1),不能因为“结果阴性”,就全盘否认其他已有的RDN研究结果。因此,SYMPLICITY HTN-3带给我们的不应是RDN的终结,而是一种理性的思考——要认识到目前经导管RDN还并不成熟,要从基础到临床重新审视[5]。
2 肾交感神经的解剖生理揭示RDN的可行性
1987年,Webb等[15]发现电刺激交感传入纤维可以降低血压。随后,Campese等[16]发现,切除肾脏交感传入神经可以阻止下丘脑去甲肾上腺素能神经元激活,并延缓慢性肾功能不全大鼠的血压进展。Converse[17]和Hausberg[18]分别观察到双肾切除的透析患者和肾移植患者的外周血管阻力和血压均明显降低。那么,肾交感神经如何实现血压调节?在未治疗的原发性高血压患者中,研究者使用局部去甲肾上腺素同位素稀释方法测量了肾脏交感神经流向血浆的递质外流量——“肾脏去甲肾上腺素外流量”,发现患者的肾交感神经外流处于高水平的激活状态,而肾交感神经的激活正是高血压发病机制的核心[11]。进一步解剖生理研究显示,肾交感神经通过神经内分泌机制来调节血压。
肾交感神经分为传入神经纤维和传出神经纤维。其中,由肾脏向中枢传入的神经纤维(简称传入神经)主要是无髓鞘的感觉纤维,起源于肾盂壁的肌层,分别接受来自肾脏机械和化学感受器的牵张和缺血刺激。刺激信号沿传入纤维上行至同侧背根神经节(T6至L4)的细胞体,经过脊髓中间神经元突触,上行至大脑的肾脏心血管中枢-下丘脑室旁核、孤束核、延髓头端腹外侧区和穹窿下器官[19]。其中,延髓头端腹外侧区和孤束核是压力反射弧的一部分,能够分别接受来自肾脏和颈动脉的传入信号,可能交互影响全身的交感神经的张力,从而成为肾脏神经调节全身交感活性的基础,但具体机制尚不清楚。而由中枢向肾脏传出的神经纤维(简称传出神经)源于脑干投射区,节前神经元轴突经脊髓出胸和腰交感干,到达脊椎前和脊椎旁交感神经节,节后神经沿肾动脉进入肾门,经肾动脉外膜沿血管分支,围绕肾血管形成网状神经丛,从皮质到髓质,以皮髓质交界处最为密集,最终到达肾小球动脉;支配着叶间动脉、弓形动脉、小叶间动脉、入球和出球小动脉、肾小球旁器、近端肾小管和髓袢升支粗段等[4]。过度激活的交感传出纤维通过释放去甲肾上腺素,刺激肾血管A型α1受体,导致肾血管收缩,降低肾血流量和肾小球滤过率;刺激球旁细胞的β1受体,增强肾素分泌率;刺激肾小管上皮细胞B型α1受体,促进水钠重吸收[19]。因此,理论上切断肾传出神经,可以通过减少肾素分泌和水钠潴留达到降血压的目的,这也正是RDN的理论基础。
交感神经纤维经过肾动脉外膜,平均地分布于动脉壁周围,主要位于内膜下0.5~2.5 mm处(图1a,少数纤维距离内膜不足0.5 mm,另有纤维远离内膜达10 mm)。因此,经导管RDN的策略是环肾动脉螺旋状消融,而不是消融肾动脉血管的同一位置的二维横截面,这样可以尽量降低肾动脉狭窄的风险[4]。故现行的操作通常是,沿肾动脉长轴方向旋转将其分割为6个区域,两个消融点的间距为5 mm(图1b),从最远一点开始消融,顺序回撤并旋转导管头端至下一靶点消融[20]。
然而,交感神经在肾动脉的分布远没有那么简单。近期Sakakura[21]发现,①从肾动脉近端至远端,交感神经纤维的分布数量逐渐减少,而与内膜的平均距离则越来越近;②神经纤维在动脉横截面圆周上的分布,以腹侧区最多、背侧区最少;③传出纤维的密度远高于传入纤维;④副肾动脉也有交感神经分布;⑤高血压者与非高血压者的神经解剖无差异。因此,在一个给定的肾动脉节段,经导管RDN的有效性似乎取决于肾动脉横截面的方位和交感神经距内皮的深度。当前RDN射频消融系统的消融深度在2~4 mm之间,能否针对变异的神经分布完成有效的去神经化,需要在消融策略和器械上进一步探索。
3 理论与实践的差距——问题出在哪里?

图1 经导管RDN的解剖基础(a)和消融策略(b)[20]
在SYMPLICITY HTN-3之前,经导管RDN虽然有效,但在不同试验中仍然存在15%~50%的“无应答者”。既然RDN治疗高血压在理论上可行,问题究竟出在哪里?一方面,从基础出发,我们不难想到,交感神经系统激活可能并不是“无应答”患者血压升高的主要机制;另一方面,从外科RDN成功的角度看,真正原因或许是技术上的失败——去神经化不完全。
3.1 RDN的适应证原发性高血压的发病机制众多,交感神经过度激活只是其中之一;现行RH的定义是,在应用包括利尿剂在内的3种或以上的足量降压药后,在规定的药物治疗足够长的时间内,血压仍难以达标的特殊类型高血压[22]。但在临床实践中,并非所有RH均与肾脏交感神经过度兴奋有关。究竟哪类高血压人群适合RDN?SYMPLICITY HTN-3的预设亚组分析结果显示,和非洲裔美国人比较,行RDN的其他美国人有获益的趋势(P=0.09)。这是否提示存在对RDN反应的人种差异?是否也存在对RDN反应的地域差异?例如,在工作生活压力较大的发展中国家,其高血压人群的肾脏交感神经兴奋度是否也存在差异?而要解决适应证的问题,有如下两条思路:
一方面,从基础出发探寻交感神经过度激活的指标。目前已知基线血压和基线心率与RDN的血压应答反应有关,尤其心率在RDN后明显下降有可能成为RDN成功的标志;而肌肉交感神经活性或血浆去甲肾上腺水平与血压应答反应并无关[4]。最近研究认为,肾血流量上升和电刺激肾动脉神经后血压下降是手术成功的标志[23,24],但尚需大型研究进一步证实。同时,在RDN有效的基础研究中,其高血压模型的诱发条件有可能成为探寻交感活跃人群的线索,例如Huang等[25]通过高胰岛素建立高血压大鼠模型,而RDN可使模型鼠的血压降至正常。
另一方面,从临床成功案例出发,逐步修订完善适应证。现行RDN的适应证为收缩压>160 mmHg的RH患者,或既往患糖尿病和心血管病史者,收缩压大于150 mmHg,以上标准是基于Symplicity和EnligHTN I两项研究[4];且出于对肾脏安全性的长远考虑,估算肾小球滤过率(eGFR)应≥45 ml(min·1.73 m2)[7]。但在目前研究中存在以下诸多值得商榷的问题,其可能直接影响着RDN的疗效及疗效判断。对RH用药疗程缺乏合乎临床实践的严格限定,究竟药物治疗多久算是无效?患者是否存在期待RDN的成功而并没有规范用药,或依顺性减低的现象?高血压的程度是否把握的太松?例如,24 h血压仅少数时间在160/100 mmHg或以上,多数时间150/90 mmHg或以下,这样的患者药物治疗应是有效的。RDN后多久才能真正评价,是否存在延迟效应?RDN后多少高血压患者能免除药物治疗?药物是高血压的辅助治疗还是RDN是辅助治疗?这些问题应该明确,并作出规定,才能评估RDN的真实临床疗效。例如一种有效的药物治疗的时间也应该限定,如短于6个月可能不能充分说明确切的疗效,而就轻易的定义为RH。一个设计或入选标准和排除标准不能反映临床实际情况和需要的试验或研究所得出来的结果不可避免的会产生各种偏倚。在以往的研究中存在着相当多的患者血压并非是持续增高的,此类患者常常出现假性疗效。此外,尽管随机对照试验(RCT)的结果(阳性或阴性)获得高级别证据,其也只限定于入选人群。然而,真实世界的临床情况千变万化,往往不是RCT能够全覆盖的,这也是SYMPLICITY HTN-3和全球SYMPLICITY注册研究结果相矛盾的原因之一。当今社会已进入大数据时代,我们应利用这一“研究总体”的契机,在真实世界中谨慎实践,通过不断积累来修正适应证,为RDN找到真正的出路。
3.2 经导管RDN的终点导管RDN可使肾交感神经消融的平均水平达到47%,而外科RDN在实验性高血压中则可达到90%~95%。在所有RDN临床研究中,只有SYMPLICITY HTN-1检验了RDN的效果,即检测去甲肾上腺素的外流量(肾脏神经释放至血浆中的递质含量)。但实际上,去甲肾上腺素外流量作为目前RDN唯一有效的检测,其实用性非常受限。
Gal等[26]试图通过高频肾脏神经刺激(RNS)来探寻RDN的终点,并取得了阶段性进展。该研究入选8例经RDN治疗的RH患者,将四极电极放在每条肾动脉的四个不同位点,以20 Hz起搏频率刺激1 min以实现RNS,比较RDN前后血压对RNS的反应。结果在RDN前,血压从108/55 mmHg增至132/68 mmHg(P<0.001);在RDN后,RNS最大反应位点的SBP受到显著抑制(43.1 mmHg vs. 9.3 mmHg,P=0.002),其中3例患者SBP增加>10 mmHg,提示有效的RDN能够抑制RNS引起的急性血压升高。
Esler的团队也正在探索着另一种方法[11]——通过检测尿中酪氨酸羟化酶的降解片段来评估RDN的有效性。随着交感神经的消融,交感神经的特殊蛋白(如酪氨酸羟化酶)会分裂和降解。降解片段可进入尿液,而未降解的部分则由于分子过大而不能进入尿液。利用酪氨酸羟化酶降解片段存在的抗体反应位点,就可以使用Western blot和ELISA进行检测。预期在RDN后,尿液中降解片段的排泄会在最初几天达到高峰,但这需要进一步验证。
此外,Esler团队还提供了一种用于实时评估肾脏传入神经消融效果的方法[11]。腺苷可作用于肾脏内的疼痛感受器,通过导管向肾动脉内注射腺苷可增加交感神经的活性和血压。因此,在RDN前后注射腺苷,出现血压下降反应则表明传入神经消融。但此方法尚未得到完全验证,仅作为一种经验性指导。
3.3 经导管RDN的消融部位从前述肾交感神经的分布可以看出,消融能量应主要集中于肾动脉远端和双侧肾动脉的环周,这样才能尽可能实现完全的RDN,但却面临诸多实际困难。此外,消融肾交感传入神经可抑制中枢交感神经外流,从而降低血压。但传入神经和传出神经的走行并不完全平行,传入神经在离开肾脏处远离肾动脉,聚集于肾动脉接近腹主动脉处。传入神经消融时,射频或超声能量的传送跨过肾动脉近端或许才能产生最佳的效果,但此处传出神经消融成功率低。如何实现传入和传出神经的同步消融,则需要进一步优化消融策略和消融器械。
4 RDN的治疗器械
“工欲善其事,必先利其器”,目前已获得CE认证的RDN器械包括Symplicity系统、EnligHTN系统、Oneshot系统、Vessix系统和Paradise系统(表3),有不同消融效果。
Symplicity系统是一款目前应用最广泛的RDN专用设备,易于操作(图1b),但仍存在一些不足:导管只有一个电极,每次只能对一个部位进行消融,而每侧肾动脉均有4~6个靶点需接受各2 min的消融,手术时间长,在SYMPLICITY HTN-1研究中的平均操作时间为40 min[28]。此外,如肾动脉迂曲,则导管头端较难贴壁,且很难保证对肾动脉壁进行360°的螺旋形消融;加之射频功率较低,穿透深度受到限制,难以损伤深部的交感神经。SYMPLICITY HTN-3使用的正是Symplicity系统,这也成为其结果遭到质疑的另一原因,这是RDN的失败还是消融设备的失败?
EnligHTN系统是一种多电极的快速肾动脉消融系统,其头端螺旋状分布的篮网上有4个电极,可以轻松推送至肾动脉靶点。篮网从处于压缩状态,体外装置使之扩张,扩张后附壁良好,可较好地提供热消融阻断交感神经纤维。EnligHTN I纳入46例RH患者(基线血压176/96 mmHg),人口学特征与Symplicity试验相似。所有接受RDN的患者均使用相同标准技术。结果显示,术后1月、3月和6月的血压分别下降28/10 mmHg、27/10 mmHg和26/10 mmHg,无明显反弹;所有患者均接受动态血压监测,发现24 h平均血压下降≤10/5 mmHg ,随访6个月维持在相似水平[29]。
Oneshot系统由一个低压非顺应性球囊和位于球囊外的一个单极螺旋电极组成,球囊扩张后可使螺旋电极与肾动脉壁接触,仅需一次放电(2 min)即可完成单侧肾动脉消融。RHAS研究是关于这个系统有效性和安全性的临床研究,其中一项小规模研究显示,9例RH患者接受该系统治疗,随访12个月,SBP从基线水平的185.67 mmHg,分别下降了30.1 mmHg(P=0.0004,随访1个月)、34.2 mmHg(P=0.002,随访3个月)、33.6 mmHg(P=0.021,随访6个月)和30.6 mmHg(P=0.019,随访12个月),无相关并发症;介入操作成功率88.9%,其中1例患者(第1例)手术失败,原因是发电器高阻抗安全切断阈值设置太低[30]。
Vessix V2系统则在一个低压整体交换型球囊(overthe-wire,OTW)导管上安装了双极电极,球囊导管直径较细,可对3.0 mm的血管进行消融,每次消融30 s。目前应用该系统的研究主要是REDUCE-HTN研究——一个开放式的前瞻性研究,139例完成6个月随访,诊室血压较术前平均下降24.6/10.3 mmHg(P<0.0001),24 h动态血压平均下降8.5/5.9 mmHg(P<0.01);41例完成12个月随访,与术前比较,血压平均下降29.6/13.6 mmHg(P<0.0001),24 h动态血压平均下降11.2/6.3 mmHg(P<0.01)。
Paradise系统是一种应用超声能量进行消融的球囊导管,球囊中有一个居中的超声发射头,发出的能量可对周围血管壁内的交感神经纤维进行环状消融;而球囊中充满的液体又可冷却周围的血管壁组织,避免血管内膜的损伤。Mabin等[27]首次应用该技术治疗RH,11例接受超声消融并完成3个月随访,结果血压平均下降36/17 mmHg,1例发生导丝所致的血管夹层,2例出现严重的肾动脉狭窄。作者认为超声消融也如射频消融一样,能够安全、显著而持续地降压;与Symplicity系统比较,其消融耗时少,患者耐受性高,且在环肾动脉完全去神经化方面更优。
需要指出,应用心脏射频消融的大头导管进行RDN风险较大。大头导管直径多为5F~8F,尖端电极表面积27 mm2,射频能量为15W~40W,且专为心腔内操作设计[31];将其应用于肾动脉很可能造成大面积内膜损伤,引起急性血栓或肾动脉狭窄,因此不建议应用。
5 RDN的其它潜在应用
在以交感神经活性增加为特点的其它疾病中,RDN的治疗或许有益,例如心力衰竭、交感神经介导的心律失常、慢性肾脏病、阻塞性睡眠呼吸暂停综合征等。在改善患者转归方面,RDN作为补充治疗终会占得一席之地。
5.1 心力衰竭心力衰竭患者存在交感神经系统过度激活,其特征为神经内分泌系统激活,外周血管阻力增加和水钠潴留,从而恶化患者的转归,而RDN在理论上可很好地抑制上述过程。在一项小型非随机研究显示[32],7例收缩性心力衰竭患者接受了RDN后,结果运动能力得以提高。与此同时,在RH患者中(约1/4表现为舒张性心力衰竭),RDN可以明显改善左室肥厚患者的心室重构和功能[33]。RDN有望突破这一现状,一项针对舒张性心力衰竭患者的大型DIASTOLE研究正在进行。
5.2 心律失常交感神经亢进在房性和室性心律失常的发病和维持中发挥着重要作用。最近病例报道[34]显示,2例难治性快速室性心律失常(如室性心动过速电风暴)的心力衰竭患者行RDN后,成功终止了室性心律失常。另一项含有27例RH伴心房颤动患者的随机对照研究显示,肺静脉隔离(PVI)联合RDN治疗较单独PVI在预防心房颤动复发方面更为有效,进一步的大型多中心随机研究(H-FIB试验)正在进行中。
5.3 其他慢性肾脏病(CKD)患者存在交感神经系统的过度活跃,病变的肾脏为交感神经系统过度活跃的源头,而这种改变在双侧肾脏切除后减轻,因此,采用RDN抑制交感神经系统过度活跃是一项非常吸引人的选择。由于RDN有可能增加肾血流量,RDN后患者的肾功能并未恶化[4],所以中重度CKD患者的肾功能有可能逐渐改善。
一项小样本研究显示,在阻塞性睡眠呼吸暂停综合征中,交感神经过度激活亦发挥着关键作用。研究发现[35],RDN后患者睡眠呼吸暂停的严重程度明显降低,中位低通气指数从基线的16.3 次/h降到4.5 次/h,明显缓解疾病。
多囊卵巢综合征是生育期妇女的常见疾病,以内分泌异常伴代谢紊乱为特征,常伴交感神经过度活跃。有报道2例多囊卵巢的年轻女性在接受RDN后,血压轻度下降、胰岛素敏感性明显增加,其中1例在闭经3年后再次出现月经[36]。
6 小结
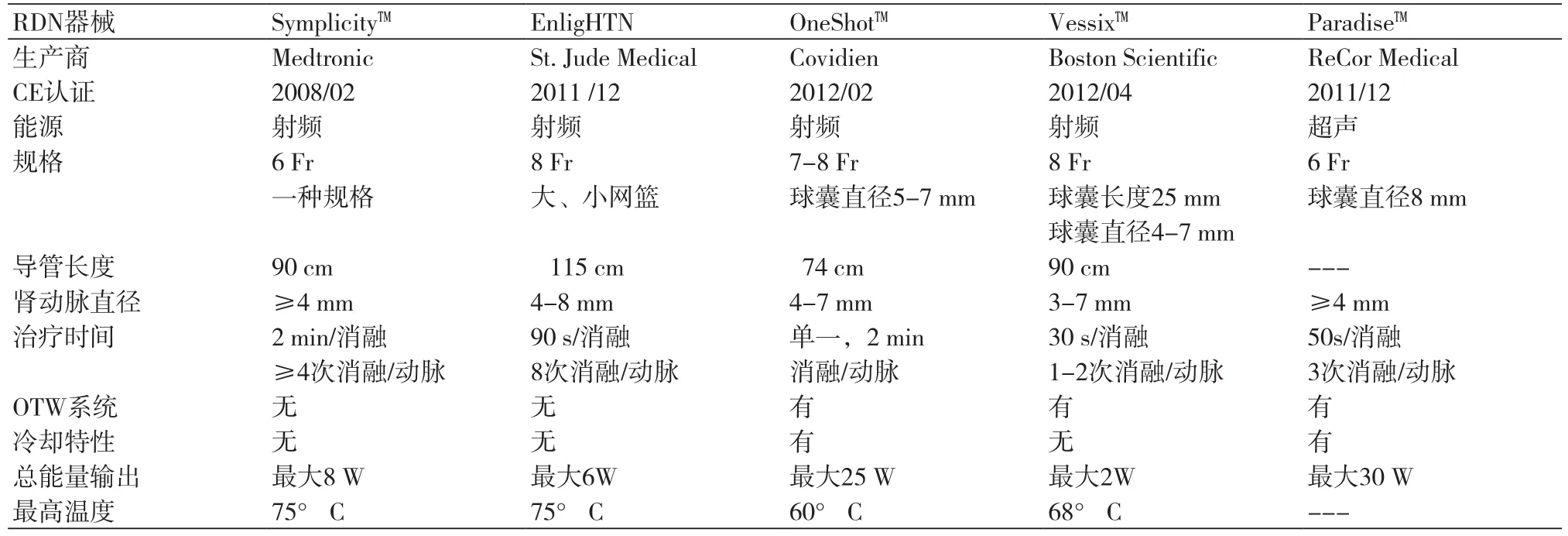
表3 RDN的器械比较[20,27]
在RH领域,关于SYMPLICITYHTN-3的讨论带来一次冷静思考的机会:RDN方法学和技术上尚待成熟,因此应严格把握治疗适应证,毕竟高血压是由多因素致病的综合征,任何单一因素控制的医疗方法都是行不通的。要把改变患者不良生活方式与习惯和规范用药同时纳入治疗方案,才能保证评估血压控制效果的真实与准确。建议加强家庭和(或)动态血压检测和患者医学教育。同时在考虑进行RDN时,临床医生和患者对血压控制的方案应充分沟通,并达到两者意见一致[7]。但我们也不能因为SYMPLICITYHTN-3“结果阴性”,就全盘否认其它已有的RDN研究结果,进而否定这项技术。作为一种治疗理念,需要基础研究的支持和临床研究的验证,需要确定评估RDN适用人群和标准,以及衡量手术疗效的标准;作为一种手术,需要手术人员和技巧的成熟与提高;作为一项医学工程技术,需要研发人员不断完善和优化治疗器械,使之发挥最大的效果。
[1] Krum H,Schlaich M,Whitbourn R,et al. Catheter-based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof-of-principle cohort study[J]. Lancet,2009,373(9671): 1275-81.
[2] Esler MD,Krum H,Sobotka PA,et al. Renal sympathetic denervation in patients with treatment-resistant hypertension (The Symplicity HTN-2 Trial): a randomised controlled trial[J]. Lancet,2010,376 (9756):1903-9.
[3] Kaltenbach B,Franke J,Bertog SC,et al. Renal sympathetic denervation as second-line therapy in mild resistant hypertension: a pilot study[J]. Catheter Cardiovasc Interv,2013,81(2):335-9.
[4] Papademetriou V,Rashidi AA,Tsioufis C,et al. Renal nerve ablation for resistant hypertension: how did we get here, present status, and future directions[J]. Circulation,2014,129(13):1440-51.
[5] 顾复生,胡大一,李虹伟. 质疑经皮经肾动脉射频消融交感神经术治疗顽固性高血压[J]. 中华心血管病杂志,2012,40(08)633-4.
[6] Widimsky J. [History of treatment of essential hypertension--part I][J]. Vnitr Lek,2002,48(1):62-70.
[7] Schlaich MP,Schmieder RE,Bakris G,et al. International expert consensus statement: Percutaneous transluminal renal denervation for the treatment of resistant hypertension[J]. J Am Coll Cardiol,2013, 62(22):2031-45.
[8] Bhatt DL,Kandzari DE,O'Neill WW,et al. A controlled trial of renal denervation for resistant hypertension[J]. N Engl J Med,2014,370(15): 1393-1401.
[9] Medtronic Randomizes First Patients in SYMPLICITY HTN-4, the First U.S. Renal Denervation Clinical Study for Patients with Moderate Uncontrolled Hypertension[N]. GlobeNewswire Europe.
[10] 顾复生,胡大一,李虹伟,等. 从SYMPLICITY HTN-3结果反思经皮导管射频消融去肾交感神经术[J]. 中华心血管病杂志,2014(07)541-2.
[11] Esler M. Illusions of truths in the Symplicity HTN-3 trial: generic design strengths but neuroscience failings[J]. J Am Soc Hypertens, 2014,8(8):593-8.
[12] Rippy MK,Zarins D,Barman NC,et al. Catheter-based renal sympathetic denervation: chronic preclinical evidence for renal artery safety[J]. Clin Res Cardiol,2011,100(12):1095-101.
[13] Esler MD,Bohm M,Sievert H,et al. Catheter-based renal denervation for treatment of patients with treatment-resistant hypertension: 36 month results from the SYMPLICITY HTN-2 randomized clinical trial[J]. Eur Heart J,2014,35(26):1752-9.
[14] Pathak A,Ewen S,Fajadet J,et al. From SYMPLICITY HTN-3 to the Renal Denervation Global Registry: where do we stand and where should we go?[J]. EuroIntervention,2014,10(1):21-3.
[15] Webb RL,Brody MJ. Functional identification of the central projections of afferent renal nerves[J]. Clin Exp Hypertens A,1987,9 Suppl 1:47-57.
[16] Campese VM, Kogosov E. Renal afferent denervation prevents hypertension in rats with chronic renal failure[J]. Hypertension,1995,25(4 Pt 2):878-82.
[17] Converse RJ,Jacobsen TN,Toto RD,et al. Sympathetic overactivity in patients with chronic renal failure[J]. N Engl J Med,1992,327(27):1912-8.
[18] Hausberg M,Kosch M,Harmelink P,et al. Sympathetic nerve activity in end-stage renal disease[J]. Circulation,2002,106(15):1974-9.
[19] Ziakas A,Gossios T,Doumas M,et al. The pathophysiological basis of renal nerve ablation for the treatment of hypertension[J]. Curr Vasc Pharmacol,2014,12(1):23-9.
[20] Ariyanon W,Mao H,Adybelli Z,et al. Renal denervation: intractable hypertension and beyond[J]. Cardiorenal Med,2014,4(1):22-33.
[21] Sakakura K,Ladich E,Cheng Q,et al. Anatomic assessment of sympathetic peri-arterial renal nerves in man[J]. J Am Coll Cardiol, 2014,64(7):635-43.
[23] James PA,Oparil S,Carter BL,et al. 2014 evidence-based guideline for the management of high blood pressure in adults: report from the panel members appointed to the Eighth Joint National Committee (JNC 8)[J]. JAMA,2014,311(5):507-20.
[24] Tsioufis C,Papademetriou V,Dimitriadis K,et al. Catheter-based renal sympathetic denervation exerts acute and chronic effects on renal hemodynamics in swine[J]. Int J Cardiol,2013,168(2):987-92.
[25] Chinushi M,Izumi D,Iijima K,et al. Blood pressure and autonomic responses to electrical stimulation of the renal arterial nerves before and after ablation of the renal artery[J]. Hypertension,2013,61(2):450-6.
[26] Huang WC, Fang TC, Cheng JT. Renal denervation prevents and reverses hyperinsulinemia-induced hypertension in rats[J]. Hypertension,1998, 32(2):249-54.
[27] Gal P,de Jong MR,Smit JJ,et al. Blood pressure response to renal nerve stimulation in patients undergoing renal denervation: a feasibility study[J]. J Hum Hypertens,2014.
[28] Mabin T,Sapoval M,Cabane V,et al. First experience with endovascular ultrasound renal denervation for the treatment of resistant hypertension[J]. EuroIntervention,2012,8(1):57-61.
[29] Catheter-based renal Symplicity,HTN-1 Inrestigators. denervation for resistant hypertension: durability of blood pressure reduction out to 24 months[J]. Hypertension,2011,57(5):911-7.
[30] Worthley SG, Tsioufis CP, Worthley MI,et al. Safety and efficacy of a multi-electrode renal sympathetic denervation system in resistant hypertension: the EnligHTN I trial[J]. Eur Heart J,2013,34(28):2132-40.
[31] Ormiston JA,Watson T,van Pelt N,et al. Renal denervation for resistant hypertension using an irrigated radiofrequency balloon: 12-month results from the Renal Hypertension Ablation System (RHAS) trial[J]. EuroIntervention,2013,9(1):70-4.
[32] Martinek M,Nesser HJ,Aichinger J,et al. Impact of integration of multislice computed tomography imaging into three-dimensional electroanatomic mapping on clinical outcomes, safety, and efficacy using radiofrequency ablation for atrial fibrillation[J]. Pacing Clin Electrophysiol,2007,30(10):1215-23.
[33] Davies JE,Manisty CH,Petraco R,et al. First-in-man safety evaluation of renal denervation for chronic systolic heart failure: primary outcome from REACH-Pilot study[J]. Int J Cardiol,2013,162(3):189-92.
[34] Brandt MC,Mahfoud F,Reda S,et al. Renal sympathetic denervationreduces left ventricular hypertrophy and improves cardiac function in patients with resistant hypertension[J]. J Am Coll Cardiol,2012,59(10): 901-9.
[35] Ukena C,Bauer A,Mahfoud F,et al. Renal sympathetic denervation for treatment of electrical storm: first-in-man experience[J]. Clin Res Cardiol,2012,101(1):63-7.
[36] Witkowski A,Prejbisz A,Florczak E,et al. Effects of renal sympathetic denervation on blood pressure, sleep apnea course, and glycemic control in patients with resistant hypertension and sleep apnea[J]. Hypertension,2011,58(4):559-65.
[37] Schlaich MP,Straznicky N,Grima M,et al. Renal denervation: a potential new treatment modality for polycystic ovary syndrome?[J]. J Hypertens,2011,29(5):991-6.
R338
A
1674-4055(2015)01-0006-07
2014-11-03)
(责任编辑:孙竹)
300052 天津,天津医科大学总医院 心脏中心
10.3969/j.1674-4055.2015.01.03

