昆明芦荟根腐病病原菌的分离及鉴定*
丁雅迪,王金华,2,缪福俊,毛德昌,谢恩来,熊智
(1.西南林业大学,云南 昆明650224;2.云南农业大学,云南 昆明650201;3.云南省林业科学院,云南 昆明650201)
芦荟 (Aloe chinensis)是百合科多年生草本植物,主要分布于热带、亚热带地区。芦荟因富含多糖、蛋白质、氨基酸、活性酶、维生素等活性物质及有益微量元素而广泛应用于医疗、美容、保健、食品等领域[1~2]。由于巨大的商业价值引起了许多国家的高度重视,并在世界各地广泛栽培[3]。近年来,我们国家对芦荟的开发应用研究从20世纪末开始起步,主要集中在化妆品[4]、药用[5~7]、保健饮料[8~9]、酒制品[10~11]、奶制品[12]等方面以及作为植物杀菌剂[13]防治植物病害,广泛的需求催生了芦荟的产业化种植,这种产业化种植尤以云南、海南、四川、福建等地范围广[14]。然而,在大规模的种植过程中,根腐病严重地制约了芦荟产业化的发展。仅在2004年云南省的根腐病发病率达到42.54%、死亡率高达 26.36%[15],研究芦荟根腐病及其防治已成为目前的研究热点。有关芦荟根腐病方面的研究还鲜有报道。故本研究对芦荟根腐病病原菌进行分离纯化研究,结合形态与ITS测序方法鉴定其病原菌,并采用回接方法对其致病性进行测定分析,为芦荟根腐病的生物防治提供理论基础。
1 材料和方法
1.1 材料
采自云南省林业科学院、西南林业大学具典型根腐病症状的芦荟及健康芦荟各10株作为分离样品,采集后置于4℃冰箱内保存备用,并观察记载田间症状表现。
马铃薯琼脂培养基 (PDA),配方见参考文献[16]。Ezup柱式基因组 DNA抽提试剂盒 (真菌)、2×Taq PCR Master Mix等均由生工生物工程(上海)股份有限公司提供。
1.2 方法
1.2.1 病原菌的分离和纯化
取芦荟根腐病样品根段,在病健组织处取样[17],样品表面经流动自来水冲洗干净后,用75%乙醇处理30 s,无菌水2~3次,用0.1%升汞溶液消毒2 min,无菌水刷洗4~5次,再用灭菌滤纸将根上的水吸干,用无菌解剖刀将根切成5 mm长的根段,接种于PDA培养基上,每个培养皿放4个根段,28℃下恒温培养,初步鉴定分离纯化后转管,保存于4℃冰箱中备用。健康芦荟样品根段按照上述方法分离纯化并与患病样品根段分离出的真菌进行对比。
1.2.2 病原菌致病性测定
采用离体根部接种法[17]进行病原菌的致病性测定,即选取芦荟1年生健康幼根作为接菌材料,将上述幼根截为6 cm长的根段,将经过分离纯化得到的芦荟病原菌打成菌饼,分别做刺伤和无刺伤接菌,幼根段采用刺伤接菌法均匀接3个菌饼,每个PDA平板中接两个根。3次重复,共18个接种点。无刺伤接菌法采用同种方法处理。将刺伤和无刺伤不接菌幼根段分别接种于PDA平板中作为对照。对上述所有处理根段两端用脱脂棉包裹,置于25℃培养箱中无菌水保湿48 h后观察发病情况,第10天统计发病率。并从发病部位再次分离病原菌,与初次所接病原菌的异同。
1.2.3 病原菌的形态观察
参照真菌分类鉴定方法,将致病性接种确定的病原菌在PDA培养基中活化后,挑取适量菌体制成切片,置于光学显微镜下观察。同时结合菌株菌落形态特征,包括性状、颜色、质地、分生孢子大小、边缘特征、生长率等情况,初步确定病原菌的种属地位。
1.2.4 菌株DNA提取及ITS PCR扩增
采用Ezup柱式基因组DNA抽提试剂盒 (真菌)提取根腐病病原菌基因组DNA,经1.2%琼脂糖凝胶电泳检测合格后,将其作为ITS序列DNA扩增的模板。ITS序列PCR扩增采用通用引物ITS1和ITS4〔生工生物工程 (上海)股份有限公司提供〕[18]。PCR 反应体系为模板 DNA 1 μL、2 × Taq Master Mix 12.5 μL、正、反引物 (10 μmol/L)各1 μL,补充去离子水至 25 μL。PCR 扩增条件:95℃预变性5 min;95℃变性30 s;56℃退火45 s;72℃延伸 1 min,30个循环;最后 72℃延伸 10 min。取5 μL的PCR扩增产物进行2%琼脂糖凝胶电泳检测经4S Green Nucle Acid染色,在凝胶成像系统上检测并拍照。
1.2.5 ITS序列测定及系统发育分析
PCR扩增产物送至上海生工生物工程股份有限公司纯化并测序。序列提交至GenBank核酸序列数据库并得到登录号,应用Blast程序对所测得菌株ITS-rDNA序列进行相似性检索。采用MEGA 5.1软件进行多序列的比对,比对结果进行系统发育分析。
2 结果与分析
2.1 根腐病症状描述
芦荟根腐病主要危害根部和茎基部。初呈水渍状病变,后褐色腐烂。主根腐烂或坏死,容易拔出,由下往上发展,地上部由基部叶的边缘开始变为红褐色,逐渐发展为全株叶片呈失水状柔软下垂,叶片和茎干枯。严重时可导致植株萎蔫死亡(图1)。

图1 芦荟根腐病症状Fig.1 The symptoms of aloe root rot
2.2 病原菌的分离及致病性测定
从芦荟病株根部分离得到1个菌株,而从健康芦荟根段并未分离出此菌株,说明这个菌株是芦荟病株特有菌株,命名为YNLH06。经形态学观察这个菌株初步鉴定为尖孢镰刀菌(Fusarium oxysporum)。将这株菌(YNLH06)进行致病性测定(表1),对照组刺伤、无刺伤不接菌饼的根段均无病斑。刺伤、无刺伤接种YNLH06菌饼的根段均有病斑,病斑率分别为94.4%和66.7%,显示的根腐病症状与初次分离病根发病情况相似,并从接种后发病部位分离的病原菌与接种所用病原菌为同种病菌,符合科赫法则,说明菌株YNLH06为芦荟根腐病病原菌。

表1 菌株YNLH06致病性测定Tab.1 Determination of pathogenic strains YNLH06
2.3 菌落形态特征
在PDA培养基上,菌落凸起,菌落初为白色、粉红色,6天后菌落中间逐渐变成紫红色,绒状角变,正反面颜色差异较大,反面分泌紫色色素。菌落高3~5 mm,小型分生孢子较多,单胞或双胞,卵圆形、肾脏形,大小5~12 um×2~3.5 um;大型分生孢子较少,多胞,多有3个分隔,镰刀形,大小19.6 ~39.4 um ×3.5 ~5.0 um;厚垣孢子球形 (图 2)。参照真菌分类学[19]鉴定方法和Booth[20]镰刀菌属的分类系统初步鉴定菌株 YNLH06为尖孢镰刀菌。
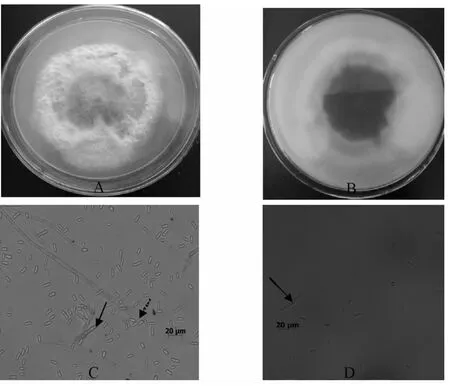
图2 病原菌菌落特征和菌丝体光学显微特征Fi g.2 Col ony and mycel i al mi cr oscopi c char act er ist ics of t he pat hogen

图3 菌株YNLH06的rDNA ITS区段PCR产物电泳结果Fig .3 Electrophoresis of PCR product of the rDNA ITS section amplified from YNLH06 strain
2.4 菌株ITS区的PCR扩增及序列测定
以引物ITS1和ITS4对YNLH06菌株的rDNA ITS区段进行扩增,获得PCR产物约545 bp(图3)。此序列已在GenBank中注册,登录号为KP267760。
2.5 菌株系统发育树的分析
序列提交至GenBank进行Blast同源比对,选取同源性较高的部分菌株序列通过MEGA5.1构建系统发育树,确定该菌株的种属地位 (图4)。白粉寄生孢菌 (Ampelomyces quisqualis)(HQ108042)为外类群,从系统发育树中可以看出菌株YNLH06与尖孢镰刀菌(Fusarium oxysporum)(KM005088、KM005080、KC196121、JN859433、JN232195)在同一系统发育分支,相似度为100%。该菌株与轮状镰刀霉菌 (Fusarium verticillioides)(KM396284)、大刀镰刀菌(Fusarium culmorum)(DQ453700、DQ450880)、马铃薯枯萎病菌(Fusarium avenaceum)(KM189441)和腐皮镰孢霉菌(Fusarium solani)(HQ905461)同源性分别为92.2%,90.9%,90.1%,86.9%,85.2%。进一步判定菌株YNLH06为尖孢镰刀菌。

图4 基于rDNA-ITS序列构建菌株的系统发育树 (邻接法)Fig.4 Phylogenetic tree(Neighbor-joining Tree)inferred from the fungal rDNA ITS sequences
3 结论与讨论
3.1 结论
从芦荟新鲜病株根中分离纯化出1个菌株YNLH06,致病性测定其为芦荟根腐病病原菌,形态结构观察结果表明其与尖孢镰刀菌的形态结构特征相同;ITS序列分析表明,该菌株与尖孢镰刀菌在同一系统发育分支,相似性为100%。因此认定尖孢镰刀菌为芦荟根腐病病原菌。
3.2 讨论
在致病性测定中,常采用灌根接种法[17]、蘸根接种法[17]、根部切伤接种法[21]。但相较于上述几种方法,离体根部接种法具有周期性短,便于观察,成本低,不需培育幼苗就可观察到病原菌的致病性等优势。离体根部接种法中,刺伤接菌的发病率比无刺伤接菌的发病率高27.7%。说明病原真菌更容易通过伤口侵入植物。因此我们可以通过改良芦荟培育方法对芦荟根腐病进行防治。
近年来研究发现根腐病普遍存在于大豆[22]、豌豆[23]、芹菜[24]、黄芪[25]等作物中,并迅速蔓延,有逐年恶化的趋势,对作物的生产造成致命的危害。通常根腐病由多种病原菌复合侵染引起[26],已鉴定出的种类主要有,层出镰孢菌 (Fusarium proliferatum)、茄镰刀菌 (F.solani)、尖孢镰刀菌(F.oxysporum)、立枯丝核菌 (Rhizoctonia solani)、终极腐霉 (Pythium ultinum)、串珠镰孢霉 (F.moniliforme)等[27~29]。芦荟的根腐病病原菌侵染是否与其它植物根腐病病原菌的侵染情况一致,由多种病原菌复合侵染引起,及这种复合侵染对芦荟根腐病的影响效应。这些都有可能受到采样时间、地点、生态环境并与升汞灭菌时间、所用培养基配方等条件的限制,仍然有待于进一步反复摸索和不断探究找出合理科学的研究方法。
[1]谢云飞,郇楠,曹元元,等.芦荟中芦荟苷的结构表征及光谱分析[J].光谱学与光谱分析,2014,34(2):386-388.
[2]肖玫,曹玉华,刘彪.芦荟汁天然饮料工艺的研究[J].食品科学,2005,26(1):271-274.
[3]万金志,徐新军,钟佳胜,等.国外芦荟药品开发现状与趋势[J].今日药学,2013,23(1):59-62.
[4]任海毅,董银卯,孟宏,等.芦荟保湿活性成分筛选及皮肤适应性研究[J].中国实验方剂学杂志,2013,19(3):252-256.
[5]张俊莉,蔡淑敏,李涛,等.芦荟减阻剂对烧伤休克大鼠微循环的影响[J].实用医学杂志,2014(10):1537-1540.
[6]李天东.罗英,韩文君.芦荟的药理作用及其应用研究进展[J].2007,17(23):2881-2886.
[7]漆平强,杨莉,郑慧凝,等.芦荟汁对小鼠腹部伤口愈合情况影响的研究[J].中国卫生产业,2014(15):28-30.
[8]韩宏伟.芦荟保健饮料生产技术方案[J].科学创新与应用,2014(14):288.
[9]黄友琴,潘嫣丽,黄卫萍,等.芦荟叶肉悬浮饮料的研制[J].安徽农业科学,2010,38(20):10884-10886.
[10]王丽娟,李再贵.芦荟白酒功能性成分及体外抗氧化性研究[J].中国酿造,2014,33(3):57-61.
[11]李艳红.芦荟啤酒加工工艺研究[J].合作经济与科技,2014(14):180-181.
[12]李竹君,刘晓娟,张挚旋,等.芦荟红枣奶的制作工艺研究[J].安徽农业科学,2010,38(25):13822-14024.
[13]袁仲玉,周会玲,田蓉,等.芦荟粗提物对苹果菜后灰霉病的防治效果与机理[J].农业工程学报,2014,30(4):255-263.
[14]何忠俊,周琼,张忠萍,等.库拉索芦荟根腐病与土壤一植株养分状况的关系研究[J].云南农业大学学报,2009,24(2):255-291.
[15]姬广海,吴亚鹏,张乃明,等.芦荟根腐病病原菌的鉴定[J].植物病理学报,2007,37(2):207-209.
[16]杨辉辉,王坦,黄思良,等.一株芝麻枯萎病菌的鉴定及其生物学特性[J].中国油料作物学报,2014,36(3):385-392.
[17]方中达.植病研究方法[M].北京:中国农业出版社,1998.
[18]桓明辉,李杨,刘晓辉,等.1株产纤维素酶木霉菌种的鉴定[J].微生物学杂志,2012,32(5):65-68.
[19]邵力平.真菌分类学[M].北京:中国林业出版社,1984.
[20]Booth C.The genus Fusarium[M].Oxon:Commonwealth agricultural Bureaux,1971.
[21]曹雪梅,李生兵,张惠玲,等.甘草根腐病病原菌鉴定[J].植物病理学报,2014,44(2):213-216.
[22]白剑宇,百丽燕,王登元,等.大豆根腐病病原菌PCR-RFLP鉴定体系的建立[J].新疆农业大学学报,2010,33(2):151-154.
[23]陈庆河,翁启勇,何玉仙,等.福建省豌豆根腐病病原及致病性研究[J].福建农业学报,2004,19(1):28-31.
[24]石延霞,孟姗姗,陈璐,等.芹菜根腐类病害的病原菌鉴定及新型防治技术[J].中国蔬菜,2014(6):71-73.
[25]陈垣,朱蕾,郭凤霞,等.甘肃渭源蒙古黄芪根腐病病原菌的分离与鉴定[J].植物病理学报,2011,41(4):428-431.
[26]刘亚亚,陈垣,郭凤霞,等.掌叶大黄根腐病病原菌的分离与鉴定[J].草业学报,2011,30(1):199-225.
[27]王明道,时延光,郜峰,等.1株引起地黄根腐的镰刀菌的鉴定及生物学特性研究[J].河南农业大学学报,2013,47(2):177-181.
[28]张萍.葫芦巴根腐病病原菌的鉴定[J].西北农业学报,2008,17(6):202-204.
[29]王多成,孟有儒,李文明,等.苜蓿根腐病病原菌的分离及鉴定[J].草业科学,2005,22(10):78-81.

