靶向髓样分化蛋白—2特异性抗炎多肽的优化
谭 燕 吴晓凤 翁 闫 红
(1.第三军医大学大坪医院野战外科研究所第一研究室,创伤、烧伤与复合伤国家重点实验室,重庆 400042;2.第三军医大学大坪医院野战外科研究所麻醉科,重庆 400042)
由创伤及感染引起的全身性炎症反应和脓毒症是临床中导致患者死亡的主要原因之一,至今尚无有效的治疗手段。目前其防治方法的研究焦点在于寻找治疗脓毒症和炎症反应后免疫抑制的有效方法。LPS对巨噬细胞的过度刺激是导致脓毒症最常见的原因,LPS与巨噬细胞膜上Toll样受体4(TLR4)的结合是启动巨噬细胞活化的关键因素[1-4]。然而TLR4与其他Toll样受体识别配体的方式不一样,它不能直接识别配体,需要与髓样分化蛋白2(MD-2)形成异二聚体,借助MD-2结构中的疏水口袋与LPS相互作用[5]。LPS激活TLR4信号通路的过程中形成了LPS/TLR4/MD-2复合体,因此通过拮抗MD-2与LPS的结合可从新的角度制备抗细菌感染免疫制剂[6]。在无LPS存在的时候,TLR4与MD-2蛋白相互连接;但在LPS存在的情况下,TLR4与MD-2形成更牢固的二聚体形式[7]。研究提示,阻断LPS与MD-2的结合,比阻断LPS与TLR4/MD-2复合物的结合要容易近100倍。这表明MD-2分子中与LPS结合的结构域对整个复合体的功能乃至之后的信号转导强度都有决定性的作用[8-10],并且,MD-2与TLR4的胞外区相偶联,是一个只含有160个氨基酸的分泌蛋白,具有分子质量小,且为可分泌型等特点,对MD-2的调控更易操作。另外有研究发现,以MD-2作为靶点,一种查尔酮的衍生物(JSH)可与MD-2竞争性结合LPS,从而抑制LPS介导的TLR4活化[6]。如果可以开发一种可以干扰LPS与MD-2结合的药物,可能是控制LPS诱导的炎症反应更为有效、事半功倍的治疗策略[6,11]。
本研究室前期实验已经成功筛选出2条针对MD-2的拮抗多肽—T 6和T 11,可部分阻断MD-2与LPS的结合,但效率不高[12]。研究证实,根据靶标蛋白在噬菌体展示肽库中筛选出阳性序列,再依据阳性序列构建突变肽库,进一步筛选靶标蛋白,筛选后得到的阳性克隆效果更佳[13-15]。本研究旨在通过对原始多肽(MD-2拮抗多肽)进行突变多肽库的构建、筛选和功能鉴定,最终获得具有更高抗炎活性的多肽。
1 材料和方法
1.1 实验材料 MD2蛋白(1787-MD/CF,R&D System公司),佛波醇乙酯(PMA,P1585,Sigma公司),回收试剂盒(Wizard SV Gel and PCR Clean-Up System,Promega公司),限制性内切酶EagⅠ 和KpnⅠ(Thermo Scientific公司 ),Klenow Fragment(Thermo Scientific公司),T 4连接酶(New England Biolabs公司)和引物(苏州金唯智生物科技有限公司),DNA ladder DL2000 和 λ –hind III digest DNA Marker(TAKARA公司),M 13-HRP抗体(GE Healthcare公司),TMB显色液(碧云天生物技术有限公司),小鼠TNF-αELISA试剂盒和IL-6 ELISA试剂盒(武汉博士德生物工程有限公司),内毒素(LPS,O111B4, Sigma公司),巨噬细胞RAW264.7细胞株(ATCC),人单核细胞白细胞THP-1细胞株(第三军医大学野战外科研究所第四研究室馈赠),C57小鼠(第三军医大学大坪医院实验动物中心)。基因扩增仪(My Gene TM Series Peltier Thermal cycler,杭州朗基科技仪器有限公司),电泳仪(EPS100,上海天能科技有限公司),电转仪(BIO-RAD, GENE PULSE II),酶标仪(ELX800,Bioteck)。
1.2 噬菌体突变肽库的构建
1.2.1 基础引物以及突变引物
1.2.1.1 基础引物:①96Etp: 5’-CATGCCCGG GT ACCT T T CT AT T CT CA CT CT-3’(用于构建和菌落PCR鉴定);②T 6:5’-TTT CGGCCGAACCT CCACCAT GAT T AT CCG GCACCGT CT T AGAGT GAGAAT AGAAAG GT-3’; ③ T 11:5’-TTTCGGCCGAACCT CCACCATTCCTAGTCAACGGAGAATCAG AGTGAGAATAGAAAGGT-3’;④ 96g IIIsp:5’-CCCTCATAGTTAGCGTAACG-3’ ( 用于测序和菌落PCR 鉴定)。
1.2.1.2 突变引物的合成策略 T 6和T 11结合多肽是针对人MD2蛋白(huMD2)模拟短肽(FSKGKYKCV)筛选得到,该序列位于hu MD2蛋白的β折叠链一端及相邻的无规则卷曲区域,基本呈线性分布。为得到更高结合能力的多肽,分别以T 6和T 11序列为基础,每次随机突变相邻的3~5个氨基酸,保留剩余的氨基酸,并同时在肽链的氨基端和羧基端引入额外的两个氨基酸,以期望获得更大的结合面。
引物中引入的氨基酸突变采用NNK策略,这种策略包含32个密码子,20种氨基酸全包含,不含终止子。对应的,因为这些密码子在反向引物上都是MNN(M表示随机突变里最常用的密码子,此处碱基A/C出现的概率均等,N代表此处碱基A/T/C/G出现的概率均等)。共合成了10条突变引物,T 6和T 11突变引物各5条,分开进行DNA操作,最后每种等量合在一起,用于建库。引物由苏州金唯智生物科技有限公司进行合成。
1.2.2 目的基因片段的合成 分别直接退火96Etp及等摩尔的T 6和T 11突变引物(T 6am、T 11am,各约3 mol),50 μl体系,直接从96 ℃退火,直到最后保温于35 ℃;再用DNA聚合酶I大片段(klenow酶)补平两端得到目的基因片段(100 μl体系,37 ℃ 30 min,75 ℃ 10 min)。
1.2.3 用KpnI/Eag I对目的基因和载体M13KE进行双酶切,后再进行胶回收。150 μl目的基因酶切体系:补平的目的片段100 μl,10倍浓度的酶切缓冲液 15 μl,KpnI酶 3 μl,EagI酶 3 μl,水 29 μl;反应条件:37 ℃ 4 h,65 ℃ 5 min。100 μl载体酶切体系:M13KE载体60 μl,10倍浓度的酶切缓冲液 10 μl,KpnI酶 5 μl,Eag I酶 5 μl,水 20 μl。反应条件:37 ℃ 过夜,65 ℃ 5 min。
1.2.4 连接以及纯化 将M 13KE噬菌体与目的基因片段的酶切产物按照1:5的比例用T 4连接酶进行连接,16 ℃ 过夜。连接产物用PCR-clean up试剂盒进行清洁,用100 μl 水洗脱,备用。
1.2.5 制备电转感受态ER2738并电转 将连接产物约100 μl加入到制备好的电转感受态大肠杆菌ER2738中,轻轻混匀,每电转杯70 μl分装,静置10 min,开始电击,立即加入400 μl SOC培养基混匀,吸出于37 ℃水浴中;提前取10μl(记为10-2)进行梯度稀释并涂板,依次稀释为10-3、10-4、10-5、10-6倍, 37 ℃培养箱培养过夜;计数。
1.3 噬菌体肽库的筛选 用无菌 TBS 缓冲液稀释抗原huMD2 10 μg 至1 ml,4 ℃过夜包被免疫 管(Nunc,Max iSorp)。 用 5 ml 1% BSA封闭液封闭免疫管,37 ℃保温2 h。弃封闭液,用 TBST(T: 0.1% Tw een-20)洗涤免疫管3次。加入噬菌体样品(含0.5%的BSA 和0.1%的Tw een-20)3 ml,37 ℃保温2 h,每30 min混匀1次。用 TBST(T: 0.1% Tween-20)洗涤免疫管6 次,洗去未结合的phage。用 Glycine-HCl(p H 2.1)洗脱结合的phage,每次1 ml,每次5 min,再加入Tris中和液160 μl。重复洗脱1次,然后合并。从洗脱的phage 样品中取10 μl用于梯度稀释和计数,感染对数中期的大肠杆菌ER2738后,涂LB/IPTG/Xgal 的Top-Agar 平板,37 ℃培养箱倒置培养过夜,第2天计数。其余的2.3 ml phage 洗脱样品用于感染50 ml 对数早期的ER2738,37 ℃剧烈震荡培养4.5 h,收集phage上清,沉淀浓缩后,用作下一轮筛选。重复2次,并将抗原hu MD2依次降低为5 μg、1 μg。 共筛选3轮。
1.4 细胞培养 RAW264.7细胞和THP-1细胞用含10%胎牛血清的RPMI 1640 完全培养基培养。THP-1经培养和计数后,加入PMA100 ng/ml共同培养24 h(THP-1细胞需经PMA刺激后才能分化为单核/巨噬样细胞),调整细胞计数为1×105个/孔。RAW264.7直接调整细胞计数为1×105个 /孔。
1.5 噬菌体克隆结合活性测定 取2个96孔板,分别包被MD2蛋白(实验组)和BSA蛋白(对照组),4 ℃过夜,再从噬菌体突变肽库中筛选出的克隆中挑选94个噬菌体克隆(其中包括A 8、F5、H2、H5、H9),连同T 6、T 11展示多肽噬菌体,共96个克隆,将克隆扩增后,纯化出噬菌体颗粒,每种噬菌体均分为2份,分别与MD2蛋白和BSA蛋白结合,37 ℃孵育2 h,PBST洗去未结合噬菌体后,再向包被板中加入二抗M13-HRP,37 ℃孵育1.5 h,PBST洗去未结合的二抗,加入TMB显色液避光显色15 min,最后加入终止液,酶标仪上检测450 nm处的吸光度(A450值)。
1.6 噬菌体克隆对RAW264.7细胞以及PMA诱导的THP-1细胞的细胞因子生成抑制作用的观察 实验分8组:对照组(RAW264.7/诱导后的THP-1) ,LPS组(RAW264.7/诱导后的THP-1+LPS) ,M13组(RAW264.7/诱导后的THP-1 +LPS +对照组噬菌体M13) , A8、F5、H2、H5、H9组(RAW264.7/诱 导 后 的 THP-1 +LPS + 噬菌体克隆A8、F5、H2、H5、H9)。各组LPS的终浓度均为1 μg/ml。处理方法:先用噬菌体克隆对细胞预孵育2 h,再用LPS刺激6 h后收集上清液, - 20 ℃冰箱保存待测。按ELISA试剂盒说明测定TNF-α的表达。从中选出比T 6、T 11抗炎效果更好的克隆进行多肽合成。
1.7 优化多肽A8、H2和原始多肽T 6、T 11对RAW264.7细胞和PMA诱导的THP-1细胞的细胞因子生成抑制作用的比较 优化多肽A8和H2合成后,均为200 μg/ml。实验分组分为6组。对照组(RAW264.7/诱导后的THP-1) ,LPS组(RAW264.7/诱 导 后 的 THP-1+LPS) ,A8组(RAW264.7/诱导后的THP-1 +LPS +A8多肽), H2组(RAW264.7/诱导后的THP-1 + LPS +H2多肽), T 6组(RAW264.7/诱导后的THP-1+LPS +T 6多肽), T 11组(RAW264.7/诱导后的THP-1 +LPS +T 11多肽)。处理方法:先用多肽分别对细胞进行预孵育2 h,再用LPS(终浓度均为1 μg/ml)刺激6 h,收集上清液, - 20 ℃冰箱保存待测。按ELISA 试剂盒说明测定TNF-α和IL-6的表达。
1.8 优化多肽A 8、H2和原始多肽T 6、T 11对小鼠细胞因子生成的影响 6~8周龄雄性C57小鼠,体重20~22 g,随机分为6组(n=5):空白对照组每只小鼠腹腔注射1 ml 生理盐水;阴性对照组每只小鼠腹腔注射 1 ml LPS(400 μg /ml)盐溶液;4 个多肽组(T 6、T 11、A8、H2组)每只小鼠分别腹腔注射T 6、T 11、A8或H2多肽200 μg/ml,并于1 h后腹腔注射LPS盐溶液1 m(l400 μg /ml)。注射LPS(阴性对照组和4个多肽组)或生理盐水(空白对照组)后6 h脱颈处死,取眼血,血清贮存于-20 ℃,待测TNF-α和IL-6含量。
1.9 统计学处理 采用SPSS17.0软件包处理各组数据,数据以± s表示,采用单因素方差分析和组间两两比较LSD检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 噬菌体突变肽库的构建
2.1.1 M13KE与目的片段酶切结果 突变引物共合成10条,T 6、T 11突变的各5条,分别标记为 T 6am1、T 6am2、T 6am3、T 6am4、T 6am5和 T 11am1、T 11am2、T 11am3、T 11am4、T 11am5。分别直接退火96Etp与等摩尔的引物T 6am、T 11am后,获得需要的目的片段。再用KpnI/Eag I对目的基因和载体M13KE进行双酶切,目的基因酶切后成功得到70 bp左右的目的片段,载体M13KE酶切后成功得到7 200 bp左右的片段。见图1。
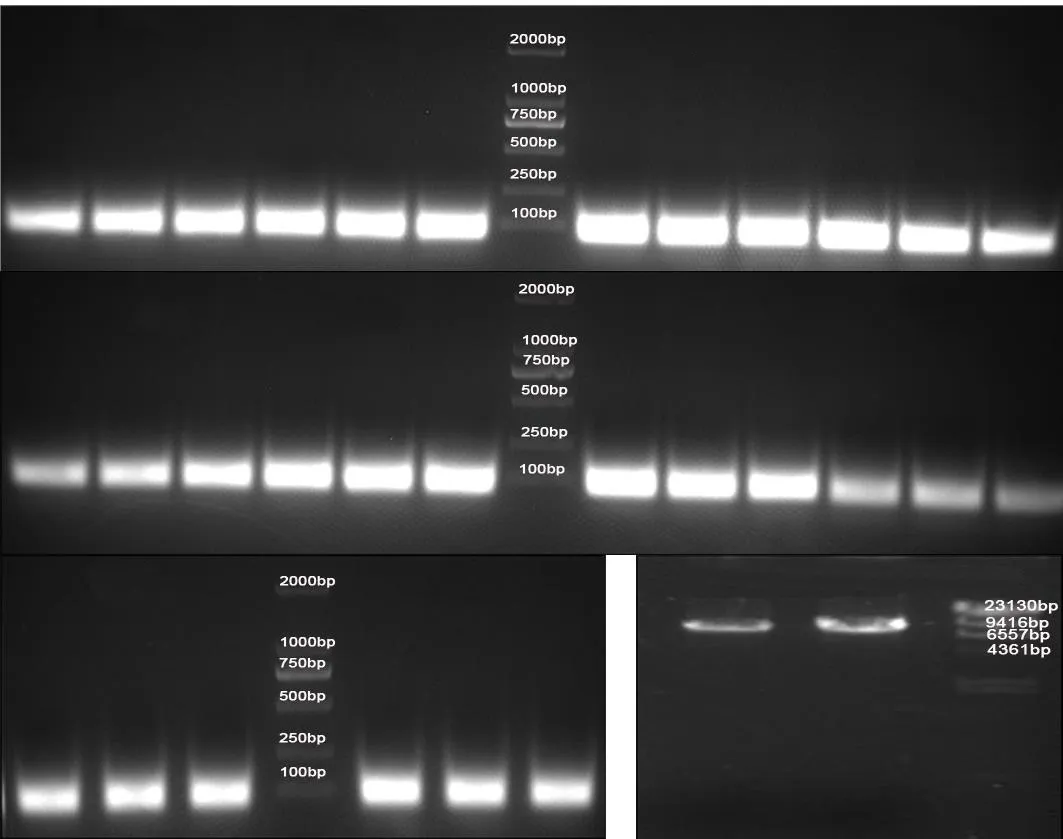
图1 M 13KE与目的片段酶切结果
2.1.2 突变肽库滴度测定结果 汇总全部培养基(约38 ml),于37 ℃ 、150 r/min摇床中1 h孵育,涂平板(直径15 cm)19个,提前取10 μl(记为10-2)进行梯度稀释 (10-3、10-4、10-5、10-6)并涂板,37 ℃培养箱培养过夜计数,10-6长了100个蓝斑克隆,计算库容约为100×106×38=3.8×109。
2.2 噬菌体突变肽库的筛选
2.2.1 肽库筛选 进行3轮筛选,每一轮结束后均记录噬菌体投入量及回收量,计算回收率。结果显示,富集率随着筛选轮数的增加而增加,说明与MD-2蛋白具有结合活性的特异性噬菌体克隆得到有效富集。见表1。

表1 用MD-2蛋白进行3轮亲和筛选中噬菌体回收率的改变
2.2.2 噬菌体克隆结合活性测定 以噬菌体展示多肽为实验组,BSA为对照组,鉴定噬菌体展示多肽与MD-2的结合力。3 轮淘选后,挑选94个克隆,ELISA 鉴定噬菌体展示多肽与MD-2的结合力,结果显示5 个噬菌体克隆所展示的多肽与MD-2全长蛋白有较高的结合力,A450值高于0.5,且均高于原始展示多肽T 6、T 11的克隆。见图2。
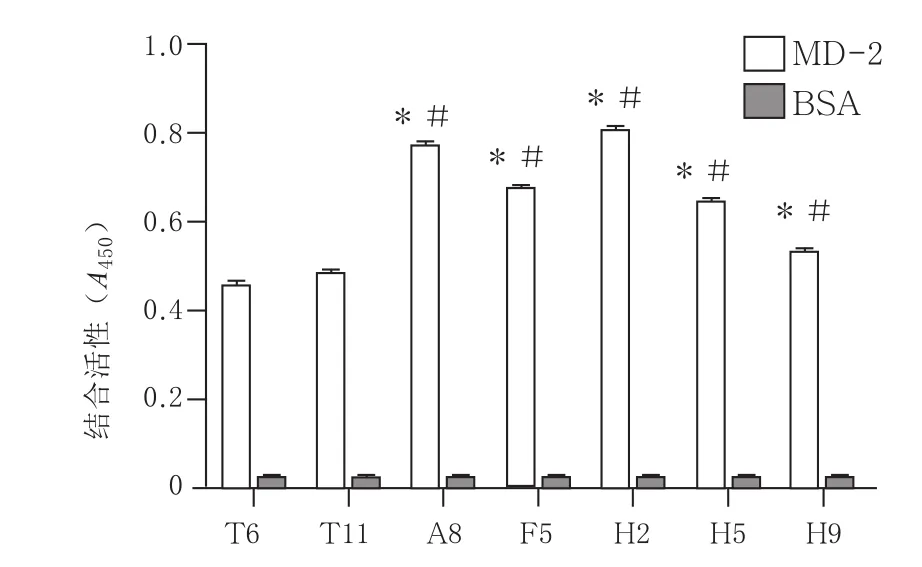
图2 筛选出的阳性结合多肽与T6、T11原始多肽和MD2亲和力的比较
2.2.3 阳性克隆DNA序列测定 从结合活性A450高于BSA对照组的5个噬菌体克隆中,提取单链DNA进行测序,并推导DNA序列编码的氨基酸,即为噬菌体表达的多肽序列。5个克隆呈现出5种不同编码的氨基酸序列。
测 序 结 果:A8:5’-AGGCGGCGCAAC ACT AGGACCACT CT T AT ACGG-3’;F5:5’-AGTAAAAGTAGTATTCCAACCAGGAT GCTGATG-3’;H2:5’-AAGCGCAAGATG AGGATGAATACGAGGCGCCTG-3’;MDH 5:5’-CGCAAACCTAAGCTTAGCCGTAG GCATATTCGA-3’;MD-H9:5’-CATACA CGCATGACGAGGAGCCGGCTTCACACA-3’
编码蛋白序列:A8:RRRNTRTTLIR; F5:SKSSIPT RMLM; H 2:KRKMRMNT RRL;H5:RKPKLSRRHIR; H9:HTRMTRSRLHT
2.3 抗炎活性的测定
2.3.1 初筛5个克隆对RAW264.7以及THP-1细胞因子生成的抑制效果 以RAW264.7和THP-1为靶细胞,对初筛出的5个克隆进行抑制炎症效果的实验验证,检测其TNF-α的表达情况。结果显示,A8、H2有较好的抑炎作用,而F5、H5、H9均无明显抑制炎症的效果。见图3。

图3 初筛克隆对RAW264.7(A)以及THP-1(B)细胞因子生成的影响
2.3.2 优化多肽A8、H2与原始多肽T 6、T 11对RAW264.7以及THP-1细胞因子生成抑制效果的比较 将初步筛选出的优化多肽A8、H2以及原始多肽T 6、T 11序列送往上海锐劲生物技术有限公司进行多肽合成。以RAW264.7以及THP-1细胞模型为靶细胞,多肽浓度采用200 μg/ml。结果,A8、H2对两种细胞的细胞因子抑制效果比原始多肽更好,提高了近1倍。见图4。
2.3.3 动物模型中优化多肽A8、H2与原始多肽T 6、T 11抗炎活性的比较 C57小鼠实验中,优化多肽A8、H2中只有H2有明显强于原始多肽T 6、T 11的抑炎效果。见图5。
3 讨 论
目前创建与靶分子亲和力高的抗原或其他蛋白的方法主要包括:通过大量免疫系统产生的变异体筛选;通过构建的肽库进行筛选;利用计算机,通过找出游离氨基酸残基与靶分子表面的交互作用区域以及改变空间构象设计等[16-18]。鉴于多肽的特点及可行性,本研究采用对原始多肽(MD-2拮抗多肽)进行突变多肽库的构建、筛选和功能鉴定,最终获得具有更高抗炎活性的多肽。
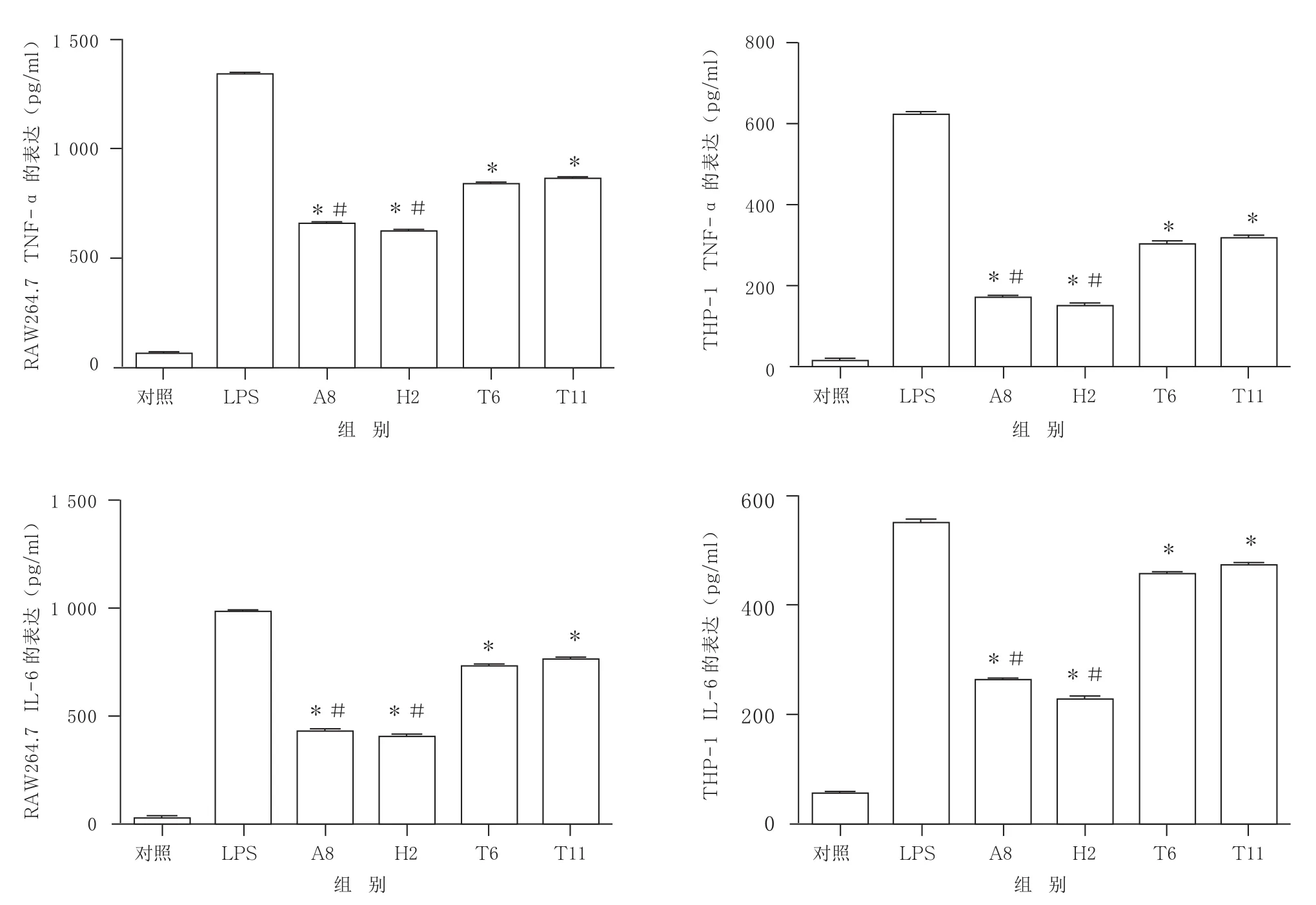
图4 优化多肽A8、H2与原始多肽T6、T11对 RAW264.7和THP-1细胞因子生成的影响

图5 动物模型中优化多肽A8、H2与原始多肽T6、T11抗炎活性的比较
本研究以本实验室前期筛选出的拮抗多肽T 6、T 11为基础,采用NNK策略成功构建突变肽库,对突变肽库进行3轮亲和筛选(以MD-2全长蛋白为靶蛋白并且MD-2全长蛋白包被量逐轮减少),以得到高亲和力的噬菌体克隆。我们随机挑取94个克隆,通过细胞因子生成抑制实验发现,其中5个克隆与MD2全长蛋白的结合高于原始T 6、T 11克隆,其中2个可显著减轻LPS刺激巨噬细胞合成和释放炎症介质,这2个噬菌体克隆所展示的融合肽可以模拟MD2的抗炎多肽。将这2个阳性克隆进行测序,并人工合成。最后通过动物实验,检测动物血清中炎性介质的表达,发现最终只有1条优化多肽具有明显强于原始多肽的抑炎效果。
本研究经过构建突变肽库对原始多肽T 6、T 11进行优化,成功得到一条在细胞水平以及动物水平上抑制炎症效果均强于原始多肽的MD2拮抗多肽H2。该优化多肽较原始多肽T 6、T 11虽在细胞抗炎效果上有明显提高,但在动物模型上抗炎效果并非特别理想。考虑原因可能为,优化后的多肽仍为小分子肽,其在体内代谢较快,如果想进一步提升靶向MD2特异性多肽的效果,多肽作为潜在药物,其给药方式以及药物的稳定性值得进一步研究。但同时,脓毒症是一个全身的综合反应,包含了多种信号通路参与其中,目前过分强调了炎症反应在脓毒性损害中的作用,忽视了严重创伤本身对抗感染免疫防御功能的削弱。在临床创伤患者治疗中更多注重的是如何通过各种措施进行相应的抗炎抗感染策略,而对机体免疫防御功能的调理重视不够。如果能把握好抑制炎症的度,将能更好指导临床脓毒症患者的用药治疗。
综上所述,本研究通过构建以T 6、T 11多肽为基础的突变肽库,进行二次筛选的方法可成功获得与MD2全长蛋白亲和力更高的多肽,该多肽对细胞以及动物均有比原始多肽T 6、T 11更佳的抗炎效果,这为MD2抗炎药物的进一步优化奠定了基础。
[1]Alberto V, Eicke L, Monks BG, Terje E, Golenbock DT. Lysines 128 and 132 enable lipopolysaccharide binding to MD-2, leading to toll-like receptor-4 aggregation and signal transduction [J]. J Biol Chem, 2003, 278(48):48313-48320.
[2]Kennedy MN, Mullen GE, Leif er CA, Lee C, Mazzoni A,Dileepan KN, Segal DM. A Complex of soluble MD-2 and lipopolysaccharide serves as an activating ligand for Toll-like receptor 4 [J]. J Biol Chem, 2004, 279(33):34698-34704.
[3]Jerala R. Structural biology of the LPS recognition[J]. Intern J Med Microbiol, 2007, 297(5):353–363.
[4]郭正纲, 米卫东. NF-κB信号通路与神经系统损伤关系的研究进展[J]. 感染、炎症、修复,2014,15(2):125-128.
[5]Park BS, Lee JO. Recognition of lipopolysaccharide pattern by TLR4 complexes[J]. Experi Molecular Med, 2013, 45(12):1373-1373.
[6]Roh E, Lee HS, Kwak JA, Hong JT, Nam SY, Jung SH, Lee JY, Kim ND, Han SB, Kim Y. MD-2 as the target of nonlipid chalcone in the inhibition of endotoxin LPS-induced TLR4 activity[J]. J Infect Dis volume, 2011, 203: 1012-1020.
[7]高东, 王晓冬, 靳广毅, 姜文奇. Toll样受体与配体复合物结构的研究进展[J]. 细胞与分子免疫学杂志, 2015, 4:553-556.
[8]Zhang J, Kumar A, Wheater M, Yu FS. Lack of MD-2 expression in human corneal epithelial cells is an underlying mechanism of lipopolysaccharide (LPS) unresponsiveness[J]. Immunol Cell Biol, 2009, 87(2):141-148.
[9]Gradisar H, Keber MM, Pristovsek P, Jerala R. MD-2 as the target of curcumin in the inhibition of response to LPS[J]. J Leukoc Biol, 2007, 82(4):968-974.
[10]Gioannini TL, Weiss JP. Regulation of interactions of Gramnegative bacterial endotoxins with mammalian cells[J].Immunol Res, 2007, 39(1-3):249-260.
[11]Park SH, Kim ND, Jung JK, Lee CK. Myeloid differentiation 2 as a therapeutic target of inflammatory disorders[J]. Pharmacol Therapeutics, 2012, 133(3):291–298.
[12]Yan H, Gu CG, Xu FL, Wu XH, Yin HH, Hu CX, Zhu XD, Liu F, Ge HJ, Chen LY, Zhang XY, Wang ZG, Xing Z, Li L. Identification of synthetic peptides that inhibit lipopolysaccharide (LPS) binding to myeloid differentiation Protein-2 (MD-2)[J]. J Immunotherapy, 2013, 36(3):197-207.
[13]Wrighton NC, Farrell FX, Chang R, Kashyap AK, Barbone FP, Mulcahy LS, Johnson DL, Barrett RW, Jolliffe LK, Dower WJ. Small peptides as potent mimetics of the protein hormone erythropoietin[J]. Science, 1996, 273(5274):458-463.
[14]Beenhouwer DO, May RJ, Philippe V, Scharff MD. High affinity mimotope of the polysaccharide capsule of Cryptococcus neoformans identified from an evolutionary phage peptide library[J]. J Immunol, 2002, 169(12):6992-6999.
[15]Sidney J, Assarsson E, Moore C, Ngo S, Pinilla C, Sette A, Peters B.Quantitative peptide binding motifs for 19 human and mouse MHC class I molecules derived using positional scanning combinatorial peptide libraries[J]. Immunome Res, 2008, 4(1):1-14.
[16]Fl eishman SJ, Bak er D. Comp utational d esign of proteins targeting the conserved stem region of influenza hemagglutinin[J]. Science, 2011, 332(6031):816-821.
[17]Nagasaki H, Chung S, Dooley CT, Wang Z, Li C, Saito Y, Clark SD, Houghten RA, Civelli O. The pharmacological properties of a novel MCH1 receptor antagonist isolated from combinatorial libraries.[J]. Eur J Pharmacol, 2009, 602(2-3):194–202.
[18]Gallop MA. Application of combinatorial technologies to drug discovery(1): background and peptide combinatorial libraries[J].J Med Chem, 1994, 37(10):1385-1401.

