KD 患儿血清对细胞活力及NF-κB 表达的影响和PDTC 的干预
薛超超 李 丰 仇慧仙 陈 其 张园海
川崎病( Kawasaki disease,KD) 是一种以全身中小血管炎为主要病变的儿童急性发热出疹性疾病,主要并发症是冠状动脉损害,可表现为冠脉扩张或者冠脉瘤[1]。近年来越来越引起儿科医师重视。遗憾的是至今未能建立公认稳定的KD 动物模型,研究多基于临床或体外细胞实验。虽然发病机制仍不完全清楚,但必然存在免疫系统的异常激活与炎性反应的过度扩大[2]。核因子-κB( NF -κB) 是一种具有基因转录功能的多项调控转录因子,在体内炎性反应过程中起到核心作用,能促发下游炎性连锁反应,所有炎症相关性疾病中几乎均能发现该通路的异常激活[3~6]。那么与冠脉病变密切相关的血管内皮细胞,其细胞内的NF -κB 信号通路能否在KD 患儿血清刺激下是否被过度激活,进而过度分泌各种细胞因子和炎性因子,造成细胞自身损害呢? 如果给予NF -κB 信号通路的抑制剂对该通路进行阻断,能否减轻血管内皮细胞的自身损害? 为证实这些猜想,笔者做了相关实验研究,现报道如下。
资料与方法
1.研究对象:2012 年7 月~2013 年6 月温州医科大学附属育英儿童医院儿童心血管科住院治疗的KD 急性期患儿30例,KD 诊断标准符合2004 年美国儿科学会和心脏病学会制定的KD 诊断标准[1]。病程均在1 周以内,未经过IVIG 治疗,排除其他免疫缺陷或者其他基础疾病。其中男性18 例,女性12 例,患儿年龄3 个月~4 岁,平均年龄2.3 ±1.4 岁。对照组为同期在笔者医院儿童保健科体检患儿30 例,其中,男性16 例,女性14 例,患儿年龄3 个月~4 岁,平均年龄2.56 ±2.22 岁,检查证实肝肾心功能正常,无基础心血管疾病,无感染性疾病依据。
2.标本采集: 抽取KD 患儿及对照儿童外周静脉血2ml,EDTA-K2 抗凝,1500r/min 离心5min,收集上清液,-80℃冰箱保存。
3. 细胞培养与分组: HUVEC 在RPMI1640 培养液( 含15%胎牛血清) 中培养24h,观察细胞已贴壁,生长良好,控制密度约1 ×106/培养瓶。随机分成4 组( 每组设10 个平行组) :对照组( N 组) ,KD 血清组( K 组) ,IVIG 组( G 组) ,PDTC组( P 组) ,除去旧培养液,分别予不同的培养液继续培养( 表1) ,24h 后取出,用于下一步实验。
表1 各组培养液及干预情况(±s)

表1 各组培养液及干预情况(±s)
分组 培养液及药物干预对照组( N 组) RPMI1640 培养基+15%正常儿童血清KD 血清组( K 组) RPMI1640 培养基+15% KD 患儿血清IVIG 组( G 组) RPMI1640 培养基+15% KD 血清+IVIG(10g/L)PDTC 组( P 组) RPMI1640 培 养 基 + 15% KD 血 清 + PDTC(100μmol/L)
4.MTT 检测细胞活力: 取培养瓶中的HUVEC,调整细胞浓度为1 ×105/ml,接种于96 孔板,每孔加入100μl 细胞悬液,放入培养箱孵育24h,按实验的4 组给与不同的处理,每组设5 个平行孔,继续培养24h。然后每孔加5mg/ml MTT 20μl,继续培养4h,每孔加入二甲基亚砜( DMSO) 100μl,震荡10min,使晶体完全溶解,酶联免疫仪在波长490nm 处读取吸光度的A 值。
5.RT-PCR 检测NF - κB p65mRNA 的表达: 通过检索GenBank 数据库,利用Primer 5.0 软件设计引物,由上海捷瑞生物工程有限公司合成,引物序列和预期PCR 产物长度见表2,用前稀释成10pmol/μl。按RNA 抽提试剂盒( Fermentas U.S.A) 说明书进行HUVEC 中RNA 的提取,RNA 的反转录,然后放入25μl 普通PCR 反应体系进行PCR 反应,反应条件见表3,扩增完成后取10μl PCR 扩增产物在2%的琼脂糖凝胶上电泳(120V,25 ~30min) ,紫外线灯下照相,用GelPro31 软件测电泳条带的IOD 比值。
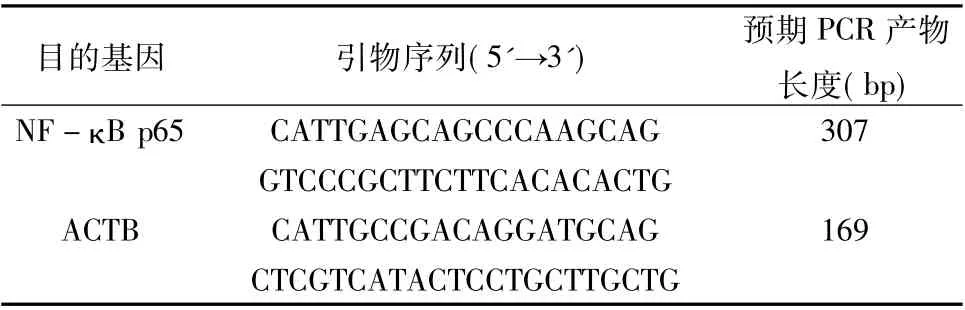
表2 引物序列和预期PCR 产物长度
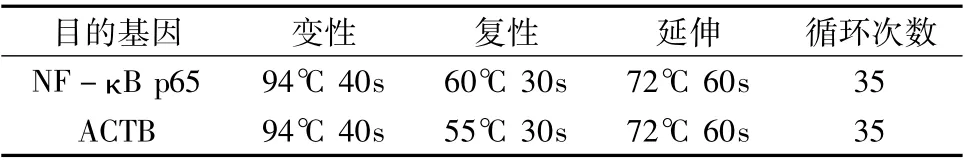
表3 目的基因的PCR 反应条件
6.Western blot 法检测HUVEC 胞核内NF -κB p65 蛋白的表达:按照碧云天核蛋白提取试剂盒说明书来提取HUVEC细胞核蛋白,BCA 法测蛋白浓度,制胶,各孔加入100μg 蛋白样品电泳,转膜,5%小牛血清封闭液封闭1h,加兔抗单克隆抗体NF-κB p65 65kDa 一抗(1∶500) 和兔抗单克隆抗体β-actin 45kDa(1∶1000) ,4℃孵育过夜。TBST 洗膜3 次,加辣根过氧化物酶( HRP) 标记的羊抗兔二抗( 1∶5000) 室温孵育1h,TBST 洗膜3 次,膜与化学发光检测试剂反应5min,曝光。利用Quantity One 凝胶分析软件测定条带的IOD 比值。
7.统计学方法:采用SPSS 17.0 统计软件分析,全部数据进行正态性检验,计数资料均值用均值±标准差(±s) 表示,多组比较采用单因素方差分析( ANOVA) ,方差齐者两两之间比较采用SNK-q 检验,以P <0.05 为差异有统计学意义。
结 果
1.MTT 法检测各组HUVEC 的细胞活力: 各组HUVEC 细胞活力的A 值见表4,图1。结果显示: ①KD 血清刺激下,HUVEC 的细胞活力较对照组显著降低( P <0.05) ; ②在丙种球蛋白或PDTC 的干预下,HUVEC 的细胞活力较单纯KD 血清刺激组均有显著升高,且两种干预措施组间比较细胞活力差异无统计学意义。
表4 各组HUVEC 活力的A 值(±s)

表4 各组HUVEC 活力的A 值(±s)
与N 组相比,* P <0.05;与K 组相比,#P <0.05
组别 n A值10 0.612 ±0.036 K 组 10 0.325 ±0.054*G 组 10 0.576 ±0.047#P 组 10 0.516 ±0.032 N 组#
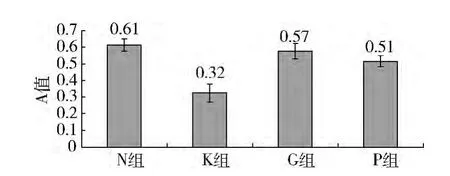
图1 各组HUVEC 细胞活力的A 值比较
2. RT - PCR 检 测 各 组HUVEC 中NF - κB p65mRNA 的 表 达: 各 组 HUVEC 的 NF - κB p65mRNA 电泳的灰度图( 图2) 及累计光密度相对值( IOD) ( 表5,图3) 。结果显示: ①KD 血清刺激下,NF- κB p65mRNA 表达较对照组显著增加( P <0.05) ;②在丙种球蛋白干预下,NF -κB p65mRNA表达较单纯KD 血清刺激组有下降趋势,但差异无统计学意义; ③在PDTC 的预下,KD 血清中NF - κB p65mRNA 表达较单纯KD 血清刺激组显著降低( P <0.05) ,且下降幅度较丙种球蛋白干预组显著( P <0.05) 。
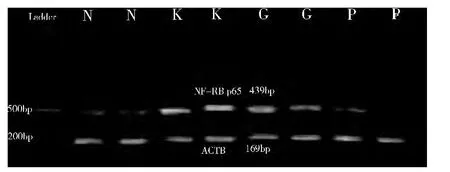
图2 各组NF-κB p65 的电泳灰度
表5 各组NF-κB p65mRNA 的相对IOD 值(±s)

表5 各组NF-κB p65mRNA 的相对IOD 值(±s)
与N 组比较,△P <0.05; 与K 组比较,◇P <0.05; 与G 组比较,* P <0.05
组别 n NF-κ B p65 mRNA N 组10 0.599 ±0.033 K 组 10 1.219 ±0.024△G 组 10 0.879 ±0.012 P 组 10 0.459 ±0.060◇*
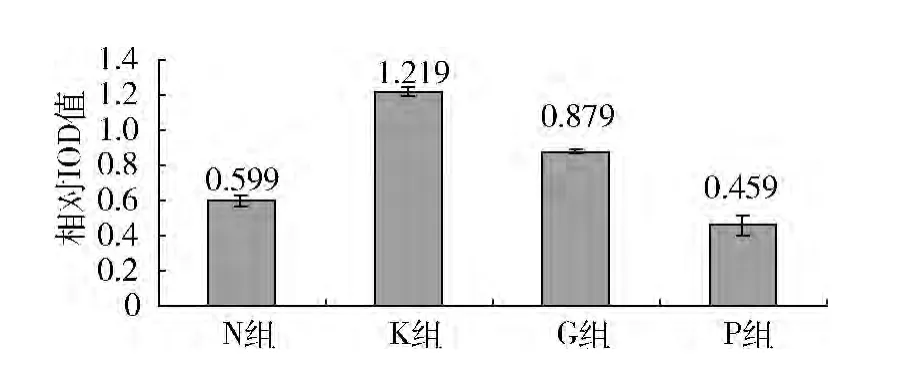
图3 各组NF-κB p65mRNA 的相对IOD 值比较
3.Western blot 法检测各组NF -κB p65 蛋白的相对表达:各组HUVEC 胞核内的NF -κB p65 蛋白电泳灰度图( 图4) 及相对IOD 值表达( 表6,图5) 。结果显示:①KD 血清刺激下,NF -κB p65 蛋白的表达较对照组显著增加( P <0.05) ; ②在丙种球蛋白干预下,KD 血清中NF -κB p65 蛋白的表达较单纯KD 血清刺激组有降低趋势,但差异无统计学意义;③在PDTC 的预下,KD 血清中NF -κB p65 蛋白表达较单纯KD 血清刺激组显著降低( P <0.05) 。
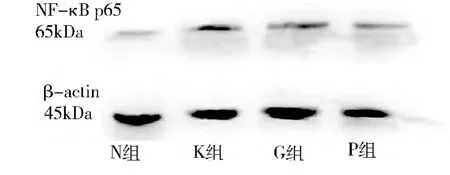
图4 各组HUVEC 中NF-κB p65、β-actin 蛋白的灰度
表6 各组HUVEC 中NF-κB p65 蛋白的相对IOD 值(±s)

表6 各组HUVEC 中NF-κB p65 蛋白的相对IOD 值(±s)
与N 组比较,△P <0.05;与K 组比较,◇P <0.05
组别 n NF-κB p65蛋白N 组10 0.195 ±0.068 K 组 10 0.526 ±0.128△G 组 10 0.479 ±0.072△P 组 10 0.172 ±0.135◇

图5 各组HUVEC 中NF-κB p65 蛋白的相对IOD 值比较
讨 论
川崎病临床主要表现为发热( >5 天) 、不规则皮疹、颈部淋巴结非化脓性肿大、眼结合膜炎、口唇皲裂、杨梅舌、掌( 跖) 红斑、手足硬性水肿等,最严重的并发症是冠状动脉损害( CAL) ,表现为冠脉扩张或者冠脉瘤[1],即使急性期未观察到CAL,成人期发生缺血性心脏病的危险性仍然增加[7]。KD 的发病机制尚不完全清楚,但必然存在免疫系统的异常激活与炎性反应的过度扩大。目前国际上较为认可的假说是,某种或某类病原体感染特殊基因的敏感个体,发生免疫系统的异常激活与过度扩大的炎性反应,进而出现的一系列病理过程[2]。所以寻找KD 的炎性反应核心环节,对KD 的发病机制和针对性治疗都有重要意义。
NF-κB 是一种多极基因调控的转录蛋白,具有广泛的生物学活性,在静息状态下,NF -κB 多以异二聚体的形式与IκB 结合存在于胞质,激活后进入细胞核发挥转录功能,进而直接或间接调控免疫炎性反应相关的靶基因如细胞因子、趋化因子、协同刺激分子及黏附分子表达,从而出现机体一系列的炎性反应表现,故认为NF-κB 信号通路在炎性反应中起到核心 作 用[8]。本 实 验 通 过 检 测 细 胞 内 NF - κB p65mRNA,细胞核内NF-κB p65mRNA 蛋白的表达,能够一定程度上反应细胞内NF -κB 信号通路的激活程度。有研究发现急性期KD 患儿外周血的单核-吞噬细胞中的NF -κB 信号通路处于异常激活状态,并且在发生冠脉损害( CAL) 的KD 患儿中更加显著,提示该信号通路在KD 的发生上可能起到关键作用[9]。但由于每个KD 患儿病程、病情轻重存在差异,患儿外周血单核-吞噬细胞数量少,故实验结果存在一定局限性。Saito 等[10]运用转基因技术,培育了E-DNIκB 模型小鼠,这种小鼠由于内皮细胞中IκBα 蛋白不能被降解,NF-κB 蛋白不能被释放进入细胞核发挥作用,结果发现E-DNIκB 模型小鼠在行腹主动脉切开再缝合术后,发生腹主动脉瘤的比例较正常小鼠明显减少,提示NF-κB 信号通路参与介导动脉壁细胞外基质的病理性重构,参与动脉瘤的形成,可能对KD 并发症起到关键作用。
血管内皮细胞是炎症早期效应靶向之一,能分泌多种炎性物质,目前国内外对血管内皮细胞的NF -κB 信号通路研究有限,故本实验选取的人脐静脉内皮细胞( HUVEC) 为研究细胞,实验中笔者发现在川崎病血清的刺激下,HUVEC 细胞活力显著下降,伴随细胞内NF-κB p65 mRNA 表达显著增强,细胞核内NF-κB 蛋白合成显著增加,提示KD 患儿血清中某些物质能促使细胞内的NF-κB 信号通路过度激活,并造成细胞自身的损伤。人体中冠状动脉内皮细胞位于血液与血管壁之间,如发生炎性介质过度分泌,不仅造成细胞自身损害,还能引起周围的血管基膜、内弹力膜破坏,最终导致冠脉扩张和冠脉瘤等并发症,故推测与KD 并发症关系密切[11]。
尽管KD 发病机制尚未明确,但标准疗法静脉注射用人免疫球蛋白( IVIG)2g/kg 联合阿司匹林口服方案的有效性已得到公认,使继发CAL 的发生率从自然病程的20% ~25%下降至3% ~5%[12]。IVIG 可从多方面对血管内皮细胞起到保护作用,如封闭血液中单核细胞、血管内皮细胞或血小板表面受体,通过调节炎性细胞功能,抑制炎性细胞黏附,中和病原体或毒素等[13~15]。本研究中在丙种球蛋白干预下,细胞活力较单纯KD 血清刺激组显著增强,伴随HUVEC 细胞内NF-κB p65 mRNA 表达和细胞核内NF-κB p65 蛋白表达较均有下降趋势,但差异无统计学意义,原因可能由于IVIG 的作用是多方面的,对该通路的抑制作用效果有限,或由于样本量较少导致的统计误差。但徐明国等[16]的实验结果显示IVIG 也能起到对NF-κB 信号通路显著抑制的作用,提示IVIG 抑制细胞NF -κB信号通路过度激活可能也是其药理机制之一。
那么单纯抑制细胞NF-κB 信号通路,是否可能对KD 的治疗有效呢? 吡咯烷二硫氨基甲酸酯( PDTC) 是一种强氧化剂,能通过抑制单核细胞-吞噬细胞浸润和抑制一氧化氮合酶( iNOS) 表达,直接或间接抑制反应性氧中间体( ROIs) 的产生等途径抑制IκB 蛋白降解,减少NF - κB 的核移位,起到对NF-κB 信号通路特异性抑制作用[17]。本实验中在PDTC 的干预下,HUVEC 细胞活力较单纯KD 血清刺激组显著增强,伴随细胞内NF -κB p65 mRNA 和细胞核内NF - κB p65 蛋白的表达均显著下降,提示PDTC 对在抑制NF -κB 信号通路的作用效果强于IVIG,并且对体外培养的内皮细胞也能起到和IVIG相近的保护作用。国外的研究还证实,PDTC 还能增强心肌梗死后心肌细胞对缺血再灌注损伤的耐受力,起到保护心肌细胞的作用。推测其有减轻冠脉扩张等并发症的作用,故说明PDTC 在KD 的治疗上有潜质的临床价值。但是在本实验中,笔者还发现由于PDTC 对NF-κB 信号通路强力的抑制作用,本实验中P 组NF-κB 蛋白表达水平甚至低于正常组。有实验研究证实,生物体内NF-κB 信号通路的作用广泛、调控精细,在炎性反应早期,可能起到保护作用,还对内皮细胞的其他正常生理功能也起重要作用,故只有能做到对NF-κB 信号通路的精确调控,特异性的抑制性药物才可能试用于临床[18]。
综上所述,本研究证明HUVEC 在KD 血清刺激下,细胞中NF-κB 信号通路被激活,造成细胞自身损害,推测与KD 的发生、发展密切相关。比较IVIG和PDTC 在体外HUVEC 的干预效果,证明PDTC 能通过抑制细胞核内NF - κB 蛋白的过度合成,增强HUVEC 对抗KD 血清的刺激,起到和IVIG 相近的保护作用,在KD 的治疗上有潜在的临床价值。同时应注意到人体内NF -κB 信号通路具有十分精细和复杂的调节机制,过度抑制很可能干扰正常生理功能,如何进行适度的抑制需要开展更深入的研究。
1 Yellen ES,Gauvreau K,Takahashi M,et al. Performance of 2004 American heart association recommendations for treatment of Kawasaki disease[J]. Pediatrics,2010,125(2) :234 -241
2 Curtis N. Kawasaki disease and toxic shock syndrome-at last the etiology is clear? [J]. Adv Exp Med Biol,2004,549(1) :191 -200
3 Hayden MS,Ghosh S. NF - κB in immunobiology[J]. Cell Research,2011,21(2) :223 -244
4 张娟,徐青. 核转录因子-κB 与支气管哮喘的研究进展[J]. 国际免疫学杂志,2010,3(33) :200 -204
5 李治琴,郑一君,陈晓微,等. IκK -α/β、IκB -αmRNA 在系统性红斑狼疮患者外周单个核细胞中的表达及临床意义[J]. 临床皮肤科杂志,2010,39(3) :148 -150
6 刘勇刚,李志花,陈汝福,等. NF-κB 特异性抑制剂PDTC 对人肝门部胆管癌细胞增殖及SMYD3 表达的影响[J]. 中山大学学报,2011,32(1) :22 -25
7 Fukazawa R,Ogawa S. Long - term prognosis of patients with Kawasaki disease: at risk for future atherosclerosis? [J]. J Nippon Med Sch,2009,76(3) :124 -133
8 Ghosh S,Kario M. Missing pieces in the NF - kappaB puzzle[J].Cell,2002,109( Supp1) : S81 -S96
9 邹峥,熊国亮,段君凯,等. 急性川崎病外周血单个核细胞核因子-кB 活化的变化[J]. 实用儿科临床杂志,2009,24( 1) :35 -37
10 Saito T,Hasegawa Y,Ishigaki Y,et al. Importance of endothelial NF-κB signaling in vascular remodeling and aortic aneurysm formation[J]. Cardiovasc Res,2013,97(1) :106 -114
11 Ashouri N,Takahashi M,Dorey F,et al. Risk factors for nonresponse to therapy in Kawasaki disease[J]. J Pediatr,2008,153(3) :365 -368
12 Newburger JW,Takahashi M,Gerber MA,et al. Diagnosis,Treatment and long - term management of Kawasaki disease: a statement for health professionals from the committee on rheumatic fever,endocarditis,and Kawasaki disease,council on cardiovascular disease in the young,American Heart Association[J]. Pediatrics,2004,114(6) :1708 -1733
13 胡静,王大为,王凤鸣,等. 内皮细胞型一氧化氮合成酶基因多态性与川崎病并冠状动脉损伤易感性的相关性[J]. 实用儿科临床杂志,2008,23(9) :663 -664
14 Yoshimura K,Tatsumi K,Iharada A,et al. Increased nitric oxide production by neutrophils in early stage of Kawasaki disease[J]. Eur J Pediatr,2009,168(9) :1037 -1041
15 Ichiyama T,Ueno Y,Isumi H,et al. An immunoglobulin agent( IVIG) inhibits NF-kappaB activation in cultured endothelial cells of coronary arteries in vitro[J]. Inflamm Res,2004,53( 6) :253 -256
16 徐明国,门丽娜,祖莹,等. 人丙种球蛋白和阿司匹林治疗对川崎病儿童循环内皮祖细胞功能的影响[J]. 中国当代儿科杂志,2011,13(12) :966 -969
17 Luengo-Blanco M,Prando C,Bustamante J,et al. Essential role of nuclear factor-kappaB for NADPH oxidase activity in normal and anhidrotic ectodermal dysplasia leukocytes[J]. Blood,2008,112( 4) :1453 -1460
18 Hamid T,Gu Y,Ortines RV,et al. Divergent tumor necrosis factor receptor-related remodeling responses in heart failure: Role of nuclear factor - kappaB and inflammatory activation[J]. Circulation,2009,119(3) :1386 -1397

