紫杉醇诱导大鼠神经病理性疼痛模型的建立①
银联飞,韦婷婷,黄容容,杨璨瑜,苏盈,韦山,沈让,宾晓芸
(右江民族医学院,广西 百色 533000 E-mail:644592440@qq.com)
随着全球恶性肿瘤发病率的不断上升,抗肿瘤药物的应用也日渐增多。紫杉醇(paclitaxel,Taxol)是一种从紫衫中提取的抗癌药物,主要通过促进细胞内的微管蛋白发生聚合,保持微管蛋白稳定,抑制细胞的有丝分裂从而抑制肿瘤细胞的恶性增殖[1],广泛应用于实体瘤的治疗中。紫杉醇化疗后的两个严重不良反应是骨髓抑制和神经病理性疼痛。对于其骨髓抑制不良反应,大多数患者通过给予粒细胞集落刺激因子能够有效抵抗中性粒细胞的减少。而紫杉醇所致的神经病理性疼痛主要表现为外周感觉性的痛觉超敏、灼痛、刺痛和麻木等症状,此症状可持续至紫杉醇停药后数月至数年[2],是一种严重的难治性痛症,基于对其机制认识的局限,目前尚无特别有效的治疗措施。一些接受紫杉醇治疗的癌症病人甚至会因为严重的疼痛而不得不中断治疗[3]。因此紫杉醇的不良反应限制了化疗药物的使用,影响肿瘤治疗效果和患者生存质量。本研究旨在探索构建紫杉醇诱导的大鼠神经病理性疼痛模型,并评估其效果,为阐明紫杉醇诱导的神经病理性疼痛的相关机制和相应药物的开发提供可靠的动物实验基础。
1 材料和方法
1.1 实验动物 选择40 只SPF 级成年Sprague-Dawley(SD)大鼠,雄性,体重200g左右,由右江民族医学院实验动物中心提供,室温20~25 ℃,12h黑/白光照,自由饮食。
1.2 动物分组及给药 随机将40只大鼠随机分为4组:溶剂对照组(A 组)、紫杉醇0.5mg/kg组(B 组),紫杉醇1.0mg/kg组(C 组),紫杉醇2.0mg/kg组(D组),每组10 只。B、C、D 组注射相应剂量的紫杉醇(溶于1ml生理盐水),A 组注射等体积的紫杉醇溶剂DMSO(二甲基亚砜)(溶于1 ml生理盐水)。隔天注射,共注射10次,持续观察20d(首次注射为第1d)。紫杉醇注射液(paclitaxel,Taxol)和溶剂DMSO(二甲基亚砜)均购于Sigma Chemical公司。
1.3 全身观察 每日测量大鼠体重,观察大鼠的饮食、排泄、毛发、步态及活动等情况。
1.4 行为学测定 测定大鼠的机械缩足反射阈值(mechanical withdrawal threshold,MWT)。将大鼠置于透明的有机玻璃箱中,底为1cm×1cm 的铁丝网,测定前使之适应30 min,以不同折力的Von Frey纤维刺激大鼠足底,以大鼠出现缩足或舔足行为记为阳性反应,否则为阴性反应。从2g开始,每个折力的von Frey纤维细丝均连续测定10次,每次刺激间隔30s,up-down法[4]计算50%缩足反应阈值,最大折力为15g,大于此值时记为15g。所有大鼠给药前2d测定基础痛阈,之后每天测定MWT 直至给药后第20d(停止给药后1d)。
1.5 组织学观察 给药后第20d,每组取5~6只大鼠,25%乌拉坦(1g/kg)深麻醉,取大鼠双侧坐骨神经固定后,石蜡包埋,切片,苏木精和伊红染色后,光镜下观察。
1.6 统计学方法 使用SPSS 18.0统计软件,数据采用重复测量方差分析,P <0.05 为差异有统计学意义。
2 结果
2.1 大鼠的一般情况 实验期间大鼠无死亡,4组大鼠均未出现脱毛、腹泻或运动失常等情况。给药前4组大鼠平均基础体重分别为(208.7±2.2)、(221.1±1.6)、(219.1±1.9)和(213.4±1.8)g,差异无统计学意义(P >0.05)。给药期间,4组大鼠体重均缓慢增长,各组大鼠间平均体重差异无统计学意义(P >0.05)。
2.2 MWT 的测定 大鼠的后足MWT 测量结果的显示,给药前四组大鼠的基础痛阈相似,后足平均MWT 分别为(14.81±0.28)、(14.51±0.39)、(14.64±0.42)和(14.66±0.39)g,差异无统计学意义(F=0.427,P =0.735>0.05)。在实验过程的各观察时间点,对照组大鼠的后肢MWT 无明显变化(P >0.05)。D 组大鼠[紫杉醇2.0 mg/(kg·d)]在第3次给药后1d(第6d),后肢MWT 与A 组(对照组)相比差异有统计学意义(F =0.126,P =0.019<0.05),在第4 次用药后1d(第8d),D 组大鼠后肢MWT 降到最低点,与A 组(对照组)相比差异有统计学意义(F =0.279,P =0<0.01),并且基本稳定此数值左右直至第20d。B组[紫杉醇0.5mg/(kg·d)]和C组大鼠[紫杉醇1.0mg/(kg·d)]都在第5次给药后1d(第10d),后肢MWT 与A 组(对照组)相比差异有统计学意义(P <0.05),B 组大鼠后肢MWT则基本为此在该水平左右(F =0.256,P =0.012<0.01),而C组在第15d之后与A 组对比差异有统计学意义(F =0.256,P =0<0.01),见表1。
表1 各实验组各时间点大鼠MWT 的变化 (n=10,±s,g)
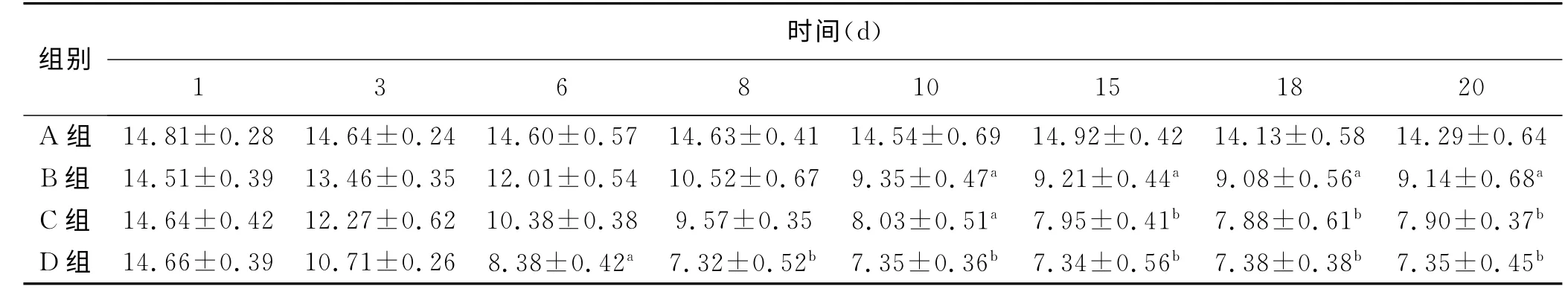
表1 各实验组各时间点大鼠MWT 的变化 (n=10,±s,g)
注:与A 组比较,a:P <0.05,b:P <0.01
时间(d)组别1 3 6 8 10 15 18 20 A 组 14.81±0.28 14.64±0.24 14.60±0.57 14.63±0.41 14.54±0.69 14.92±0.42 14.13±0.58 14.29±0.64 B组 14.51±0.39 13.46±0.35 12.01±0.54 10.52±0.67 9.35±0.47a 9.21±0.44a 9.08±0.56a 9.14±0.68a C组 14.64±0.42 12.27±0.62 10.38±0.38 9.57±0.35 8.03±0.51a 7.95±0.41b 7.88±0.61b 7.90±0.37b D 组 14.66±0.39 10.71±0.26 8.38±0.42a 7.32±0.52b 7.35±0.36b 7.34±0.56b 7.38±0.38b 7.35±0.45 b
2.3 组织学观察 光镜下观察大鼠的坐骨神经显微结构,与对照组相比,可见紫杉醇处理组大鼠坐骨神经髓鞘肿胀,部分髓鞘空泡变,部分许旺细胞结构破坏,许旺细胞核增多,见图1。
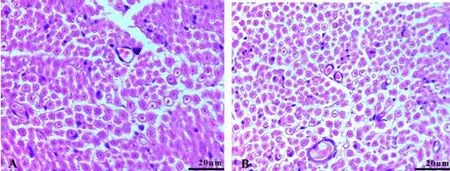
图1 坐骨神经冠状切面结构,紫杉醇
3 讨论
近年来,医学分子生物学发展迅猛,神经病理痛模型的建立也逐渐成熟,如慢性坐骨神经缩窄损伤(chronic constriction injury of sciatic nerve,CCI)模型、脊神经结扎(spinal nerve ligation,SNL)模型,坐骨神经分支损伤(spared nerve injury,SNI)模型,以及糖尿病所致的神经病理痛模型等人们都进行了广泛的研究[5],但是国内对化疗药物引起的外周神经病理性疼痛模型的研究较少,人们对紫杉醇引起的化疗痛的机制尚未研究透彻,而且紫杉醇化疗痛对阿片类药物不敏感,目前临床上缺乏有效方法来预防或减轻此种神经损害,因此构建紫杉醇诱导的大鼠神经病理性疼痛模型,为系统深入地研究其机制,并寻求可靠的治疗方法,设计有效的干预药物有着十分重要的意义。
本实验通过对大鼠重复间断地腹腔注射浓度分别为0.5、1.0、2.0 mg/(kg·d)的紫杉醇观察到,最早在第三次连续用药后(给药第6d),剂量浓度为2.0 mg/(kg·d)的实验组中,大鼠出现了机械痛敏,在第4次给药后(用药第8d)达到最小,并且基本稳定在该水平。相对于本实验中注射紫杉醇剂量为1.0 mg/(kg·d)的大鼠,2.0mg/(kg·d)剂量组的大鼠机械痛阈出现得更早,更稳定。实验结果提示,隔天腹腔注射2.0mg/(kg·d)的紫杉醇建立稳定的致神经病理性疼痛模型。本研究的紫杉醇致痛敏最佳剂量低于2000年Authier等[6]的32mg/kg,高于陈治军等[7]的1.0mg/(kg·d)。另外,本研究隔天注射的频率高于Authier等[6]的一周一次,而与陈治军等[7]、Boyette等[8]的剂量与注射频率相一致。另外,本实验结果还提示,重复间断腹腔注射2.0mg/(kg·d)紫杉醇的实验组大鼠在用药8d左右,机械刺激疼痛阈值达到最低数值。
综合对注射紫杉醇后大鼠的机械阈值改变、组织学改变和一般情况观察与分析,我们认为,隔天腹腔注射2.0mg/(kg·d)紫杉醇可以成功建立大鼠神经病理性疼痛模型,表现为外周感觉神经的机械超敏,且存在组织学的结构变化。用药8d左右可以考虑作为下一阶段研究紫杉醇诱导的神经病理性疼痛机制的合理、有效时间段。本研究采用紫杉醇诱导的神经病理性疼痛动物模型构建方法简便可行,成本不高,神经病变确切,可为紫杉醇诱导的神经病理性疼痛机制的研究,开发治疗紫杉醇化疗痛的药物提供有价值的评价工具。
[1] Ren K,Rouald Dubner.Neuron-glia crosstalk gets serious:role in pain hypersensitivity[J].Current Opinion in Anaesthesiology,2008,21(5):570-579.
[2] Kiya T,Kawamata T,Namiki A,et al.Role of satellite cell-derived l-serine in the dorsal root ganglion in paclitaxel-induced painful peripheral neuropathy[J].Neuroscience,2011,174:190-199.
[3] Kaplan JG,Einzig AI,Schumburg HH.Taxol causes permanent large fiber peripheral nerve dysfunction:a lesson for preventative strategies[J].J Neurooncol,1993,16(2):105-107.
[4] Chaplan SR,Bach FW,Pogrel JW,et al.Quantitative assessment of tactile allodynia in the rat paw[J].J NeurosciMethods,1994,53(1):55-63.
[5] 毛庆祥,杨天德.神经病理性疼痛动物模型[J].中国医药指南,2008,6(3):13-14.
[6] Authier N,Gillet JP,Fialip J,et al.Descript ion of a short-term taxol-induced nociceptive neuropathy in rats[J].Brain Res,2000,887(2):239-249.
[7] 陈治军,田玉科,罗放,等.紫杉醇致大鼠外周神经病理性疼痛模型的建立[J].华中科技大学学报:医学版,2008,37(6):785-790.
[8] Boyette-Davis J,Xin W,Zhang H,et al.Intraepidermal nerve fiber loss corresponds to the development of taxol-induced hyperalgesia and can be prevented by treatment with minocycline[J].Pain,2011,152(2):308-313.

