柱前荧光标记法结合HPLC-FLD 测定石榴中四种三萜酸
袁恩光,李国梁,*,吴宏亮,刘书成,夏 莲,尤进茂,,索有瑞
1 曲阜师范大学生命有机分析重点实验室,曲阜 273165;2 中国科学院西北高原生物研究所,西宁 810001;3广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,湛江 524088
三萜酸总体可以分为羽扁豆烷型、齐墩果烷型、熊果烷型等结构类型(常见的三萜酸结构式见图1)。通过对三萜酸类化合物的生物活性及毒性研究,发现其具有溶血、抗炎、抗菌、抗病毒、降低胆固醇、杀软体动物等活性[1]。近期许多研究也表明三萜酸具有抗肿瘤和抗HIV 病毒的活性[2]。目前三萜酸类化合物中齐墩果酸和熊果酸的研究最为广泛,其在预防癌症、保肝护肝等方面有特殊的功效,并且还具有强心、降压、降脂、降糖等方面生理功能[3]。在许多中药中三萜酸类化合物能表现出特殊的生理活性,例如枇杷叶中的三萜酸具有镇咳[4]、降血糖[5]、调节免疫力[6]抗抑郁[7]的功能;山楂中的三萜酸具有预防动脉粥样硬化[8]和降血脂[9]的功能。三萜酸因其结构复杂人工合成困难,目前主要从天然植物中提取获得,因此寻找富含三萜酸类化合物的植物来源越来越引起人们的广泛关注和重视。
在天然药物中,自身具有较大共轭体系的化合物如黄酮类、蒽醌类等可以在紫外检测器或者荧光检测器下进行准确的测定。但是三萜酸类分子本身并没有共轭体系并且紫外吸收也比较低,所以很难采用一般的分光光度法对其含量进行准确的测定。近年来所采用的气相色谱、HPLC-UV[10]、HPLCMS[11]、毛细管电泳[12]等在选择性、灵敏性、准确性和效率方面都没有太大的进步或者存在诸多的缺点和不足。本实验采用HPLC-FLD-MS 技术,2-(7H-二苯并[a,g]咔唑)乙基对甲苯磺酸酯(DBCETS)作为荧光标记试剂,建立了高灵敏、高选择性的三萜酸检测方法,该方法可在45min 内实现4 种三萜酸的基线分离,检测限(S/N=3)可达1.10~1.48 ng/mL,这种方法与常规方法相比具有快速、高效、灵敏等优点。
石榴是一种具有较高营养价值和保健功能的药食两用资源,有“全身是宝”的美称。目前我国已成为是世界上第一大石榴种植国。从石榴皮中鉴定出来的化合物主要有黄酮类、生物碱类、鞣质类、有机酸类等[13],石榴中三萜酸成分的报道较少,只有关于齐墩果酸与熊果酸的报道[14]。本实验将利用新建立的方法首次对石榴不同部位中科罗索酸、山楂酸、齐墩果酸及熊果酸进行分析测定。
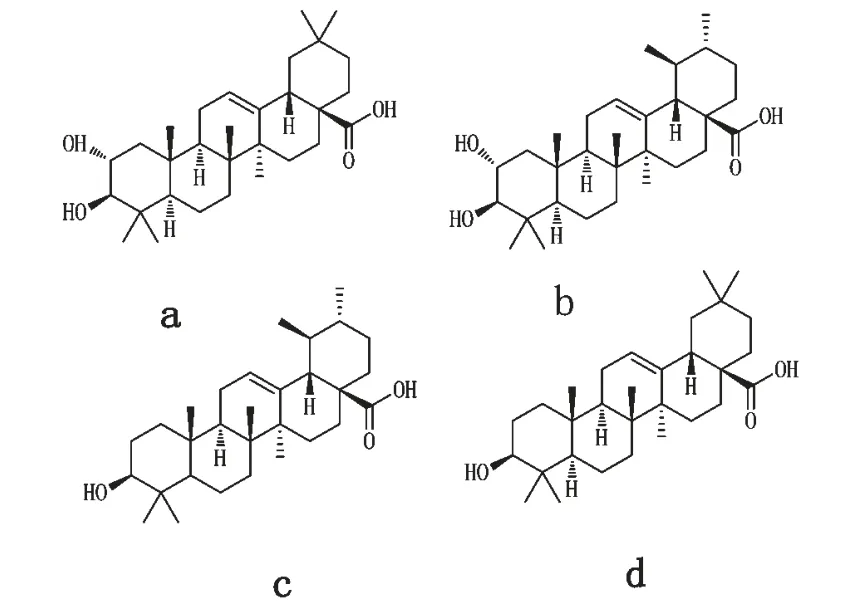
图1 山楂酸(a)、科罗索酸(b)、熊果酸(c)、齐墩果酸(d)的化学结构式Fig.1 Chemical structures of maslinic acid(a),corosolic acid(b),ursolic acid(c)and oleanolic acid(d)
1 材料与方法
1.1 实验药品
三萜酸标准对照品,包括山楂酸、科罗索酸、齐墩果酸和熊果酸均购自Sigma 公司(圣路易斯,密苏里州,美国);HPLC 级乙腈(CH3CN)购自禹城化学试剂有限公司(山东省,中国);2-(7H-二苯并[a,g]咔唑)乙基对甲苯磺酸酯(DBCETS)为实验室自制;娃哈哈纯净水、碳酸钾和N,N-二甲基甲酰胺(DMF)等其它试剂均为分析纯。
1.2 仪器设备与条件
Agilent 1100 液相色谱-质谱联用仪(Agilent 公司,美国),配备四元梯度泵(G1311A)、在线真空脱气机(G1322A)、荧光检测器(G1321A)和自动进样器(G1316A);质谱系统:Esquire-LC NT software;高效液相系统软件:HP ChemStation;色谱条件:Hypersil BDS C18柱(200×4.6 mm,5 μm,依利特公司,大连,中国),流速为1.0 mL/min,进样量10 μL,柱温25 ℃,荧光激发和发射波长分别为300 nm 和395 nm;流动相为乙腈/水(5∶95,v/v)(A)和乙腈(B);梯度洗脱程序:0~5 min,65%B;5~15min,65%~90%B;15~38 min,90%~92%B;38~40 min,92%~93%B;40~45 min,93%~100%B。所用流动相经过0.2(m 的尼龙膜过滤。质谱条件:大气压化学电离源(APCI),正离子模式,喷雾压力60 psi,干燥气流量为5 L/min,干燥气温度350 ℃,Vap 温度450 ℃,毛细管电压3500 V,电晕电流4000 μA(Pos)。KQ-100DE 型数控超声波清洗器(昆山市超声仪器有限公司)。
1.3 石榴样品
石榴(Punica granatum)采自中国山东枣庄地区,将石榴样品的果皮、石榴花、石榴籽各部分分开,在50 ℃条件下干燥至恒重,用不锈钢碾碎器碾成粉末后过筛(60 目),储存在冰箱中备用。称取10 g粉末样品,于三颈烧瓶中加入100 mL 90%乙醇,超声萃取10 min,取部分提取液进行抽滤,取所得滤液2 mL 氮气吹干,残余物用200 μL 乙腈重新溶解备用。
1.4 标准溶液的配制
准确称取23.25 mg DBCETS 用DMF 定容至10 mL,相应低浓度的溶液用DMF 稀释而成。称取三萜酸标品,用乙腈/DMF(9∶1,v/v)配制成浓度为1×10-2mol/L 标液,相应低浓度的三萜酸标品用乙腈/DMF(9∶1,v/v)稀释而成,放置于冰箱中于4 ℃下保存。
1.5 荧光标记条件优化
响应面法在较少的时间次数和较短的时间内对所进行的实验进行全面研究与分析。在荧光标记条件优化实验中选取标记时间(min)、标记温度(°C)及标记试剂用量进行组合。以-1、0、1 代表自变量水平,按方程xi=(Xi-X0)∕ΔX 对自变量进行编码。其中,xi为自变量的编码值;Xi为自变量的真实值;X0为实验中心点处自变量的真实值;ΔX 为自变量的变化步长。实验因素见表1。
采用Design Expert(Trial Version 7.0.3,Stat-Ease Inc.,Minneapolis,MN,USA)软件对实验数据进行回归分析,拟合二次多项式方程可以表达为:

式中:Y 为预测响应值(衍生化效率);Xi和Xj为自变量编码水平;β0为常数项;βi为线性回归系数;βii为二次项回归系数;βij为交互项回归系数。多项式模型方程拟合可靠性由R2表达,其统计学上的显著性由F 值检验。
1.6 三萜酸荧光标记
向2 mL 安瓿瓶中依次加入200 μL 衍生试剂,30 μL 三萜酸混合标品或样品提取溶液(100 μL),10 mg K2CO3和125 μL DMF,密封后于90 ℃水浴中振荡反应30 min,完毕后放置冷却,向衍生液中加入500 μL 乙腈/DMF(1∶1,v/v)稀释后直接进样10 μL。三萜酸的荧光标记概况图见图2。

图2 三萜酸荧光标记示意图Fig.2 The derivatization of DBCETS with betulinic acid
2 结果与讨论
2.1 三萜酸标记条件优化
本研究采用三因素三水平BBD 设计优化标记试剂用量、标记时间及标记温度,实验结果列于表1中。方差分析表明,模型具有较高的显著性(P<0.001),温度对衍生反应影响不显著。R2>0.96 表明,实验数据与模型预测值相吻合。失拟项的F 值不显著,意味着模型对于预测反应精确性很高。变异系数(C.V.%)小于9.76%表示该模型具有很好重复性。通过对实验数据进行回归拟合,得多元二次回归模型:
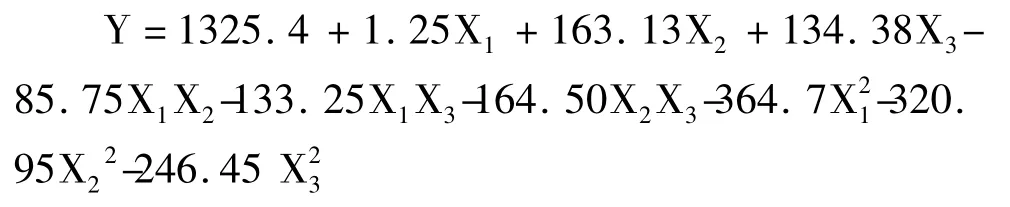
通过响应面图可直观地反映各因素的交互作用对响应值的影响,从而确定最佳衍生条件。图3a 为标记试剂用量与标记时间对标记效率的影响,如图所示随着衍生试剂量的增加,衍生效率增加,当标记试剂量达到一定值时,随着标记试剂量的增加衍生效率略有降低;标记时间从25 min 提高到35 min 过程中,随着时间的延长,标记效率先升高到最大值,然后趋于稳定。另外图3b 为标记时间与标记温度对衍生化效率的影响;图3c 为标记温度与标记试剂用量对标记效率的影响。通过软件Design-Expert求解回归方程,得到三萜酸荧光标记的最佳标记条件:标记试剂与三萜酸摩尔比为7,标记温度为90 °C,标记时间为30 min,模型预测值为1325,在此条件下进行3 次平行实验,测定得峰面积为1390,与预测值基本吻合,偏差较小,证明该模型用于优化三萜酸的标记条件是可行的。

表1 响应面实验因素与水平、实验设计及结果(峰面积)Table 1 Factors,levels and response values(peak area)of response surface analysis

注:X1:时间;X2:温度;X3:试剂与标准品摩尔比。Note:X1:labeling time;X2:reaction temperature;X3:molar ratio of labeling reagent to standard.
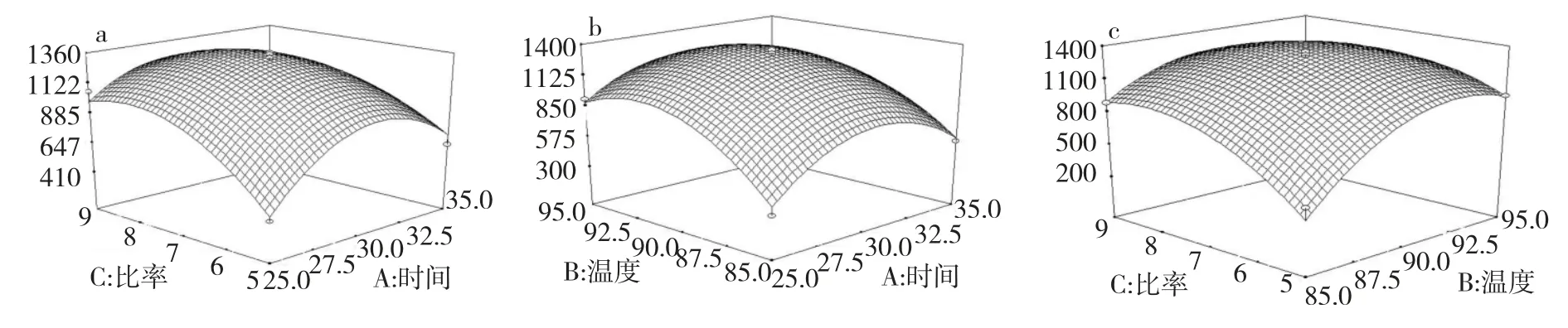
图3 因素交互作用对三萜酸标记效率影响的响应面图Fig.3 The 3D response surface plots of peak area affected by labeling conditions
2.2 色谱分离与质谱鉴定
本研究对不同色谱柱包括Hypersil C18(200 mm×4.6 mm,5 μm)、Hypersil BDS C8(200 mm×4.6 mm,5 μm)、Hypersil BDS C18(200 mm×4.6 mm,5 μm)、Spherisorb C18(200 mm×4.6 mm,5 μm)进行了评估,结果表明Hypersil BDS C18(200 mm×4.6 mm,5 μm)分离效果最好。同时我们还对不同的流动相进行了考察,结果表明最佳流动相为A:乙腈/水(5∶95,v/v),流动相B:100%乙腈。混合标准品的色谱图见图4。实验中通过标准对照品保留时间及在线质谱对各色谱峰进行定性。三萜酸衍生物产给出强烈的分子离子峰,分子离子碰撞诱导解离后产生多个特征碎片离子峰。代表性的熊果酸衍生物的质谱数据见图5,如图所示熊果酸衍生物在质谱条件下产生分子离子峰m/z 747.8(MS),特征碎片峰m/z 294.4、m/z 409.3 和m/z 730(MS/MS)。
2.3 线性回归方程、检出限重现性和回收实验

图4 混合标准品色谱图:过量荧光标记试剂(a)、山楂酸(b)、科罗索酸(c)、齐墩果酸(d)、熊果酸(e)Fig.4 HPLC-FLD chromatogram of the mixed standard:excessive fluorescent labeling reagent(a),maslinic acid(b),corosolic acid(c),oleanolic acid(d)and ursolic acid(e)
本实验采用建立的色谱方法,进样量在0.025~6.0 μg/mL 范围内,依据峰面积和进样量,对所测定的三萜酸类化合物进行线性回归,所得各衍生物的回归方程、相关系数和检出限(信噪比按S/N=3计算)见表2。方法的检测限为1.10~1.48 ng/mL。对三萜酸衍生物平行六次分析,保留时间和峰面积的相对标准偏差在0.01%~0.05% 和1.28%~1.85%范围内。

图5 熊果酸衍生物的质谱裂解模式图Fig.5 MS and MS/MS spectra of representative ursolic acid derivative and the cleavage mode of protonated molecular ion
为了评估实验的准确性,称取一定量的石榴样品,精确加入一定量的三萜酸对照品进行提取分析,并计算回收率。回收率根据公式(测量值-内源性值)/添加值×100% 计算,结果见表2,三萜酸的回收率在92.9%~100.4%之间。
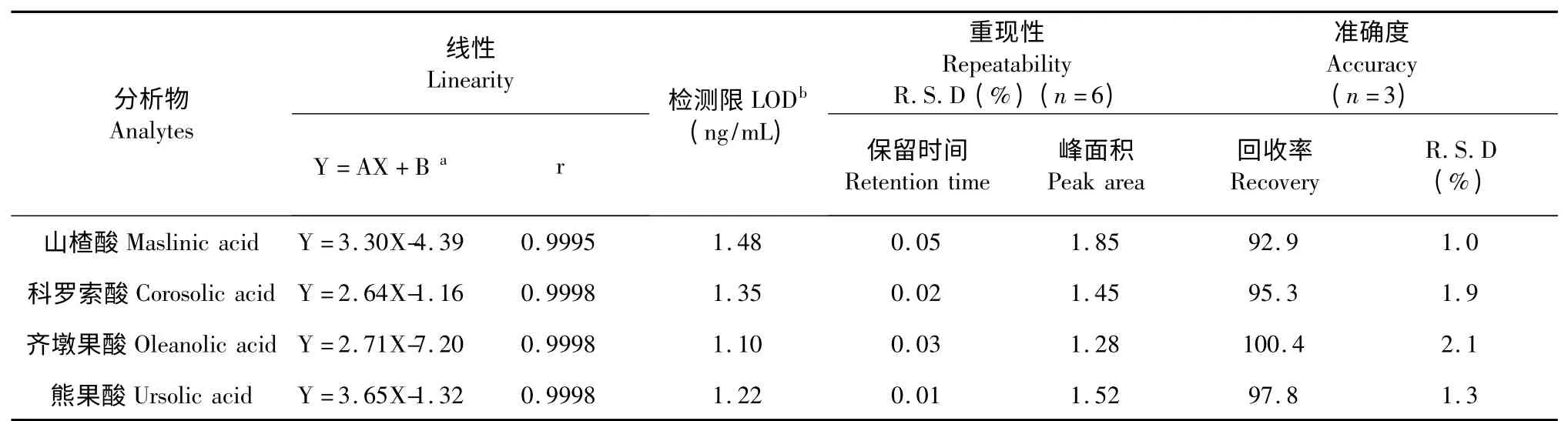
表2 线性方程、检测限、精密度和准确度Table 2 Linear equations,detection limits,precision and accuracy of the developed HPLC-FLD method
2.4 新建立的方法与已报道方法对比
将建立的新方法与已报道的三萜酸测定方法进行比较,对比结果见表3。在大多数情况下,三萜酸利用HPLC 结合各种检测器直接测定,没有采用衍生化的方法。但是三萜酸没有生色基团,最常用的检测波长是205 nm 附近,这会导致检测限偏高和基线波动,不能实现三萜酸的准确定量分析。HPLC结合蒸发光散射检测器(ELSD),质谱(MS)和核磁共振(NMR)也有报道,得到的检测限在pmol/μL 水平(见表3)。本方法给出的检测限为1.10~1.48 ng/mL,明显低于表3 中已报道的方法(HPLC-MS、GC、CE 等),表明该方法比已报道的方法具有更高的检测灵敏度。此外HPLC-MS 仪器设备昂贵,且普及率低,而HPLC-FLD 设备价格相对便宜,一般常规实验室均有配备。
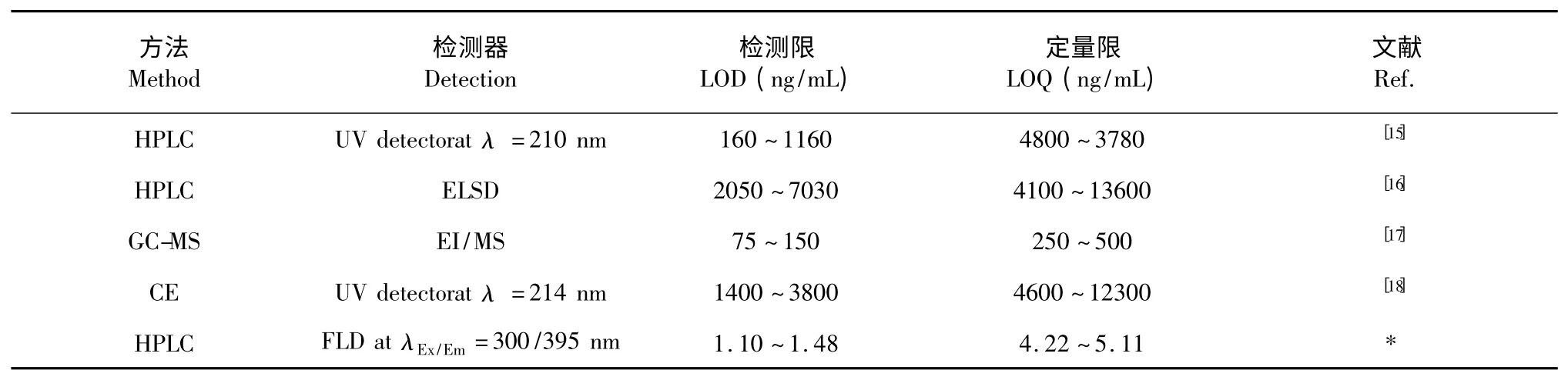
表3 新建立的方法与已报道方法对比Table 3 Comparison of the developed method with traditional methods
2.5 石榴样品中三萜酸分析
我们将新建立的方法应用于石榴中不同部位(包括果石榴皮、石榴花、石榴籽)的三萜酸分析。石榴中的不同部位色谱图见图6。其中有四种三萜酸被检测到,包括山楂酸、科罗索酸、齐墩果酸和熊果酸。四种三萜酸的含量见表4。石榴中不同部位三萜酸含量有差异。例如:石榴花中的齐墩果酸和熊果酸含量明显比山楂酸和科罗索酸高,而石榴皮和石榴籽中的四种三萜酸的含量差距相对比较小。石榴花中的齐墩果酸和熊果酸含量很高可达201.5 mg/g 和206.3 mg/g。石榴籽中的科罗索酸含量最高。石榴皮中的四种三萜酸含量相对都较少。

图6 石榴花(A)、石榴皮(B)及石榴籽(C)的HPLC-FLD 色谱图Fig.6 HPLC-FLD chromatograms of pomegranate flower(A),pomegranate rind(B)and pomegranate seeds(C)

表4 石榴中不同部位四种三萜酸的含量Table 4 Triterpenic acid content in different parts of pomegranate
3 结论
本实验首次采用DBCETS 作为荧光标记试剂,结合HPLC-FLD-MS 技术,建立了快速、高灵敏的三萜酸检测方法。对石榴中三萜酸柱前荧光标记条件进行了系统研究,从而保证了三萜酸的充分提取及荧光标记。该分析方法可在45 min 内实现4 种三萜酸的基线分离,检测限(S/n=3)可达1.10~1.48 ng/mL,与已报道方法相比具有检测灵敏度高、选择性强、分析时间短等优势。将建立的方法对石榴中的不同部位包括石榴皮、石榴花、石榴籽中的三萜酸组分进行了准确定量分析。该研究为三萜酸的检测方法研究提供了新思路,建立的方法可广泛应用于其它植物样品中三萜酸快速、高灵敏检测分析。同时该研究得到的石榴中不同部位的三萜酸含量信息,为石榴资源的综合利用及深层次产品开发提供数据支持。
1 Yao XS(姚新生),Wu LJ(吴立军).Medicinal chemistry of natural products,The Fourth Edition(天然药物化学第四版).Beijing:People’s Medical Publishing House,2003.306.
2 Janakiram NB,Indranie C,Malisetty SV,et al.Chemoprevention of colon carcinogenesis by oleanolic acid and its analog in male f 344 rats and modulation of cox-2 and apoptosis in human colon HT-29 cancer cells.Pharm Res-Dordr,2008,25:2151-2157.
3 Somova LO,Nadar A,Rammanan P,et al.Cardiovascular,antihyperlipidemic and antioxidant effects of oleanolic and ursolic acids in experimental hypertension.Phytomedicine,2003,10:115-121.
4 Liu RX(刘荣霞),Bi KX(毕开顺).Establishment of HPLC-fingerprint analysis for the quality assessment of Angelica sinensis.Chin Pharm J(中国药学杂志),2003,38:757-760.
5 Li F(李锋),Wang H(王航),Xue YK(薛原楷),et al.The experimental study on hypoglycemic activity of triterpenic acids from loquat leaf.Pharm Biotechnol(药物生物技术),2011,18:328-331.
6 Ge JF(葛金芳),Hu CM(胡成穆),Li J(李俊),et al.Immunoregulatory actions of triterpene acids loquat leaf(TAL).Chin Pharmacol Bull(中国药理学通报),2006,22:1194-1198.
7 Cao WW(曹尉尉),Lu B(陆波).Antidepressant activity of centalla asiatic triterpenic acid and its main constituents.J Pharm Prac(药学实践杂志),2008,26:185-187.
8 Zhu YF(褚衍芳),Hang WX(黄文兴).Effect of sheng mai injection on glucocorticoid receptor content in peripheral leukocytes in rats.Pharmacol Clin Chin Mater Med(中药药理与临床),1988,4(2):22-27.
9 Mou YD(缪亚东),Ouyang Z(欧阳臻),Yuan B(袁斌).Study on purification of the effective position of the droping blood-fat from fructus crataegi.Food Res Dev(食品研究与开发),2008,29:104-108.
10 Kontogianni VG,Exarchou V,Troganis A,et al.Rapid andnovel discrimination and quantification of oleanolic and ursolic acids in complex plant extracts using two-dimensional nuclear magnetic resonance spectroscopy--comparison with hplc methods.Anal Chim Acta,2009,635:188-195.
11 Fang X,Wang J,Yu X,et al.Optimization of microwave-assisted extraction followed by rp-hplc for the simultaneous determination of oleanolic acid and ursolic acid in the fruits of chaenomeles sinensis.J Sep Sci,2010,33:1147-1155.
12 Yang P,Li Y,Liu X,et al.Determination of free isomeric oleanolic acid and ursolic acid in pterocephalus hookeri by capillary zone electrophoresis.J Pharm Biomed,2007,43:1331-1334.
13 Tang LL(唐丽丽),Liu LW(刘邻渭),Sun LF(孙丽芳),et al.Pomegranate peel polyphenols extraction and analysis.Food Res Dev(食品研究与开发),2010,31:121-126.
14 Zheng YM(郑艺梅),Liu CH(刘长华),Chen SK(陈树坤).Study on the ingredient difference between granatum and pomegranate seed.Acade Period Farm Prod Proc(农产品加工·学刊),2008,12:37-49.
15 Lee MK,Ahn YM,Lee KR,et al.Development of a validated liquid chromatographic method for the quality control of prunellae spica:Determination of triterpenic acids.Anal Chim Acta,2009,633:271-277.
16 Guo S,Duan JA,Tang YP,et al.Characterization of triterpenic acids in fruits of ziziphus species by HPLC-ELSD-MS.J Agric Food Chem,2010,58:6285-6289.
17 Sánchez ávila N,Priego Capote F,Luque de Castro MD.Ultrasound-assisted extraction and silylation prior to gas chromatography-mass spectrometry for the characterization of the triterpenic fraction in olive leaves.J Chromatogr A,2007,1165:158-165.
18 Qi S,Ding L,Tian K,et al.Novel and simple nonaqueous capillary electrophoresis separation and determination bioactive triterpenes in chinese herbs.J Pharm Biomed Anal,2006,40:35-41.

