黄连提取物对植物病原真菌抑制作用及机理初探
张驰翔,王 周,朱奇奇,蒲 博,焦士蓉
西华大学生物工程学院,成都 610039
黄连(C.chinensis)是常见的抗菌消炎中药,临床上长期用于抗肠道细菌感染、降热镇痛。现代医学证明,其特殊的药理性质主要与其根茎中所含生物碱相关,其中主要包括小檗碱、黄连碱、巴马汀、药根碱[1],其分子结构均属异喹啉生物碱。关于黄连提取物中主要成分生物碱的抑制细菌实验,其中小檗碱的抑菌活性最大,黄连碱和巴马汀次之,药根碱最小[2]。4 种黄连生物碱对革兰氏阳性菌的抑制活性大于革兰氏阴性菌和酵母菌。为开发新型真菌抑制剂提供方向。
植物病原真菌是引起农作物病害的主要原因,是农业生产中重大的问题,因此选取五种常见的植物病原真菌小麦赤霉菌、水稻立枯丝病菌、玉米小斑病菌、番茄灰霉菌和油菜菌核病菌为实验对象。本文主要对黄连提取物抑制真菌作用进行了测定,并对其抑制机理进行了初步探究。
1 仪器与材料
DHG-9070A 型电热恒温鼓风干燥箱,HH-S 型数显恒温水浴锅,旋转蒸发仪RE-52B,SHZ-D(II)循环水式真空泵,TB-214 型电子天平,FDU-1100 冷冻干燥机,超低温冰箱Heto Mltra Freeze MF 3410,DL-1 万能电炉,YJ-875 医用净化工作台,自动台式灭菌器,SGSP-02 电热恒温隔水式培养箱,万能视频成像装置(成都励扬精密机电有限公司),UV-2600型紫外可见光分光光度计等。
分析纯葡萄糖(成都市科龙化工试剂厂),琼脂粉(成都市科龙化工试剂厂),硫酸链霉素原药(Amresco.0382)。
小麦赤霉菌(Gibberella zeae,子囊菌亚门,ACCC编号:31053),水稻立枯丝病菌(Rhizoctonia solani,半知菌亚门,ACCC 编号:30374),玉米小斑病菌(Helminthosporium maydis,半知菌亚门,ACCC 编号:30138),番茄灰霉菌(Botrytis cinerea,半知菌亚门,ACCC 编号:30387),油菜菌核病菌(Sclerotinia sclerotiorum,子囊菌亚门,ACCC 编号:36169),菌种均购自中国农业微生物菌种保藏。
西华大学生物工程学院提供黄连提取物成品(小檗碱≧19.09%,巴马汀≧4.90%,药根碱≧2.79%)。
2 实验方法
2.1 平板生长速率法
将黄连提取物溶解于无菌水中(浓度为50 mg/mL 溶液),采用平板生长速率法,在无菌条件下接入含毒培养基和对照培养基的中心,适宜温度下分别恒温培养一段时间后采用十字交叉法测量菌落直径取其平均值[3,4]。通过以下公式计算其相对抑菌率:

2.2 二倍稀释平板生长速率法
初筛后抑菌活性达90%以上的菌株,采用二倍稀释法,重复处理3 次,按照2.1 方法培养一段时间测量菌落直径取其平均值。通过以下公式计算其相对抑菌率,再根据几率值分析法,采用SPSS 软件计算EC50值及其置信区间并求出相关系数和回归方程。

2.3 孢子形成的抑制作用测定方法
将抑菌稳定性实验中培养6 d 的各处理和对照组,用Φ=6.0 mm 打孔器于距菌落边缘3~4 mm处打取菌块,用无菌水将菌块上的孢子洗下,血球计数板在光学显微镜下直接计孢子数,每块菌重复3次。用下列公式计算形成孢子数量及对孢子形成的抑制率[5]:

2.4 孢子萌发的抑制作用测定方法
采用凹玻片培养法[6],室温下培养。孢子萌发以芽管的长度超过孢子的直径长度的一半为准,每两小时计数一次,直至阴性对照萌发率达到50%以上,每个片选3 个视野计数,最后9 个观察数据平均作为试验数据。用下列公式计算孢子萌发抑制率,计算出毒力回归方程式、EC50及相关系数。

2.5 对菌丝形态的影响
将培养的各处理和对照菌落,在恒温培养6 d后,用拨针挑取病原菌菌落边缘的菌丝体和正常菌丝体制成玻片标本,在显微镜下观察病源菌菌丝形态[7]。
2.6 对菌丝形态的影响
2.6.1 电导率的测定方法
将菌种接种在PDA 培养基上培养4 d,用直径6 mm 的打孔器沿菌落边缘打取菌饼,移入PDB 培养基内,120 rpm 振荡培养5 d。然后将培养液抽滤,菌丝用生理盐水冲洗干净,备用。称取2 g 菌丝放入50 mL 烧杯中,使用无菌去离子水清洗3 次。加入20 mL 去离子水和供试提取液,使药液呈浓度梯度。然后分别在0、5、15、30、60、90 和120 min 时测定电导率,重复3 次[8]。
2.6.2 总多糖的测定
总多糖采用蒽酮比色法测定,参考钟芳晓[9]的实验方法。
2.6.3 总蛋白质的测定
蛋白质的测定采用考马斯亮蓝G250 染色法[10]。
3 结果与讨论
3.1 黄连提取物抑菌实验结果
3.1.1 提取物抑菌初筛
按照2.1 实验方法,以多菌灵为参考组进行抑菌实验,结果见下表1。
从上表可知,黄连提取物对于小麦赤霉菌、玉米小斑菌、番茄灰霉菌、油菜菌核菌四种真菌具有较好的抑制率。
3.1.2 提取物抑菌稳定性
按照2.2 实验方法进一步筛选,测定其稳定性,结果见下表2。
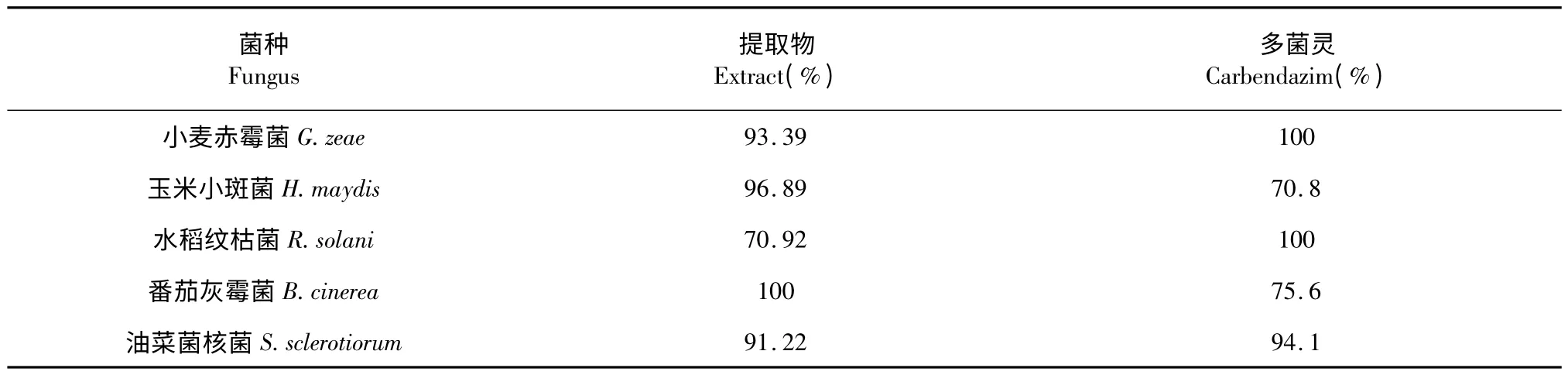
表1 抑菌实验初筛Table 1 Prelimiary screening of antifungal activity
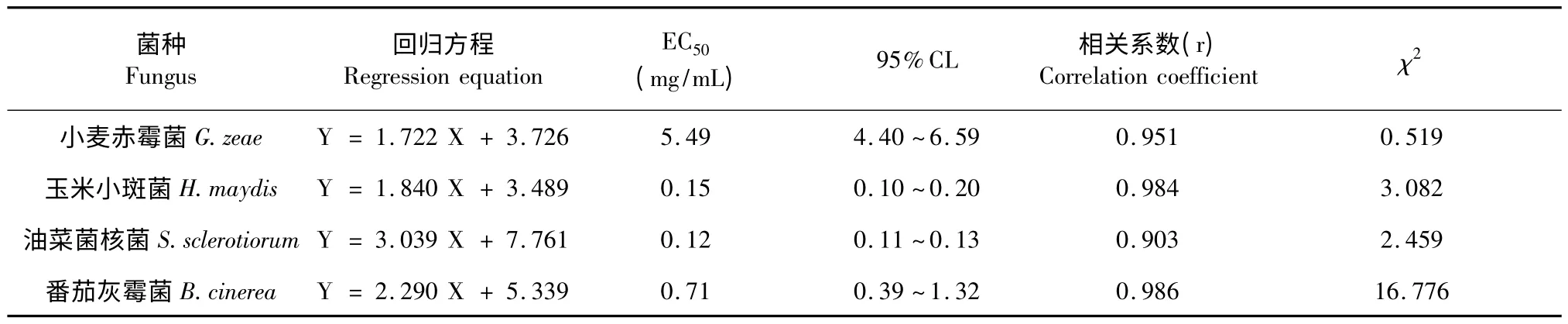
表2 抑菌实验稳定性Table 2 Stability of antifungal experiments
由上表可知,4 种菌的稳定性实验结果经SPSS软件计算,分析可得其检验结果可靠,进一步说明黄连提取物对于4 种菌具有较好的抑制作用。
3.2 黄连水提取物对真菌抑制机理初探
3.2.1 提取物对真菌孢子形成的影响
按照2.3 的实验方法,将提取物配制成浓度为1.5、0.75、0.375、0.188、0.094 mg/mL 的PDA 培养基,接种油菜菌核菌28 ℃培养6 d,测定其孢子数并计算孢子形成抑制率,实验结果如下。
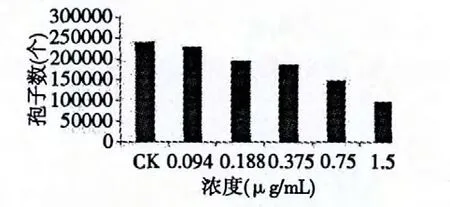
图1 提取物对油菜菌核菌孢子形成的影响Fig.1 Effects of extract on formation of S.sclerotiorum spores
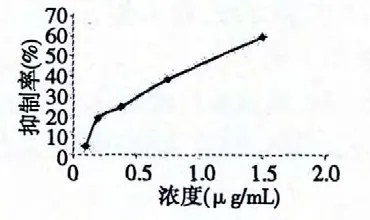
图2 提取物对油菜菌核菌孢子形成的抑制作用Fig.2 Inhibition of extract against formation of S.sclerotiorum spores
从图1 及图2 可以看出,黄连提取物对油菜菌核菌孢子形成有一定的抑制作用。随着提取物浓度的增大抑制率也增加,当处理组浓度为1.5 mg/mL时抑制率达到59.54%。
3.2.2 提取物对真菌孢子萌发的影响
按照2.4 的实验方法,提取物制成浓度为1.5、0.75、0.375、0.188、0.094 mg/mL 的溶液,在凹面载玻片上进行孢子萌发率的测定,结果如图3 和表3。

图3 提取物对油菜菌核菌孢子萌发影响Fig.3 Effects of extract on formation of S.sclerotiorum spores
从上表可以看出,黄连提取物对油菜菌核菌孢子萌发有较好地抑制作用。当提取物浓度达到1.5 mg/mL 的时候,抑制率达到76.19%,具有较好的抑制效果,其EC50为0.478 mg/mL。
3.2.3 提取物对真菌菌丝形态的影响
按照2.5 的实验方法,将黄连提取物配制成浓度为1.5 mg/mL 的PDA 培养基,接种油菜菌核菌培养6 d,挑取菌丝进行显微镜测定,结果如下。
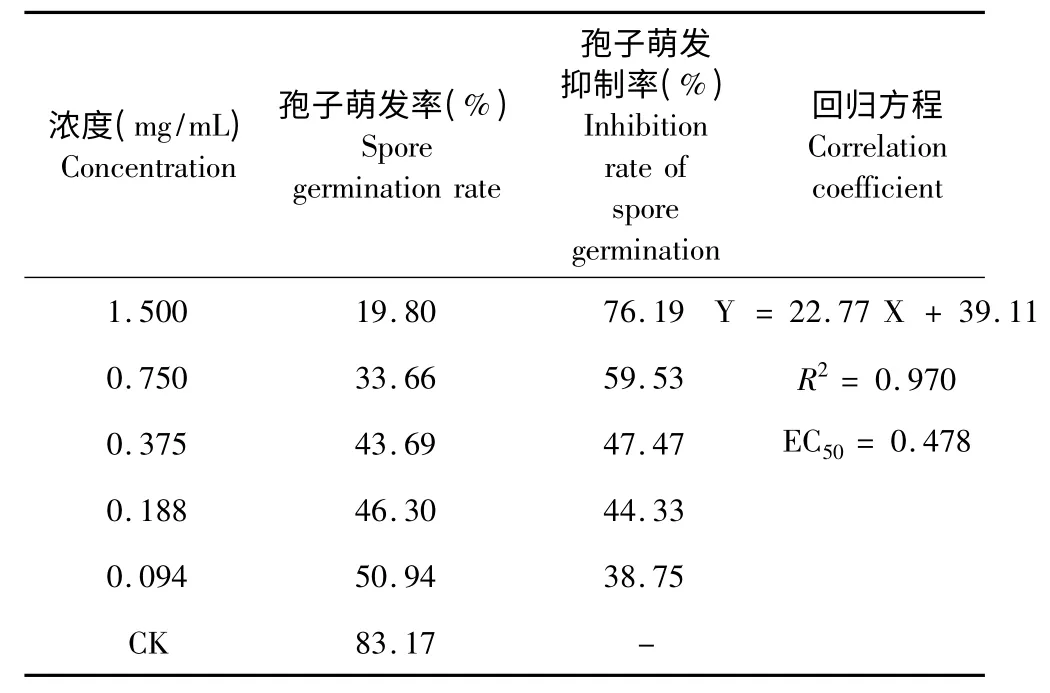
表3 提取物对油菜菌核菌孢子萌发毒力测定结果Table 3 Toxicity of extract against formation of S.sclerotiorum spores
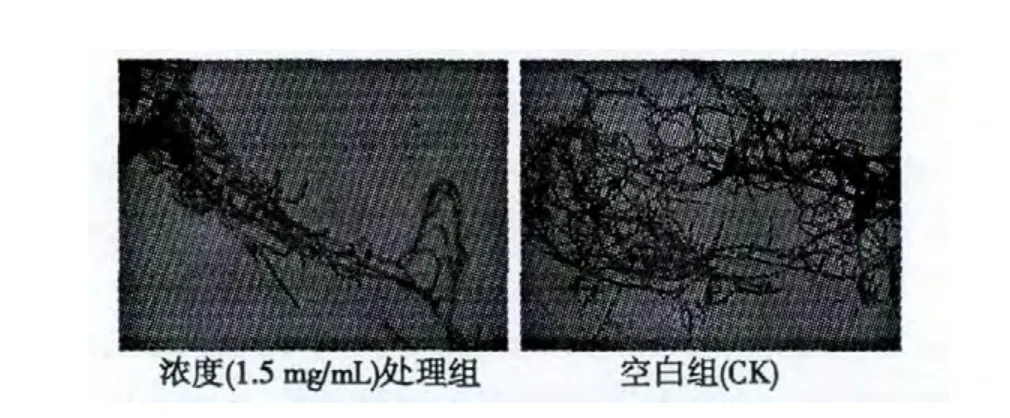
图4 提取物对油菜菌核菌菌丝形态的影响Fig.4 Effects of extract on mycelial shape of S.sclerotiorum
从上图可知,经黄连提取物处理后的油菜菌核菌菌丝形态与对照组菌丝形态没有较大差别。
3.2.4 提取物对真菌菌膜通透性的影响
3.2.4.1 电导率测定结果
按照2.6.1 的实验方法,将黄连提取物配制成浓为1.5、0.75、0.375、0.188、0.094 mg/mL 的溶液,分别加入2 g 油菜菌核菌菌丝,于5、15、30、60、90、120 min 时测定电导率,实验结果如图5。
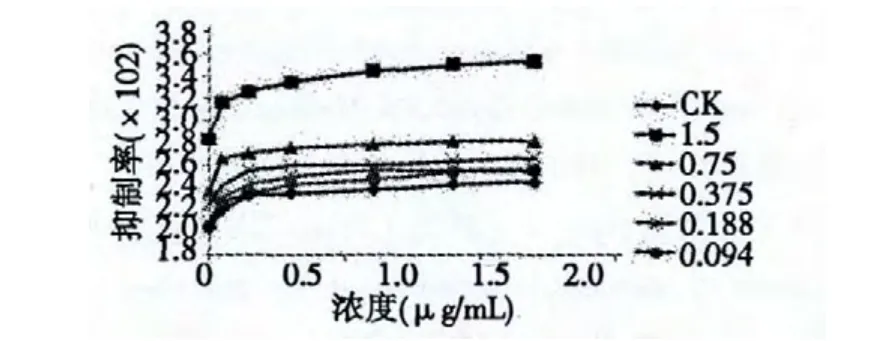
图5 提取物对油菜菌核菌菌体细胞膜渗透性的影响Fig.5 Effect of extract on permeability of cell membranes of S.sclerotiorum
从上图可以看出,油菜菌核菌在加入药液后培养一段时间电导率有所增大,说明菌丝内电解质渗漏。在浓度为0.094、0.188、0.375 mg/mL 时电导率变化不大,浓度为1.5 mg/mL 时电导率大大增加了,说明高浓度提取物对油菜菌核菌细胞体渗透性有明显效果。
3.2.4.2 膜外渗透总多糖测定结果
按照2.6.2 的实验方法,将黄连提取物配制成浓为1.5、0.75、0.375、0.188、0.094 mg/mL 的溶液,分别加入2 g 油菜菌核菌菌丝,28 ℃培养48 h,离心,上清液测定总多糖含量。
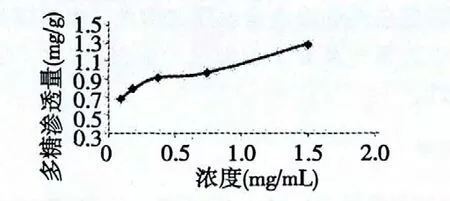
图6 提取物对油菜菌核菌膜外总多糖含量的影响Fig.6 Effect of extract on soluble polysaccharide content of S.sclerotiorum
从图6 可知,加入黄连提取物处理后油菜菌核菌菌丝总多糖的渗透量随着加入浓度的增加而增大。阴性对照组的渗透量为0.45 mg/g,加入样液后渗透量增大。
3.2.4.3 膜外渗透总蛋白质测定结果
按照2.6.3 的实验方法,将黄连提取物配制成浓为1.5、0.75、0.375、0.188、0.094 mg/mL 的溶液,分别加入2 g 油菜菌核菌菌丝,28 ℃培养48 h,离心,上清液测定蛋白质含量。
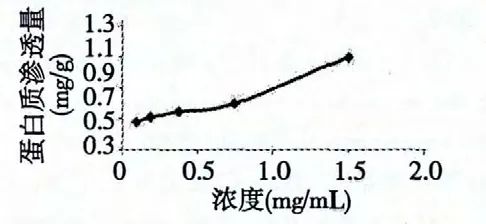
图7 提取物对油菜菌核菌膜外蛋白质含量的影响Fig.7 Effect of extract on soluble protein content of S.sclerotiorum
油菜菌核菌蛋白质渗透量随着加入提取物的浓度增大而增加。对照的渗透量为0.57 mg/g。加入提取物浓度为1.5 mg/mL 时,蛋白质渗透量为1.1 mg/g,说明高浓度的提取物对油菜菌核菌细胞膜通透性有较大影响。
4 结论
抑菌实验结果显示,黄连提取物对于五种常见植物病原真菌均具有一定的抑制,以市面上常用的多菌灵为参考,提取物对小麦赤霉菌、玉米小斑菌、番茄灰霉菌、油菜菌核菌四种真菌具有较好的抑制率,为新型真菌抑制剂开发做了基础。
抑菌实验机理初探显示,黄连水提物对油菜菌核菌孢子的形成有一定的抑制作用,对孢子的萌发也有明显的作用。处理后的油菜菌核菌菌丝没有明显变化。电导率随着处理液浓度增加而增大,胞外多糖和蛋白质的渗透量也随之增大。表明提取物能抑制油菜菌核菌孢子的形成及萌发,增大了细胞膜通透性。
1 Ma HM(马红梅),Chen G(陈刚),Li W(李文),et al.Chemical composition the separation and identification of Rhizoma coptidis.J Shengyang Pharm Univ(沈阳药科大学学报),2011,9:695-699.
2 Yang Y(杨勇),Ye XL(叶小利),Li XG(李学刚).Antimicrobial effect of four alkaloids from Coptidis rhizome.Lishizhen Med Mater Med Res(时珍国医国药),2007,18:3013-3014.
3 Yin SW(殷帅文),Wang QX(王庆先),Li Q(李强),et al.Antifungal activity of twenty common plant extracts againsttwo plant fungi:Flavonoids from Lycoris aurea.Nat Prod Res Dev (天然产物研究与开发),2009,21:306-311.
4 Feng H,Zhang CX,Liu J,et al.Synthesis and fungicidal activity of 2-(3-fluorophenylcarbamoyl)phenyl acetate.3thed Asian J Chem,2013,25:4541-4543.
5 Fang ZD(方中达).Plant disease research method (植病研究方法,第三版),1998.152.
6 Zhang JY(张继英),Qi YC(戚元成),Wang LQ(王兰青).Some bactericide put miscellaneous comparison experiment.Edible Fungi (食用菌),2009,3:68-70.
7 Zhang XH(张新虎),He J(何静),Shen HM(沈慧敏).Siberian cocklebur extract of tomato gray mold inhibitory effect and antibacterial mechanism.Acta Pratacul Sin(草业学报),2008,17(3):99-104.
8 Li HS(李合生).Biochemical experiment technology of plant physiology.Beijing:Higher Education Press,2000.
9 Zhong FX(钟方晓),Ren HH(任海华),Li Y(李岩).Comparison of methods determination of polysaccharide content.Lishizhen Med Mater Med Res(时珍国医国药),2007,18:1916-1917.
10 Li ZJ(李志江).Study on determination of protein content of beer by coomassie brilliant G-250 dyebinding.Liquor Making(酿酒),2008,(35):70-72.

