北细辛挥发油对5 种镰刀菌的抑菌活性及其成分分析
于婷婷,李 强,王茂青,何 朋,尚 坤,吴秀菊*
1东北农业大学生命科学学院,哈尔滨 150030;2 黑龙江省农垦总局科研育种中心,哈尔滨 150036
马铃薯(Solanum tuberosum L.)是我国重要的经济作物,其产量和种植面积随产业结构的调整逐年增加[1],而块茎腐烂是影响马铃薯产量和品质的主要限制因素之一,其中由镰刀菌引发的干腐病是马铃薯贮藏期间引起块茎腐烂最常见的病害,可导致窖储损失率高达60%,造成重大经济损失[2,3]。目前防治马铃薯干腐病的方法主要是在贮藏过程中保持干燥通风及以奥力克-霉止、多菌灵等农药消毒种薯,但随之会产生病原菌抗药性、农药长时间残留、高毒性、高污染等问题[4,5]。因此开发环境友好、作用方式特异、对非靶标生物相对安全等特点的植物源农药倍受人们的关注[6,7]。
北细辛又名辽细辛,为马兜铃科细辛属多年生药用植物,除具有解热、镇静、镇痛等药效外[8],还有良好的杀虫作用和一定的抗菌活性[9-11]。近年来研究表明,北细辛独特的药理作用,主要与其挥发油有关[12]。北细辛挥发油对灰霉病菌(Botrytis cinerea Pers.)等5 种黄瓜致病菌、茄子黄萎病致病菌大丽轮枝菌(Verticillium dahliae Kleb)、4 种人参致病菌均有良好的抑制效果[13-15]。作为植物源农药,北细辛具有一定的开发应用前景。
本试验探究了北细辛挥发油对5 种马铃薯干腐病致病菌镰刀菌的抑菌效果,以期为马铃薯干腐病的有效防治和基于北细辛的植物源农药开发提供理论依据。
1 材料与方法
1.1 供试材料
供试植物北细辛(辽细辛)购于黑龙江省药材市场,经黑龙江省中医药大学王振月教授鉴定为马兜铃科细辛属北细辛。供试菌种为引起马铃薯干腐病的5 种病原菌,分别为拟枝孢镰刀菌(Fusarium sporotrichioides)、拟丝孢镰刀菌(F.trichothecioides)、黄色镰刀菌(F.culmorum)、燕麦镰刀菌(F.avenaceum)、茄病镰刀菌蓝色变种(F.solani var.coeruleum)。5 种病原菌均由东北农业大学李凤兰老师提供,保存于本实验室。
供试培养基为PDA 培养基和VBC 培养基。
1.2 方法
1.2.1 挥发油的提取
北细辛全株阴干,用粉碎机粉碎后过40 目筛,放在通风干燥处备用。称取100 g 粉末,以1∶10 的料液比加入1000 mL 蒸馏水,超声辅助浸提60 min后,用水蒸气蒸馏法提取挥发油,重复3 次,挥发油提取率为2.1%。挥发油置于4 ℃冰箱保存备用。
1.2.2 菌种的活化
将保存在4 ℃的5 种镰刀菌于室温下恢复几分钟,然后挑取少量菌丝接种于PDA 培养基上,并置于25~28 ℃恒温培养箱中培养,待用。
1.2.3 挥发油对菌丝生长活性的抑制作用
采用菌丝生长速率法,用适量吐温60 助溶挥发油后,加入到PDA 培养基中,配成质量浓度为1.0、0.5、0.25、0.125、0.0625、0.0313 g/L 的培养基,以等体积的吐温60 作为对照(CK),充分摇匀后,倒入培养皿中制成平板。待凝固后,每个平板中央接入1 个直径0.5 cm 的菌饼,每一菌种、每个梯度设3个重复。然后置于25~28 ℃的恒温培养箱中培养,96 h 后采用十字交叉法测菌落直径,取平均值,按下式计算菌丝抑制率。
菌丝抑制率(%)=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-0.5)×100%
以菌丝抑制率为横坐标,挥发油质量浓度为纵坐标,绘制毒力回归方程,并计算得出半抑制浓度IC50。
1.2.4 挥发油对镰刀菌孢子萌发的抑制作用
以VBC 培养基诱导产生大量孢子,采用凹玻片法测定孢子的萌发率。具体做法是取在VBC 培养基上培养6~7 d 的镰刀菌,以无菌水将孢子冲洗下,用4 层纱布过滤,将滤液充分摇匀制成孢子悬浮液,调节其浓度,在10 ×10 低倍镜下观察,每个视野50~60 个孢子。用少量吐温60 溶解挥发油,与孢子悬液混合配成质量浓度分别为0.1、0.2、0.4、0.8 g/L 的孢子悬液,以无菌水作为空白对照。在凹玻片上分别滴入1 滴含不同质量浓度挥发油的孢子悬浮液。将凹玻片放在一个含有吸水滤纸的培养皿中,置于25~28 ℃培养箱中,12 h 后镜检,观察孢子萌发情况,统计100~150 个孢子,每个处理重复3次。按下列公式计算孢子萌发率和孢子抑制率。
孢子萌发率(%)=萌发孢子数/总孢子数×100%
孢子抑制率(%)=(对照组萌发率-处理组萌发率)/对照组萌发率×100%
以孢子抑制率为横坐标,挥发油质量浓度为纵坐标,绘制毒力回归方程,并计算得出IC50。
1.2.5 地上部分和地下部分挥发油的提取
分别以水蒸气蒸馏法和超声辅助浸提法对北细辛地上部分和地下部分进行挥发油的提取,获得A(地上部分水蒸气蒸馏法)、B(地下部分水蒸气蒸馏法)、C(地上部分超声辅助浸提法)和D(地下部分超声辅助浸提法)等4 组挥发油。每次称取50 g 植株粉末,每组设3 次重复。挥发油经无水硫酸钠干燥后,以安捷伦7890A-5975c 气相色谱-质谱联用仪进行GC-MS 分析。GC-MS 分析条件参照李凡海等[16]。
1.3 数据分析
应用SPSS 17.0 统计分析软件对试验数据进行方差分析,并进行Duncan’s 多重比较。
2 结果与分析
2.1 挥发油对5 种镰刀菌菌丝生长的影响
采用二倍稀释法设置浓度梯度,考察不同浓度挥发油对5 种镰刀菌菌落直径的抑制作用。由表1可以看出,0.0313~1 g/L 的挥发油均可抑制供试镰刀菌的菌落直径,抑制效果随挥发油质量浓度的升高而增加。与对照(不加挥发油)相比,当挥发油浓度为0.0313 g/L 时,对供试镰刀菌菌落直径的抑制作用均达极显著水平(P<0.01)。可见,北细辛挥发油对供试镰刀菌有良好的抑制作用。
由表1 可知,随着质量浓度的增加,北细辛挥发油对5 种镰刀菌菌丝生长的抑制作用明显增强。通过5 个线性毒力回归方程(y=ax +b),得出半抑制浓度(IC50)均小于0.5 g/L,说明北细辛挥发油对5种供试镰刀菌菌丝生长均具有较强的抑制作用。比较半抑制浓度IC50,燕麦镰刀菌<黄色镰刀菌<拟丝孢镰刀菌<拟枝孢镰刀菌<茄病镰刀菌蓝色变种。其中,对燕麦镰刀IC50为0.148 g/L,说明挥发油对燕麦镰刀菌菌丝生长的抑制效果最显著;其次为对黄色镰刀菌、拟丝孢镰刀菌和拟枝孢镰刀菌,IC50在0.228~0.333 g/L;对茄病镰刀菌蓝色变种菌丝生长的抑制作用最弱,IC50为0.387 g/L。当挥发油质量浓度为1 g/L 时,对燕麦镰刀菌、黄色镰刀菌具有杀菌的作用。
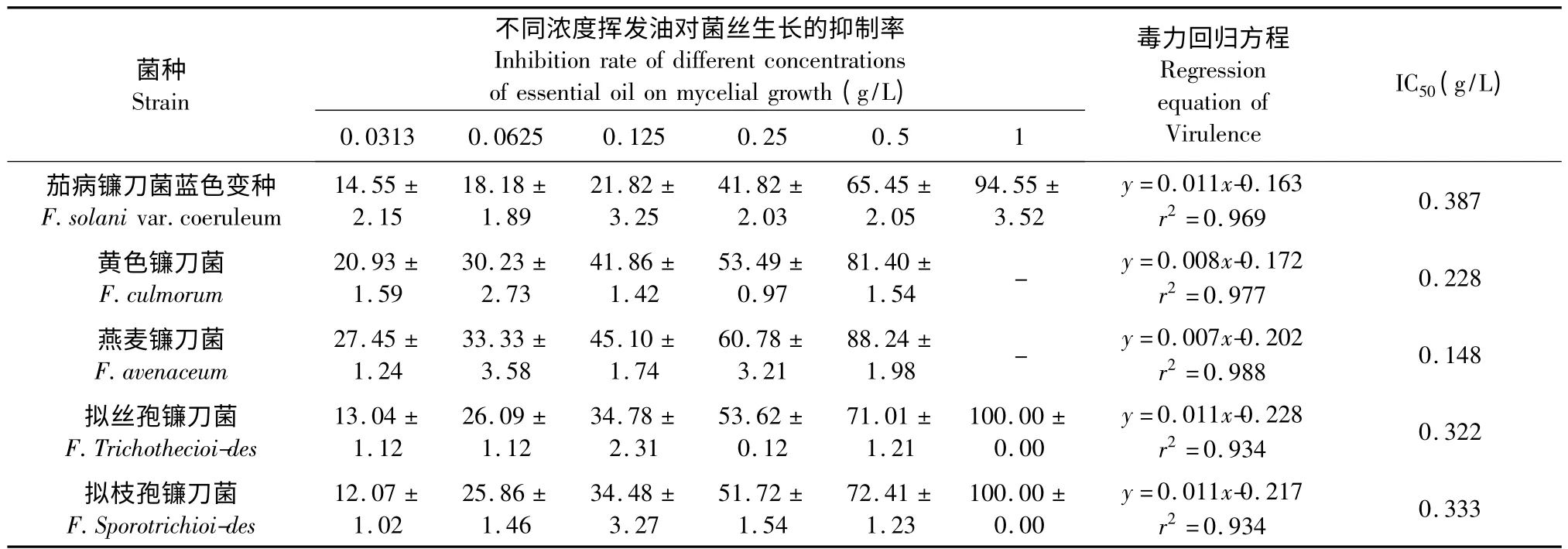
表1 挥发油对5 种镰刀菌菌丝生长的抑制作用Table 1 Inhibitory effects of essential oil on the mycelial growth of five Fusariums
2.2 挥发油对5 种镰刀菌孢子萌发的影响
由表2 可知,北细辛挥发油对5 种镰刀菌孢子萌发均有明显的抑制作用,除茄病镰刀菌蓝色变种外,对其它4 种镰刀菌的IC50均小于0.5 g/L。随着挥发油浓度的增加,萌发率减小,抑制率增加。比较半抑制浓度IC50,燕麦镰刀菌<拟枝孢镰刀菌<黄色镰刀菌<拟丝孢镰刀菌<茄病镰刀菌蓝色变种,说明挥发油对燕麦镰刀菌孢子萌发的抑制效果最好。

表2 挥发油对5 种镰刀菌孢子萌发的抑制作用Table 2 Inhibitory effects of A.heterotropoides essential oil on the germination of Fusarium spores
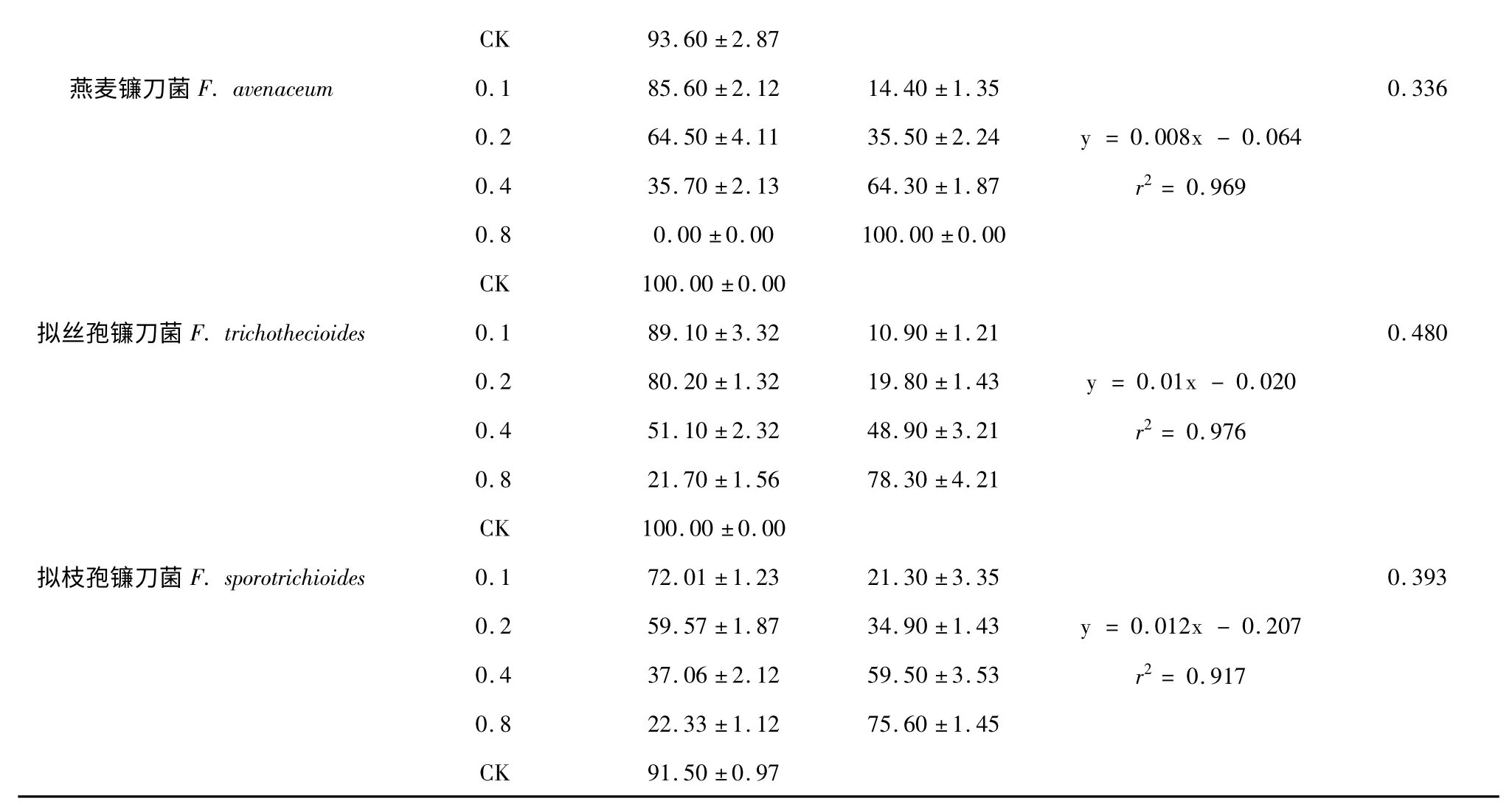
注:“x”代表抑制率,“y”代表挥发油浓度。Note:“x”represents the inhibition rate,“y”represents concentration of essential oil.
2.3 不同提取方法下地上部分和地下部分挥发油提取率的比较
采用水蒸气蒸馏法和超声辅助浸提法分别对地上部分和地下部分挥发油进行提取,每次称取50 g样品,每组设3 次重复,结果如表3 所示。可知,地下部分挥发油含量明显高于地下部分,且超声辅助浸提法提取率更高,而且出油很快,大大缩短了提取时间,从而节省了工艺时间。

表3 四组挥发油提取率的比较Table 3 Comparison of extraction rates of 4 groups of essential oils
2.4 GC-MS 分析结果
各取4 种北细辛挥发油1 μL 注入GC-MS 联用仪进行分析,得到4 个总离子流色谱图,见图1。通过检索NIST 05 标准谱库,并结合质谱裂解规律进行核对,共鉴定出51 种成分,并采用峰面积归一法计算各化学成分的相对含量,结果见表4。
其中,地上部分水蒸气蒸馏法挥发油中分离出74 个化学成分,鉴定了32 个成分,已鉴定成分占挥发油总量的96.081%;地下部分水蒸气蒸馏法挥发油中分离出61 个化学成分,鉴定出31 个成分,已鉴定成分占挥发油总量的95.713%;地上部分超声辅助浸提法挥发油中分离出105 个化学成分,鉴定出36 个成分,已鉴定成分占挥发油总量的94.858%;地下部分超声辅助浸提法挥发油中分离出42 个化学成分,鉴定出28 个成分;已鉴定成分占挥发油总量的98.374%。4 种挥发油中共有18 种相同成分,其中包括甲基丁香酚、黄樟醚、3,4,5-三甲氧基甲苯、3,5-二甲氧基甲苯、优香芹酮等,分别占4 种挥发油含量的66.5%、81.54%、66.85%、85.44%。可见地下部分挥发油中主要成分比地上部分含量高。

图1 地上部分水蒸气蒸馏法(A)、地下部分水蒸气蒸馏法(B)、地上部分超声辅助浸提法(C)及地下部分超声辅助浸提法(D)提取挥发油总离子流色谱图Fig.1 Total ion chromatograms of essential oils of aerial (A)or underground (B)part extracted by steam distillation and aerial(C)or underground (D)part extracted by ultrasonic-assisted extraction

表4 四组挥发油成分的GC-MS 分析结果Table 4 Chemical composition of four groups of essential oils
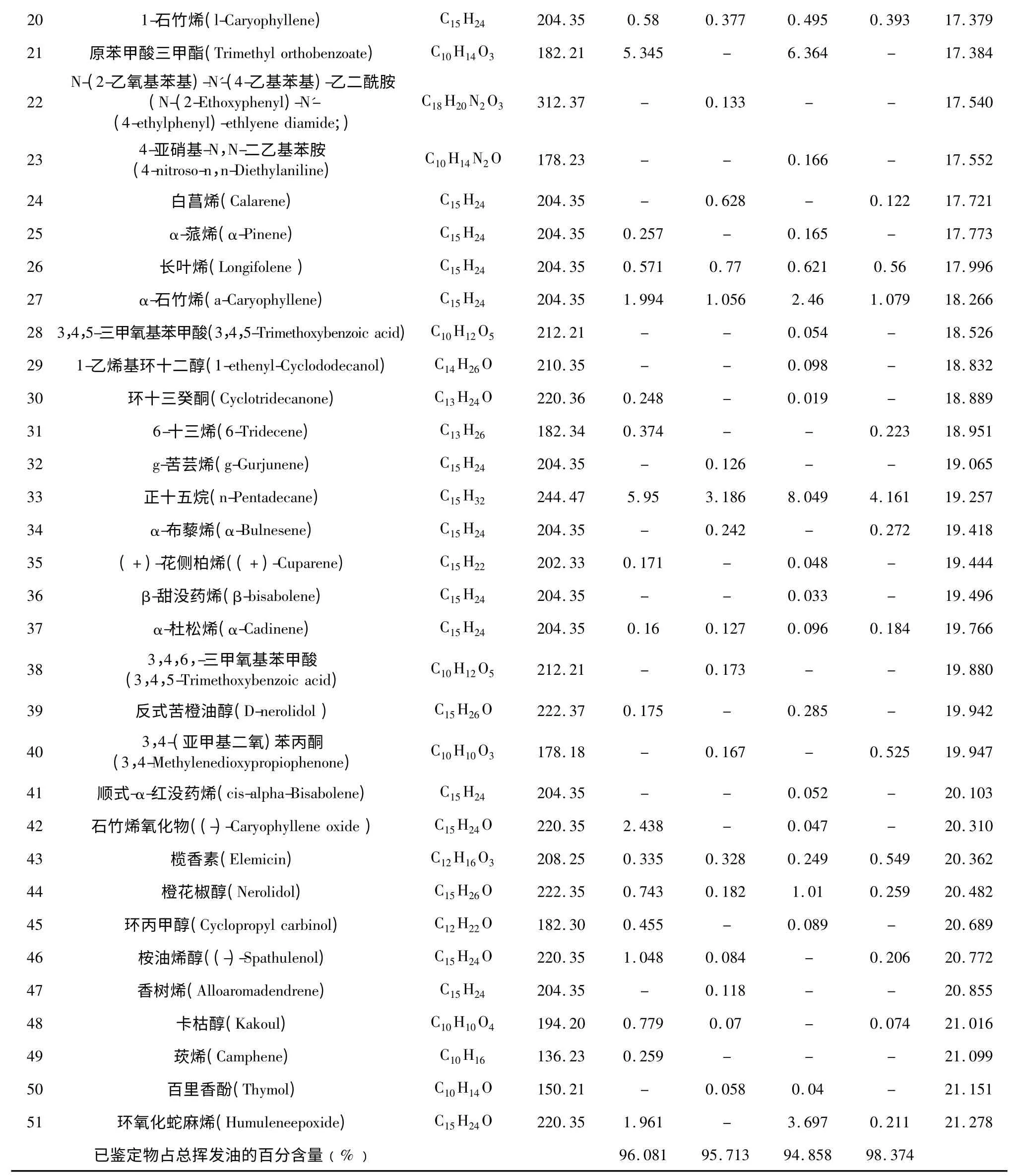
注:“-”表示未检出。Note:“-”represents not detected.
3 讨论
由镰刀菌引发的马铃薯干腐病发病率高,危害严重。目前主要依靠化学农药进行防治。虽然防治效果显著,但病原菌极易产生抗药性,同时危害对人类健康和环境。而植物源农药来源于植物,污染较小,易降解,使用效果好,是发展绿色农业的理想农药。但是相关研究主要集中在杀虫剂类,而对杀菌剂研究较少。因此,不断开发新的植物源杀菌剂成为当务之急。挥发油是植物源农药中研究比较广泛一类化合物。已有报道细辛挥发油可以有效抑制番茄早疫病菌、茄子枯萎病菌等多种病菌[17,18]。本研究发现北细辛挥发油对马铃薯干腐病致病菌镰刀菌的抑菌效果显著,且抑制作用与挥发油质量浓度呈剂量依赖性。说明北细辛挥发油可有效防治马铃薯干腐病,可将北细辛开发为植物源农药。
比较看来挥发油对供试菌丝生长与孢子萌发的抑制效果有所不同,孢子萌发的抑制试验中,抑制效果拟枝孢镰刀菌>黄色镰刀菌>拟丝孢镰刀菌,而在菌丝生长的抑制试验中,黄色镰刀菌>拟丝孢镰刀菌>拟枝孢镰刀菌。
挥发油GC-MS 结果显示,其主要成分与前人研究大致相同[16,19],其中甲基丁香酚含量最高。本研究发现地下部分超声辅助浸提法中甲基丁香酚的含量近于50%,甲基丁香酚为北细辛主要的药用成分,其提取方法的优化对于提高北细辛的利用率具有重要意义。不同栽培技术、存放时间、产地、提取方法等对挥发油的有效成分均有所影响[20]。4 组挥发油虽然有18 种共同成分,但是其他成分及含量存在差异,说明提取方法及地上部分与地下部分所含成分不同所致。
本研究尚未对北细辛挥发油抑菌机制、4 种挥发油的抑菌活性比较进行系统性的探讨,对其抑菌活性成分也尚未明确。下一步将对北细辛挥发油作用后致病菌菌丝和孢子形态、生理生化指标以及致病菌基因和蛋白表达水平变化等方面进行深入研究,进一步阐明北细辛挥发油的抑菌机制,为北细辛挥发油的实际应用提供理论指导。
4 结论
以水蒸气蒸馏法对北细辛全株提取的挥发油对5 种供试镰刀菌菌丝生长和孢子萌发均有较强的抑制作用,且抑制作用与挥发油质量浓度呈剂量依赖性。说明北细辛挥发油可有效抑制马铃薯干腐病镰刀菌,可进一步开发成为植物源农药。
采用水蒸气蒸馏法、超声辅助浸提法提取北细辛挥发油,通过GC-MS 分析,鉴定出的成分占各挥发油的含量均达94%以上。初步鉴定出51 种成分,其中地上部分水蒸气蒸馏法中32 种,地下部分31 种;地上部分超声辅助浸提法中36 种,地下部分28 种。
地下部分挥发油提取率高于地上部分,挥发油以甲基丁香酚和黄樟醚为主要成分,因此推测两种物质为北细辛产生抑菌作用的有效成分。
1 Li YC,Bi Y,Ge YH,et al.Antifungal activity of sodium silicate on Fusarium sulphureum and its effect on dry rot of potato tubers.J Food Sci,2009,74:213-218.
2 Hou ZY (侯忠艳).Occurrence and control of dry rot of potato.Mod Agric Sci Technol (现代农业科学技术),2012,10:173-179.
3 Du M,Ren X,Sun QH,et al.Characterization of Fusarium spp.causing potato dry rot in China and susceptibility evaluation of Chinese potato germplasm to the pathogen.Potato Res,2012,55:175-184.
4 Li M (李梅),Tian SL (田世龙),Cheng JX (程建新),et al.Virulence and inhibition activity of three kinds of preservatives against the pathogen of the potato tuber dry rot.Plant Protect (植物保护),2013,39:188-192.
5 Cabanas R,Castella G,Abarca ML,et al.Thiabendazole resistance and mutations in the β-tubulin gene of Penicillium expansum strains isolated from apples and pears with blue mold decay.FEMS Microbiol Lett,2009,297:189-195.
6 Sun XC (孙现超),Peng JF (彭健芳),Zhang N (张宁),et al.Inhibitory effect and identification of an antagonistic actinomyces strain JY-22 against Fusarium solani causing potato dry rot.Acta Phytophyl Sin (植物保护学报),2013,40:38-44.
7 Han JY (韩俊艳),Sun CL (孙川力),Ji MS (纪明山).Recent advance of Chinese herb-Asarum.Chin Agric Sci Bull(中国农学通报),2011,27(9):46-50.
8 Zhu YL (朱跃兰),Hou XJ (侯秀娟),Zhao FM (赵凤毛).Research progress of Asarum application security use.Chin Arch Tradit Chin Med (中华中医药学刊),2010,28:1175-1177.
9 Han JY (韩俊艳),Wang J (王军),Han X (韩雪),et al.Effects of essential oil from Asarum heterotropoides on toxicity and related enzymes of Tetranychus urticae..Nat Prod Res Dev (天然产物研究与开发),2012,24:525-528.
10 Dan Y,Liu H,Gao W,et al.Activities of essential oils from Asarum heterotropoides var.mandshuricum against five phytopathogens.Crop Prot,2010,29:295-299.
11 Ji LZ (姬兰柱),Wang GQ (王桂清),Liu Y (刘艳),et al.Effects of Asarum essential oils on physiological and biochemical indexes of two agricultural pest insects.Guangdong Agric Sci (广东农业科学),2013,8:87-91.
12 Wang XL (王晓丽).Recent advance of Chinese herb-Asarum.Asia-Pacific Tradit Med (亚太传统医药),2013,9(7):68-71.
13 Wang GQ (王桂清).In vitro antibacterial activity of Asarum essential oils on five kinds of cucumber disease pathogens.J Changjiang Veget (长江蔬菜),2008,8:44-47.
14 Zhou BL (周宝利),Jiang CY (姜春云),Chen ZX (陈志霞),et al.Effects of Herba Asari extracts on eggplant Verticillium dahliae,its growth and resistance physiological indexes.China Veget (中国蔬菜),2012,24:86-91.
15 Feng SF (逢世峰),Wu LJ (吴连举),Guang YM (关一鸣),et al.Inhibition effects of volatile oil of Asarum on 4 kinds of pathogens of Ginseng using in vitro tests.Special Wild Econ Animal Plant Res (特产研究),2008,5(3):37-39.
16 Chen YL (陈燕銮),Liu QQ (刘秋琼),Wang JZ (王建壮),et al.Composition analysis of volatile oil of Asarum heterotropoides var.mandshuricum extracted by three different methods.J Chin Med Mater (中药材),2013,36:1447-1451.
17 Li SH (李少华).Antifungal activities and active compounds of the extracts from Asarum himalaicum against Alternaria solani.J China Agric Univ (中国农业大学学报),2011,16(3):67-71.
18 Li FH (李凡海),Wang GQ (王桂清).Antibacterial activity of Asarum essential oils and three chemical pesticides on the Fusarium Oxysporum.Agric Sci Technol Equip (农业科技与装备),2014,7:10-13.
19 Wang B (王波),Jiang B (蒋斌),Shen XK (沈夕坤),et al.Analysis of essential oil components by gas chromatography.Chin Arch Tradit Chin Med (中华中医药学刊),2014,32:2726-2729.
20 Liu DJ (刘东吉),Liu CS (刘春生).Chemical components of volatile oil of cultivated Asarum produced in different places.Chin J Exp Tradit Med Form (中国实验方剂学杂志),2010,16(9):79-82.

