鲶鱼下脚料中鱼油的提取及贮藏稳定性研究
朱迎春 ,张坤生,霍乃蕊,马俪珍
(1.天津科技大学食品工程与生物技术学院,天津 300457;2.山西农业大学食品科学与工程学院,太谷 030801;3.天津农学院食品科学与生物工程学院,天津 300384;4.天津商业大学生物技术与食品科学学院,天津 300134)
从海洋哺乳动物鲸类和海洋鱼类以及淡水鱼所获得的油脂,统称为“鱼油”,以区别来自陆地动、植物和其他海洋动、植物的油脂.鱼油富含不饱和脂肪酸EPA、DHA 等组分,对人体健康有益且具有特殊价值.随着人们对鱼油食用价值研究的不断深入,鱼油的开发利用愈发受到人们的重视[1–2].
鱼油的提取方法有蒸煮法、淡碱水解法、水法和超临界流体萃取法等[3].蒸煮法使用较广,所涉及的实验参数较少,Aidos 等[4]对该法进行优化,生产出较好质量和较高产量的鱼油.淡碱水解法是我国鱼油生产普遍采用的一种方法,所用淡碱为氢氧化钠稀溶液,盐为氯化钠溶液,工艺已非常成熟.该方法与蒸煮法相比具有出油率和维生素得率高,产品色泽浅、游离脂肪酸含量少的优点,但提油后的残渣得不到有效利用,形成了新的废弃物[5].陈英乡[6]提出水法提取鱼油的工艺,向原料中加入一定量的水,通过加热使蛋白质变性,破坏蛋白质和脂肪的结合关系,经高速离心得到鱼油.超临界萃取法是近些年来发展起来的新工艺,较适合于粗鱼油加工后期生理活性物质EPA 和DHA 的分离提纯,但是投入规模较大、所需资金较多[3].
本实验作为“淡水鱼鱼糜安全及品质控制和副产物高值化利用关键技术研究与工程示范”课题的一部分,不仅要得到鱼油,还要使脱油后的残渣适合酶解处理.蒸煮法、淡碱水解和水法会使蛋白变性,使其不能进行酶解,故用多种有机溶剂提取鱼油,筛选得率较高的方法,获得感官质量和贮藏性能较好的鱼油,并使脱油后的残渣能进一步利用,以提高原料的综合利用率.
1 材料与方法
1.1 原料预处理与试剂
将市售鲶鱼(革胡子鲶)加工过程中废弃的碎肉、鱼皮、鱼骨、内脏分开绞碎,冷却贮藏备用.
正己烷、异丙醇、乙醚、石油醚、正丁醇、丙酮等均为分析纯.VE,1,000,IU/g,北京索莱宝科技有限公司.
1.2 仪器设备
TDL–5 型离心机,上海安亭科学仪器厂;DZF–6051 型真空干燥箱,上海精宏实验设备有限公司;RE–52A 型旋转蒸发仪,上海亚荣生化仪器厂;FP62型熔点仪,瑞士梅特勒公司;7890A 型气相色谱仪,美国Agilent 公司.
1.3 不同有机溶剂提取鱼油
分别采用不同有机溶剂在低于其沸点的条件下浸提5,h,丙酮、正丁醇、正己烷、丙酮–石油醚(V(丙酮)∶V(石油醚)=1∶4)的浸提温度分别为40、100、50、40,℃.方法如下:称取1.00,g 鲶鱼碎肉于100,mL碘量瓶中,按料液比1∶18 加入提取剂,振摇提取20,min,过滤,并用少量提取剂洗涤碘量瓶及残渣2~3 次.滤液转入已烘干至恒质量的接收瓶中,除去有机溶剂后转入100,℃烘箱中烘至恒质量,分别测定鱼油的提取率.根据提取率及鱼油的感官质量考察提取效果.
除以上4 种方法外,还利用正己烷–异丙醇法来提取鱼油:准确称取鲶鱼碎肉1,g 于100,mL 碘量瓶中,按料液比1∶18 加入正己烷–异丙醇(V(正己烷)∶V(异丙醇)=3 ∶2),50,℃充分水浴振摇20,min.用砂芯漏斗抽滤,并用2,mL 提取剂分3 次洗碘量瓶及残渣.滤液转入250,mL 分液漏斗中,加入10,mL 10,g/L 的Na2SO4溶液,振摇1,min,静置分层,下层水相用 2,mL 正己烷–异丙醇(V(正己烷)∶V(异丙醇)=7∶2)反萃取3 次.合并上层有机相于已称量的三角瓶中,70,℃水浴挥发溶剂,再转入100~105,℃烘箱中烘10,min[7].取出后按式(1)计算提取率并进行感官质量评定.

1.4 正己烷-异丙醇法最优条件的确定
将筛选出的提取方法在前期单因素实验的基础上进行正交实验设计(表1),确定最佳提取条件.其中A 因素为萃取时正己烷–异丙醇的体积比,B 因素为提取时间(min),C 因素为反萃取时正己烷–异丙醇的体积比.
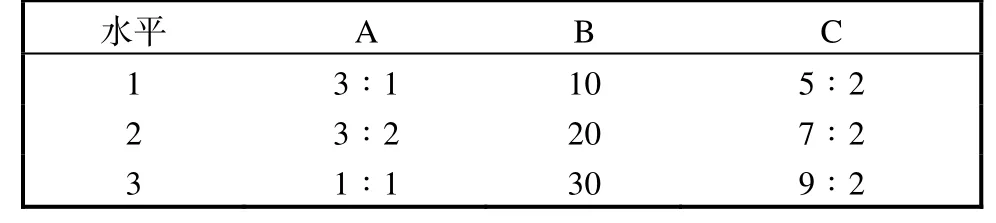
表1 正交实验因素编码表Tab.1 Design of the orthogonal experiment
1.5 鲶鱼不同部位鱼油的提取
利用筛选出的最佳工艺条件,分别以鲶鱼碎肉、鱼皮、鱼骨、内脏为原料提取鱼油,计算提取率.
1.6 鱼油稳定性实验
从鲶鱼碎肉提取出的鱼油分别添加 50、100,mg/kg 的VE,置于室温(25,℃)贮藏,同时将不添加VE 的鱼油作为对照,分别贮藏在37,℃、室温(25,℃)及4,℃.贮藏期间测定其酸价、碘价、过氧化值的变化.37,℃贮藏的鱼油每天测定1 次指标,共测定7次;室温(25,℃)贮藏的鱼油每3,d 测定1 次指标,共测定7 次;4,℃贮藏的鱼油每7,d 测定1 次指标,共测定4 次.酸价、过氧化值、碘价分别参照GB/T 5530—2005《动植物油脂·酸值和酸度测定》、GB/T 5538—2005《动植物油脂·过氧化值测定》、GB/T 5532—2005《动植物油脂·碘值的测定》[8–9]进行测定.
1.7 鱼油中脂肪酸组成的测定
精确吸取从鲶鱼碎肉提取的鱼油样品0.1,mL 以及1,mL 内标物(十七烷酸甲酯),放入10,mL 容量瓶中.再加入2,mL 提取液(V(苯)∶V(石油醚)=1∶1),静置30,min 以上,以浸提油脂,然后加入1,mL 0.4,mol/L 的KOH/CH3OH 溶液,静置10,min 以上,甲酯化后加超纯水至刻度,待上层液澄清后,准确移取1,μL 进样,进行色谱分析.
对测定条件(程序升温、气体流量、压力等)反复摸索,最终确定脂肪酸分离效果最佳的色谱条件为:DB–WAX 型石英毛细管柱(30,m×0.25,mm),固定相FFAP;FID 检测器,检测器温度280,℃;进样口温度 280,℃,柱温先 180,℃保持 20,min,然后以0.5,℃/min 的速率将温度升至200,℃;载气(N2)流量25,mL/min,H2流量 40,mL/min,空气流量 450 mL/min;分流比30∶1.
2 结果与分析
2.1 不同有机溶剂的提取效果
不同有机溶剂提取鱼油,提取率及鱼油的感官质量见表2.综合考虑选用正己烷–异丙醇法提取鱼油,虽提取率略低于正己烷,但鱼油的感官质量最好.
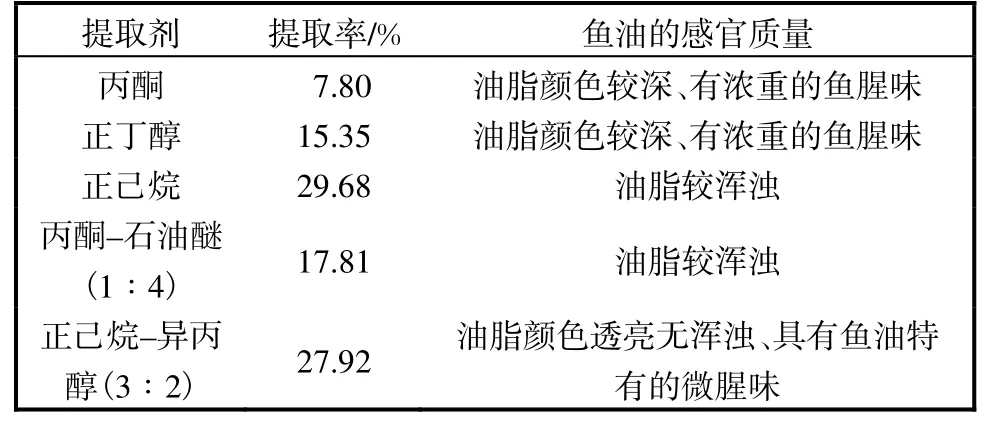
表2 不同提取剂的提取效果Tab.2 Extraction efficacy of fish oil using different organic solvents
2.2 提取条件正交实验结果
正交实验结果见表3,方差分析结果见表4.A、B、C 3 个因素对鱼油的提取率均产生极显著影响.3因素的影响顺序为A>C>B,即萃取时正己烷–异丙醇的体积比对提取条件的影响最大,其次为反萃取时正己烷–异丙醇的体积比.
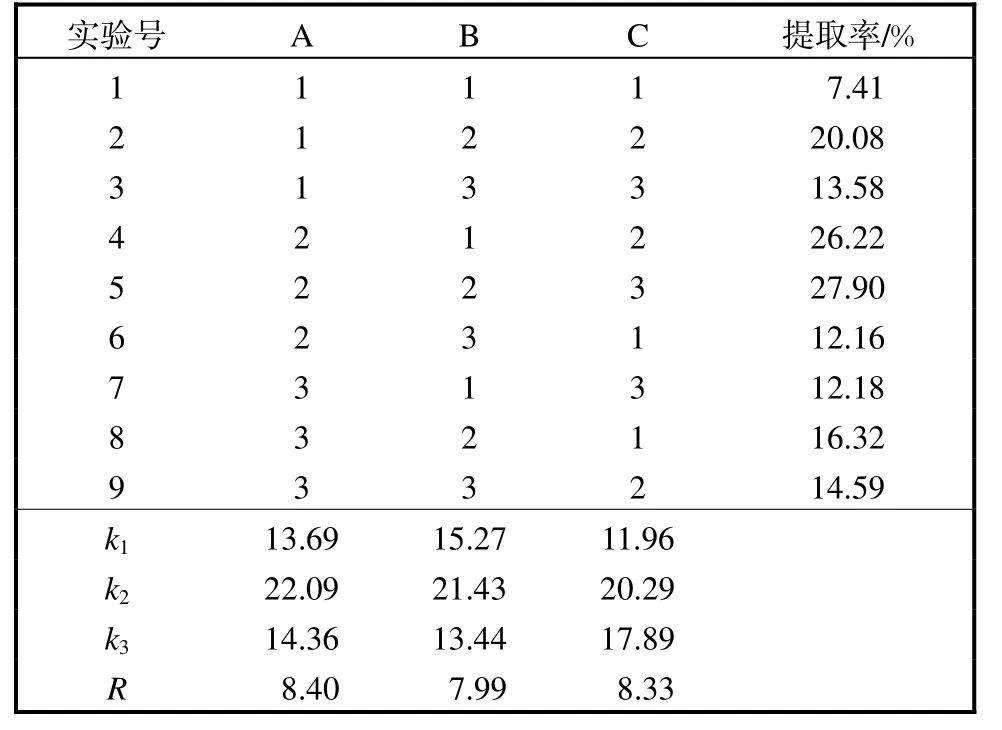
表3 鱼油提取条件正交实验结果Tab.3 Design and the results of orthogonal experiment for the extraction of fish oil
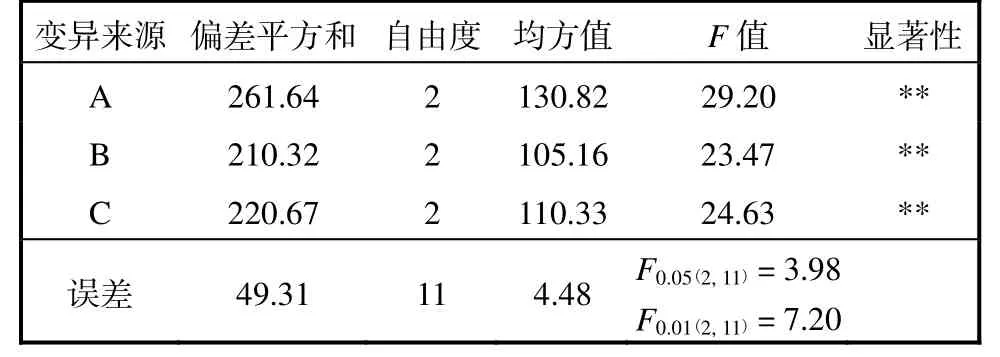
表4 鱼油提取条件的方差分析Tab.4 Variation analysis of fish oil extraction conditions
最理想的提取条件是A2B2C2,但实验中没有此组合,故将第5 组提取条件A2B2C3与理想的提取条件A2B2C2进行验证实验,结果在理想的提取条件下提取率相当(27.92%)且提取时间较短.因此,最后确定鱼油提取条件为:萃取时正己烷–异丙醇的体积比为3∶2,提取时间为20,min,反萃取时正己烷–异丙醇的体积比7∶2.
2.3 鲶鱼不同部位的鱼油提取率
不同部位鱼油的提取率分别为:鱼内脏(55.69%)>鱼碎肉(27.92%)>鱼皮(10.72%)>鱼骨(6.43%).此结果一定程度上也反映了鱼油在鱼体内的分布状况.鱼内脏中存在大块鱼油,所以提取率最高;由于鱼骨较难绞碎,先期进行了高压处理,此过程会引起部分油脂的损失,这也是其提取率最低的原因之一.
2.4 鱼油在不同贮藏条件下酸价、碘价和过氧化值的变化
酸价可反映脂肪酸的分解程度,油脂酸败将导致游离脂肪酸的增加.油脂在较高温度下容易发生水解,在低温下三酰甘油酯中的酯键发生水解的机率要小一些.不同贮藏条件下鱼油酸价的变化如图1 所示.由图1 可知:随贮藏时间的延长,贮藏温度越高,酸价也越高.在鱼油中添加VE,可以抑制酸价的升高,VE 添加量为100,mg/kg 时,酸价最低,与4,℃冷藏条件下的结果一致.
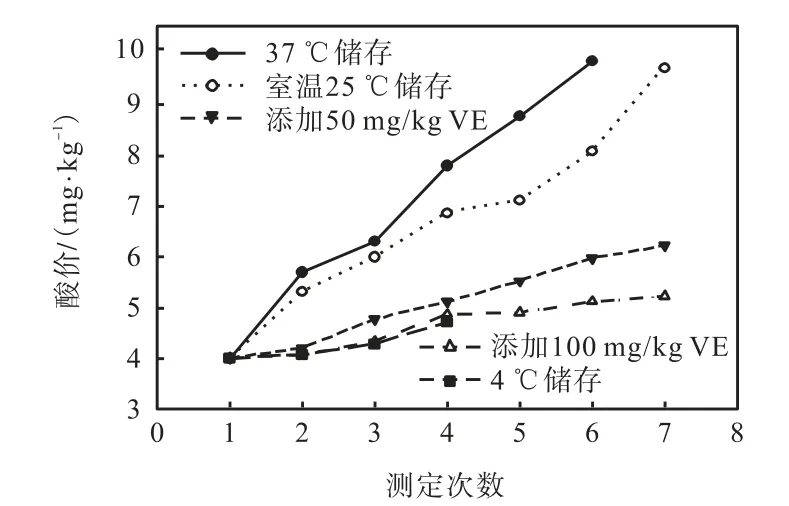
图1 不同贮藏条件下鱼油酸价的变化Fig.1 Changes of fish oil acid value under different storage conditions
过氧化值是判断油脂酸败的重要指标,也是判断油脂氧化及氧化程度的主要指标.不同储存条件下鱼油过氧化值的变化如图2 所示.由图2 可知:随贮藏时间的延长,37,℃下贮藏的鱼油过氧化值上升幅度大于其他实验组,特别是在贮藏初期增幅尤大,这与他人的实验结果[10–11]相一致.降低贮藏温度或在鱼油中添加VE 会使过氧化值降低,在鱼油中添加100,mg/kg 的VE 或在4,℃冷藏条件下贮藏时,过氧化值最低,产品氧化稳定性较好.
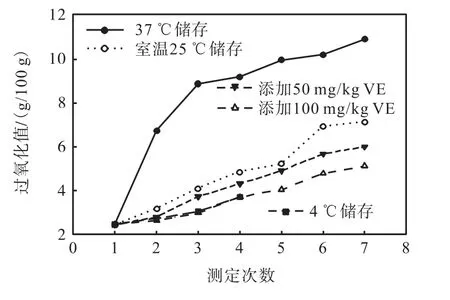
图2 不同储存条件下鱼油过氧化值的变化Fig.2 Changes of fish oil peroxide value under different storage conditions
碘价可用来判断脂肪酸的不饱和度.不同储存条件下鱼油碘价的变化如图3 所示.由图3 可知:随贮藏时间的延长,不同贮藏条件下鱼油的碘价变化不尽相同.在鱼油中添加100,mg/kg VE 室温储存与4,℃冷藏条件下储存效果相当,碘价基本维持原有水平,变化不大.而在鱼油中添加的VE 量为50,mg/kg时,碘价低于 100,mg/kg VE 添加组和 4,℃储存组.随着贮藏温度的升高,鱼油碘价值降低的趋势比较明显.由图1—图3 可以看出:在37,℃温度条件下贮存的鱼油稳定性较差;但是添加100,mg/kg VE 后常温下贮存或在4,℃冷藏条件下贮藏的鱼油稳定性均较高.
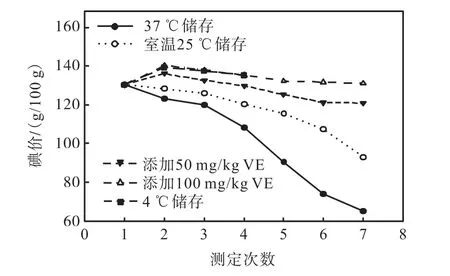
图3 不同储存条件下鱼油碘价的变化Fig.3 Changes of fish oil iodine value under different storage conditions
2.5 鱼油脂肪酸组成
正己烷-异丙醇法提取的鱼油,其脂肪酸各组分的质量分数见表5.
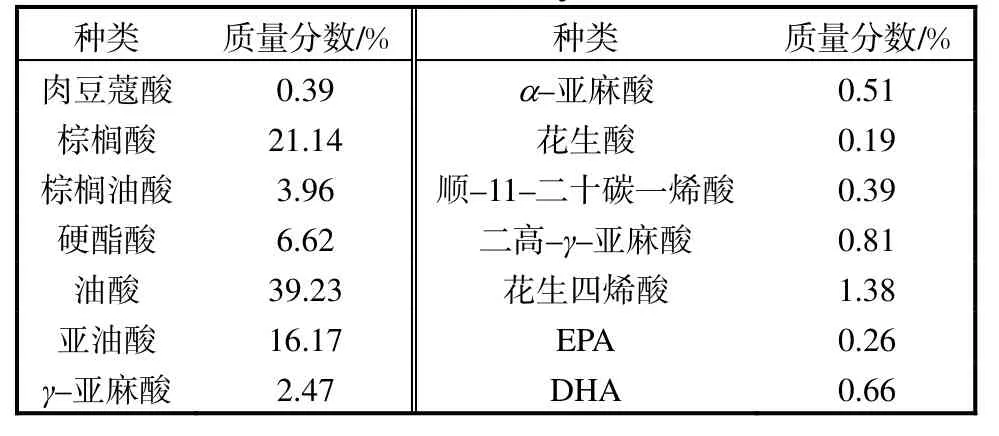
表5 鱼油脂肪酸组分及质量分数Tab.5 Content of fatty acid in fish oil
由表5 可知:鲶鱼鱼油的主要成分为C14~C22脂肪酸,其中饱和脂肪酸质量分数为28.34%,不饱和脂肪酸质量分数为65.84%,而多不饱和脂肪酸总质量分数高达22.62%.饱和脂肪酸以棕榈酸、硬酯酸为主,其中棕榈酸质量分数最大(21.14%).不饱和脂肪酸以C18∶1、C20∶1、C20∶5、C22∶6为主,其中油酸质量分数最高,而鱼油中多不饱和脂肪酸中含有AA(花生四烯酸)、DHA(二十二碳六烯酸)和EPA(二十碳五烯酸),质量分数分别为1.38%、0.66%和0.26%,其中DHA 和AA 的质量分数高于草鱼腹部和内脏中鱼油的DHA 和AA 质量分数[14].
3 讨论
3.1 正己烷–异丙醇法的优点
我国的鱼油厂普遍采用淡碱水解法生产鱼油[5],在此基础上相继又产生了钾法及氨法,这些方法会使脱油后的原料变性而不能进一步利用.所以,本实验采用有机溶剂进行鱼油的提取.该法提取的鱼油提取率较高且感官质量较好,且脱油后的原料能进一步进行酶解处理制备鲶鱼多肽,从而可提高原料的附加值.在对有机溶剂进行筛选的过程中,长期以来,氯仿–甲醇法一直被用作从各类样品中提取脂质的标准方法,尤其适用于磷脂含量较高的油脂的提取,由于氯仿、甲醇都具有较强的毒性,存在安全隐患,所以本实验选用了毒性较低的正己烷和异丙醇作为提取试剂.为了进一步解决溶剂残留的问题,在生产中还应与酶提取法、超临界CO2萃取法等多种技术相结合,有效降低有机溶剂残留量.
对使用过的提取剂通过旋转蒸发仪进行回收,实验结果表明回收率为63.33%,用回收的提取剂对鱼油进行提取,提取率为13.20%,虽然有所降低(一次提取率为27.92%),但仍可节省提取剂的用量,降低提取成本.
3.2 鲶鱼鱼油的营养价值
大多数动物油脂不饱和脂肪酸含量较低,熔点较高,消化吸收率低,故营养价值较低.本研究提取的鲶鱼鱼油含有亚油酸、亚麻酸、花生四烯酸、EPA 和DHA 等有益于人体健康的脂肪酸,营养价值颇高.计算可知,总脂肪、必需脂肪酸、饱和脂肪酸、不饱和脂肪酸的质量分数分别为 94.18%、19.96%、28.34%和 65.84%.其中,α–亚麻酸的质量分数为0.51%,高于植物杏仁油中的质量分数(0.13%)[15],亚麻酸可以在体内衍生出视网膜受体中最丰富的脂肪酸二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),为维持视紫红质正常功能所必需.经测定鲶鱼鱼油的熔点为15,℃,较低的熔点可以提高鱼油的消化吸收率,提升它的营养价值.
3.3 鲶鱼鱼油的稳定性
鱼油易氧化的原因主要是因为鱼油中含有不饱和脂肪酸.整个储存期间,在不同的储存条件下,鱼油的碘价下降,酸价、过氧化值升高,说明其稳定性下降.添加一定剂量的VE,可有效抑制油脂的氧化,当添加剂量为100,mg/kg 时,其储存效果与冷藏效果相当.在下一步的研究中,拟将低温贮藏和添加VE相结合,预计会有更好的效果.我国卫生标准规定,作为食品添加剂,VE 在动物脂肪中的添加量为0.001%~0.05%[16],本研究VE 的添加量在国家要求的标准范围内,所以不存在安全问题.
[1]黄志斌.水产品综合利用工艺学[M].北京:中国农业出版社,1996:89.
[2]汪之和.水产品加工和利用[M].北京:化学工业出版社,2003:332–333.
[3]罗蔓莉,李学英,王大忠,等.油脂提取技术研究现状[J].现代农业科技,2013(23):297–299.
[4]Aidos I,Kreb N,Boonman M,et al.Influence of production process parameters on fish oil quality in a pilot plant[J].Journal of Food Science,2003,68(2):581–586.
[5]彭增起.水产品加工学[M].北京:中国轻工业出版社,2010:269.
[6]陈英乡.水法提取鱼油的生产工艺研究[J].食品科学,1996,17(3):15–18.
[7]韩菊,魏福祥,云自厚.采用低毒溶剂提取脂质[J].分析化学,2002,30(4):450–453.
[8]大连轻工业学院等八大院校.食品分析[M].北京:中国轻工业出版社,2006:139–140.
[9]张水华.食品分析[M].北京:中国轻工业出版社,2005:105–109.
[10]Selmi S,Sadok S.The influence of season on lipid content and fatty acids profile of Euthynnus alletteratus fillets and by-products[J].Journal of Muscle Foods,2010,21(2):365–378.
[11]Roach J A G,Mossoba M M,Yurawecz M P,et al.Chromatographic separation and identification of conjugated linoleic acid isomers[J].Analytica Chimica Acta,2002,465(1/2):207–226.
[12]杨官娥,杨琦,赵建滨,等.钾法提取鱼油工艺的研究[J].山西医科大学学报,2001,32(1):31–32.
[13]杨官娥,杨琦,赵建滨,等.氨法提取鱼油工艺的研究[J].中国海洋药物,2002(3):25–27.
[14]孙炳新,苏阳,郝婷婷,等.提取条件对草鱼鱼油特性的影响及其脂肪酸组成分析[J].食品工业科技,2013,34(5):100–104.
[15]闫仲丽,杨志岩,降升平,等.杏仁油中脂肪酸组成的GC/MS 分析[J].天津科技大学学报,2007,22(4):41–43.
[16]郝利平,夏延斌,陈永泉,等.食品添加剂[M].北京:中国农业大学出版社,2002:73–74.

