黄花杓兰菌根真菌rDNA ITS的多样性
缪福俊,蒋 宏,王宏虬,原晓龙,陈 剑,杨宇明,王 娟
(1.云南省林业科学院 国家林业局云南珍稀濒特森林植物保护和繁育重点实验室 云南省森林植物培育与开发利用重点实验室,云南昆明650201;2.西南林业大学林学院,云南 昆明650224)
黄花杓兰菌根真菌rDNA ITS的多样性
缪福俊1,蒋 宏1,王宏虬2,原晓龙1,陈 剑1,杨宇明1,王 娟1
(1.云南省林业科学院 国家林业局云南珍稀濒特森林植物保护和繁育重点实验室 云南省森林植物培育与开发利用重点实验室,云南昆明650201;2.西南林业大学林学院,云南 昆明650224)
杓兰属Cypripedium植物因具较高的观赏和药用价值而长期被过度采集,已成为濒危植物。菌根真菌是其栽培和保育能否成功的重要协同因子。采用免培养技术对滇西北4个不同居群的黄花杓兰Cypripedium flavum毛根的真菌进行核糖体脱氧核糖核酸内转录间隔区(rDNA ITS)区段扩增。结果表明:从4个居群的毛根中共克隆得到366个真菌ITS-taxa,其中白水河居群93个,石卡雪山居群90个,天生桥居群103个,纳帕村居群80个;黄花杓兰毛根系统中存在丰富多样的菌根真菌类型,分别涉及胶膜菌属Tulasnella,伏革菌属Corticium,瘤菌根菌属Epulorhiza和丝核菌属Rhizoctoia 4个属及一类归属未定的真菌(uncultured mycorrhizal fungi);胶膜菌属对于黄花杓兰具有一定的寄主专一性特征,可能对黄花杓兰的生长有促生作用。以上结果为菌肥的研制和黄花杓兰植物的栽培与保育工作提供科学依据。图1表3参24
微生物学;黄花杓兰;菌根真菌;rDNA ITS;胶膜菌属;多样性
Key words:microbiology;Cypripedium flavum;mycorrhizal fungi;rDNA ITS;Tulasnella;diversity
黄花杓兰Cypripedium flavum属兰科Orchidaceae杓兰属Cypripedium植物,为中国特有种,分布于云南西北部、西藏东南部、四川、甘肃南部和湖北西部的高海拔地区,是一种典型的多年生高山草本植物[1]。因其花型独特、色彩艳丽,是整个兰科植物中最具特色的类群之一,极具观赏价值。然而,人类对杓兰野生环境的日益破坏,使得黄花杓兰种群数量急剧下降。该种已处于濒危状态,亟待保护[2-3]。目前,在杓兰属植物保育工作中,因多数自花不育导致自然结实率较低,种子微小,多采取分株繁殖和组织培养方式进行扩繁种苗[4-5]。在此过程中存在一个很大的瓶颈:在扩繁种苗过程中,杓兰幼苗出现生长缓慢、死亡率高等常见问题,极大地限制了濒危植物杓兰的保育工作[6-7]。前人的研究表明:兰科植物对菌根真菌具有较高的依赖性,菌根可能成为杓兰营养代谢的重要协同因子[8]。在自然条件下,兰属植物必须与真菌建立共生关系,其种子萌发、幼苗生长发育以及成年兰属植物营养的获取才得以实现[9]。Harley等[8]于1983年首次证实杓兰和真菌是互利的关系。同时Hadley等[10]也认为:平衡的共生关系可在一定条件下变为寄生关系,接种根际促生菌可显著提高杓兰幼苗的成活率。Shimura等[11]的研究表明:两者可能是斗争的关系,但通过前期的斗争,一旦真菌与杓兰建立共生关系后,可互利共生。王瑞苓等[12]通过对黄花杓兰植株根的生长周期切片观察,也证实菌根真菌与黄花杓兰是互惠互利的共生关系。臧穆等[13]在黄花杓兰的根际和根皮层细胞内发现了不同阶段的小型菌核,菌核的存在表明:杓兰和真菌是协同的关系。侯天文等[14]研究发现:四川黄龙沟杓兰的菌根真菌多样性随生长季节转换呈现的变化规律与营养需求规律是基本一致的。高倩等[15]对黄花杓兰,云南杓兰Cypripedium yunnanense,西藏杓兰Cypripedium tibeticum和斑花杓兰Cypripedium guttatum的菌根结构及其周年动态变化进行了研究,发现真菌的新近入侵、开始被消解、消解后的残余及消解后的物质4个阶段在这4种杓兰的生活周期中周而复始地进行。上述前人的研究主要集中于菌根解剖结构特征观察和真菌的入侵方式等方面,有关杓兰属植物菌根真菌多样性的研究还缺乏报道。本研究前期调查发现,黄花杓兰在滇西北高海拔区域分布较多,这为研究杓兰属植物菌根真菌提供极好的试验材料。本研究以黄花杓兰毛根为材料,提取总DNA,采用免培养巢式聚合酶链式反应(PCR)技术扩增其真菌核糖体脱氧核糖核酸内转录隔离区(rDNA ITS)区段,并对不同居群黄花杓兰的菌根真菌多样性进行分析,为杓兰属植物的保育和开发利用方面提供科学依据。
1 材料与方法
1.1 试验材料
采样地的地理位置信息详见表1。采集时间为杓兰花盛开期(2013年6月10日)。黄花杓兰为地生兰,生于林缘,样地为腐殖质土壤。根据采样地点分为4个不同的居群,对每种选样植株(居群)中随机选取5株进行取样,在黄花杓兰的根尖处选取毛根段10个·株-1,长约1 cm。用水洗净根尖土壤,置于装有十六烷基三甲基溴化铵(CTAB)缓冲液的1.5 mL离心管中,避光低温储存。
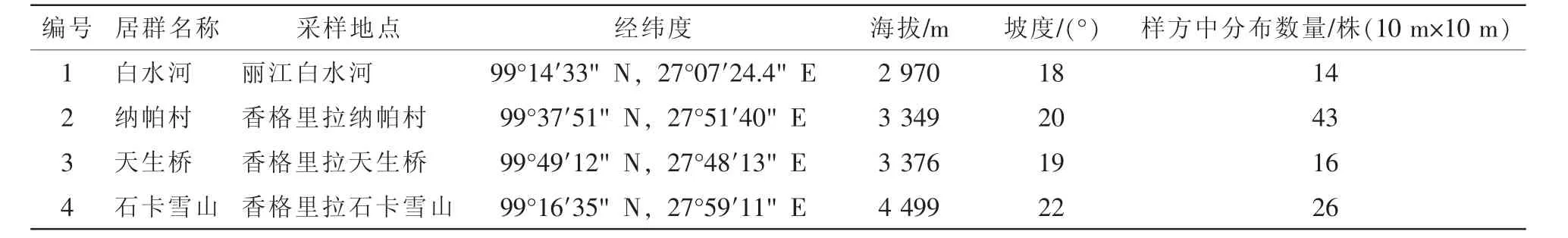
表1 滇西北黄花杓兰采样居群表Table 1 Sample collection of Cypripedium flavum at Northwest of Yunnan
1.2 方法
1.2.1 样品总DNA的提取 采用天根DNA试剂盒提取各样品中的总DNA。
1.2.2 样品rDNA ITS区段扩增和多样性分析 采用Nest PCR方法扩增,第1轮PCR扩增引物为NSI1和NLB4(NSI1:5′-GATTGAATGGCTTAGTGAG-3′,NLB4:5′-GGATTCTCACCCTCTATGA-3′)。反应体系为:1.0 μL模板DNA,1.0 μL NSI1,1.0 μL NLB4,9.5 μL双蒸水(ddH2O),12.5 μL Prime STAR Max DNA Premix(2×)。反应条件为:98℃30 s,60℃5 s,72℃10 s,30次循环,72℃1 min。
第2轮PCR扩增引物为NSI1-F和ITS4(NSI1-F:5′-CTTGGTCATTTAGAGGAAGTAA-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′)。反应体系为:1.0 μL第1轮Nest PCR产物做模板DNA,1.0 μL NSI1-F,1.0 μL ITS4,9.5 μL ddH2O,12.5 μL Prime STAR Max DNA Premix(2×)。反应条件为:98℃10 s,55℃5 s,72℃10 s,30次循环,72℃1 min。
将扩增出的PCR产物分别用限制性内切酶Hinf1和Alu1进行酶切分析。反应体系为:3.0 μL PCR产物,1.0 μL内切酶缓冲液(10×),1.0 μL内切酶,5.0 μL双蒸水。37℃水浴4 h。经电泳检测,分析限制性片段长度多态性(RFLP)带型。将代表不同的RFLP带型的单克隆样品挑出,连接载体pEASYBlunt转入Trans1-T1感受态细胞中,挑取阳性克隆,用菌液PCR法(M13F、M13R引物)鉴定重组子,确认包含重组子的克隆,送上海生工公司用M13F和M13R引物测序。测序结果用DNAman去除载体后使用在线软件NCBI Blast进行比对分析。
1.2.3 多样性指数计算 集中性测度:λ=Σ[Ni(Ni-1)/N(N-1)];多样性测度:D=1-Σ [Ni(Ni-1)/N(N-1)],公式中N为样方中物种总体个数,Ni为第i种个体数。
2 结果与分析
2.1 黄花杓兰毛根中真菌rDNA ITS区段聚合酶链反应(PCR)扩增结果
黄花杓兰部分毛根总DNA的提取电泳结果如图1A所示,其真菌rDNA ITS区段扩增结果如图1B所示,表明提取的总DNA条带清晰,采用巢式PCR可较好地扩增得到rDNA ITS区段,大小均在750 bp左右。
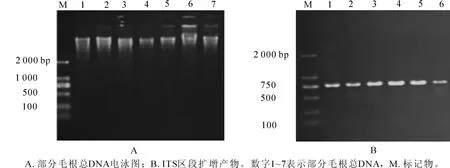
图1 黄花杓兰毛根中真菌rDNA ITS PCR扩增的电泳结果Figure 1 Agarose gel electrophoresis results of rDNA ITS PCR amplification products of mycorrhizal fungi from Cypripedium flavum
2.2 黄花杓兰毛根中真菌ITS序列分析结果
从4个不同居群黄花杓兰的毛根中直接提取的总DNA,通过Nest PCR扩增及克隆建立了4个克隆库,总共得到了366个单克隆,其中从白水河居群中得到93个单克隆,从石卡雪山居群中得到90个单克隆,从天生桥居群中得到103个单克隆,从纳帕村居群中得到80个单克隆。
2.3 不同居群黄花杓兰ITS序列多样性分析
从表2可见:白水河居群涉及3个真菌属,分别属于瘤菌根菌属Epulorhiza,归属未定真菌(Uncultured mycorrhizal fungi)和胶膜菌属Tulasnella,均属典型的兰科菌根真菌类型。其中,瘤菌根菌属占大多数,频率为58.1%,同源性为97%,其次是胶膜菌属,与美胞胶膜菌Tulasnella calospora的同源性高达98%,可初步确定为美胞胶膜菌。集中性指数λ=0.489,多样性测度D=0.511;石卡雪山居群涉及3个真菌属,分别属于胶膜菌属、丝核菌属Rhizoctoia和瘤菌根菌属。其中,胶膜菌属占大多数,频率为41.1%,同源性为98%,其次是丝核菌属。集中性指数λ=0.350,多样性测度D=0.650;天生桥居群涉及3个真菌属,分别属于胶膜菌属,伏革菌属Corticium和瘤菌根菌属。胶膜菌属占大多数,频率为69.9%,同源性为97%,其次是伏革菌属。集中性指数λ=0.568,多样性测度D=0.432;纳帕村居群涉及1个真菌属,全部属于胶膜菌属,与美胞胶膜菌的同源性高达99%。集中性指数λ=0.640,多样性测度D=0.360。
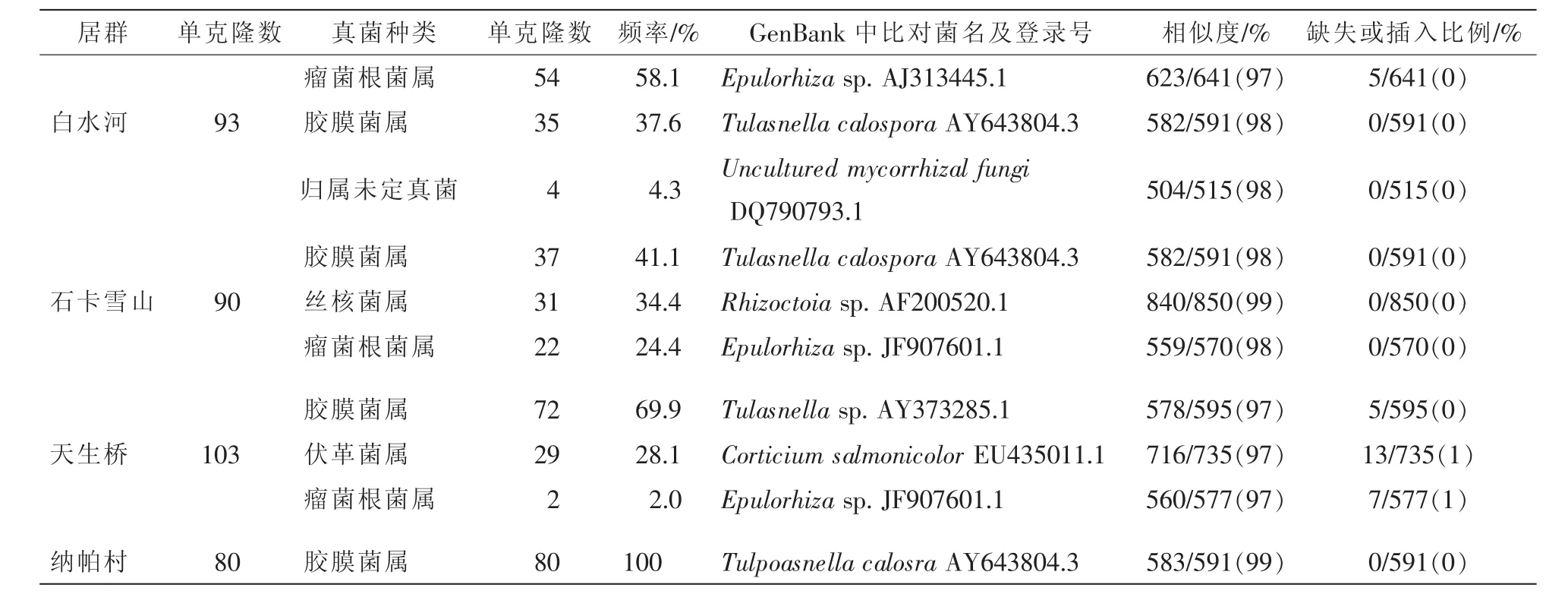
表2 黄花杓兰菌根真菌rDNA ITS序列的Blast比对结果Table 2 Blast results of rDNA ITS sequences of mycorrhizal fungi from Cypripedium flavum
2.4 不同居群黄花杓兰菌根真菌类型
从表3可见:4个居群的黄花杓兰菌根系统中涉及4个真菌属,其中胶膜菌属、瘤根菌属和伏革菌属隶属于担子菌亚门Basdiomycotina,丝核菌属隶属于半知菌亚门Deuteromycotina,还有一类归属未定的真菌,所占频率最少,为1.0%。说明不同居群的黄花杓兰菌根系统中可能存在丰度不同的真菌菌落结构,如白水河居群真菌群落丰富多样,涉及3个真菌属,但在纳帕村黄花杓兰居群只有胶膜菌属,其多样性较为单一。胶膜菌属在每一个居群中都出现且占有较大的比例,高达61.2%。

表3 黄花杓兰菌根不同属真菌的比例Table 3 Number ratio from different genus of mycorrhizal fungi from C.flavum
3 结论与讨论
本研究首次采用微生物免培养技术对滇西北4个不同居群的黄花杓兰植物的毛根总DNA进行提取,用真菌ITS区2对引物NSI1/NLB4和NSI1-F/ITS4直接扩增毛根中真菌的ITS区段,免去了微生物纯培养的过程。从4个不同居群的黄花杓兰毛根中总共克隆得到366个真菌ITS-taxa,与NCBI数据中的菌根真菌进行比对,表明均属菌根真菌类型。说明黄花杓兰菌根系统中存在丰富多样的真菌类型,此方法能较好地反应黄花杓兰菌根中真菌多样性水平,能快速的获得菌根真菌生态系统中的真菌群落类型。
目前研究已知,感染兰科植物根部并能与之共生的真菌类型约有担子菌亚门的7个属(瘤菌根菌属,胶膜菌属,腊壳菌属Sebacina,念珠菌根菌属Moniliopsis,角担菌属Ceratobasidium,层孔菌属Fomes和伏革菌属);半知菌亚门的1个属(丝核菌属)和子囊菌亚门的1个属(毛壳菌属Chaetomium)[16-18]。而本研究发现:4个居群黄花杓兰菌根真菌类型(胶膜菌属、瘤菌根菌属、丝核菌属和伏革菌属)为典型的兰科植物菌根真菌,均在兰科植物菌根真菌系统中已报道。其中,胶膜菌属在每一个居群中都占有较大的比例,且在每个居群中都出现,说明胶膜菌属可能是黄花杓兰菌根真菌系统中的优势种群,存在着一定的寄主特异性。这与已有的研究结果一致。对胶膜菌属的美孢胶膜菌进行研究发现,该菌能促进兰科植物(石斛Dendrobium candidum和地宝兰Geodorum eulophioides)的种子萌发,可能对兰科植物的定植和生长有促进作用[19]。在本研究的另外3个居群中都涉及到瘤菌根菌属真菌,所占比例仅次于胶膜菌属,说明有瘤菌根菌属对黄花杓兰也有着一定的寄主特异性。相关研究也表明,分离自兰科植物的瘤根菌属和胶膜菌属真菌共同促进兰科植物的生长发育[20-21]。Oliveira等[22]对巴西4种兰花不同居群的菌根真菌进进行菌群多样性研究发现,其根内生真菌主要为腊壳菌属,高达81.61%,对这4种兰花有着寄主专一性。另外,在3个居群的黄花杓兰菌根系统中涉及3种类型的真菌,说明不同种的真菌能促进同一种杓兰植物生长发育。这很可能是因为这些真菌皆能提供兰科植物萌发生长所需要的营养物质,它们之间存在营养专一性[23-24],此结论还有待进一步研究证实。
[1] 蔡凝枫,严宁,胡虹,等.黄花杓兰云南中甸居群遗传结构及克隆多样性的分析[J].云南植物研究,2008,30(1):69-75.
CAI Ningfeng,YAN Ning,HU Hong,et al.Genetic structure and clonal diversity of Cypripedium flavum(Orchidaceae)populaitons from South-west China[J].Acta Bot Yunnan,2008,30(1):69-75.
[2] 于永福.中国兰花状况调查[J].森林与人类,2004,24(5):26-27.
YU Yongfu.The orchids in China[J].For Hum,2004,24(5):26-27.
[3] CRIBB P.The Genus Cypripedium[M].Oregon:Timber Press,1997:126-127.
[4] 郑桂灵,李鹏,台永东,等.杓兰属植物的开花和结实动态[J].生态学报,2010,30(12):3182-3187.
ZHENG Guiling,LI Peng,TAI Yongdong,et al.Flowering and fruit set dynamics in Cypripedium[J].Acta Ecol Sin, 2010,30(12):3182-3187.
[5] 黄家林,胡虹.黄花杓兰种子无菌萌发的培养条件研究[J].云南植物研究,2001,23(1):105-108.
HUANG Jialin,HU Hong.Seed germination requirements of Cypripedium flavum in axenic culture [J].Acta Bot Yunnan,2001,23(1):105-108.
[6] 马全宝,张建军.2个杓兰品种及其栽培管理技术[J].甘肃农业科技,2009(11):54-55.
MA Quanbao,ZHANG Jianjun.Two kinds of Cypripedium and its cultivation manager techniques[J].Gansu Agric Sci Technol,2009(11):54-55.
[7] 李鹏,罗毅波.中国特有兰科植物褐花杓兰的繁殖生物学特征及其与西藏杓兰的生殖隔离研究[J].生物多样性, 2009,17(4):406-413.
LI Peng,LUO Yibo.Reproductive biology of an endemic orchid Cypripedium smithii in China and reproductive isolation between C.smithii and C.tibeticum[J].Biodivers Sci,2009,17(4):406-413.
[8] HARLEY J L,SMITH S.Mycorhizal Symbiosis[M].London:Academic Press,1983:203-205.
[9] 赵国英,徐宝萍,董然.杓兰属植物研究现状[J].北方园艺,2013(8):185-188.
ZHAO Guoying,XU Baoping,DONG Ran.Research status of Cypripedium plants[J].Northern Hortic,2013(8):185-188.
[10] HADLEY G.Orchid Biology:Reviews and Perspectives[M].Ithaca:Cornell University Press,1982:83-118.
[11] SHIMURA S,KODA Y.Enhanced symbiotic seed germination of Cypripedium macranthos var.rebunense following inoculation after cold treatment[J].Physiol Plant,2005,123(3):281-287.
[12] 王瑞苓,胡虹,李树云.黄花杓兰与菌根真菌共生关系研究[J].云南植物研究,2004,26(4):445-450.
WANG Ruiling,HU Hong,LI Shuyun.Notes on symbiotic relationship between Cypripedium flavum and its mycorrhizal fungi[J].Acta Bot Yunnanica,2004,26(4):445-450.
[13] 臧穆,王瑞苓,胡虹.黄花杓兰根内的小型菌核[J].云南植物研究,2004,26(5):495-496.
ZANG Mu,WANG Ruiling,HU Hong.Bulbils exist in root of Cypripedium flavum[J].Acta Bot Yunnan,2004,26(5):495-496.
[14] 侯天文,金辉,刘红霞,等.四川黄龙沟优势兰科植物菌根真菌多样性及其季节变化[J].生态学报,2010,30(13):3424-3432.
HOU Tianwen,JIN hun,LIU Hongxia,et al.The variations of mycorrhizal fungi diversity among different growing periods of the dominant orchids from two babitats in the Huanglong valley,Sichuan[J].Acta Ecol Sin,2010,30(13):3424-3432.
[15] 高倩,李树云,胡虹.4种杓兰的菌根结构及其周年动态[J].广西植物,2009,29(2):187-191.
GAO Qian,LI Shuyun,HU Hong.Structure and annual changing pattern of mycorrhizae of four Cypripedium species[J].Guihaia,2009,29(2):187-191.
[16] 盖雪鸽,邢晓科,郭顺星.兰科菌根的生态学研究进展[J].菌物学报,2014,33(4):753-767.
GAI Xuege,XING Xiaoke,GUO Shunxing.Ecological research of orchid mycorrhizae:a review[J].Mycosystema, 2014,33(4):753-767.
[17] 王芝娜,李杰,张银杰.中国兰属植物菌根真菌的rDNA ITS分析[J].西北农林科技大学学报:自然科学版,2013,41(4):191-196.
WANG Zhina,LI Jie,ZHANG Yinjie.rDNA ITS analysis of mycorrhizal fungi of Cymbidium plants[J].J Northwest A&F Univ Nat Sci,2013,41(4):191-196.
[18] RASMUSSEN H N.Recent development in the study of orchid mycorrhiza[J].Plant Soil,2002,244(1/2):149-163.
[19] 王丽琨.美孢胶膜菌(Tulasnella calospora)原生质体制备与CaCl2-PEG转化初步试验[D].北京:北京林业大学, 2013.
WANG Likun.Protoplasts Formation and Preliminary Trial of PEG-mediated Transformation of Tulasnella calopspora[D].Beijing:Beijing Forestry University,2013.
[20] BOUGOURE J J,BOUGOURE D S,CAIRNEY J W G,et al.ITS-RFLP and sequence analysis of endophytes from Acianthus,Caladenia and Pterostylis(Orchidaceae)in Southeastern Queensland[J].Mycol Res,2005,109(4):452-460.
[21] 李潞滨,胡陶,唐征,等.我国部分兰属植物菌根真菌rDNA ITS序列分析[J].林业科学,2008,44(2):160-164.
LI Lubin,HU Tao,TANG Zheng,et al.rDNA ITS analysis of mycorrhizal fungi in Cymbidium plants[J].Sci Sliv Sin,2008,44(2):160-164.
[22] OLIVEIRA S F,BOCAYUVA M F,VELOSO T G,et al.Endophytic and mycorrhizal fungi associated with roots of endangered native orchids from the Atlantic Forest,Brazil[J].Mycorrhiza,2014,24(1):55-64.
[23] DEARNALEY J D W.Further advances in orchid mycorrhizal research[J].Mycorrhiza,2007,17(6):475-486.
[24] LIU Hongxia,LUO Yibo,LIU Hong.Studies of mycorrhizal fungi of Chinese orchids and their role in orchid conservation in China-a review[J].Bot Rev,2010,76(2):241-262.
The rDNA ITS diversity of mycorrhizal fungi with Cypripedium flavum
MIAO Fujun1,JIANG Hong1,WANG Hongqiu2,YUAN Xiaolong1,CHEN Jian1,YANG Yuming1,WANG Juan1
(1.Key Laboratory for Conservation of Rare,Endangered&Endemic Forest Plants,State Forestry Administration, Yunnan Provincial Key Laboratory of Cultivation and Exploitation of Forest Plants,Yunnan Academy of Forestry, Kunming 650201,Yunnan,China;2.School of Forestry,Southwest Forestry University,Kunming 650224,Yunnan, China)
Cypripedium plants,which are endangered by over-harvesting due to their high ornamental and medicinal value,use mycorrhizal fungi to guarantee cultivation and conservation.In order to explore the diversity of mycorrhizal fungi,the rDNA internal transcribed spacer(ITS)sequences from mycorrhizal fungi of four C.flavum populations(Baishui River,Shika Snow Mountain,Tiansheng Bridge,and Napa Village)were amplified by nested polymerase chain reaction(PCR)methods.Results showed a total of 336 distinct ITS-taxa of C. flavum obtained from clones of mycorrhizal fungi with populations from Baishui River(93),Shika Snow Mountain (90),Tiansheng Bridge (103),and Napa Village (80).Blast results of rDNA ITS sequences showed a rich diversity in mycorrhizal fungi systems with mycorrhizae belonging to Tulasnella,Corticium,Epulorhiza,and Rhizoctoia.Tulasnella fungi probably had host-specificity and growth-promoting effects on C.flavum.These results may provide a scientific basis for further conservation work of C.flavum and fungal manure development.[Ch,1 fig.3 tab.24 ref.]
S718.81;Q948.12
A
2095-0756(2015)07-0815-06
10.11833/j.issn.2095-0756.2015.05.024
2014-12-08;
2015-01-22
云南省应用基础研究计划青年项目(2014FD070);国家林业公益性行业科研专项(201204110);云南省应用基础研究重点项目(2013FA054);云南省社会事业发展专项(2010CA010);云南省中青年学术技术带头人后备人才培养项目(2010CI016);云南藏区典型区域生态安全防控技术研究及应用示范项目;云南省教委湿地生态学创新团队项目
缪福俊,研究实习员,从事根际微生物研究。E-mail:miaofujun@yeah.net。通信作者:王娟,教授,从事植物分子生物学与植物菌根研究。E-mail:schima@163.com

