IL-17,IL-6,IL-1β与儿童原发性肾小球疾病的相关性研究
贺丽蓉 邵晓珊 李宇红 蒋新辉 徐海霞 应蓓 邱杰 郑莎莎 林俊
(1.贵阳医学院,贵州 贵阳550004;2.贵阳市儿童医院肾脏免疫科,贵州 贵阳550003)
原发性肾小球疾病(primary glomerular diseases)在我国肾脏疾病谱中占有重要的地位,是一组原因不明的免疫炎症反应性疾病,有相似的临床表现如蛋白尿、血尿、高血压、不同程度的水肿以及肾功能损害,也是儿童时期最常见的慢性肾脏疾病之一,其确切病因和发病机制尚未完全阐明。近年研究发现,Th17细胞(T help 17cells)在自身免疫性疾病发病过程中起着重要作用[1]。白细胞介素-17(interleukin-17,IL-17)、IL-6和IL-1β是与 Th17细胞密切相关的三种细胞因子,多发性硬化、系统性红斑狼疮等患者血浆或病变组织中IL-17或IL-6、IL-1β表达增高,推测其可能参与了这些疾病的发病过程[2-3]。原发性肾小球疾病是常见的自身免疫性疾病。本研究旨在通过检测IL-17、IL-6和IL-1β的表达,探讨它们在原发性肾小球疾病中的临床意义。
1 资料与方法
1.1 研究对象
收集贵阳市儿童医院肾脏科2013年12月至2014年12月住院的30例确诊为原发性肾小球疾病患儿临床资料。男20例,女10例;发病年龄1.58~14岁,平均(8.2±3.8)岁。其中肾炎型肾病综合征10例,单纯型肾病综合征10例,肾小球肾炎9例,孤立性血尿1例。同时收集10例健康体检儿童外周血作为正常对照,男8例,女2例,平均(5.9±3.3)岁。本研究经贵阳市儿童医院伦理委员会批准同意,符合伦理学标准,家属知情同意。
1.2 诊断与分型标准
所有病例临床诊断均符合中华医学会儿科学分会肾脏病学组2000年11月珠海会议制定的诊断标准[4],均排除紫癜性肾炎、狼疮性肾炎、乙肝病毒相关性肾炎等继发性肾脏疾病及其它免疫性疾病,且均无肾脏病家族史。
1.3 方法
1.3.1 荧 光 定 量 PCR(Real-time PCR)检 测IL-17mRNA的表达 主要试剂为核酸提取试剂盒(CW0582,康为世纪),逆转录试剂盒(C28025-032,Invitrogen公司),2×UltraSYBR Mixture(CW0956,康为世纪)。根据核酸提取试剂盒说明书提供的方法提取血液总RNA。提取后用紫外分光光度计测定所提取RNA的浓度和纯度,所有用于逆转录的样品要求比值在1.9~2.1之间。再按照逆转录试剂盒提供的方法,逆转录合成cDNA。制备的cDNA于-20℃保存备用。然后采用SYBR Green I嵌合荧光法,应用美国Applied Biosystems Stepone Plus荧光定量PCR仪进行扩增检测。根据 NCBI Gene Bank中人的IL-17的mRNA序列,采用计算机辅助设计(primer5.0)相关引物,由上海生工生物工程技术设计合成、纯化。引物序列为:IL-17上游:5'-GAGAAGATACTGGTGTCCGTGG-3',下游:5'-TGAGTTTAGTCCGAAATGAGGC-3'(产物大小:171bp);GAPDH 上游:5'-TGGACCTGACCTGCCGTCTAG-3', 下 游:5'-AGGAGTGGGT-GTCGCTGTTGA-3'(产物大小:150bp)。扩增结束后应用Stepone Software v2.1分析软件进行分析,计算目的基因IL-17的相对表达量。
1.3.2 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测血浆中细胞因子IL-17、IL-1β及IL-6的表达 收集所有受试者清晨空腹肝素或EDTA抗凝血,收集标本后30min内2500rpm离心5min,分离获得血浆。采用ELISA法检测血浆中IL-17、IL-1β及IL-6的含量,操作严格按照试剂书说明书进行。ELISA试剂盒购自杭州联科试剂公司。
1.4 统计学处理
采用GraphPad Prism 5统计软件进行统计分析。计量资料数据以均数±标准差(¯x±s)表示,运用t检验;P<0.05示差异有统计学意义。
2 结 果
2.1 Real-time PCR检测外周血中IL-17mRNA 的表达 IL-17及GAPDH的PCR扩增曲线拐点清楚,指数期明显,扩增曲线整体平行性好,基线平无上扬现象,说明扩增良好:溶解曲线均为单峰,峰型锐利,其他位置无明显波形,表明扩增产物单一,特异性好。结果显示实验组IL-17mRNA表达水平显著高于对照组(P<0.05)。见图1~3及表1。
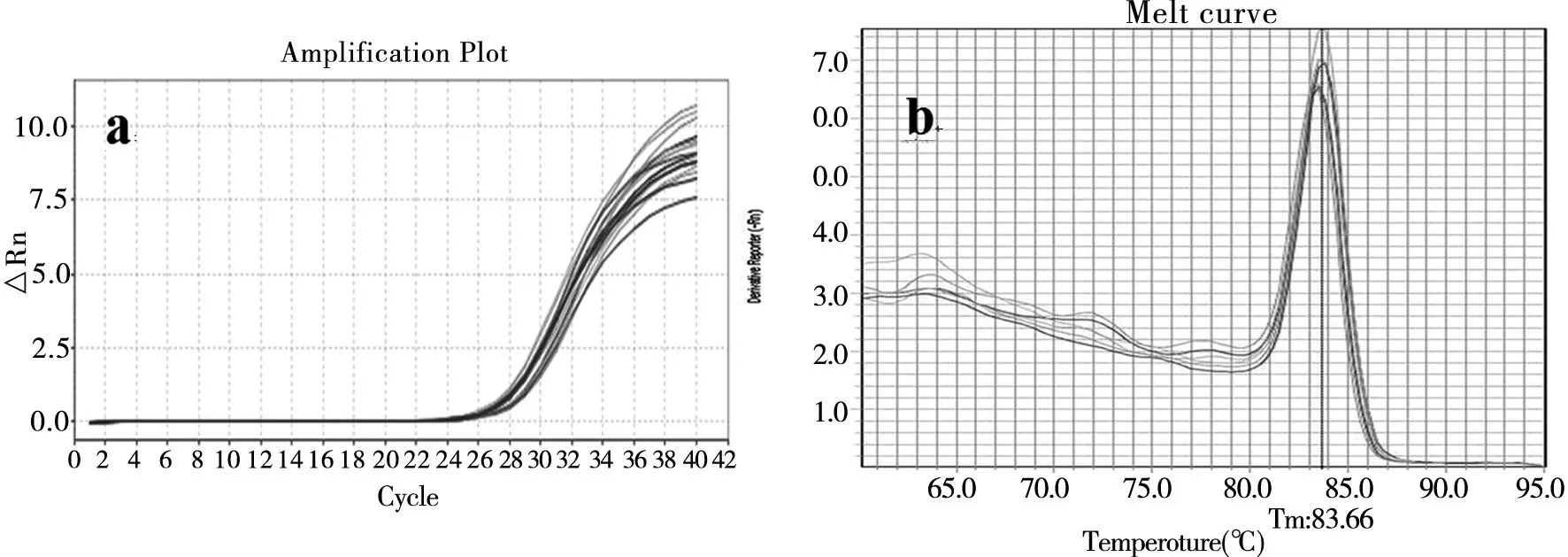
图1 IL-17的扩增曲线(a)和溶解曲线(b)(Tm:83.66℃)
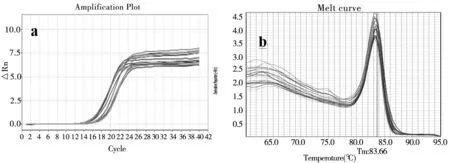
图2 GAPDH 的扩增曲线(a)和溶解曲线(b)(Tm:83.52℃)
表1 各组外周血中IL-17mRNA的表达(±s)

表1 各组外周血中IL-17mRNA的表达(±s)
相对表达对照组组别 n IL-17mRNA 10 1.095±0.212实验组 30 4.427±2.870 t 3.636 P<0.05
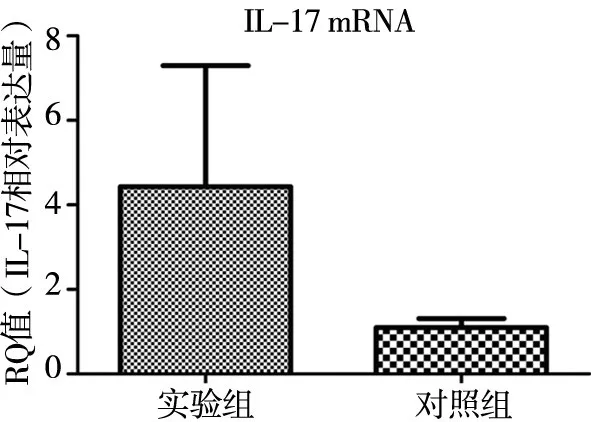
图3 各组外周血中IL-17mRNA的表达
2.2 ELISA 检测血浆IL-17、IL-1β以及IL-6的表达 原发性肾小球疾病患儿血浆中IL-17、IL-1β以及IL-6的含量均明显高于正常对照组(P<0.05),差异有统计学意义。见表2及图4。

表2 各组血浆中IL-17、IL-1β以及IL-6的水平比较 (pg/mL)

图4 各组血浆中IL-17、IL-1β以及IL-6的水平比较(pg/mL)
3 讨 论
Th17细胞是新发现的一个不同于Th1和Th2细胞的Th细胞亚群。研究表明[5],Th17细胞参与调节和控制免疫应答,在自身免疫性疾病中发挥着重要作用。IL-17、IL-1β、IL-6、IL-23和 RORγt等在Th17细胞发育、增殖及发挥效应方面起重要作用[6]。
IL-17是Th17细胞分泌的主要效应细胞因子,其受体分布于体内多种组织,是一种强大的前炎症细胞因子,也是炎症反应的微调因子,通过促进中性粒细胞和单核细胞聚集,诱导细胞释放前炎症因子,引起炎症细胞浸润和组织损伤,参与肾脏炎症反应的发生和发展,在宿主抗细菌感染免疫中发挥重要作用[7-10]。它在慢性炎症疾病及自身免疫性疾病的发病机制中的作用也成为了研究热点[11-12]。IL-17作为Th17细胞的特异性效应因子,本实验采用实时荧光定量PCR对原发性肾小球疾病患儿外周血IL-17mRNA水平进行了检测,发现IL-17mRNA水平高于正常对照组,结果较普通PCR更精确,特异性更高,证实了原发性肾小球疾病患儿外周血中存在IL-17的异常活化,加重了免疫反应的发生。
研究表明,IL-6,IL-23及IL-1β同时存在能刺激初始 CD4+T 细胞大量分泌IL-17[13]。IL-17又能够促进多种细胞,如上皮细胞、内皮细胞、成纤维细胞等分泌IL-1、IL-6等炎症因子,并且能够与之协同,放大局部炎症效应[14]。IL-1β是一种重要的促炎症因子,诱导炎症细胞浸润和其他炎症因子产生,加重炎症反应。有研究发现,IL-1β可刺激肾小球系膜细胞活化和增殖,在肾脏疾病的发生、发展过程中起着重要的作用[15]。本研究通过酶联免疫吸附试验发现患儿血浆中IL-17、IL-1β以及IL-6的表达水平均明显增强,提示Th17相关致炎因子IL-17、IL-1β以及IL-6参与了原发性肾小球疾病的发病过程。
IL-1β、IL-6作为 Th17细胞的上游刺激因子配合IL-17作为Th17细胞的下游刺激因子。我们的研究结果显示,外周血中核酸水平增高同时血浆中IL-17、IL-1β以及IL-6的表达水平均明显增强,说明Th17细胞的相关炎性因子的异常活化,可能参与了原发性肾小球疾病的发病过程,但其与肾脏疾病的严重程度是否有关联还需进一步扩大样本量同时配合肾组织病理检查进行分析。既往有研究报道在 原 发 性 肾 病 综 合 征 (primary nephrotic syndrome,PNS)患儿肾组织中IL-17表达的阳性率微小病变组高于正常对照组,提示IL-17在儿童PNS的发生及大量蛋白尿的形成方面有显著作用;肾组织上IL-6的表达在微小病变组较正常对照组无明显差别,但在非微小病变组明显升高,提示IL-6在儿童PNS的慢性肾脏病进程中可能有重要作用,但与儿童PNS的发病可能关联性不强[16]。
随着基础和临床研究的不断深入,越来越多的数据表明Th17细胞相关炎性因子在一些类型的肾脏炎症性疾病的发病过程中起重要作用,特异性针对Th17细胞相关炎性因子的治疗可能是治疗肾脏疾病的新靶点[17]。但是Th17在原发性肾小球疾病中的具体发病机制还不清楚,还需要大量深入的研究去进一步阐明Th17细胞及其相关炎性因子对原发性肾小球疾病的作用及机制,从而为治疗原发性肾小球疾病开辟新的道路。
[1] Shao XS,Yang XQ,Zhao XD,et al.The prevalence of Th17cells and FOXP3regulate T cells(Treg)in children with primary nephrotic syndrome[J].Pediatr Nephrol,2009,24(9):1683-1690.
[2] Zhang X,Jin J,Peng X,et al.Simvastatin inhibits IL-17 secretion by targeting multiple IL-17-regulatory cytokines and by inhibiting the expression of IL-17transcription factor RORC in CD4+imphocytes[J].J Immunol,2008,180(10):6988-6996.
[3] 徐靓,张慧涛,郑晶,等.白细胞介素17在狼疮性肾炎小鼠中的表达及抗白细胞介素17抗体的干预作用[J].中国病理生理杂志,2014,30(2):343-346.
[4] 中华医学会儿科学分会肾脏病学组.小儿肾小球疾病的临床分类、诊断及治疗[J].中华儿科杂志,2001,39(12):746-749.
[5] Huh JR,Leung MW,Huang P,et al.Digoxin and its derivatives suppress TH17cell differentiation by antagonizing RORγt activity[J].Nature,2011,472(7344):486-490.
[6] 张勇,邢广群,张蓓,等.鲫鱼汤对阿霉素肾病大鼠Thl7细胞相关炎性因子表达的影响[J].中国实验动物学报,2013,21(4):16-20.
[7] 林佳如,杨满,张晓燕,等.Th17细胞与肾脏疾病关系的研究进展[J].国际泌尿系统杂志,2012,32(3):415-418.
[8] Steinmetz OM,Summers SA,Gan PY,et al.The Th17-defining transcription factor RORγt promotes glomerulonephritis[J].J Am Soc Nephrol,2011,22(3):472-483.
[9] Milner JD.IL-17producing cells in host defense and atopy[J].Curr Opin Immunol,2011,23(6):784-788.
[10] 刘利,杨满,樊均明.Th17细胞在IgA肾病发病机制中的作用[J].中国中西医结合肾病杂志,2012,13(5):462:464.
[11] 王莉,李秋,王莉佳,等.原发性肾病综合征患儿外周血Th17与CD4+CD25+Foxp3+调节性T细胞的水平[J].细胞与分子免疫学杂志,2010,26(8):783-786.
[12] Gaffen SL.Recent advances in the IL-17cytokine family[J].Curr Opin Immunol,2011,23(5):613-619.
[13] Ghoreschi K,Laurence A,Yang XP,et al.Generation of pathogenic T(H)17cells in the absence of TGF-βsignalling[J].Nature,2010,467(7318):967-971.
[14] 王莉,李秋,李翠,等.白细胞介素-17对系膜细胞功能的影响及其分子机制[J].临床儿科杂志,2014,32(2):178-182.
[15] Wang R,Wan Q,Zhang Y,et al.Emodin suppresses interleukin-1beta induced mesangial cells proliferation and extracellular matrix production via inhibiting P38MAPK[J].Life Sci,2007,80(26):2481-2488.
[16] 李宇红,邵晓珊,江超,等.原发性肾病综合征患儿肾组织中IL-17、IL-6、TGF-β1表达水平与临床病理分析[J].贵州医药,2015,39(1):65-67.
[17] 周乐天,刘伏友.Th17细胞与肾小球疾病的研究进展[J].中南大学学报(医学版),2013,38(4):432-436.

