祛风除湿颗粒的质量标准研究
郑 飞 ,孙敬蒙,张炜煜#(1.长春中医药大学吉林省人参科学研究院,吉林 长春 130117;.长春中医药大学药学院,吉林 长春 130117)
祛风除湿颗粒由鹿衔草、石菖蒲、牛膝、甘草等中药制成的复方制剂,具有通经活络、祛风除湿的功效,用于治疗风湿痹痛,腰膝疼痛。本制剂中,君药为鹿衔草,具有祛风湿、强筋骨的功能,其化学成分为黄酮类、酚苷类、醌类、萜类等,黄酮类成分含量最多,主要为金丝桃苷,2″-O-没食子酰基金丝桃苷,槲皮素[1-4]。为方便患者服用、携带,将祛风除湿颗粒制成颗粒剂,为有效控制复方制剂的质量,本实验采用薄层色谱法(thin layer chromatography,TLC)对石菖蒲、牛膝、甘草进行薄层定性鉴别,采用高效液相色谱法(high performance liquid chromatography,HPLC)测定金丝桃苷的含量,进而制定该制剂的质量标准。
1 材料
1.1 仪器
Agilent 1200 高效液相色谱仪(美国安捷伦公司);Agilent C18-SB 色谱柱(4.6 mm×250 mm,5 μm);UV-9600 型紫外-可见分光光度计(上海元析仪器有限公司);AR2140 型电子精密天平(梅特勒-托利多仪器有限公司);电热恒温水浴锅(北京科伟永鑫实验仪器设备厂);SD-1000 型喷雾干燥机(东京理化)。
1.2 药品与试剂
石菖蒲、牛膝、甘草对照药材(中国食品药品检定研究院,批号:120904-201016,ID:ZRUG-OA5Q,0.5 g);金丝桃苷标准品(中国生物制品检定所,批号:111521-201004);甲醇、乙腈均为色谱纯(sigma);硅胶G、GF254 薄层板;甲醇、磷酸均为分析纯(北京化工厂);娃哈哈纯净水(娃哈哈集团有限公司);复方祛风湿颗粒(自制,批号:20140121)。
2 方法与结果
2.1 祛风除湿颗粒的制备
取处方量的鹿衔草、牛膝、石菖蒲,加12 倍于药材量的70%乙醇,回流提取2 次,每次1 h,合并滤液,滤过,滤液回收乙醇并浓缩至密度为1.02 ~1.05(60 ℃测)的浓缩液,备用;醇提后的药渣与甘草加10 倍于药材量的水煎煮2 次,每次1.5 h,滤过,合并水煎液并浓缩至密度为1.02 ~1.05(60 ℃测)的浓缩液,合并醇提和水煎液;采用喷雾干燥技术,进风温度为110 ℃,进料速度为260 ml/h,雾化压力为100 kPa,得喷雾干燥粉末,备用;称取处方量提取物干燥粉末及辅料,过筛混合,加入适量乙醇制软材,14 目标准筛制粒,50 ℃~60 ℃干燥,12 目筛整粒,即得。
2.2 性状
对多批样品进行颜色、气、味综合观察。确定本品为棕色颗粒;气香,味微苦。
2.3 定性鉴别
2.3.1 石菖蒲:取本品3 批(批号:20140113、20140119、20140126),每批2 g,研细,分别加石油醚(60 ~90 ℃)20 ml,加热回流1 h,滤过,滤液蒸干,残渣加石油醚(60 ~90 ℃)2 ml使溶解,作为供试品溶液。另取石菖蒲对照药材1 g,同法制成对照药材溶液。再按处方比例另取缺石菖蒲以外的药材按制备工艺制得阴性颗粒,按供试品溶液制备方法制成阴性对照溶液。照薄层色谱法[《中华人民共和国药典:一部》(2010年版)附录ⅥB]试验,吸取上述3 种溶液各10 μl,分别点于同一硅胶G 薄层板上,以石油醚(60 ~90 ℃)-乙酸乙酯(V ∶V=4 ∶1)作为展开剂[5-7],展开,取出,晾干,置紫外光灯(365 nm)下检视,见图1。结果表明,供试品在与对照药材色谱相对应位置上显相同颜色斑点,阴性无干扰。
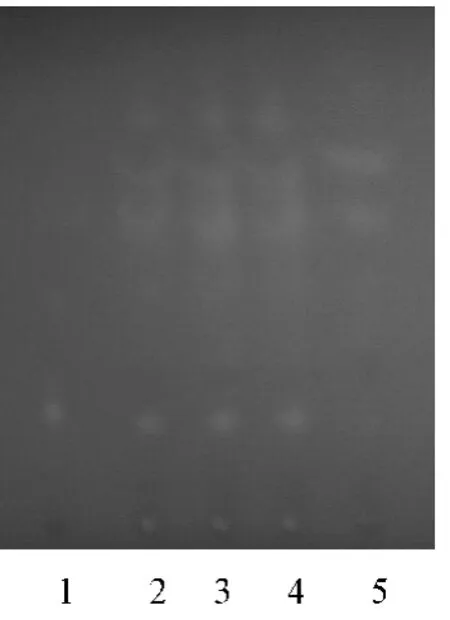
图1 石菖蒲的TLC 图Fig 1 TLC of A.tatarinowii
2.3.2 牛 膝:取 本 品3 批(批 号:20140113、20140119、20140126),每批2 g,研细,分别加乙醇20 ml 回流提取40 min,滤过,滤液加入盐酸2 ml 回流提取1 h 后浓缩至约5 ml,加水10 ml,用石油醚(60 ~90 ℃)提取2 次,每次20 ml,合并石油醚液,蒸干,残渣加乙醇2 ml 使溶解,作为供试品溶液。另取牛膝对照药材2 g,同法制成对照药材溶液。再按处方比例另取缺牛膝以外的药材按制备工艺制得阴性颗粒,按供试品溶液制备方法制成阴性对照溶液。照薄层色谱法[《中华人民共和国药典:一部》(2010 年版)附录ⅥB]试验,分别吸取上述溶液各10 μl,点于同一硅胶G 薄层板上,以氯仿-甲醇(V∶V=10∶1)作为展开剂[8-9],展开,取出,晾干,置紫外光灯(365 nm)下检视。见图2。结果表明,供试品在与对照药材色谱相对应位置上显相同颜色斑点,阴性无干扰。2.3.3 甘 草:取 本 品3 批(批 号:20140113、20140119、20140126),每批2 g,研细,分别加甲醇40 ml,超声处理30 min,滤过,滤液蒸干,残渣加水20 ml 使溶解,用水饱和正丁醇萃取2 次,每次20 ml,合并正丁醇液,用正丁醇饱和的水溶液20 ml洗涤1 次,弃去水液,取正丁醇液蒸干,残渣加甲醇10 ml 使溶解,作为供试品溶液。另取甘草对照药材,同法制成对照药材溶液。再按处方比例另取缺甘草以外的药材,按制备工艺制得阴性颗粒,按供试品溶液制备方法制成阴性对照溶液。照薄层色谱法[《中华人民共和国药典:一部》(2010 年版)附录ⅥB]试验,吸取上述溶液各10 μl,分别点于同一硅胶G 薄层板上,以乙酸乙酯-甲酸-冰醋酸-水(V ∶V ∶V ∶V=15 ∶1 ∶1 ∶1)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置紫外灯(365 nm)下检视[10-11],见图3。结果表明,供试品在与对照药材色谱对应位置上显相同颜色斑点,阴性无干扰。

图2 牛膝的TLC 图Fig 2 TLC of A.bidentata blume

图3 甘草的TLC 图Fig 3 TLC of G.uralensis fisch
2.4 检查
2.4.1 粒度:照粒度测定法[《中华人民共和国药典:一部》(2010 年版)附录ⅪB 第二法,双筛分法]进行测定。分别取3批(批号:20140113、0140119、20140126,下同)自制样品30 g,称定质量,置1 号筛和5 号筛中,保持水平状态过筛,左右往返,边筛动边轻叩3 min。取不能通过一号筛和能通过5 号筛的颗粒及粉末,称定质量,计算所占百分比。结果表明,3 批自制样品不能通过1 号筛和能通过5 号筛的颗粒及粉末所占比例分别为10.6%,9.3%和11.2%,均<15%,符合规定。
2.4.2 水分:照水分测定法[《中华人民共和国药典:一部》(2010 年版)附录ⅨH]进行测定。分别取3 批自制样品5 g,平铺于干燥至恒重的扁形称量瓶中,厚度不超过5 mm,疏松供试品不超过10 mm,精密称定,打开瓶盖在100 ~105 ℃干燥5 h,将瓶盖盖好,移置干燥器中,冷却30 min,精密称定,再在上述温度干燥1 h,冷却,称定质量,至连续2 次称定质量的差异不超过5 mg 为止[12]。根据减失的质量,计算供试品中含水量(%)。结果表明,3 批自制样品的含水量分别为3.9%,4.2%和4.9%,均小于6.0%,符合规定。2.4.3 溶化性:取上述3 个批号的自制样品各1 袋,分别加热水200 ml,搅拌5 min,立即观察[13]。结果表明,3 批自制样品倒入水中搅拌5 min,溶液呈混悬状,且混悬均匀,符合规定。2.4.4 装量差异:照《中华人民共和国药典:一部》(2010 年版)附录IC“颗粒剂制剂通则”项下要求,对3 批样品的装量差异进行检查。取上述3 个批号的自制样品各10 袋,分别称定每袋内容物的质量,每袋装量与标示量相比较。结果表明,3 批自制样品每袋的质量均未超过标示装量(5 ±5 ×7%)g,符合规定,见表1。

表1 装量差异检查结果Tab 1 Results of the gross deviation
2.5 金丝桃苷的含量测定
2.5.1 标准品溶液的制备:取金丝桃苷的标准品约5 mg,精密称定,置25 ml 量瓶中,加甲醇适量,振摇使其溶解,加甲醇稀释至刻度,滤过,即得。
2.5.2 供试品溶液的制备:取自制颗粒5 g,精密称定,研细,置100 ml 烧杯中,加甲醇50 ml,超声30 min,放冷,滤过,取续滤液5 ml,于60 ℃水浴上挥干,残渣加甲醇溶解,转移至25 ml量瓶中,加甲醇稀释至刻度,摇匀,滤过,取续滤液[14],即得。
2.5.3 最大吸收波长的确定:取金丝桃苷对照品溶液0.5 ml,置5 ml 量瓶中,用甲醇稀释至刻度,摇匀,按紫外-可见分光光度法[《中华人民共和国药典:一部》(2010 年版)附录ⅤA]以相应试剂为空白,在200 ~800 nm 波长范围内进行扫描,扫描结果见图4。结果表明,对照品溶液分别在257、361 nm 波长处有最大吸收峰,《中华人民共和国药典》(2010 年版)规定的检测波长为360 nm,综合扫描结果,确定测定波长为360 nm。
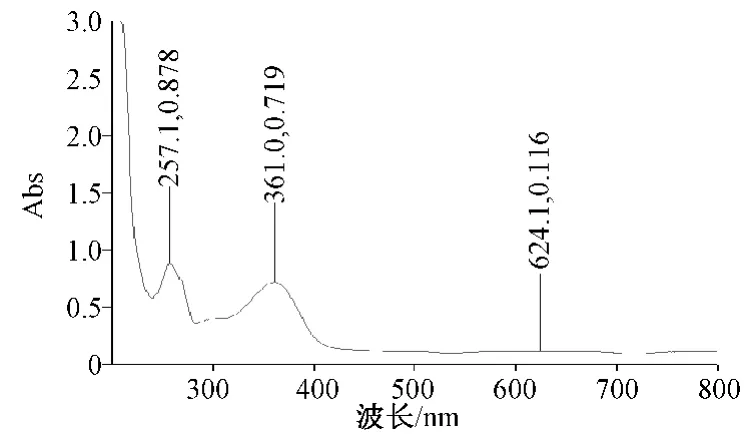
图4 金丝桃苷对照品的光谱扫描图Fig 4 Spectral scans of hyperoside reference substance
2.5.4 色谱条件:Agilent C18-SB 色谱柱(4.6 mm ×250 mm,5 μm);紫外检测器;流动相乙腈-0.1% 磷酸溶液(V ∶V =18 ∶82);柱温25 ℃;流速1 ml/min;检测波长360 nm[15]。2.5.5 系统适用性实验:在本色谱条件下,供试品溶液中金丝桃苷得到较好的分离,其色谱峰的保留时间与对照品一致,见图5。

图5 金丝桃苷HPLC 图Fig 5 HPLC chromatograms of hyperoside
2.5.6 方法学考察:(1)线性关系考察:分别精密量取金丝桃苷对照品溶液0.1、0.5、1.0、1.5、2.0 ml,置2 ml 量瓶中,加甲醇稀释至刻度,摇匀,过滤,取续滤液,作为不同浓度对照品溶液;分别将不同浓度对照品溶液进样10 μl 测定,记录峰面积,以对照品浓度(X)对峰面积(Y)进行线性回归,得回归方程为Y=14 376X+130.44,r=0.999 6,金丝桃苷在0.01 ~0.20 mg/ml 浓度范围内线性关系良好。(2)中间精密度试验:中间精密度为在同一个实验室,不同时间由不同分析人员使用不同分析设备测定结果之间的精密度。分别取2 批平行样品3 份,按“2.5.2”项下制备供试品溶液,依法进行含量测定,结果RSD为1.81%,表明仪器精密度良好。(3)重复性试验:在相同操作条件下,由同一个分析人员在较短的间隔时间内测定所得结果的精密度。取同一批样品6 份,按“2.5.2”项下制备供试品溶液,依法进行含量测定,结果RSD为1.95%,表明样品重复性良好。(4)稳定性试验:在本试验条件下,取供试品溶液分别在室温放置0、2、4、6、8、12 h,依法进行含量测定,结果RSD为1.83%,表明供试品溶液至少在12 h 内稳定。(5)回收率试验:精密吸取已知含量的供试品溶液6 份,分别精密加入0.020 0 mg 金丝桃苷对照品溶液,按“2.5.2”项下制备供试品溶液,依法进行含量测定,结果平均回收率为100.95%(n=6),表明此方法可行。
2.6 样品含量测定
分别取3 批样品适量,按“2.5.2”项下方法制备供试品溶液,测定金丝桃苷的含量,结果见表2。根据上述测定结果,3 批样品金丝桃苷平均含量为42. 54mg/袋。根据生产实际,在平均含量的基础上分别下调20%制定本制剂含量限度[16],即本品每袋(5 g)中含金丝桃苷不得少于34 mg/袋。

表2 祛风除湿颗粒中金丝桃苷含量测定(n=3)Tab 2 Content determination of hyperoside in Qufengchushi Granules(n=3)
3 讨论
在甘草的定性鉴别试验中,按《中华人民共和国药典:一部》(2010 年版)“甘草”项下鉴别方法操作,供试品的处理相对复杂。参考文献,并经过反复试验,确定供试品的处理方法先加甲醇超声提取,再水饱和正丁醇萃取,并调整了各相展开剂比例,得到了斑点清晰、分离度较好的TLC 色谱图。
金丝桃苷为黄酮醇苷类化合物,在260 ~360 nm 下有最大吸收,本试验选择360 nm 为检测波长,以尽可能地排除提取物中其他杂质的干扰,考察流动相的不同比例,最终得到的金丝桃苷色谱峰与其他杂质峰分离度良好。该法测定结果稳定可靠,且重现性好,为制剂的质量控制提供了依据。
本试验主要对祛风除湿颗粒中的石菖蒲、牛膝和甘草进行了定性鉴别,并对制剂样品中金丝桃苷的含量进行了测定,结果表明所建立的分析方法简便可行、重复性好,可列入该制剂的质量标准中。
[1] 国家药典委员会.中华人民共和国药典:一部[S].2010 年版.北京:中国医药科技出版社,2010:304.
[2] 李东,杨松,宋宝安,等.鹿蹄草属植物的研究进展[J].贵州大学学报:自然科学版,2008,25(2):188-194.
[3] 林萍,易宏伟,张斐.金丝桃苷药理作用研究进展[J]. 中国现代中药,2012,14(10):23-26.
[4] 柳景,王昌利,崔锐.复方鹿衔草总黄酮的提取工艺[J]. 中国实验方剂学杂志,2011,17(8):29-31.
[5] 梁惠珍,倪艳,李先荣.复方脑清胶囊的薄层色谱鉴别[J].中国实验方剂学杂志,2013,19(15):70-72.
[6] 李素云,李孝栋.石菖蒲薄层鉴别及挥发性成分分析[J]. 福建中医药大学学报,2012,22(5):48-50.
[7] 覃鸿恩,何萌萌,吕杨等.健脑益智胶囊薄层鉴别研究[J].陕西中医学院学报,2013,36(6):114-116.
[8] 刘征辉,叶挺祥,赵琳琳等.血府逐瘀颗粒薄层色谱鉴别方法的研究[J].天津中医药,2012,29(3):292-294.
[9] 王希斌,王晓燕,刘广娟等. 复方地龙胶囊薄层鉴别方法研究[J].广西医科大学学报,2014,31(6):1015-1017.
[10] 石克,冉海琳.桑菊感冒冲剂中连翘、甘草的薄层色谱鉴别[J].海峡药学,2009,21(9):43-44.
[11] 李敏. 四季感冒片中甘草薄层鉴别方法研究[J]. 亚太传统医药,2015,11(8):26-27.
[12] 林丽美,许招懂,姚江雄,等. 夏桑菊颗粒质量标准研究[J]. 中成药,2012,34(8):1500-1505.
[13] 王惠川,张爱军,王华丽.茵陈大黄颗粒的质量标准研究[J]. 中国医院用药评价与分析,2008,8(7):516-517.
[14] 张园园,陈晓辉,孙艳艳,等. 反相高效液相色谱法测定普通鹿蹄草中的黄酮苷类成分[J].色谱,2007,25(3):367-370.
[15] 钟方丽,王晓林,敬采月.高效液相色谱法测定刺玫果中金丝桃苷的含量[J].食品科学,2010,31(24):281-284.
[16] 李婷,叶豆丹,鲍慧玮,等. 治郁颗粒的成型工艺及质量控制[J].中国实验方剂学杂志,2014,20(6):19-22.

