多中心非干预前瞻性开放的3000例苦碟子注射液应用情况及不良反应集中监测
于 倩,赵阿娜,付秀娟(.吉林大学中日联谊医院药学部,吉林 长春 00;.长春市中心医院药学部,吉林 长春 00;.吉林大学第二医院药学部,吉林 长春 004)
多中心非干预前瞻性开放的3000例苦碟子注射液应用情况及不良反应集中监测
于 倩1,赵阿娜2,付秀娟3(1.吉林大学中日联谊医院药学部,吉林 长春 130033;2.长春市中心医院药学部,吉林 长春 130021;3.吉林大学第二医院药学部,吉林 长春 130041)
目的:吉林地区7家医院对苦碟子注射液上市后的安全性进行再评价,为临床合理用药提供参考。方法:采用多中心非干预前瞻性集中监测的方法,观察2012年6月 – 2014年3月3000例应用苦碟子注射液的患者,对药物的临床应用及不良反应情况进行分析。结果:使用苦碟子注射液的患者年龄主要分布在40 ~ 80岁,与苦碟子注射液的药理作用相关;有26.83%的患者为超剂量用药,虽未引起不良反应,仍应予以重视;功能主治符合药品说明书;停药原因比较明确,有1例死亡病例与患者年龄及疾病进程有关;在3000例患者中发生3例不良反应,不良反应发生率为0.1%。结论:应加强苦碟子注射液的临床合理应用及不良反应监测,避免超剂量用药;初步建立一套中药注射剂安全性再评价模式,供今后的实践工作予以借鉴。
苦碟子注射液;安全性;评价;前瞻性集中监测;不良反应
苦碟子注射液药理研究表明,其具有抗血小板聚集、抑制血栓形成、增加纤溶酶活性、促进血栓溶解、扩张血管、降低血管阻力、增加脑、心血流量等作用[1]。其临床应用已有12年,功能主治为活血止痛、清热祛瘀。用于瘀血闭阻的胸痹,证见:胸闷、心痛,口苦,舌暗红或存瘀斑等。适用于冠心病、心绞痛见上述病状者,亦可用于脑梗死者。本研究采集了吉林地区7家医院苦碟子注射液的相关数据并进行分析,以期为临床合理用药提供参考。
1 资料与方法
1.1 资料来源
本文资料来源于吉林地区7家医院2012年6月–2014年3月的3000例神经内科、心血管内科、中医科住院患者,其中吉林大学第一医院41例;吉林大学第二医院513例;吉林大学中日联谊医院1179例;长春市中心医院995例;吉林省人民医院50例;白山中心医院99例;吉林大学第四医院123例。
1.2 方法
1.2.1多中心非干预前瞻性集中监测 采用多中心非干预前瞻性集中监测的方法观察在此期间的3000例住院患者,对苦碟子的应用情况及不良反应(ADR)进行分析。该方法是指多个中心在一定的时间、一定的范围内对某一医院内所发生的不良反应及药物应用情况作详细记录,分析不良反应发生率并讨论其危险因素。目前,有关苦碟子注射液的统计和分析主要来源于自发呈报系统,对不良反应信号的产生和评价工作带来阻碍[2]。应用集中监测方法可以弥补其不足,收集到的不良反应信息更加全面,针对性强,准确性高,可根据收集到的临床资料对不良反应进行关联性评价;可根据不良反应的发生与临床使用,判断不良反应的影响因素[3]。因此采用集中监测的方法进行研究,流程详见图1。
1.2.2入选及排除标准 (1)神经内科、心血管内科和中医科使用苦碟子注射液的住院患者纳入观察对象,填写筛选卡;排除不在研究单位使用苦碟子注射液患者,精神异常患者,不符合说明书适应证、注意事项、疾病人群的患者。(2)出现药品不良反应,怀疑不良反应与苦碟子病例组有关的患者纳入病例组。(3)未出现药品不良反应,与病例组同期(±7 d)使用苦碟子注射液,原患疾病与病例组的相同或相似,可纳入病例对照组。

图1 医院集中监测流程图Fig 1 Flowchart of hospital centralized monitoring
1.2.3统计学处理 2014年3月将多中心整理的数据汇总到吉林大学中日联谊医院进行统计分析,建立Epidata数据库,并将筛选卡中使用该药的科室、登记号、患者姓名、性别、年龄、病程、诊断、过敏史和苦碟子注射液的用药天数、剂量、溶媒、用药目的、合并用药以及停用原因等相关信息录入其中,数据库得到的各项数据用SPSS20.0软件进行分析。
2 结果
2.1 患者年龄
3000例患者各年龄段构成比如图2所示,平均年龄是(60.82±13.73)岁。

图2 患者年龄分布图Fig 2 Age distribution chart of the patients
2.2 苦碟子注射液使用情况
2.2.1使用科室分布 本次观察到使用苦碟子注射液的科室为心血管内科、神经内科、中医科,病例数分别为1676例、1224例、100例。
2.2.2使用剂量与溶媒 患者均采用静脉滴注的给药方式,苦碟子使用剂量为40 mL的有2195例患者,占总人数73.17%,其余的使用剂量均为50 mL;溶媒使用情况详见表1,有67.10%的患者溶媒使用量为250 mL的0.9%氯化钠注射液,基本符合说明书推荐的给药方式和用法用量;苦碟子使用剂量为50 mL以及溶媒量低于250 mL的为超说明书用药情况,临床应用时应予以重视。
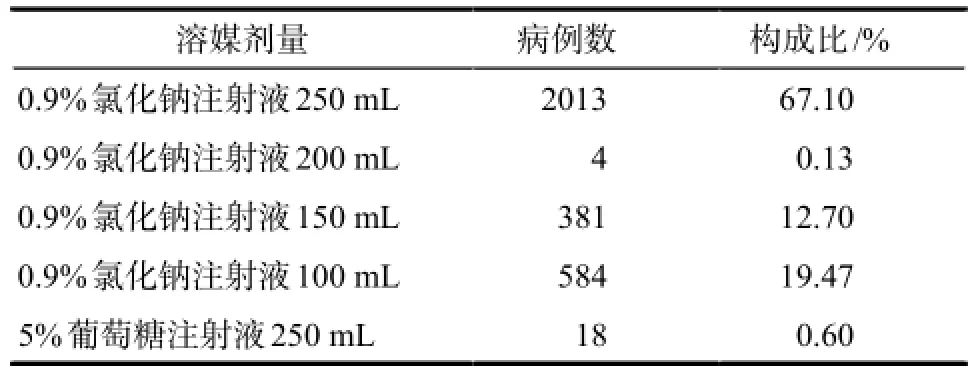
表1 苦碟子注射液溶媒使用情况Tab 1 The solvent utilization ofKudieziinjection
2.2.3用药天数 苦碟子注射液14 d为一个疗程,患者平均用药(8.23±6.76)d,具体情况详见表2。
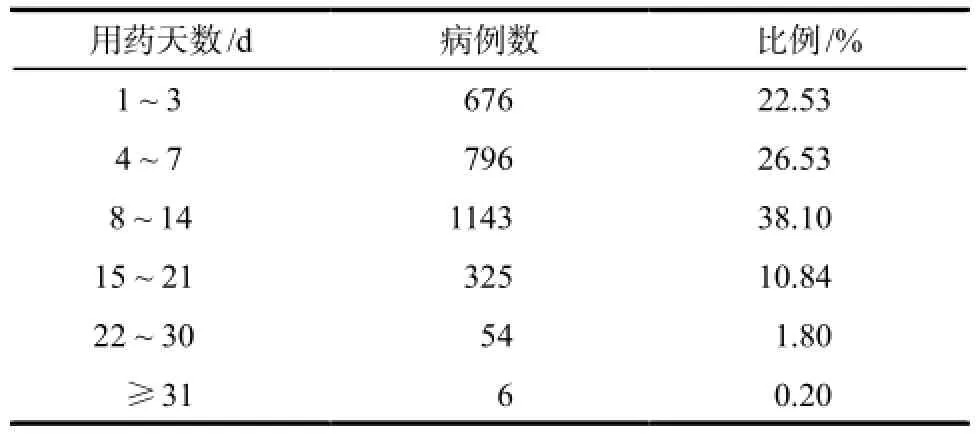
表2 苦碟子注射液用药天数情况Tab 2 Statistics of utilization days aboutKudieziinjection
2.2.4停药原因 苦碟子注射液的停药原因主要有:出院(1869例)、好转(872例)、疗程结束(128例)、换药(101例)、不良反应(3例)、死亡(1例)、其他原因(26例)。
2.3 联合用药情况
多中心统计的3000例患者多数伴有其他原患疾病,如高血压、冠心病等,因此苦碟子注射液在临床应用过程中常与其他药物联合使用,其中2915例患者采用联合用药的形式,主要的联合用药情况见表3。

表3 联合用药分布情况Tab 3 Distribution of drug combination
2.4 不良反应监测
多中心调查的3000例患者中,有3例在用药期间出现不良反应(表4),其中2例是说明书中提及的不良反应,1例说明书中未提及,无严重不良反应病历报告。3例病历报告中,均是用药2 d内发生ADR。原患疾病主要为缺血性脑血管病、眩晕综合征、高血压3级、高胆固醇血症等。
3 讨论
3.1 临床应用情况分析
苦碟子注射液的使用患者多为中老年人,年龄集中在40 ~ 80岁之间,性别比例接近1∶1;其药理作用为:扩张冠脉血管,改善心肌血氧供应,增加纤维蛋白溶解酶活性,抑制血栓形成[4]。3个临床科室使用苦碟子注射液的主要目的均为改善循环、抑制血小板聚集,治疗冠心病、心绞痛等病症,结果显示苦碟子注射液的应用基本符合药物功能主治和适应证。有805例患者为超剂量用药,使用剂量为50 mL,虽然未引起不良反应,但仍需规范用药剂量,以达到安全用药的目的;有87.16%的患者用药天数为1 ~ 14 d,谨遵医嘱,其中用药时间较长的患者多为病情反复的中老年人;停药原因基本明确,其中1例死亡原因可能与患者年龄较大,并患有多种疾病,与疾病进展有关,非使用苦碟子注射液造成。
3.2 不良反应情况分析
中药注射剂不良反应的判定,依照《药品不良反应报告和监测管理办法》[5]的标准, 3000例患者发生3例不良反应,发生率为0.1%,属偶见范畴,主要表现为左上肢肿胀、皮疹、呼吸困难,且症状不需要特殊处理,停药后即自行恢复,其中皮疹、呼吸困难为说明书中已知的不良反应,左上肢肿胀在说明书中未提及。文献[6]指出,由静脉注射给药途径所引起ADR的占78.56%,因此苦碟子注射液的3例不良反应与给药途径的关系有待于进一步研究。由图1可知,发生ADR的患者均为中老年人,这可能与其联合用药较多,损伤肝肾功能,使体内药动学参数改变,血药浓度维持在一个较高水平,促使中枢神经系统对多种药物敏感性增高有关。有学者认为老年人ADR发生率为中青年的25倍[7]。药品不良反应监测是医院药学服务的一项重要内容,临床药师应积极参与患者用药的跟踪调查,加强ADR的宣传,使全体医务人员掌握ADR的相关知识,促进ADR监测工作更好的开展,以确保临床安全、 有效、合理的用药[8]。

表4 苦碟子注射液不良反应发生情况Tab 4 Adverse reactions ofKudieziinjection
3.3 病例组与对照组的确定
病例与对照组匹配,要求对照组病例在某些因素或者特征上与原病例保持一致,目的是对两组进行比较时可以排除匹配因素的干扰[9],本次采用的为1∶R配比,根据前期小样本实验观察,该药不良反应发生率低,所以为每个病例选择4个对照,可同时研究不良反应的发生与多种因素之间的关系,为后续的研究提供数据支持。
总之,通过文献检索发现,国内关于苦碟子注射液的研究主要是其某种疗效或不良反应分析情况,尚未有对于苦碟子注射液多中心非干预前瞻性开放的临床安全性研究。吉林地区7家医院采用多中心前瞻性的方法对苦碟子注射液的应用情况及不良反应进行集中监测,能够更真实、更客观的评价上市后药品的安全性。集中监测方法可以弥补自发呈报系统的不足,统计特定药物在特定范围、时间或地点内的不良反应发生率,数据真实可靠,具有参考性。通过此次观察,结合2010年国家中医药管理局发布的《中成药临床应用指导原则》[10],为临床应用提供安全、合理的参考信息,初步形成一套中药注射剂安全性再评价模式,供今后的实践工作予以借鉴。
[1] 戴锦娜,尹然,陈晓辉,等.苦碟子化学成分和药理作用研究进展[J].西北药学杂志,2006,21(2):94-96.
[2] 王丹,沈璐.药品不良反应主动监测的方法与我国的应用[J].中国药物评价,2012,29(1):85-87.
[3] 杨军.丹红注射液四种上市后安全性评价方法的比较研究[D].郑州:郑州大学,2011.
[4] 王彩霞,赵强.苦碟子注射液的药理作用[J].实用药物与临床,2005,8(5):43-45.
[5] 卫生部药品不良反应监测中心.药品不良反应报告和监测管理办法[S].2004.
[6] 郭代红,陈超,马亮,等.2009 – 2013年军队医院67 826例药品不良反应报告分析[J].中国药物应用与监测,2014,11(5):300-304.
[7] 陈象青,方焱,陈礼明,等.关于中药注射剂及其安全性的思考[J].医学与哲学,2009,30(2):80-81.
[8] 陈静芬.我院270例药品不良反应报告分析[J].中国药物应用与监测,2010,7(1):40-42.
[9] 吕晓珍,詹思延.第四讲:病例对照研究[J].中国循证儿科杂志,2009,4(5):463-466.
[10] 卫生部.国家中医药管理局文件.中成药临床应用指导原则[S].国中医药医政发[2010]30号.
Application analysis and adverse reactions centralized monitoring of 3000 cases Kudiezi injection by non-intervention prospective multicenter open study
YU Qian1, ZHAO A-na2, FU Xiu-juan3(1. Department of Pharmacy, China-Japan Union Hospital of Jilin University, Changchun 130033, China; 2. Department of Pharmacy, the Central Hospital of Changchun, Changchun 130021, China; 3. Department of Pharmacy, the Second Hospital of Jilin University, Changchun 130041, China)
Objective:To re-evaluate the post-marketing safety of Kudiezi injection in seven hospitals of Jilin area, and provide references for the clinical use of drugs.Methods:Using the prospective centralized monitoring method of non-intervention in multicenter, 3000 cases used Kudiezi injection were observed from June 2012 to March 2014, the clinical application of the drug and the adverse reactions were analyzed.Results:The patients were mainly in the 40 – 80 years old, which was associated with the pharmacological effects of Kudiezi injection. About 26.83% of the patients were overdose use of drugs, although no adverse reaction was found in those patients, overdose use of drugs should be paid attention to. Indications of the drug comply with the package insert and the compare the reasons for withdrawal of drug were clear. One death case was associated with disease progression and advanced age; three cases of adverse reactions occurred in 3000 cases of patients, adverse reaction rate was 0.1%.Conclusion:Reasonable clinical application of Kudiezi injection should be strengthened, such as avoiding overdose use of drug, strengthening the monitoring of adverse reactions and reducing the incidence of adverse reactions. The safety re-evaluation model of traditional Chinese medicine injection was initially established, which can provide experience for future practice.
Kudiezi injection; Safety; Evaluation; Prospective centralized monitoring; Adverse reaction
R969.3
A
1672 – 8157(2015)03 – 0167 – 04
2014-12-22
2015-03-18)
吉林省食品药品安全监测中心项目(2012)科技字(3193)号
付秀娟,女,主任药师,主要从事医院药学及药事管理工作。E-mail:fxj462003@163.com
于倩,女,主任药师,主要从事医院药学及药事管理工作。E-mail:819389186@qq.com

