早期糖尿病肾病患者血清尿酸水平与肾小球滤过率的相关性研究
张莉 朱翠颜 王筱菁 邢晓欢 黎雅清 林健才
临床研究论著
早期糖尿病肾病患者血清尿酸水平与肾小球滤过率的相关性研究
张莉 朱翠颜 王筱菁 邢晓欢 黎雅清 林健才
目的分析糖尿病肾病(DKD)1~3期患者血清尿酸水平与肾小球滤过率估计值(eGFR)的关系,探讨血清尿酸在诊断早期DKD的应用价值。方法纳入2型糖尿病患者中已确诊合并DKD的239例患者(A组)、正常健康人228名(B组),2组受检者的eGFR均≥30 ml/(min ·1.73 m2),并按DKD分期将A组分为A1组(DKD 1期)96例、A2组(DKD 2期)101例、A3组(DKD 3期)42例。比较各组及各亚组间血清尿酸水平,分析A、B组各自血清尿酸水平与eGFR的相关性。结果A、B组间eGFR比较差异无统计学意义(P>0.05),A组血清尿酸水平高于B组(P <0.01);A1~3组间血清尿酸比较差异有统计学意义(P<0.05),并且随DKD分期呈上升趋势(P <0.05)。A、B组中,血清尿酸与eGFR均有良好相关性(P<0.01),多重线性回归显示,血清尿酸是DKD患者eGFR下降的危险因素(P<0.01)。结论高血清尿酸与早期DKD的eGFR异常相关,是其危险因素之一,提示尿酸可能参与DKD早期肾损害的发生、发展。
2型糖尿病;糖尿病肾病;血清尿酸;肾小球滤过率
糖尿病肾病(DKD)是2型糖尿病(T2DM)最严重的微血管并发症之一,据统计,近1/3的糖尿病患者可发展至DKD,越早期发现并予合理干预治疗可以延缓甚至减少终末期肾脏病(ESRD)的发生。大量研究已证实高血尿酸在DKD的发生、发展中起重要作用,甚至为启动因素[1]。本研究分析了合并早期DKD患者血清尿酸水平与肾小球滤过率估计值(eGFR)的相关性,旨在探讨血清尿酸在诊断早期DKD的应用价值,现报告如下。
对象与方法
一、研究对象
2011年10月至2014年7月在我院住院的早期DKD的239例患者(A组),均符合1999年WHO关于2型糖尿病的诊断标准,并排除1型糖尿病、继发性糖尿病及DKA、高渗性昏迷等其他糖尿病急性并发症。其中男125例,女114例,年龄26 ~90岁。另选取2011年5月至2014年7月在我院体检的空腹及餐后2 h血糖均正常的健康人228名(B组),其中男113名,女115名,年龄20~77岁。2组eGFR均≥30 ml/(min·1.73 m2)。按2012年NKF-KDOGI指南[2]根据eGFR将A组分为A1~A3 3个亚组:A1组eGFR≥90 ml/(min· 1.73 m2);A2组eGFR 60~89 ml/(min·1.73 m2);A3组eGFR 30~59 ml/(min·1.73 m2);根据该指南,DKD 1~3期[eGFR≥30 ml/(min ·1.73 m2)]为早期DKD。所有研究对象均排除有可能引起血清尿酸继发性升高疾病的患者(白血病、红细胞增多症、多发性骨髓瘤、甲状腺疾病、尿崩症、恶性肿瘤等)。所有患者近1个月未使用利尿剂、别嘌呤醇、环孢素、抗结核药物及其他已知影响尿酸代谢的药物。本研究获医院伦理委员会批准,并征得患者知情同意。
二、方法
记录所有参与者的性别、年龄、糖尿病病程(A组)、吸烟史、身高、体质量,计算体表面积、BMI。禁食8~12 h后,于清晨采静脉血,检测血清尿酸、胱抑素C、同型半胱氨酸(Hcy)、血清肌酐、GHbA1c、餐后2 h血糖(PPG)、空腹C肽、餐后2 h C肽(C肽-2 h)、总胆固醇、甘油三酯、HDL-C、LDL-C、总三碘甲状腺原氨酸(TT3)、FT3、总甲状腺素(TT4)、FT4、促甲状腺素(TSH)、尿白蛋白;留取晨尿及24 h尿检测尿白蛋白、尿蛋白。血清尿酸的测定采用尿酸酶-过氧化物酶偶联法;胱抑素C的测定采用快速自动化的颗粒增强透射免疫比浊法;肾动态显像采用美国GE公司Infinia VC Hawkeye AC双探头SPECT/CT,99Tcm-DTPA由广东希埃医药有限公司提供,放化纯度>95%。患者显像前30 min常规饮水300 ml,弹九式注射99Tcm-DTPA后在SPECT显像仪上行肾功能检查,用Gate's法计算双肾及分肾的eGFR值,并用体表面积[Stevenson公式,体表面积=0.0061×身高(cm)+0.0128×体质量(kg)-0.1529]校正[3]。
三、统计学处理
结 果
一、A组与B组受检者的临床资料比较
A组与B组受检者的eGFR、性别构成、年龄、吸烟史、BMI、收缩压、舒张压、HCY、胱抑素C、甘油三酯、LDL-C、HDL-C、血清白蛋白比较差异无统计学意义(P>0.05),血清肌酐、血清尿酸、尿蛋白、空腹血糖、PPG、GHbA1c、空腹C肽、C肽-2 h、总胆固醇比较差异有统计学意义(P<0.05)。其中A组血清尿酸水平明显高于B组(P<0.01),见表1。
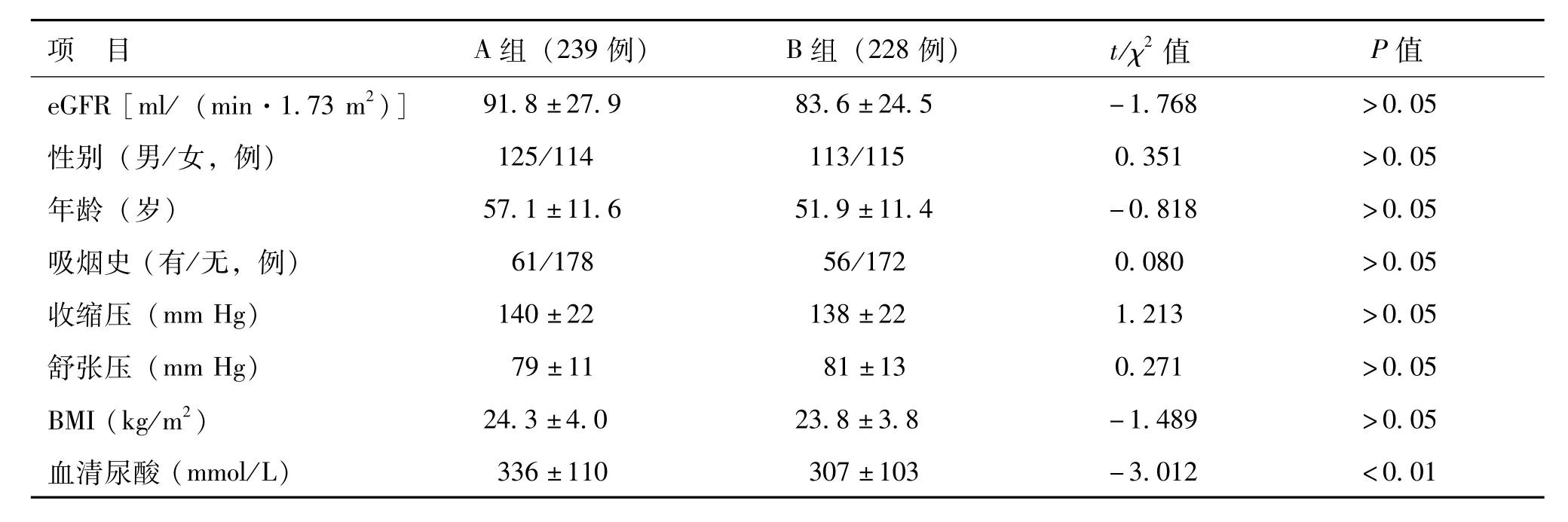
表1 A组与B组受检者的临床资料比较
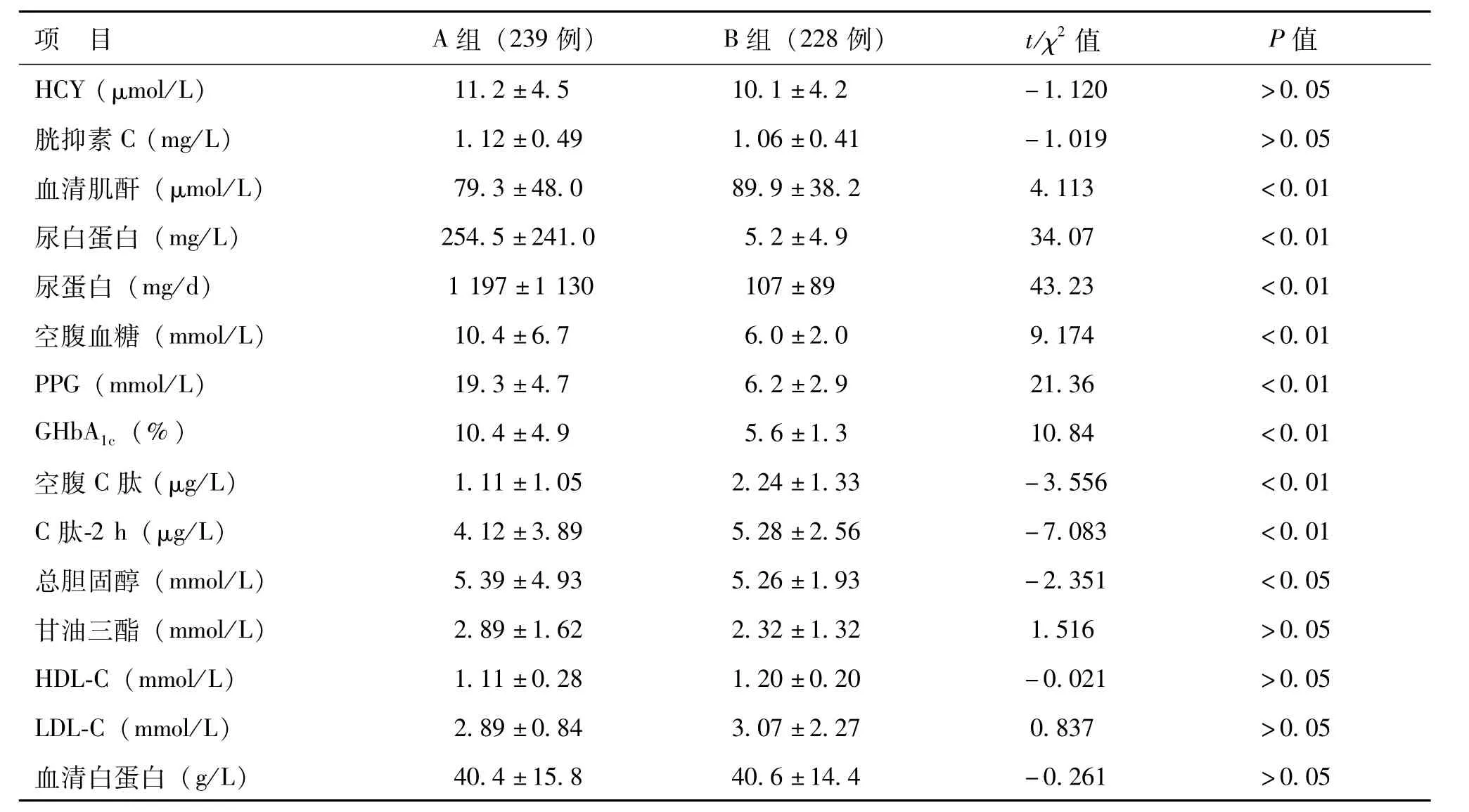
续表
二、A组各亚组DKD患者的临床资料比较
A1~3组DKD患者间性别构成、吸烟史、舒张压、HCY、胱抑素C、空腹血糖、PPG、GH-bA1c、空腹C肽、C肽-2 h、总胆固醇、HDL-C、LDL-C、血清白蛋白比较差异均无统计学意义(P>0.05),BMI、收缩压、血清肌酐、尿白蛋白在A1与A3组、A2与A3组间比较差异有统计学意义(P<0.05),3组的年龄、病程、血清尿酸、尿蛋白、甘油三酯比较差异均有统计学意义(P<0.05),并且血清尿酸的平均水平随着DKD分期增加而升高,见表2。
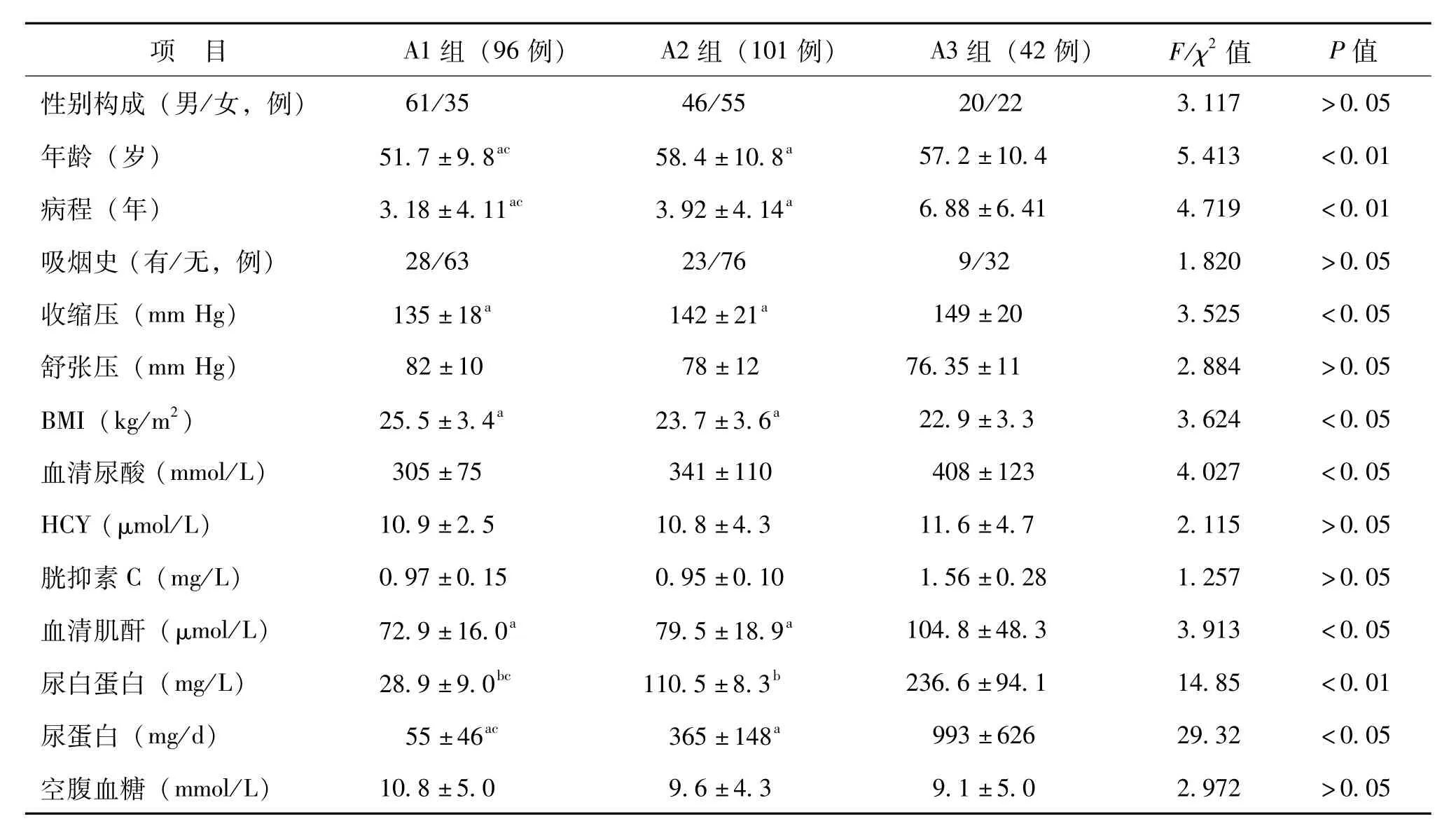
表2 A1~3组DKD患者的临床资料比较
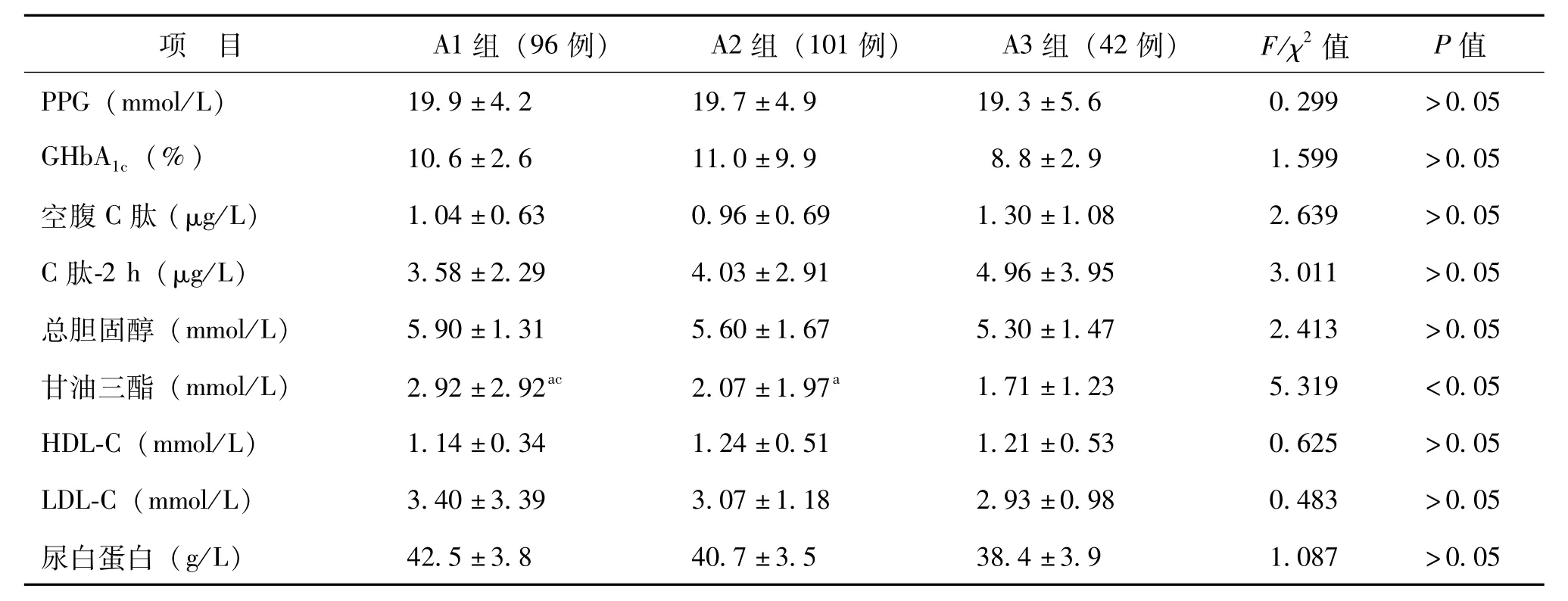
续表
三、A组与B组受检者的eGFR与各指标相关性分析
A组DKD患者中年龄、病程、收缩压、BMI、血清肌酐、血清尿酸、尿蛋白、空腹血糖、GH-bA1c、总胆固醇、甘油三酯与eGFR有关(P<0.05)。B组健康人群的年龄、血清肌酐、血清尿酸、总胆固醇与eGFR有关(P<0.05)。2组的血清尿酸与eGFR均呈负相关(P均<0.01),见表3。
四、A组与B组中eGFR的回归结果
以eGFR为因变量,以经过单因素分析有意义的指标为自变量进行多重线性回归,结果显示,A组中年龄、血清肌酐、尿蛋白、血清尿酸均是其影响因素(P均<0.05),见表4;而B组排除血清尿酸后,高龄、高血清肌酐、高总胆固醇是其危险因素(P<0.05),见表5。
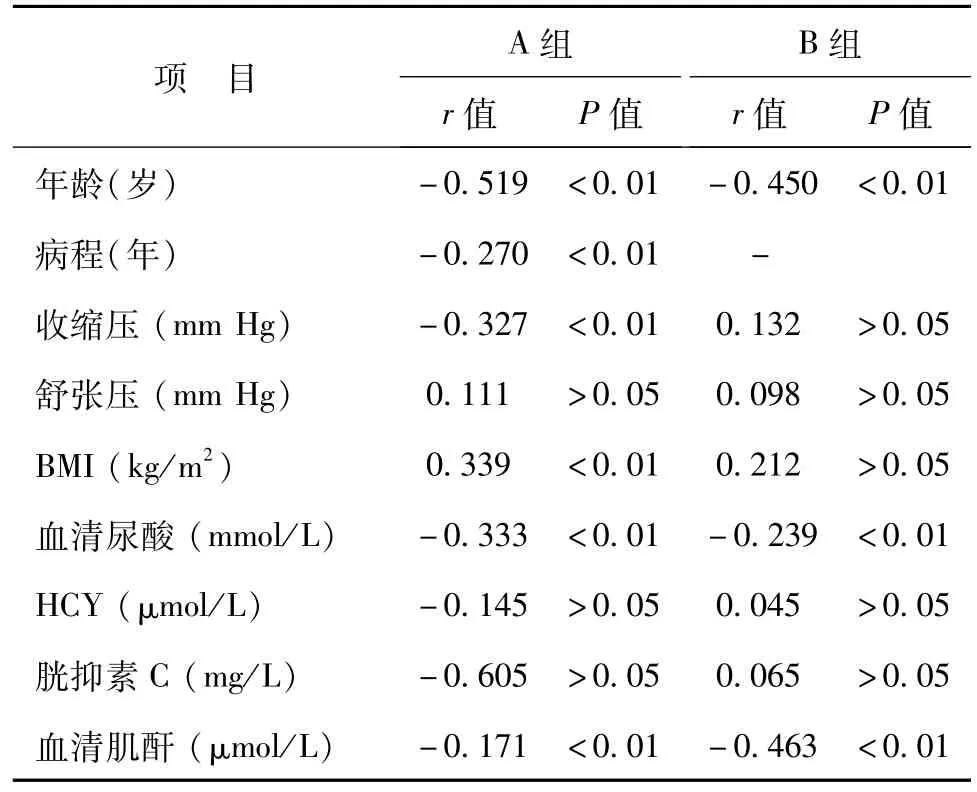
表3 A组与B组受检者的eGFR与各指标相关性分析
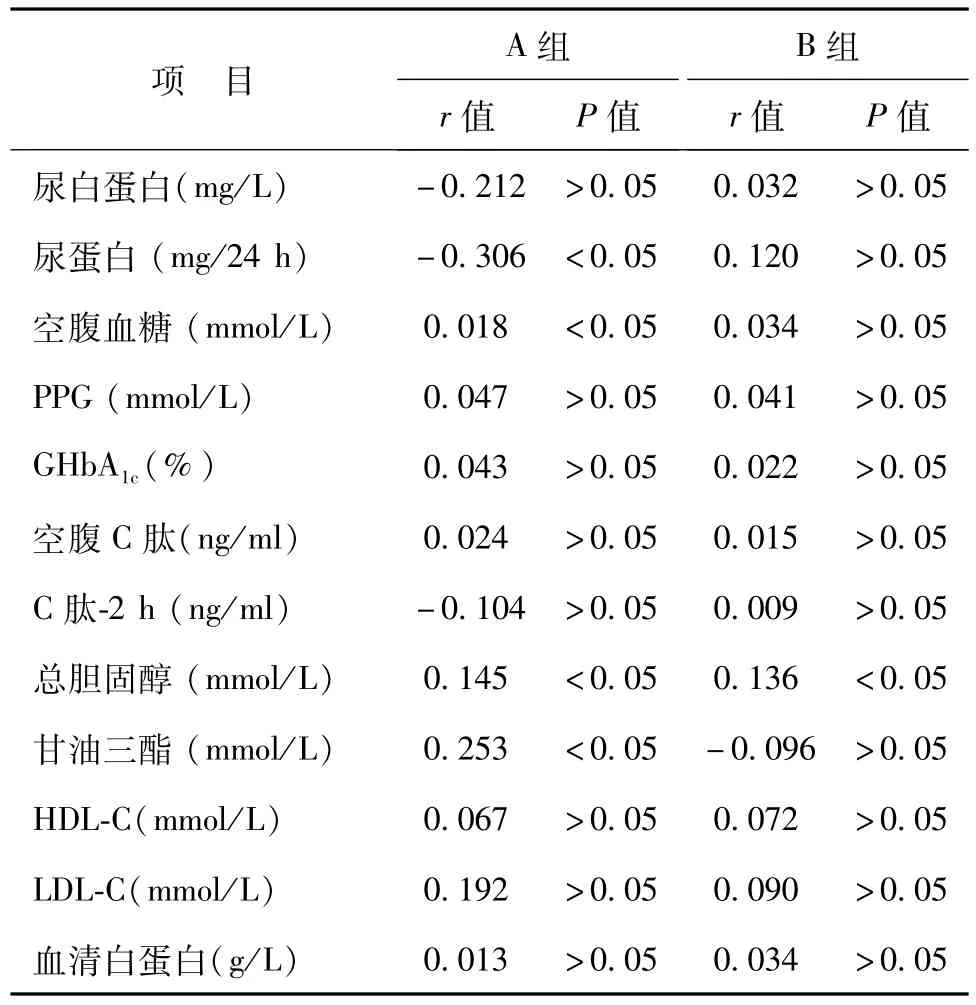
续表
讨 论
DKD的发生与进展是多因素综合作用的结果,包括糖代谢紊乱、肾脏血流动力学的改变、多种细胞因子参与以及遗传背景影响等,本研究多重线性回归显示,A组DKD早期病变指标eGFR与年龄、血清肌酐、尿蛋白、血清尿酸呈负相关,与BMI呈正相关。
eGFR是国际公认诊断DKD以及DKD分期的金标准,但由于放射性污染、价格、设备等因素限制了临床应用。目前临床常规使用血清肌酐等反映肾损害情况,但研究发现血清肌酐受人种、年龄、性别构成、肌肉量、饮食等因素影响,在肌肉量少的人群如女性及老年患者中GFR在50 ml/min以下时血清肌酐仍可在正常范围[4]。本研究中,血清肌酐仅在A1与A3组、A2与A3组间比较有统计学意义,A1、A2组中尚处于正常水平,A3组则明显升高,提示血清肌酐在eGFR≤60 ml/(min· 1.73 m2)时才出现异常,不能反映T2DM早期(DKD 1期及2期)的肾功能变化。
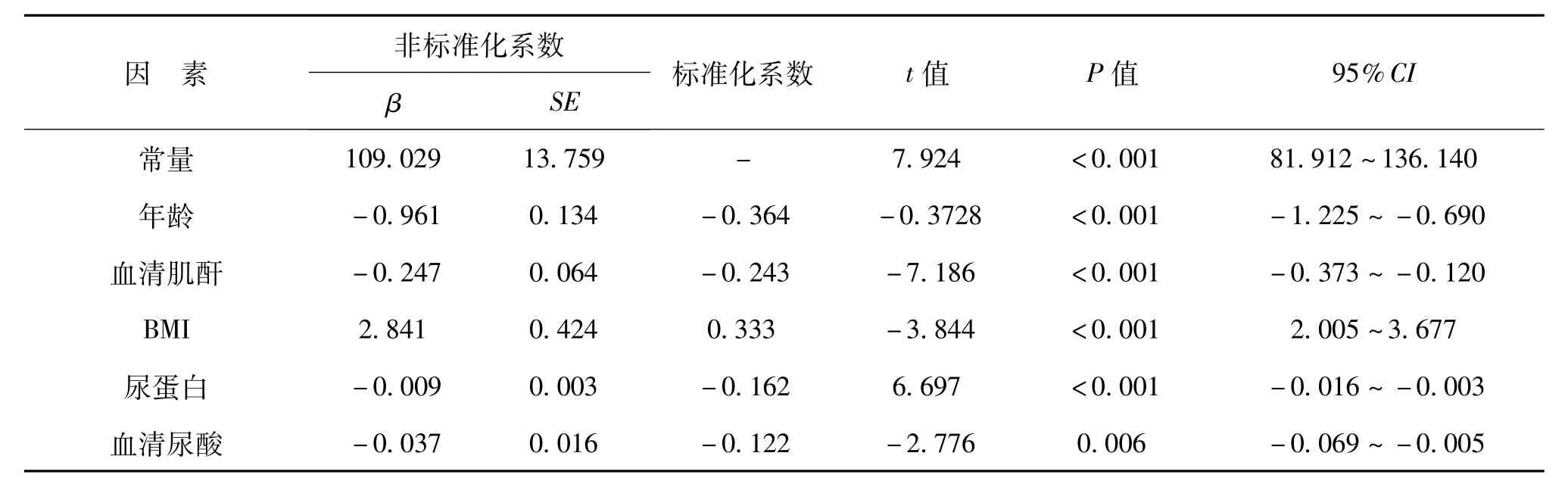
表4 A组DKD患者eGFR影响因素的多因素回归结果
已有研究表明,血清尿酸在DKD的发生、发展中起重要作用,甚至为其启动因素,即使血清尿酸仍处于正常水平[5-6]。这可能与氧化应激、尿酸盐沉积等机制有关[7]。血清尿酸可更直观地预测GFR下降水平[8]。本研究表明,A、B组间eGFR比较差异无统计学意义,而A组的血清尿酸水平高于B组,与代谢综合征人群血清尿酸水平更高这一结论相符[9]。血清尿酸在A、B组中与eGFR均呈负相关,但多重线性回归结果显示,在B组中血清尿酸不是eGFR的危险因素。本研究发现,在DKD 1~3期3个亚组中血清尿酸比较差异均有统计学意义,并且呈逐渐上升的趋势。有研究表明,血清尿酸急性升高对机体有抗氧化保护作用,慢性升高尤其在高于正常时则表现为促氧化作用[10]。尿白蛋白是临床上传统的评价DKD的指标之一,但UKPDS研究发现有51%的T2DM患者无白蛋白尿改变已发展成慢性肾功能不全[11]。本研究亦显示,尿白蛋白仅在A1与A3组、A2与A3组间比较差异有统计学意义,与血清肌酐表现类似,因此,尿白蛋白同样不能反映DKD 1~2期中eGFR的改变。
综上所述,在早期DKD人群中,血清尿酸与eGFR可能存在一定的相关关系,并且有可能直接参与早期DKD的发生和发展,是其危险因子之一。因此,血清尿酸在评估eGFR、诊断早期DKD有一定的诊断价值,有望成为一个简单而有效的评估因子。合并高尿酸血症的患者应尽早进行临床干预,如降尿酸药物治疗。对于老年、病程长的患者,即使血清尿酸正常,也应提倡减少富含尿酸的食物如海鲜及酒精类的摄入,这或对早期DKD肾功能保护有重要意义。
[1]刘洁,王战建.2型糖尿病患者血尿酸水平与肾脏损害的相关性研究.中华临床医师杂志:电子版,2013,7:5794-5797.
[2]National Kidney Foundation.KDOQI Clinical Practice Guideline for Diabetes and CKD:2012 Update.Am J Kidney Dis,2012,60:850-886.
[3]吴哈,石洪成.Gate's法测定肾小球滤过率及其影响因素.国际放射医学核医学杂志,2009,33:132-135.
[4]V Oláh A,Fodor B,Horváth A.Challenge and limitations in determination of serum creatinine.Orv Hetil,2008,149:317-323.
[5]Rosolowsky ET,Ficociello LH,Maselli NJ,et al.High-normal serum uric acid is associated with impaired glomerular filtration rate in nonproteinuric patients with type 1 diabetes.Clin J Am Soc Nephrol,2008,3:706-713.
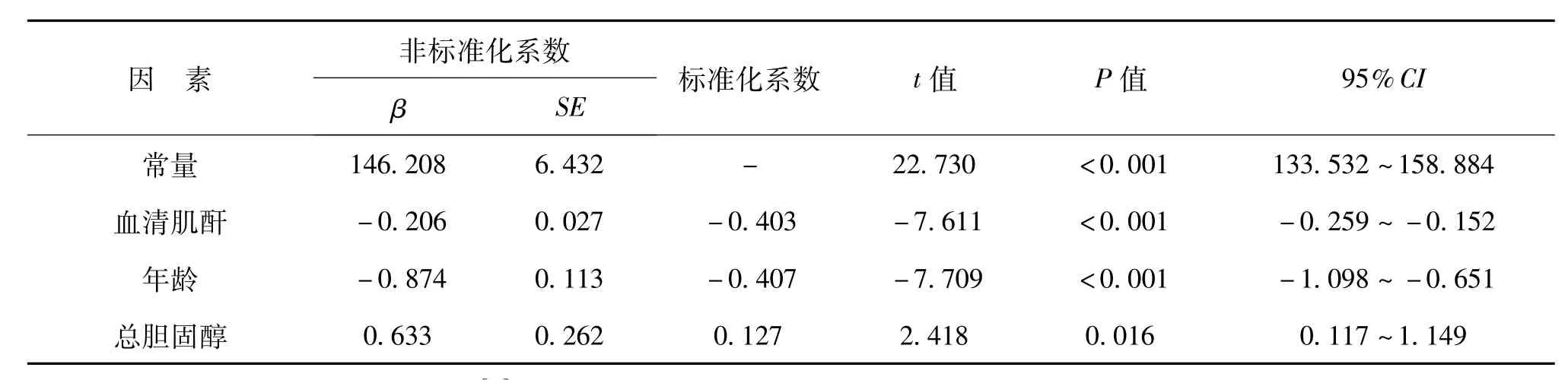
表5 B组健康人群eGFR影响因素的多因素回归结果
[6]Zoppini G,Targher G,Chonchol M,et al.Serum uric acid levels and incident chronic kidney disease in patients with type 2 diabetes and preserved kidney function.Diabetes Care,2012,35:99-104.
[7]汪开琳,梁干雄.2型糖尿病患者血尿酸水平与糖尿病肾病关系的研究进展.海南医学,2013,24:576-578.
[8]Ito H,Abe M,Mifune M,et al.Hyperuricemia is independently associated with coronary heart disease and renal dysfunction in patients with type 2 diabetes mellitus. PLoS One,2011,6:e27817.
[9]赵海萍,宋辉,刘贺荣,等.血尿酸与代谢综合征关系的研究.中国糖尿病杂志,2012,20:572-575.
[10]de Oliveira EP,Burini RC.High plasma uric acid concentration:causes and consequences.Diabetol Metab Syndr,2012,4:12.
[11]Macisaac RJ,Ekinci EI,Jerums G.Markers of and risk factors for the development and progression of diabetic kidney disease.Am J Kidney Dis,2014,63:S39-S62.
Correlation between serum uric acid and glomerular filtration rate in T2DM patients with early stages of diabetic kidney disease
Zhang Li,Zhu Cuiyan,Wang Xiaojing,Xing Xiaohuan,Li Yaqing,Lin Jiancai.Department of Endocrinology,Jiangmen Hospital of Sun Yat-sen University,Jiangmen 529030,China
ObjectiveTo analyze the relationship between serum uric acid(SUA)and estimated glomerular filtration rate(eGFR)in type 2 diabetes mellitus(T2DM)patients with stages 1-3 of diabetic kidney disease(DKD)and evaluate the diagnostic value of SUA in early DKD.MethodsIn total,231 T2DM patients complicated with DKD were assigned into group A and 228 healthy controls in group B.All participants presented with eGFR≥30 ml/(min·1.73 m2).Patients in group A were sub-grouped into A1(stage DKD-1,n=96),A2(stage DKD-2,n=101)and A3(stage DKD-3,n=42)groups according to DKD staging.The SUA levels were statistically compared and the correlation between SUA and eGFR was analyzed among different groups and sub-groups.ResultseGFR did not significantly differ between groups A and B(P >0.05),whereas SUA level in group A was significantly higher compared with that in group B(P<0.01). The SUA levels significantly differed among subgroups A1,A2 and A3(P<0.05)and were elevated along with DKD staging(P<0.05).In both groups A and B,SUA level was significantly correlated with eGFR (both P<0.01).Multiple linear regression analysis revealed that SUA was a risk factor for eGFR impairment in DKD patients(P<0.01).Conclusions SUA is related to the abnormity of eGFR during early DKD and acts as one of the independent risk factors,prompting that SUA probably participates in the incidence and development of renal damage during early stage of DKD.
Type 2 diabetes mellitus;Diabetic kidney disease;Serum uric acid;eGFR
2014-11-20)
(本文编辑:林燕薇)

10.3969/g.issn.0253-9802.2015.04.013
529030江门,中山大学附属江门医院江门市中心医院
,林健才,E-mail:jmsl169@126.com

