低表达miR-33a诱导胰腺癌细胞对吉西他滨的耐药
复旦大学附属肿瘤医院肿瘤研究所,复旦大学上海医学院肿瘤学系,上海 200032
低表达miR-33a诱导胰腺癌细胞对吉西他滨的耐药
梁晨,王瑧,李影奕
复旦大学附属肿瘤医院肿瘤研究所,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:胰腺癌是一种恶性程度很高的肿瘤。由于其对一线化疗药物吉西他滨的耐受,往往导致预后较差。MicroRNA(miRNA,miR)是一类非编码小RNA,参与肿瘤的多种生物学功能。miR-33a作为代谢相关的miRNA被广泛研究,而与耐药之间关系的报道较少。该研究通过探讨miR-33a参与胰腺癌吉西他滨耐药及其作用解析,为胰腺癌化疗提供新的理论依据。方法:采用原位杂交方法检测胰腺癌组织中miR-33a的表达情况;采用实时荧光定量PCR(Real-time PCR)检测各胰腺癌细胞系中miR-33a的表达情况。利用SW1990和Miapaca-2胰腺癌亲本细胞株,构建吉西他滨耐药细胞株(SW1990res,Miapaca-2res)及miR-33a稳定表达细胞株(SW1990-miR-33a,Miapaca-2-miR-33a、SW1990res-miR-33a和Miapaca-2res-miR-33a);采用细胞毒性实验检测miR-33a的表达对胰腺癌细胞对吉西他滨敏感性的影响。结果:miR-33a在胰腺癌组织样本中普遍低表达。与HEK293T正常人胚肾细胞相比,其在各胰腺癌细胞系中均呈低表达。miR-33a过表达可以增加胰腺癌细胞对吉西他滨的药物敏感性,能有效逆转胰腺癌细胞对吉西他滨的耐药。结论:miR-33a在胰腺癌组织中低表达,导致胰腺癌患者对吉西他滨获得性耐药。增加miR-33a表达,从而增强了胰腺癌细胞对吉西他滨的药物敏感性,为开发新型胰腺癌分子靶向治疗药物,联合化疗提供新的理论依据。
miR-33a;胰腺癌;吉西他滨耐药
胰腺癌是一类恶性程度很高的肿瘤,病死率居恶性肿瘤的第4位[1]。目前,胰腺癌的5年总生存率<5%,并且中位生存期<1年[2]。吉西他滨作为胰腺癌化疗的一线药物用于临床已经有十几年,但是大部分胰腺癌患者会出现对吉西他滨的耐药,最终导致化疗失败[2-3]。近期有研究[4-5]发现通过调控吉西他滨在细胞内的代谢,诱导耐药的发生,但其耐药的分子机制还不完全清楚。因此,探讨胰腺癌对吉西他滨耐药的分子生物学机制,对于胰腺癌的个体化治疗及预后评估具有重要的价值。
MicroRNA(miRNA,miR)是一类长约22个碱基的非编码小RNA。它们可以在转录后对其靶基因进行沉默调控,从而发挥癌基因或抑癌基因的作用[6-8],并且miRNA的表达失调也参与了胰腺癌细胞的增殖、转移、化疗耐药和肿瘤的预后评估[6-9]。miR-33a作为脂质代谢重要的调节分子被广泛报道[10-11],其与肿瘤之间的关系也越来越受到研究者的关注,但是目前其与吉西他滨耐药的关系研究较少。本研究通过探讨miR-33a参与胰腺癌吉西他滨耐药及其作用解析,为胰腺癌化疗提供新的理论依据。
1 材料和方法
1.1 细胞系
人类胰腺癌细胞株PCI55是由日本金泽大学肿瘤研究所惠赠,其余胰腺癌细胞株均购自于美国模式培养物保藏所(American Type Culture Collection,ATCC)。其中,人胰腺癌细胞株PCI55、Miapaca-2和PANC-1培养于含10%胎牛血清的RPMI-1640培养基中培养,置于37 ℃、CO2体积分数为5%的培养箱中培养。Capan-1、SW1990和人胚肾HEK293T细胞培养于含10%胎牛血清的DMEM培养基中,置于37 ℃、CO2体积分数为5%的培养箱中培养(培养基和血清均购自Biosera公司)。
1.2 锁核酸原位杂交(locked nucleic acidin situhybridization,LNA-ISH)检测
人胰腺癌组织来自复旦大学附属肿瘤医院,并且经过患者知情同意。组织经过脱蜡,于37 ℃用蛋白酶K消化15 min,随后通过梯度酒精脱水。250 nmol/L的5’-和3’-端用地高辛双标记的miR-33a探针(序列为:5’-Dig_ N-TGCAATGCAACTACAATGCAC-Dig_N-3’;购自丹麦Exiqon公司)50 ℃杂交过夜。随后依次用5×SSC、1×SSC和0.2×SSC缓冲液彻底清洗切片。再用封闭液封闭30 min,然后用碱性磷酸酶标记的抗地高辛抗体在37 ℃温育30 min,再通过NBT/BCIP作为碱性磷酸酶的底物,37 ℃反应120 min,产物显示为深蓝色,最后用核固红染核,封片,显微镜下观察。本研究采用5S rRNA探针或灭菌蒸馏水代替miR-33a探针,分别作为阳性对照和阴性对照。原位杂交结果判断:miR-33a的表达由阳性细胞的数量和阳性强度来评分,阳性细胞数量(<5%为0分;5%~50%为1分;>50%为2分),阳性强度(无色为0分;淡蓝色为1分;蓝紫色为2分),2者评分相乘,0分定为阴性,1~2分定为低表达,3~4分定为高表达。
1.3 实时荧光定量PCR(Real-time PCR)检测
利用TRIzol(购自美国Invitrogen公司)提取细胞中总的RNA,用PrimeScript RT Reagent Kit[购自宝生物工程(大连)有限公司]将RNA反转录成cDNA。再用SYBR®Premix Ex Taq™Ⅱ,ROX Reference Dye[购自宝生物工程[(大连)有限公司],按照产品说明书进行Real-time PCR检测。U6 snRNA引物序列上游为5’-CTCGCTTCGGCAGCACA-3’;下游为5’-AACGCTTCACGAATTTGCGT-3’,由生工生物工程(上海)股份有限公司合成。miR-33a的引物购自广州锐博生物科技有限公司。通过ΔΔCt方法计算目的基因的相对表达量,结果以±s 表示。
1.4 胰腺癌吉西他滨耐药细胞系建立
采用间歇浓度梯度倍增法诱导建立胰腺癌耐药细胞株SW1990res和Miapaca-2res。具体过程:在6孔板中分别接种4×104个的SW1990和Miapaca-2细胞,至对数生长期,加入吉西他滨,使其在SW1990的培养基中终浓度为0.25 μmol/L,而对Miapaca-2的终浓度为0.5 μmol/L。在培养箱内共同培养48 h后,弃含药培养液。待存活细胞长至80%传代2次,再重复同一剂量的药物培养;至较稳定后,依次递增每次使用药物浓度,直至其对高浓度的吉西他滨产生稳定耐药性(SW1990res和Miapaca-2res两细胞株对吉西他滨稳定耐受的最高浓度分别是32和64 μmol/L),并且在无药培养液中以及反复冻存后耐药性依然保持稳定。
1.5 利用慢病毒构建miR-33a的稳定表达细胞株
将人类miR-33a序列(GUGCAUUGUA GUUGCAUUGCA)插入到慢病毒表达载体pCDH-CMV-copGFP中,构建成miR-33a过表达质粒。使用LipofectamineTM2000(购自美国Life Technologies公司)将pCDH-CMV-copGFP-miR-33a表达质粒与病毒包装质粒ps-PAX2和pMD2.G共转染至HEK293T细胞中,转染后48 h收集病毒液。将收集得到的病毒液分别感染SW1990、SW1990res、Miapaca-2和Miapaca-2res胰腺癌细胞,并在培养基中加入8 μg/mL polybrene(购自美国Sigma公司)。感染48 h后收集细胞,通过流式细胞仪分选最终获得miR-33a稳定表达细胞株SW1990-miR-33a、SW1990resmiR-33a、Miapaca-2-miR-33a和Miapaca-2res-miR-33a。
1.6 吉西他滨半数抑制浓度(IC50)检测
取对数生长期的胰腺癌细胞,按1×104个/孔接种于96孔板中,每孔100 μL,贴壁培养24 h后吸出培养基。以培养基稀释吉西他滨贮液配制不同浓度的吉西他滨,然后每孔分别加入相应培养基100 μL,每个浓度设置6个复孔;同时设置无药物的细胞对照组和无细胞的空白对照组。处理48 h后,每孔加入10 μL CCK-8[东仁化学科技(上海)有限公司]溶液,37 ℃温育2 h,在酶标仪450 nm波长下测定吸光度(A)值。计算并绘制药物剂量—存活率曲线,利用GraphPad PRISM 5.0软件计算IC50。实验重复3次。
1.7 统计学处理
2 结 果
2.1 miR-33a在胰腺癌组织中低表达
本研究收集了40例胰腺癌患者的肿瘤组织标本,通过原位杂交技术检测miR-33a的表达情况。与阳性对照和阴性对照相比较,结果发现,miR-33a在胰腺癌的癌旁组织和癌组织中均表达,并且,miR-33a在胰腺癌的癌旁组织中高表达,在胰腺癌组织中普遍为低表达(47.5%)或阴性(30%),表明miR-33a在胰腺癌组织中的表达被抑制,提示miR-33a可能是一种抑制癌症的miRNA(图D)。
2.2 miR-33a在胰腺癌细胞系中低表达
本研究进一步检测了胰腺癌细胞系中miR-33a的表达水平。本研究分别提取了Capan-1、Miapaca-2、PANC-1、PCI55和SW1990各胰腺癌细胞株的总RNA,通过Real-time PCR检测发现,miR-33a在Capan-1细胞中表达量相对较低,在SW1990中表达量相对较高,但是各胰腺癌细胞系miR-33a的表达量均明显低于正常人胚肾HEK293T细胞(图2)。
2.3 miR-33a可以增强胰腺癌细胞对吉西他滨的敏感性
利用Miapaca-2和SW1990胰腺癌细胞构建了2株miR-33a的稳定过表达细胞株,分别是Miapaca-2-miR-33a和SW1990-miR-33a,并通过Real-time PCR证实了miR-33a在2株细胞株中过表达,提示稳定转染细胞株构建成功(图3A、B)。采用细胞毒性实验检测了miR-33a对胰腺癌细胞吉西他滨敏感性的影响,结果显示,SW1990和SW1990-miR-33a的IC50分别为500和200 nmol/L,可见miR-33a过表达细胞株,经吉西他滨处理后,细胞活力显著受到抑制,提示细胞过表达miR-33a可以增强其对吉西他滨的敏感性(图3C)。此外,亲本细胞株Miapaca-2的IC50为1 000 nmol/L,而Miapaca-2-miR-33a细胞的IC50为331 nmol/L,IC50也明显降低,说明经吉西他滨处理后,miR-33a过表达细胞株的细胞活力更容易受到抑制(图3D、E)。
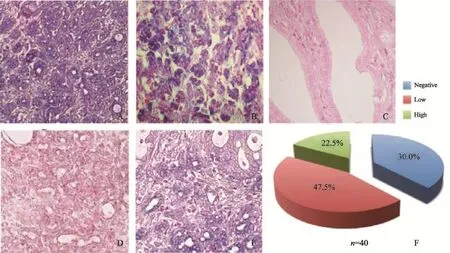
图1 原位杂交检测miR-33a在胰腺癌组织中的表达情况Fig. 1 Aberrant expression of miR-33a in human pancreatic cancer tissue detected by in situ hybridization
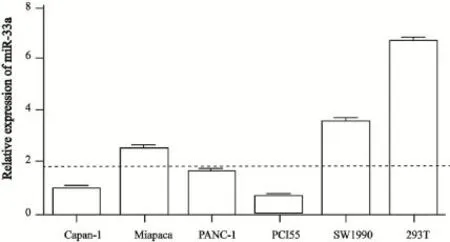
图2 miR-33a在各胰腺癌细胞系和HEK293T细胞中的表达情况Fig. 2 Expression profiling of miR-33a in human pancreatic cancer cell lines and HEK293T
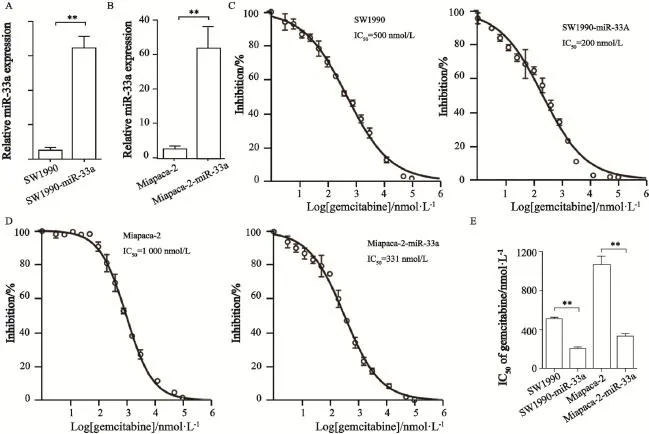
图3 miR-33a过表达可以增强胰腺癌细胞的吉西他滨的敏感性Fig. 3 Over expression of miR-33a could increase the chemosensitivity to gemcitabine in pancreatic cancer cells
2.4 miR-33a可以逆转胰腺癌细胞对吉西他滨耐药
为了考察miR-33a对吉西他滨耐药的影响,本研究构建了2株吉西他滨耐受的胰腺癌细胞系,分别是SW1990res和Miapaca-2res。SW1990res和Miapaca-2res耐药细胞的IC50分别是100和168 μmol/L,结合亲本细胞株SW1990和Miapaca-2对吉西他滨的IC50分别为0.5和1 μmol/L,由此计算得出耐药指数分别是200和168,提示成功建立胰腺癌吉西他滨耐药细胞株。Real-time PCR检测结果提示,在吉西他滨耐药的胰腺癌细胞株SW1990res和Miapaca-2res中,miR-33a的表达被进一步抑制(图4A)。由于前期研究结果显示,miR-33a可以增强胰腺癌细胞对吉西他滨的敏感性,所以我们进一步探讨miR-33a过表达能否逆转耐药细胞株对吉西他滨的耐药性。首先,构建稳定过表达miR-33a的SW1990res-miR-33a和Miapaca-2res-miR-33a细胞株。Real-time PCR检测结果显示,miR-33a稳定转染的耐药细胞株构建成功(图4B)。细胞毒性实验结果表明,miR-33a过表达耐药细胞株SW1990res-miR-33a和Miapaca-2res-miR-33a的IC50分别28和60 μmol/L,经吉西他滨处理后,IC50明显降低,细胞活力显著受到抑制,从而有效地逆转耐药细胞株对吉西他滨的耐受(图4C~E)。
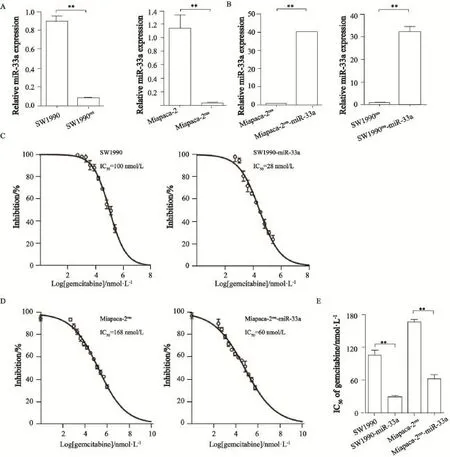
图4 miR-33a过表达可以逆转胰腺癌耐药细胞对吉西他滨的耐药Fig. 4 Over expression of miR-33a could reverse the gemcitabine resistance in resistant pancreatic cancer cells
3 讨 论
化疗耐受普遍发生在肿瘤治疗过程中,也是一些肿瘤患者治疗失败的重要原因。目前研究表明,胰腺癌耐药是由多种机制调控产生,参与获得性耐药的共同机制主要有以下几个方面:①Survival通路的激活是诱导耐药的重要机制之一[12];②药物排泄增加,如多药耐药基因1(MDR-1)所表达的p-gp是ATP依赖性转运体,可以将大部分药物在起效前排出细胞[13];③药物作用的下游分子发生过表达或突变,进而发生耐药[14]。吉西他滨作为细胞周期特异性药物,可以被代谢为具有活性的三磷酸核苷,与dCTP竞争掺入DNA链中,抑制DNA的复制,进而引起细胞凋亡[4]。吉西他滨目前仍被视为治疗胰腺癌最为有效的化疗药物之一,然而其化疗耐受是胰腺癌治疗过程中的一个重要障碍,并且其耐受的具体机制尚不清楚。因此,吉西他滨耐药机制作为胰腺癌研究的热点,有助于开发和完善胰腺癌的治疗方法。人类平衡型核苷转运体1(human equilibrative nucleoside transporter-1,hENT-1)的表达下降,限制了吉西他滨的细胞内摄取,是公认的体外耐药机制之一[15]。当吉西他滨被摄取进入细胞后,若脱氧胞苷激酶的活性丧失,将阻碍其转变为单磷酸盐,进而影响其合成活性形式,最终导致耐药的发生。核苷还原酶的过表达,同样通过抑制DNA的合成和修复参与吉西他滨的耐药过程[16]。此外,AKT依赖途径对于吉西他滨耐药也起到了重要作用[17]。
近年来,随着研究不断深入,发现miRNA与肿瘤的增殖、凋亡以及耐药有着密切的关系[9]。因此,在肿瘤的分子生物学研究中,miRNA作为一种非编码RNA得到了广泛关注,并且有望作为部分肿瘤的诊断和预后指标[18-19]。有报道[10]显示,miR-33a对胆固醇的合成和脂质代谢有着重要的调节作用,并且可以通过激活AKT的磷酸化,促进合成细胞外基质,导致肝硬化的形成[20]。但是它与肿瘤的关系目前研究较少,具体的作用机制也不完全清楚。Thomas等[21]发现,miR-33a在淋巴瘤、肝癌和结肠癌等多种肿瘤细胞中普遍低表达,并且发挥了抑癌基因的作用。在本研究中,同样发现miR-33a在各胰腺癌细胞中表达受到抑制,因此推测其在胰腺癌中也起到了一定抑癌作用。
有报道[11]显示,miR-33a可以通过下调TWIST的表达,促进骨肉瘤细胞发生顺铂耐药。然而,本研究结果发现,miR-33a在胰腺癌细胞中对吉西他滨有着一定的增敏作用。由于miRNA在不同的细胞中可以通过降解不同的靶基因发挥不同的生物学功能[22],所以miR-33a可能在胰腺癌中有特殊的靶基因,并且在胰腺癌细胞中对吉西他滨的增敏作用也具有一定的细胞特异性及组织特异性。有报道[23]显示,miR-33a有多个肿瘤相关靶基因,其中细胞周期蛋白依赖性激酶6(cyclindependent kinase 6,CDK6)就是一个重要靶基因,其通过下调CDK6影响细胞周期,抑制细胞增殖。Fang等[24]发现,miR-33a可以下调β-catenin的表达,进而负向调控Wnt信号通路。此外,miR-33a还可以下调Pim-1(一种肿瘤相关激酶)的表达,从而影响细胞增殖能力[21]。由于这些靶基因同样可以参与到肿瘤化疗的耐药过程中[14],所以,本研究推测,miR-33a可能在胰腺癌细胞中通过下调这些靶基因抑制细胞的增殖,进而增加细胞对吉西他滨的敏感性,但是具体机制还有待进一步的研究。
此外,miRNA的表达往往受到某些刺激调控,如乏氧等[25-26]。本研究发现,在胰腺癌耐药细胞中,miR-33a的表达水平明显低于亲本细胞,可能吉西他滨激活了细胞中的相关通路,进而对miR-33a的表达起到抑制作用,最终诱导细胞发生获得性吉西他滨耐药。但是经吉西他滨处理后诱导miR-33a表达抑制的具体机制尚需进一步研究,以阐明miR-33a与耐药的关系。
综上所述,miR-33a是胰腺癌中一种新型的吉西他滨增敏分子,可以有效逆转吉西他滨的耐药。利用其进行基因靶向治疗,可能为临床治疗难治性胰腺癌提供新的思路。
[1] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2012 [J] . CA Cancer J Clin, 2012, 62(1): 10-29.
[2] LI D, XIE K, WOLFF R, et al. Pancreatic cancer [J] . Lancet, 2004, 363(9414): 1049-1057.
[3] BURRIS H A 3rd, MOORE M J, ANDERSEN J, et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial [J] . J Clin Oncol, 1997, 15(6): 2403-2413.
[4] BERGMAN A M, PINEDO H M, PETERS G J. Determinants of resistance to 2’,2’-difluorodeoxycytidine (gemcitabine)[J] . Drug Resist Updat, 2002, 5(1): 19-33.
[5] ANDERSSON R, AHO U, NILSSON B I, et al. Gemcitabine chemoresistance in pancreatic cancer: molecular mechanisms and potential solutions [J] . Scand J Gastroenterol, 2009, 44(7): 782-786.
[6] ESQUELA-KERSCHER A, SLACK F J. Oncomirs -microRNAs with a role in cancer [J] . Nat Rev Cancer, 2006, 6(4): 259-269.
[7] CALIN G A, CROCE C M. MicroRNA signatures in humancancers [J] . Nat Rev Cancer, 2006, 6(11): 857-866.
[8] CALIN G A, CROCE C M. MicroRNA-cancer connection: the beginning of a new tale [J] . Cancer Res, 2006, 66(15): 7390-7394.
[9] SUN T, KONG X, DU Y, et al. Aberrant microRNAs in pancreatic cancer: Researches and clinical implications[J] . Gastroenterol Res Pract, 2014, 2014(386561.
[10] RAYNER K J, SUAREZ Y, DAVALOS A, et al. MiR-33 contributes to the regulation of cholesterol homeostasis [J] . Science, 2010, 328(5985): 1570-1573.
[11] ZHOU Y, HUANG Z, WU S, et al. miR-33a is up-regulated in chemoresistant osteosarcoma and promotes osteosarcoma cell resistance to cisplatin by down-regulating TWIST [J] . J Exp Clin Cancer Res, 2014, 33: 12.
[12] BORJA-CACHO D, JENSEN E H, SALUJA A K, et al. Molecular targeted therapies for pancreatic cancer [J] . Am J Surg, 2008, 196(3): 430-441.
[13] O’DRISCOLL L, WALSH N, LARKIN A, et al. MDR1/ P-glycoprotein and MRP-1 drug efflux pumps in pancreatic carcinoma [J] . Anticancer Res, 2007, 27(4B): 2115-2120.
[14] ISAAC M, SIU A, JONGSTRA J. The oncogenic PIM kinase family regulates drug resistance through multiple mechanisms[J] . Drug Resist Updat, 2011, 14(4-5): 203-211.
[15] MACKEY J R, MANI R S, SELNER M, et al. Functional nucleoside transporters are required for gemcitabine influx and manifestation of toxicity in cancer cell lines [J] . Cancer Res, 1998, 58(19): 4349-4357.
[16] NAKANO Y, TANNO S, KOIZUMI K, et al. Gemcitabine chemoresistance and molecular markers associated with gemcitabine transport and metabolism in human pancreatic cancer cells [J] . Br J Cancer, 2007, 96(3): 457-463.
[17] KIM M P, GALLICK G E. Gemcitabine resistance in pancreatic cancer: picking the key players [J] . Clin Cancer Res, 2008, 14(5): 1284-1285.
[18] LINDNER K, HAIER J, WANG Z, et al. Circulating microRNAs: emerging biomarkers for diagnosis and prognosis in patients with gastrointestinal cancers [J] . Clin Sci (Lond), 2015, 128(1): 1-15.
[19] SALIDO-GUADARRAMA I, ROMERO-CORDOBA S, PERALTA-ZARAGOZA O, et al. MicroRNAs transported by exosomes in body fluids as mediators of intercellular communication in cancer [J] . Onco Targets Ther, 2014, 7:1327-1338.
[20] LI Z J, OU-YANG P H, HAN X P. Profibrotic effect of miR-33a with Akt activation in hepatic stellate cells [J] . Cell Signal, 2014, 26(1): 141-148.
[21] THOMAS M, LANGE-GRUNWELLER K, WEIRAUCH U, et al. The proto-oncogene Pim-1 is a target of miR-33a [J] . Oncogene, 2012, 31(7): 918-928.
[22] LIANG C, LI Y Y. Use of regulators and inhibitors of Pim-1, a serine/threonine kinase, for tumour therapy (review) [J] . Mol Med Rep, 2014, 9(6): 2051-2060.
[23] CIRERA-SALINAS D, PAUTA M, ALLEN R M, et al. Mir-33 regulates cell proliferation and cell cycle progression [J]. Cell Cycle, 2012, 11(5): 922-933.
[24] FANG Y, FENG Y, WU T, et al. Aflatoxin B1 negatively regulates Wnt/beta-catenin signaling pathway through activating miR-33a [J] . PLoS One, 2013, 8(8): e73004.
[25] VAN ROOIJ E, SUTHERLAND L B, LIU N, et al. A signature pattern of stress-responsive microRNAs that can evoke cardiac hypertrophy and heart failure [J] . Proc Natl Acad Sci U S A, 2006, 103(48): 18255-18260.
[26] HUANG X, DING L, BENNEWITH K L, et al. Hypoxiainducible miR-210 regulates normoxic gene expression involved in tumor initiation [J] . Mol Cell, 2009, 35(6): 856-867.
Down regulation of miR-33a is involved in gemcitabine chemoresistance in human pancreatic cancer
LIANG Chen, WANG Zhen, LI Yingyi (Cancer Research Institute, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
LI Yingyi E-mail: liyingyi@fudan.edu.cn
Background and purpose:Pancreatic cancer is one of the most deadly human malignant neoplasms. Resistance to chemotherapeutic drugs is a major reason responsible for poor prognosis in the treatment of pancreatic cancer patients. MicroRNA (miRNA, miR) is a family of small non-coding RNA molecules, dysregulated miRNA is associated with various tumor biological function. miR-33a has been widely reported as a metabolismrelated miRNA, while its relationship with drug resistance has little understand. This study was focused on the effect of miR-33a on gemcitabine chemoresistance in pancreatic cancer to bring the novel theoretical basis to chemotherapy for pancreatic cancer.Methods:In situ hybridization and Real-time PCR were used to analyze the miR-33a expressions in pancreatic cancer tissue sample and cell lines, respectively. Cell counting kit 8 (CCK-8) assay was used to calculate the IC50value of different pancreatic cancer cells.Results:miR-33a was down-regulated in pancreatic cancer tissue and cell lines compared with para-cancerous tissues and normal HEK293T cells. Moreover, miR-33a over expression not only could enhance the chemosensitivity to gemcitabine in pancreatic cancer cells, but also rescue the gemcitabine resistance in pancreatic cancer cells.Conclusion:Down regulation of miR-33a in pancreatic cancer decreases the chemosensitivity to gemcitabine, resulting in development of acquired gemcitabine chemoresistance. It provides the theoretical basis to develop a new molecular targeted drug to combine with chemotherapy for pancreatic cancer.
miR-33a; Pancreatic cancer; Gemcitabine chemoresistance
10.3969/j.issn.1007-3969.2015.02.002
R735.9
A
1007-3639(2015)02-0087-08
2014-11-26
2015-01-20)
国家自然科学基金面上项目(30973476、81272727、81472223);上海市浦江人才计划(10PJ1402100)。
李影奕 E-mail:liyingyi@fudan.edu.cn

