针刺预处理对脑梗死大鼠细胞凋亡及炎性因子的影响*
秦彦强孙忠人张亚娟魏庆双姜 凡刘尚策
(1.黑龙江中医药大学,黑龙江 哈尔滨,150040;2.黑龙江省哈尔滨市第二医院,黑龙江 哈尔滨 150056)
·研究报告·
针刺预处理对脑梗死大鼠细胞凋亡及炎性因子的影响*
秦彦强1,2孙忠人1△张亚娟2魏庆双1姜 凡1刘尚策1
(1.黑龙江中医药大学,黑龙江 哈尔滨,150040;2.黑龙江省哈尔滨市第二医院,黑龙江 哈尔滨 150056)
目的探讨针刺预处理对脑梗死大鼠细胞凋亡及炎性因子的影响。方法采用改良Zea Longa方法制备大脑中动脉闭塞脑梗死(MCAO)模型,将90只大鼠随机分为正常组、假手术组、脑梗死组、缺血预处理组、针刺预处理组5组各18只,每组均分为1、3、7 d 3个亚组各6只。正常组不予特殊处理;假手术组只切开皮肤,暴露颈总动脉、颈内外动脉,不插入线栓;脑梗死组采用改良Zea Longa方法制备MCAO模型;缺血预处理组于造模前24 h于颈外动脉插入自制线栓,栓塞大脑中动脉后,间断缺血30 min;针刺预处理组于造模前针刺大鼠双侧风池穴,连续7 d。各组分别于处死前4 h进行神经功能评分,TUNEL法检测细胞凋亡,Realtime PCR和ELISA法分析脑组织TNF-α、IL-1β。结果脑梗死组、缺血预处理组、针刺预处理组大鼠神经功能评分、TUNEL法阳性细胞计数、TNF-α、IL-1β mRNA表达水平和含量均高于正常组和假手术组 (均P<0.05)。缺血预处理组、针刺预处理组1 d时大鼠神经功能评分与脑梗死组差别不大(P>0.05),而两组在3、7 d时,大鼠神经功能评分均低于脑梗死组(P<0.05或P<0.01)。缺血预处理组与针刺预处理组大鼠神经功能评分差别不大(P>0.05)。正常组和假手术组可见少量TUNEL阳性细胞,梗死组、缺血预处理组和针刺预处理1 d时TUNEL阳性细胞数均较多,3 d时开始下降。而缺血预处理组、针刺预处理组3 d时阳性细胞数明显减少,少于梗死组。脑梗死组、缺血预处理组、针刺预处理组1、3、7 d时,TUNEL法阳性细胞计数均高于正常组和假手术组(均P<0.05)。缺血预处理组、针刺预处理组1 d时TUNEL法阳性细胞计数与脑梗死组差别不大(P>0.05),而在两组3、7 d时,TUNEL法阳性细胞计数均低于脑梗死组(P<0.01或P<0.01)。缺血预处理组与针刺预处理组TUNEL法阳性细胞计数1、3、7 d时差别不大(均P>0.05)。脑梗死组、缺血预处理组、针刺预处理组1、3、7 d时的TNF-α、IL-1β mRNA水平和含量均高于正常组和假手术组(均P<0.05)。缺血预处理组、针刺预处理组1、3、7 d时,TNF-α、IL-1β mRNA表达水平和含量均低于脑梗死组 (P<0.05或P<0.01)。缺血预处理组与针刺预处理组1、3、7 d时,TNF-α、IL-1β mRNA表达水平和含量则差别不大(均P>0.05)。结论脑梗死后,梗死灶边缘神经细胞凋亡,TNF-α mRNA、IL-1β mRNA表达上升,炎性因子TNF-α、IL-1β增多。针刺风池穴预处理,可以抑制神经细胞调亡,减少炎性因子TNF-α mRNA、IL-1βmRNA表达,降低TNF-α、IL-1β含量,减轻脑梗死炎性反应,改善脑梗死大鼠模型神经功能。
脑梗死 针刺 预处理 细胞凋亡 炎性因子
随着老龄化社会的到来,脑血管疾病逐渐成为目前我国三大致死性疾病之一[1],而在脑血管疾病中,脑血栓形成占1/3。由于中枢神经元损伤的不可逆性,该病往往形成残疾,重则危及生命。因此,积极开展脑梗死预防工作,对降低缺血性脑血管疾病尤其脑梗死的发病率、致残率和致死率等显得尤为重要。而缺血耐受现象的提出,为脑梗死预防性治疗提供了广阔的思路,也提出了多种预处理方式。
在临床中,针刺风池穴可以改善脑供血不足所引发的各种症状,包括眩晕、一过性黑蒙等,尤其对椎-基底动脉系统TIA具有良好改善作用。有研究表明TIA可诱发脑缺血耐受,且有学者证实针刺“风池穴”,对椎-基底动脉系统血流速度具有“双相、良性”调节作用[2]。笔者在临床中总结发现,发生脑血栓形成性脑梗死采用针刺风池穴治疗者,其病灶面积通常较小,且经康复训练后,后遗症较少。因此,针刺风池穴可能存在激活大脑的缺血耐受现象。笔者通过针刺风池穴预处理对脑梗死大鼠模型,观察其对脑梗死大鼠模型细胞凋亡的影响,探讨其诱导脑缺血耐受的作用机制。现报告如下。
1 材料与方法
1.1 动物 健康成年SD雄性大鼠90只,体质量(330±10)g,合格证号为黑201402415,由黑龙江中医药大学实验动物中心提供。
1.2 试剂与仪器 TUNEL测试试剂盒:美国Roche公司 (批号11772465001)。DBA工作液现用现配。TriZol:美国Invitrogen公司(批号15596018)。DEPC:美国Sigma公司 (批号20130952)。RNAisoReagent、SybrGreen Taq、cDNA Synthesis Kit购自大连 TaKaRa公司。TransScriptTM One-Step RT-PCR SuperMix购自北京全式金生物技术有限公司。TNF-α、IL-1β及βactin mRNA引物由上海生物工程技术服务有限公司合成。TNF-α、IL-1β酶联免疫吸附测定试剂盒:伊莱瑞特生物科技有限公司(批号E-EL-R0019c)。酶标仪(450nm波长滤光片):北京博仪恒业科技发展有限公司。光学显微镜(MCL-300):美佳朗。电热恒温箱(DHP-9052):上海一恒公司。华佗牌针灸针(0.25mm×25mm):苏州医疗用品厂有限公司。高精度移液器(WKYⅢ-5):上海佳安分析仪器厂。荧光定量PCR仪(ABI-7500):美国ABI公司。
1.3 分组与造模 采用随机数字表法,将大鼠随机分为正常组18只,假手术组18只,脑梗死组18只,缺血预处理组18只,针刺预处理组18只5组,每组均分1、3、7 d 3个亚组各6只。正常组同步喂养,无任何处理;假手术组只切开皮肤,暴露劲总动脉、颈内外动脉,不插入线栓,术后缝合皮肤。脑梗死组采用改良Zea Longa[3]方法制备大鼠模型;缺血预处理组于造模前24 h于颈外动脉插入自制线栓,栓塞大脑中动脉后,间断缺血30 min;针刺预处理组于造模前针刺大鼠双侧风池穴,连续7 d。具体方法1)大鼠脑梗死动物模型制备方法:大鼠造模前6 h禁食,10%水合氯醛腹腔麻醉,于颈部距正中线右侧0.5 cm切开颈部皮肤,剥离至暴露劲总动脉、颈内外动脉,结扎颈外动脉及劲总动脉近段,血管夹夹闭颈内动脉,于颈总动脉剪一小口,插入备好线栓,固定,松开动脉夹,将线栓送入经颈内动脉至大脑前动脉,至送入出现阻力,栓塞大脑中动脉,制备左侧大脑中动脉闭塞脑梗死模型。2)缺血预处理方法:大鼠麻醉,经颈外动脉插入自制线栓,栓塞大脑中动脉后,间断缺血30 min(3次10 min,每个10 min后将线栓退至颈内动脉内恢复血流10 min),术后拔出线栓,结扎颈外动脉残端。常规饲养24 h后,采用改良Zea Longa法制备大鼠脑梗死模型。3)针刺方法:针刺大鼠双侧风池穴,每日针刺l次,每次30 min。连续针刺7 d。针刺结束后行MCAO动物模型制备。
1.4 观察指标 1)神经功能评分:实验动物清醒后,自由饮食,各组于取材前4 h进行神经功能评分。采用Longar 5分制标准。0分:无神经功能缺损,动物行为正常。1分:提尾时左前肢内收,不能完全伸展。2分:自发行走时向左侧转圈。3分:行走时身体向左侧倾倒。4分:不能自发行走,或昏迷。2)细胞凋亡:采用TUNEL法检测。各组大鼠于取材前6 h禁食水,4%多聚甲醛溶液200 mL,0.9%氯化钠200 mL灌注取脑;石蜡切片常规脱蜡至水;滴加胃蛋白酶K(20 μg/mL溶于10 mM的Tris/HCL中,pH值7.4~8.0)室温孵育30 min,PBS冲洗2次;标记,擦干样品周围的水,滴加50 μL的Tunel反应混合液,在湿盒中37℃孵育60 min,PBS冲洗3次;信号转化和分析,擦干样品周围的水分,加入50 μL的转化剂-POD,在湿盒中37℃孵育30 min,PBS冲洗3次;显色,滴加显色剂DAB,室温下10 min,蒸馏水充分冲洗;苏木素复染1 min;常规脱水透明,中性树胶封片,显微镜下观察。应用Motic Med 6.0病理图像分析系统,每张片随机观察并计数脑损伤边5个不重复视野,在400倍镜视野下计数脑损伤区周围组织中TUNEL阳性的细胞。取平均值作为每个标本平均每高倍视野内的统计数据 (个/HP)。3)TNF-α、IL-1β mRNA的表达:采用Real-time PCR检测。样本RNA提取,每组大鼠脑组织,用液氮研磨成粉末,加入1 mL的TRIZOL试剂,混匀,室温静置5 min,提取总RNA;逆转录反应,2 μg RNA按照试剂盒说明进行逆转录反应,42℃30 min,85℃5 min。PCR仪进行PCR反应,按SYBR Premix Ex Taq 12.5 μL;PCR Forward Primer(10 μM)0.5 μL;PCR Reverse Primer(10 μM)0.5 μL;DNA模板1.0 μL;dH2O(灭菌蒸馏水)10.5 μL分别配制Real-time PCR反应体系。各样品目的mRNA和内参 (GAPDH)分别进行Real-time PCR反应。PCR仪中制备合格标准品(溶解曲线的吸收峰单一的PCR产物者)。β-actin基因表达作为内参,分别采集TNF-α、IL-1β、β-actin扩增各循环荧光信号。 Rotor-Gene 6.0版软件收集循环阈值(CT值),目的基因相对mRNA表达水平计算按照公式:目的基因相对mRNA表达=2-△△CT。4)脑组织中TNF-α、IL-1β含量:采用ELISA检测。各组大鼠取梗死边缘脑组织5 mg,液氮保存待用。按照大鼠酶联免疫吸附试验试剂盒提供说明书步骤测定组织TNF-α、IL-1β的含量。

表1 Real-time PCR基因引物序列
1.5 统计学处理 应用SPSS19.0统计软件。计量资料以(±s)表示。多个样本间比较采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠神经功能学评分比较 见表2。脑梗死组、缺血预处理组、针刺预处理组大鼠神经功能评分均高于正常组和假手术组(均P<0.05)。缺血预处理组、针刺预处理组1 d时大鼠神经功能评分与脑梗死组差别不大(P>0.05),而在两组3、7 d时,大鼠神经功能评分均低于脑梗死组(P<0.05或P<0.01)。缺血预处理组与针刺预处理组大鼠神经功能评分差别不大 (P> 0.05)。
表2 各组大鼠神经功能学评分比较(分,±s)
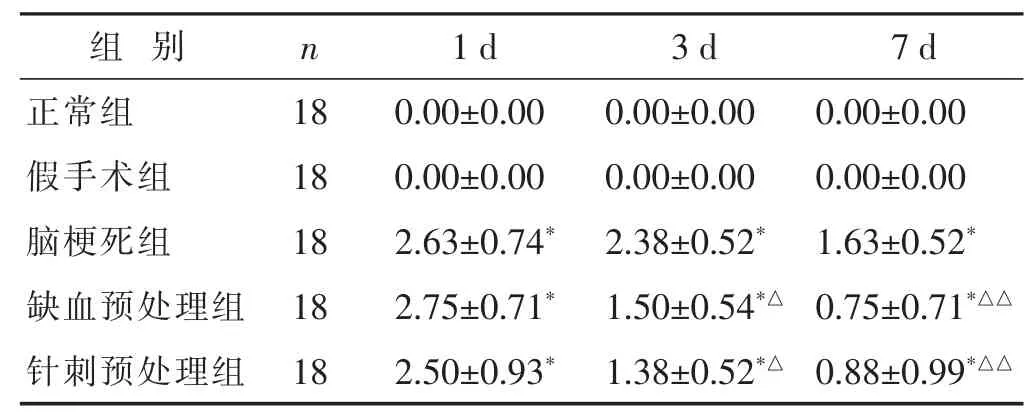
表2 各组大鼠神经功能学评分比较(分,±s)
与正常组、假手术比较,*P<0.05;与脑梗死组比较,△P<0.05,△△P<0.01。下同。
组别n 7 d正常组 1 8 0 . 0 0 ± 0 . 0 0假手术组 1 8 0 . 0 0 ± 0 . 0 0脑梗死组 1 8 1 . 6 3 ± 0 . 5 2*1 d 3 d 0 . 0 0 ± 0 . 0 0 0 . 0 0 ± 0 . 0 0 0 . 0 0 ± 0 . 0 0 0 . 0 0 ± 0 . 0 0 2 . 6 3 ± 0 . 7 4*2 . 3 8 ± 0 . 5 2*缺血预处理组 1 8 0 . 7 5 ± 0 . 7 1*△△2 . 7 5 ± 0 . 7 1*1 . 5 0 ± 0 . 5 4*△针刺预处理组 1 8 2 . 5 0 ± 0 . 9 3*1 . 3 8 ± 0 . 5 2*△0 . 8 8 ± 0 . 9 9*△△
2.2 各组细胞凋亡情况比较 见图1~4,表3。正常组和假手术组可见少量TUNEL阳性细胞 (图1),梗死组、缺血预处理组和针刺预处理1 d时TUNEL阳性细胞数均较多,3 d时开始下降。而缺血预处理组(图2)、针刺预处理组(图3)3 d时阳性细胞数明显减少,少于梗死组(图4)。脑梗死组、缺血预处理组、针刺预处理组1、3、7 d时,TUNEL法阳性细胞计数均高于正常组和假手术组(均P<0.05)。缺血预处理组、针刺预处理组1 d时TUNEL法阳性细胞计数与脑梗死组差别不大(P>0.05),而在两组3、7 d时,TUNEL法阳性细胞计数均低于脑梗死组(P<0.05或P<0.01)。缺血预处理组与针刺预处理组TUNEL法阳性细胞计数1、3、7 d时差别不大(均P>0.05)。
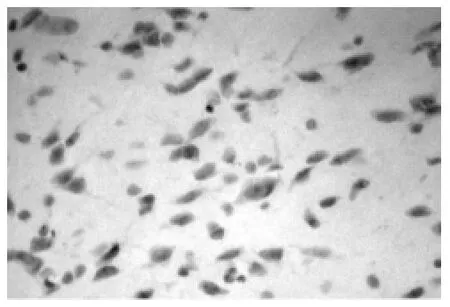
图1 正常组(×400)

图2 缺血预处理3d组(×400)

图3 针刺预处理3 d组(×400)
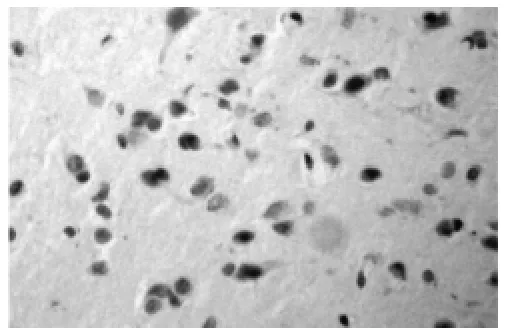
图4 脑梗死3 d组(×400)
表3 各组TUNEL法染色阳性细胞计数比较(±s)

表3 各组TUNEL法染色阳性细胞计数比较(±s)
组别n 7 d正常组 1 8 1 0 . 1 8 ± 1 . 9 5假手术组 1 8 1 2 . 5 4 ± 2 . 0 1脑梗死组 1 8 2 7 . 3 8 ± 3 . 2 5*1 d 3 d 1 0 . 1 3 ± 2 . 1 1 1 1 . 2 1 ± 2 . 5 4 1 3 . 4 1 ± 3 . 1 4 1 2 . 5 4 ± 3 . 6 5 3 5 . 0 0 ± 5 . 1 5*3 0 . 1 3 ± 4 . 5 2*缺血预处理组 1 8 1 8 . 5 4 ± 5 . 2 1*△△3 4 . 8 5 ± 4 . 9 6*2 4 . 6 2 ± 5 . 6 2*△针刺预处理组 1 8 3 6 . 2 3 ± 6 . 3 0*2 5 . 2 0 ± 5 . 7 3*△1 9 . 5 0 ± 3 . 7 7*△△
2.3 各组TNF-α、IL-1β mRNA表达比较 见表4。脑梗死组、缺血预处理组、针刺预处理组1、3、7 d时,TNF-α、IL-1β mRNA水平均高于正常组和假手术组(均P<0.05)。缺血预处理组、针刺预处理组1、3、7 d时,TNF-α、IL-1β mRNA表达水平均低于脑梗死组(P<0.05或P<0.01)。缺血预处理组与针刺预处理组1、3、7 d时,TNF-α、IL-1β mRNA表达水平则差别不大(均P>0.05)。
表4 各组TNF-α、IL-1β mRNA表达比较(ng/mL,±s)
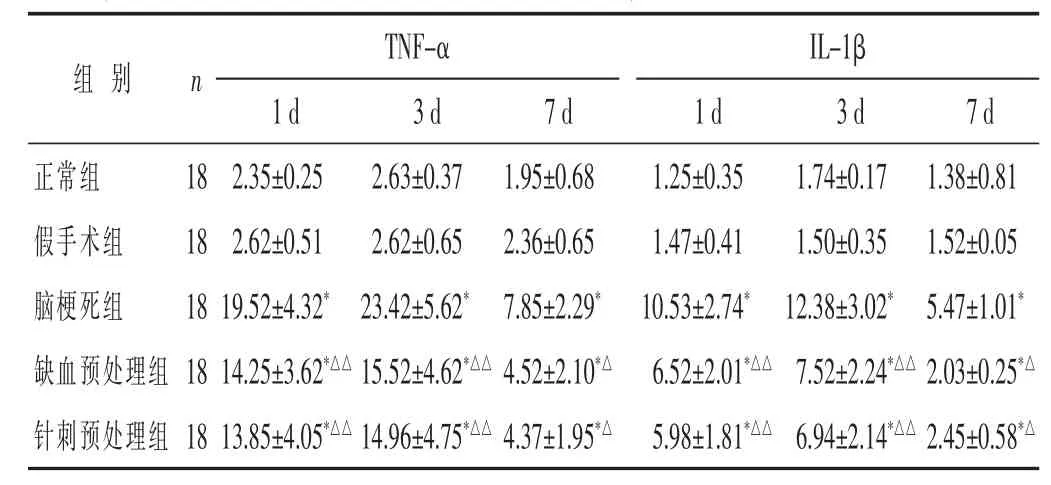
表4 各组TNF-α、IL-1β mRNA表达比较(ng/mL,±s)
组别 n T N F -α I L -1 β 1 d 3 d 7 d 1 d 3 d 7 d正常组 1 8假手术组 1 8脑梗死组 1 8缺血预处理组 1 8针刺预处理组 1 8 2 . 3 5 ± 0 . 2 5 2 . 6 3 ± 0 . 3 7 1 . 9 5 ± 0 . 6 8 1 . 2 5 ± 0 . 3 5 1 . 7 4 ± 0 . 1 7 2 . 6 2 ± 0 . 5 1 2 . 6 2 ± 0 . 6 5 2 . 3 6 ± 0 . 6 5 1 . 4 7 ± 0 . 4 1 1 . 5 0 ± 0 . 3 5 1 9 . 5 2 ± 4 . 3 2*2 3 . 4 2 ± 5 . 6 2*7 . 8 5 ± 2 . 2 9*1 0 . 5 3 ± 2 . 7 4*1 2 . 3 8 ± 3 . 0 2*1 . 3 8 ± 0 . 8 1 1 . 5 2 ± 0 . 0 5 5 . 4 7 ± 1 . 0 1*1 4 . 2 5 ± 3 . 6 2*△△1 5 . 5 2 ± 4 . 6 2*△△4 . 5 2 ± 2 . 1 0*△6 . 5 2 ± 2 . 0 1*△△7 . 5 2 ± 2 . 2 4*△△1 3 . 8 5 ± 4 . 0 5*△△1 4 . 9 6 ± 4 . 7 5*△△4 . 3 7 ± 1 . 9 5*△5 . 9 8 ± 1 . 8 1*△△6 . 9 4 ± 2 . 1 4*△△2 . 4 5 ± 0 . 5 8*△2 . 0 3 ± 0 . 2 5*△
2.4 各组ELISA法检测不同时间点TNF-α、IL-1β的含量比较 见表5。脑梗死组、缺血预处理组、针刺预处理组1、3、7 d时,TNF-α、IL-1β含量均高于正常组和假手术组(均P<0.05)。缺血预处理组、针刺预处理组1、3、7 d时,TNF-α、IL-1β含量均低于脑梗死组(P<0.05或P<0.01)。缺血预处理组与针刺预处理组1、3、7 d时,TNF-α、IL-1β含量则差别不大 (均P>0.05)。
表5 各组ELISA法检测不同时间点TNF-α、IL-1β的含量比较(ng/mL,±s)
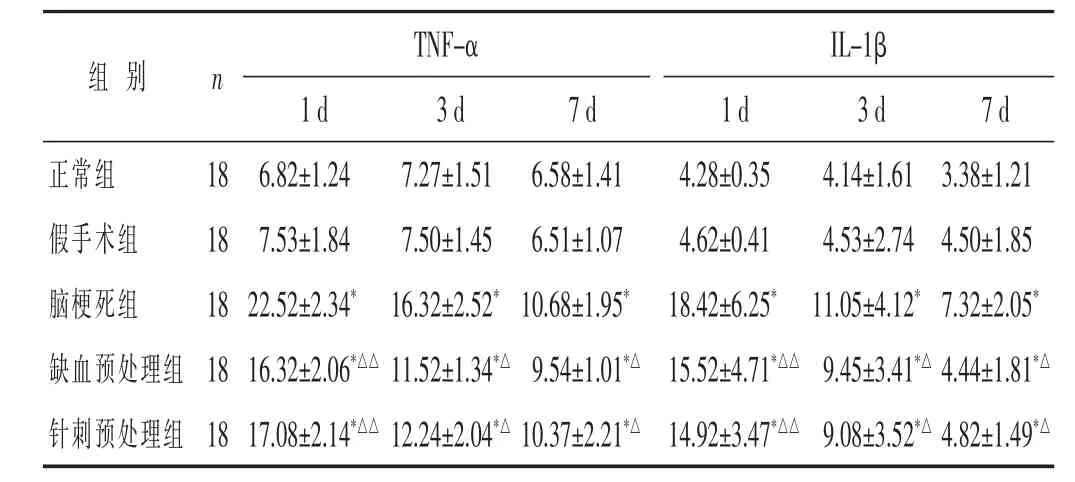
表5 各组ELISA法检测不同时间点TNF-α、IL-1β的含量比较(ng/mL,±s)
组别 n T N F -α I L -1 β 1 d 3 d 7 d 1 d 3 d 7 d正常组 1 8假手术组 1 8脑梗死组 1 8缺血预处理组 1 8针刺预处理组 1 8 6 . 8 2 ± 1 . 2 4 7 . 2 7 ± 1 . 5 1 6 . 5 8 ± 1 . 4 1 4 . 2 8 ± 0 . 3 5 4 . 1 4 ± 1 . 6 1 7 . 5 3 ± 1 . 8 4 7 . 5 0 ± 1 . 4 5 6 . 5 1 ± 1 . 0 7 4 . 6 2 ± 0 . 4 1 4 . 5 3 ± 2 . 7 4 2 2 . 5 2 ± 2 . 3 4*1 6 . 3 2 ± 2 . 5 2*1 0 . 6 8 ± 1 . 9 5*1 8 . 4 2 ± 6 . 2 5*1 1 . 0 5 ± 4 . 1 2*3 . 3 8 ± 1 . 2 1 4 . 5 0 ± 1 . 8 5 7 . 3 2 ± 2 . 0 5*1 6 . 3 2 ± 2 . 0 6*△△1 1 . 5 2 ± 1 . 3 4*△9 . 5 4 ± 1 . 0 1*△1 5 . 5 2 ± 4 . 7 1*△△9 . 4 5 ± 3 . 4 1*△1 7 . 0 8 ± 2 . 1 4*△△1 2 . 2 4 ± 2 . 0 4*△1 0 . 3 7 ± 2 . 2 1*△1 4 . 9 2 ± 3 . 4 7*△△9 . 0 8 ± 3 . 5 2*△4 . 8 2 ± 1 . 4 9*△4 . 4 4 ± 1 . 8 1*△
3 讨 论
《黄帝内经》提倡“不治已病治未病”,“未病”并非是没有病,一般定义为体内已有病因存在但尚未致病的人体状态。此与现代医学的预处理理念相似,故发掘治未病手段诱导脑缺血耐受存在现实意义。
缺血性脑血管疾病是一组以动脉硬化为基础,以脑组织发生缺血缺氧性损伤为主要病理改变的疾病。在损伤早期,往往是多种机制共同参与疾病发生、发展过程。局部炎症反应往往在早期就激活[4-5],小胶质细胞、巨噬细胞、免疫细胞等升高,激活一系列炎症转导机制,产生并释放炎性细胞因子如TNF-α、IL-1β、IL-6等。缺血性脑损伤后血脑屏障破坏,通透性增加,从而引起脑水肿及一些继发损伤[6];大量的活性氧自由基(ROS)产生[7],介导脂质过氧化反应可以损伤神经细胞膜和细胞器,使神经细胞发生肿胀、变性甚至坏死。同时尚伴有兴奋性氨基酸毒性反应[8]、细胞内钙超载[9]等,最终诱导细胞发生坏死和凋亡[10]。
Kitagawa等[11]于1990年报导在沙土鼠大脑内存在缺血耐受现象。缺血耐受现象的发现为脑梗死的防治提供了新的思路和新途径。但是缺血预处理方法临床实现困难,是否还存在其他预处理手段可以诱导脑缺血耐受呢,有实验研究证实针刺预处理也可诱导脑缺血耐受,从而对脑组织起保护作用[12-13],但研究报道针刺预处理选用腧穴不一。在临床中我们发现风池穴具有治疗病种多样性,疗效显著性、针刺时患者痛苦小等特点,并在前期临床研究中证实具有脑保护作用,但其具体作用机制尚待挖掘。
《铜人腧穴针灸图经》指出风池主“目眩,苦头痛,颈项痛不得回顾,目泪出,欠气多”。风池穴位于斜方肌两侧与胸锁乳突肌上端汇合处,上项线直下凹陷处发际内,其与颈交感神经联系密切。研究发现,针刺风池穴可以调节椎基底动脉血流[14],临床中我们也发现,针刺风池穴可以改善脑供血、脑血流,治疗因脑供血不足引起的眩晕,也可以起到降低交感神经紧张度,兴奋迷走神经,诱导胆碱能抗炎通路发挥抗细胞凋亡作用。细胞凋亡是脑损伤后神经组织细胞发生的一系列生物学特征的改变,在缺血性脑损伤早期,各组炎症因子作用下,缺血区脑组织发生大量细胞凋亡,是继发性脑损伤的病理生理过程[15]。TUNEL法可以对凋亡细胞核或凋亡小体进行原位染色,并能够准确的反应细胞凋亡的生物化学及形态学改变。脑梗死后各种促炎因子、抗炎因子均参与了其发生发展过程。肿瘤坏死因子是一种由单核细胞分泌的,在炎症反应中处于最先激活细胞因子之一,参与介导细胞凋亡过程。IL-1β是一种重要的炎性因子,炎性反应发生时,可进一步激活中性粒细胞及内皮细胞,形成级联式瀑布反应,并最终诱导细胞死亡和凋亡。
本研究结果示,针刺预处理和缺血预处理均能够实现早期改善恢复脑梗死后神经功能、抗细胞凋亡作用。脑梗死组、缺血预处理组和针刺预处理组于缺血损伤后1 d出现TNF-α mRNA、IL-1β mRNA表达升高,脑组织中TNF-α、IL-1β含量亦增高,并且达峰值,3 d时开始逐渐下落,与文献报道趋势一致[16],缺血预处理和针刺预处理均可抑制炎性因子TNF-α mRNA、IL-1β mRNA表达,减轻脑梗死炎性反应。综上所述,针刺风池穴预处理,可以改善脑梗死大鼠神经功能,抑制神经细胞调亡,减少炎性因子TNF-α mRNA、IL-1β mRNA表达,从而减轻脑梗死炎性反应,可能是其诱导脑缺血耐受的作用机制之一。
[1] 王北松.缺血性脑血管病研究近况与中医治疗概略[J].中医药信息,2001,18(3):2-5.
[2] 王强,朱广旗,胡蓉.针刺风池、“供血”穴治疗椎-基底动脉供血不足临床疗效与机制探讨[J].中国针灸,2009,29(11):861-864.
[3] Zea Longa E,Weinstein PR,Carison S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[4] Jong Youl Kim,Masahito Kawabori,Midori A.Yenari.Innate inflammatory responses in stroke:mechanisms and potential therapeutic targets[J].Current medicinal chemistry,2014,21(18):2076-2097.
[5] Rong Jin,Lin Liu.Role of inflammation and its mediators in acute ischemic stroke[J].Journal of cardiovascular translational research,2013,6(5):10.
[6] Bolanle M.The immune response to acute focal cerebral ischemia and associated post-stroke immunodepression:a focused review[J].Aging and Disease,2014,5(5):307-326.
[7] Lingfeng Wu,Kunnan Zhang.Inflammatory response and neuronal necrosis in rats with cerebral ischemia[J].Neural Regeneration Research,2014,9(19):1753-1762.
[8] Savita Khanna,Zachary Briggs,Cameron Rink.Inducible glutamate oxaloacetate transaminase as a therapeutic target against ischemic stroke[J].Antioxidants&Redox Signaling, 2015,22(2):177.
[9] Rachna S,Pandya,Lijuan Mao.Central nervous system agents for ischemic stroke:neuroprotection mechanisms[J].Central Nervous System Agents in Medicinal Chemistry,2011,11(2):89.
[10]Syamantak Majumder,M.Ilayaraja.Chick embryo partial ischemia model:a new approach to study ischemia Ex Vivo[J]. PLoS ONE,2010,5(5):528.
[11]kitagawa K,Matsumoto M,Tagaya M,et al.Ischamic tolerance phenomenon found in the brain[J].Brain Res,1990,528(2):21-22.
[12]孙忠人,唐伟,王威,等.针刺预处理诱导全脑缺血大鼠海马区即刻早期基因c-fos mRNA及其蛋白的表达[J].中国临床康复,2006,10(19):125-127.
[13]陈丽平.百会、水沟穴不同时程电针预处理对脑缺血再灌注大鼠血脑屏障的影响[D].浙江:浙江中医药大学,2013:3.
[14]袁晓军,郝喜书,赖仲平,等.针刺风池穴对脑血流的影响[J].中医杂志,1996,37(5):28.
[15]Raghupathi R,Conti AC,Graham DI,et al.Mild traumatic brain injury induces apoptotic cell death in the cortex that is preceded by decreases in cellular Bcl-2 immunoreactivity[J]. Neuroscience,2002,110(4):605-616.
[16]刘旭.脑梗死患者血清TNF-α、IL-6和IL-8水平变化的临床意义分析[J].中国现代药物应用,2015,9(2):42.
Effect of Acupuncture Preconditioning on Apotosis and Inflammatory Factors of ischemic cerebral
QIN Yanqiang,SUN zhongren,ZHANG Yajuan,et al. Heilongjiang University Of Chinese Medicine,Heilongjiang,Harbin 150040,China
【Asbstract】Objective:To observe the effect of acupuncture preconditioning on the apoptosis and inflammatory factors of ischemic cerebral apoplexy.Methods:90 adult male SD rats were randomly divided into 5 groups:normal group,Sham group,cerebral infarction group,ischemic preconditioning group,acupuncture,preconditioning group,with 18 rats in each group.Each group was divided into one day,three days,seven days group,with 6 rats in each group.Middle cerebral artery occlusion(MCAO)model was prepared using the modified Zea Longa,all of the rats of acupuncture preconditioning group pinprick"Feng Chi Acupoints"before the MCAO model preparedconsecutive 7 days.The neurological score were detected 4 hours ago in each group when rats were sacrificed. Cells apoptosis was detected by TUNEL,and Real-time PCR and ELISA method were used to analyze tissue TNF-α beta,IL-1.Results:The method of the Acupuncture preconditioning could improve the neurological score,there were differences between the two group(P<0.05);It also can reduce the cell's apoptosis(P<0.05),decrease the expression of TNF-αmRNA,IL-1β mRNA of brain(P<0.05),reduce the content of the TNF-α and IL-1β(P<0.05).Conclusions:The method of acupuncture preconditioning can improve neurological in rats of cerebral,its also can inhibit neuronal apoptosis and decrease the expression of TNF-α mRNA,IL-1βmRNA,reduce the inflammatory response.
Acupuncture;Preconditioning;Cerebral;Apoptosis;Inflammatory Factors
R285.5
A
1004-745X(2015)04-0565-05
10.3969/j.issn.1004-745X.2015.04.001
2015-02-08)
国家自然科学基金资助项目(30873298);黑龙江中医药大学“优秀创新人才支持计划”科研项目(领军人才类)(2012RCL01)
△通信作者(电子邮箱:szr006@163.com)

