植物生长调节剂对长柄扁桃种子萌发及幼苗生长的影响
鲁春艳,井赵斌,冯喜兵,陈晓艳,郭春会*
(1.西北农林科技大学 园艺学院,陕西 杨陵712100;2.陕西省农村科技开发中心,陕西 西安710054;3.安塞县农业局,陕西 安塞717402)
长柄扁桃又名柄扁桃(Amygdalus pedunculata),是蔷薇科扁桃属的落叶灌木,是我国特有的扁桃属野生种,抗性好,适应性强,具有较高的生态价值,其果仁营养价值高,既可食用,又可药用和工业用,具有较高的经济开发价值[1]。
种子萌发是植物生长周期的转折点,也是植物适应环境变化以保持自身繁衍的重要特性,直接关系到物种繁殖以及种群维持、扩展和恢复等生态过程[2]。目前,国内外对于各种植物萌芽试验较多,主要是物理方法和化学方法。物理方法主要包括控制温度、光照等[3-8];化学方法主要有激素处理(赤霉素,细胞分裂素,脱落酸等)[9-13],盐处理(KNO3,NaCl,NaHCO3)[13-15],无 机 酸 处 理 (浓 硫 酸、H2O2)[16-17],其他有机物处理(乙酰水杨酸,硫脲,氨基酸)[18]。但对于长柄扁桃品种,还没有系统大量的萌发试验研究。本试验利用不同的植物生长调节剂处理5个长柄扁桃种子,探讨其对长柄种子的萌发及其幼苗生长状况的影响,旨在为生产实践提供基础科学依据。
1 材料与方法
1.1 试验材料
试验选取5个长柄扁桃(Amygdalus pcdunculata)品种,分别为长柄扁桃1号、长柄扁桃2号、长柄扁桃3号、长柄扁桃4号和长柄扁桃5号,各长柄扁桃品种属于旱生灌木且耐寒,全部来源于陕西省神木县。
1.2 试验方法
1.2.1 种子形态特征测定 随机抽取20粒带壳种子,用游标卡尺测量种子的长、宽、厚,精确到0.01 mm。破壳取仁后,同样用游标卡尺测量仁粒的长、宽、厚,精确到0.01mm。根据种子和种仁长、宽、厚测定值,计算单粒种子体积(长×宽×厚)与单粒种仁体积(长×宽×厚)。
1.2.2 种子千粒重及出仁率测定 随机选取各品种1 000粒带壳的种子,称量并记录数据;将1 000粒种子破壳取仁,将收集的全部仁粒称量并记录数据;最后计算种子的出仁率。
1.2.3 种子萌芽试验 从5个长柄扁桃品种中各随机选取525个种子,进行7个处理,每个处理3个重复,各处理均进行15d的低温处理(1~3℃)。其所设处理:GA3的浓度为1 000mg·L-1,6-BA、SA、Cys、Met的浓度为100mg·L-1,H2O2的浓度为0.25%,对照为蒸馏水处理。
种子表面消毒用5%的次氯酸钠浸泡3min,然后用灭菌的蒸馏水清洗。种子在各处理溶液中浸泡24h,用灭菌蒸馏水漂洗3次,然后用于播种。
萌芽试验采用透明小号无菌塑料发芽盒(12cm×12cm×6cm),内盛约5cm厚的发芽基质。首先在盒内约覆盖3cm厚的基质,然后将各水平处理的种子摆放到发芽盒合适的位置,再覆基质2cm,浇水,在昼夜21~23℃的温室中培养。种子的胚根从种皮中出现视为萌芽,种子发芽出苗后,根据沙的水分状况,适时浇水,每天观察和记录种子的发芽数,直至不发芽,之后计算各长柄扁桃种子的萌芽率、萌芽指数、活力指数。萌芽率=发芽种子数/供试种子数;发芽指数(Gi)=∑(Gt/Dt),Gt表示第n 日的发芽数,Dt表示发芽试验第n日。
不同处理的幼苗生长量测定,发芽后的种子移栽到营养钵,经过10d培养后,每个处理随机选取15棵幼苗,分为3组(作为3个重复),每组5棵,洗去基质和沙子,用卫生纸吸去表面水分,用 Win-RHIZO根系扫描分析系统测量根系和茎的长、表面积、体积等。用紫光平台扫描仪(LA2000)将摘取的叶片扫描,再用Image软件测定叶片的面积。
采用Excel软件进行数据处理,采用SPSS20.0软件进行数据分析。
2 结果与分析
2.1 长柄扁桃种子的形质特征指标
长柄扁桃种子形状不一,有纺椎形、心形、球形等,顶端具有小尖头、基部圆形、两侧稍扁、浅褐色,表面平滑或稍有褶皱。种壳质地坚硬且脆。种仁宽卵形,棕黄色[19]。由表1可知,长柄扁桃3号的千粒重最大,长柄扁桃1号最小;长柄扁桃2号的千仁重最大,长柄扁桃5号的千仁重最小;长柄扁桃2号的出仁率明显高于其他长柄扁桃。种子千粒重与种子单粒体积呈正相关,种子的千仁重与种仁的单粒体积也呈正相关。各长柄扁桃种子的千粒重、千仁重、出仁率、单粒种子和种仁都具有显著差异性。
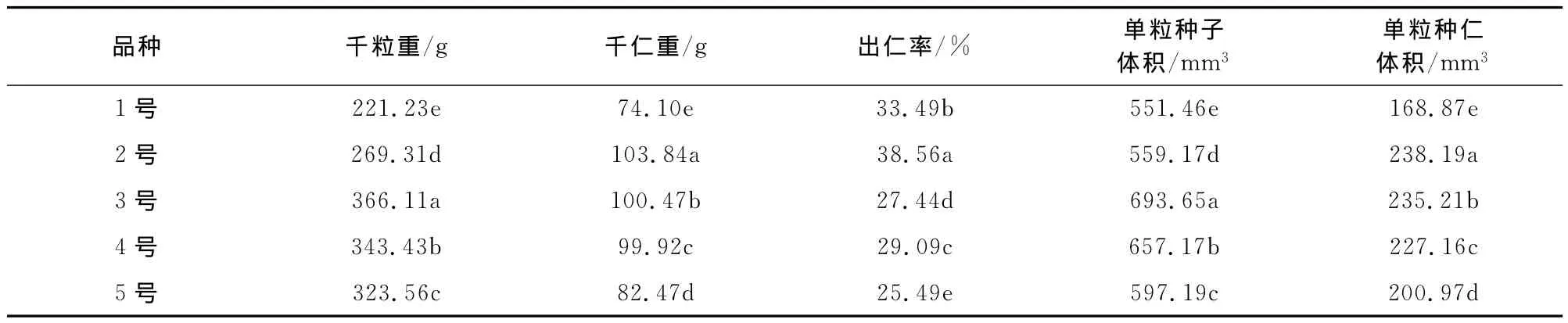
表1 长柄扁桃种子的重量和体积特征Table 1 Characteristics of seeds weight and volume on A.pedunculata
2.2 生长调节剂对长柄扁桃种子萌芽的影响
由表2可知,用蒸馏水处理的各长柄扁桃种子的萌芽率大小顺序为2号>3号=4号>5号>1号,而由表1可知,各长柄扁桃的千仁重与单粒种子的大小顺序为2号>3号>4号>5号>1号,可以看出长柄扁桃种子的萌芽率与种仁的质量和体积呈正相关关系。除6-BA处理外,在其他处理中,长柄扁桃2号和长柄扁桃4号的萌芽率均高于其他3种扁桃。除6-BA和Met处理外,在其他处理中,长柄扁桃2号和长柄扁桃4号的发芽指数均高于其他3种扁桃。
由表2可知,GA3处理的各长柄扁桃种子萌芽率比对照高25%以上,发芽指数比对照高19以上,长柄扁桃4号的发芽指数比对照高32.99。H2O2处理的长柄扁桃1号、4号和5号的萌芽率比对照高了32%以上;其发芽指数比对照高24。Cys处理的种子萌芽率低于对照;除长柄扁桃4号种子外,其余长柄扁桃种子的发芽指数均低于对照。Met处理的种子,长柄扁桃1号、2号和3号种子的萌芽率不高于对照,长柄扁桃4号和5号种子的萌芽率略高于对照;长柄扁桃2号和3号种子的发芽指数低于对照,长柄扁桃1号、4号和5号种子的发芽指数高于对照。6-BA处理的种子萌芽率、发芽指数都明显低于对照。SA处理的各长柄扁桃种子,没有萌芽。
GA3和H2O2处理的各长柄扁桃种子萌芽率、发芽指数都明显高于同一品种对照;Cys和Met处理的种子,各指标与同一品种对照没有明显的差异;6-BA和SA对种子的萌发有明显的抑制。长柄扁桃1号、4号和5号种子在各生长调节素处理中,H2O2对其促进作用最明显;长柄扁桃2号和3号种子在各生长调节素处理中,GA3对其促进作用最明显。
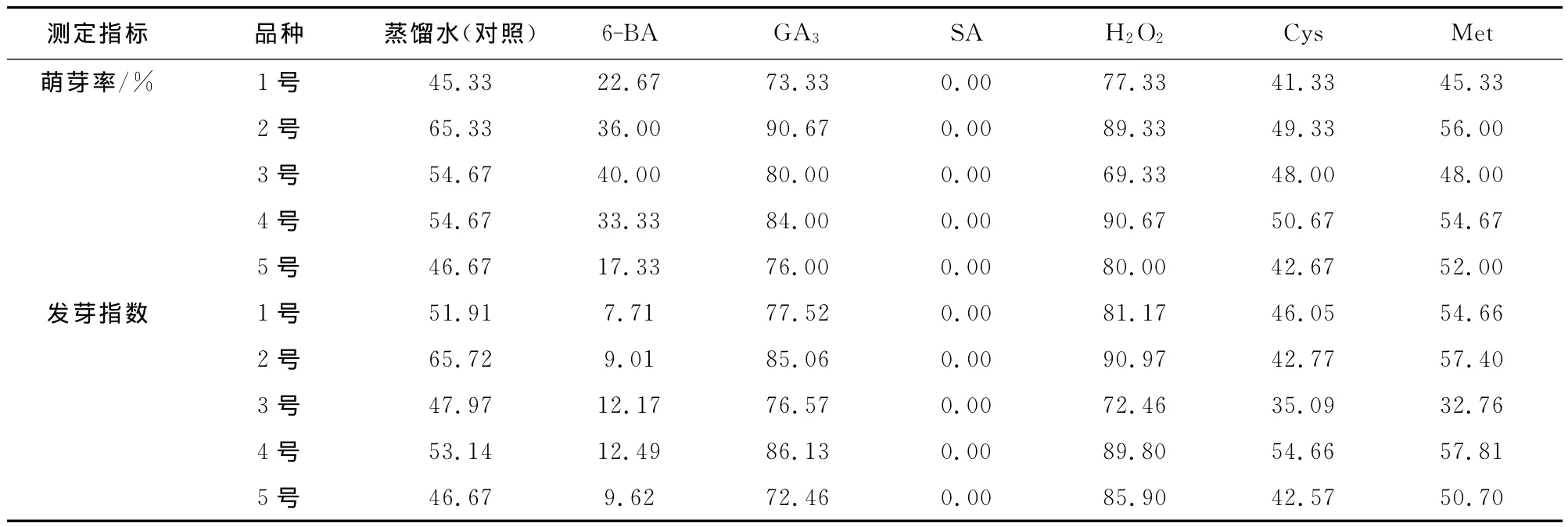
表2 生长调节剂对长柄扁桃种子萌芽的影响Table 2 Influence of growth regulators on seed germination of A.pedunculata
2.3 生长调节剂对长柄扁桃幼苗茎和叶的影响
由图1可知,GA3、H2O2、6-BA和 Met处理的长柄扁桃1号种子茎总长都高于对照,而且GA3和H2O2处理的种子茎总长高于对照7倍以上;Cys处理的种子茎总长低于对照。GA3和H2O2处理的长柄扁桃2号种子茎总长明显高于对照;6-BA和Met处理的种子茎总长略高于对照;Cys处理的种子茎总长低于对照。GA3和H2O2处理的长柄扁桃3号、4号和5号种子,其茎总长都高于对照;6-BA、Met和Cys处理的种子茎总长都低于对照。
由图2可知,GA3、H2O2、6-BA和 Met处理的长柄扁桃1号和2号种子,其茎投影总面积都高于对照,特别是GA3和H2O2处理的种子,其茎总投影面积明显高于对照;Cys处理的种子茎投影总面积低于对照。GA3、H2O2和6-BA处理的长柄扁桃3号种子,其茎投影总面积高于对照;Met和Cys处理的种子茎投影总面积都低于对照。GA3和H2O2处理的长柄扁桃4号种子,其茎投影总面积高于对照;Met、6-BA和Cys处理的种子茎投影总面积都低于对照。GA3和H2O2处理的长柄扁桃5号种子,其茎投影总面积高于对照;6-BA和Met处理的种子茎投影总面积都略高于对照;Cys处理的种子茎投影总面积低于对照。
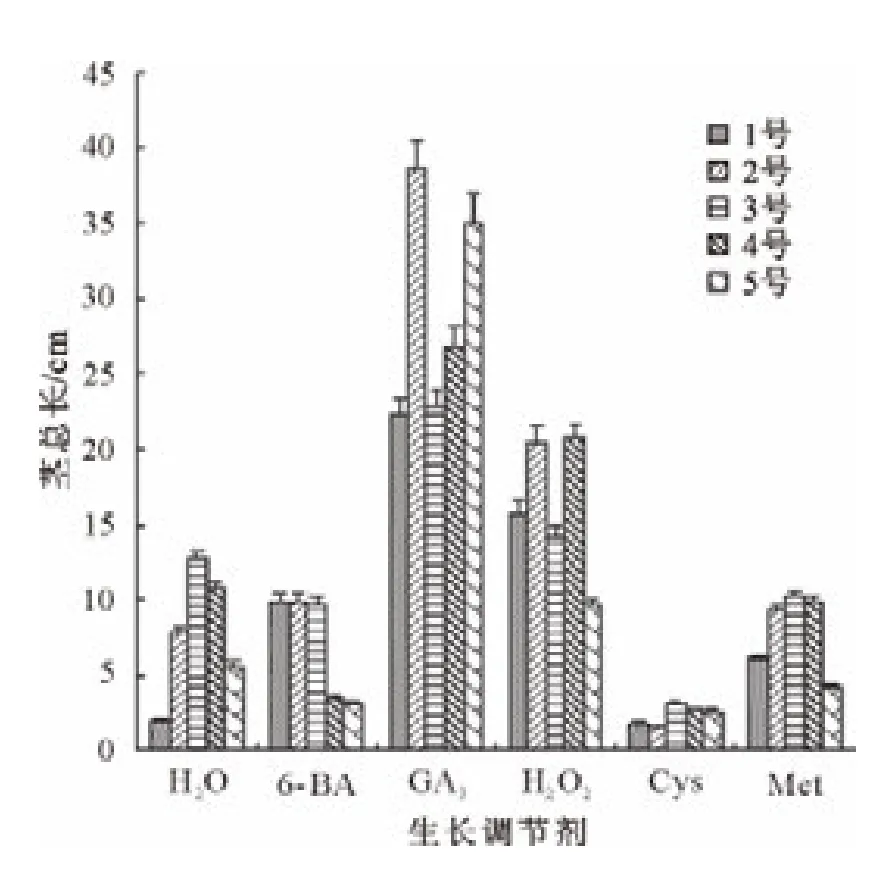
图1 生长调节剂对各长柄扁桃茎总长的影响Fig.1 Effect of growth regulators on total stem length A.pedunculata

图2 生长调节剂对各长柄扁桃茎投影总面积的的影响Fig.2 Effect of growth regulator on total projected area of the stems
由图3可知,H2O2、GA3、6-BA和 Met处理的长柄扁桃1号种子,其茎总表面积都高于对照;Cys处理的种子茎总表面积低于对照。GA3、6-BA和H2O2处理的长柄扁桃2号种子,其茎总表面积都明显高于对照;Met处理的种子略高于对照;Cys处理的种子茎总表面积低于对照。GA3、6-BA处理的长柄扁桃3号种子,其茎总表面积都高于对照;H2O2处理的种子与对照相当;Met和Cys处理的种子茎总表面积低于对照。H2O2、GA3处理的长柄扁桃4号和5号种子,其茎总表面积都高于对照;其他处理的种子都低于对照。
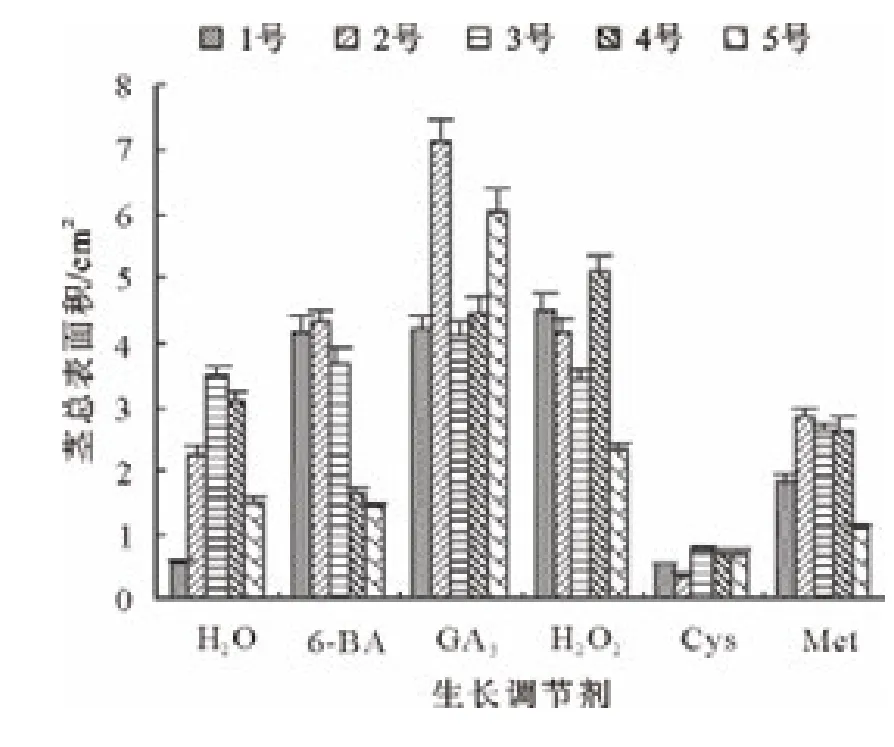
图3 生长调节剂对各长柄扁桃茎总表面积的影响Fig.3 Effect of growth regulators on total surface of stem
由图4可知,所有处理的长柄扁桃1号种子,其茎总体积都高于对照,6-BA、H2O2、GA3和 Met处理的种子明显高于对照。6-BA和GA3处理的长柄扁桃2号种子,其茎总体积明显高于对照;H2O2和Met处理的种子与对照相当;Cys处理的种子明显低于对照。6-BA处理的长柄扁桃3号种子茎总体积高于对照;H2O2、GA3和Met处理的种子与对照相当;Cys处理的种子明显低于对照。H2O2处理的长柄扁桃4号种子茎总体积高于对照;其余处理的种子都低于对照。GA3、6-BA、H2O2处理的长柄扁桃5号种子,其茎总体积高于对照;Met和Cys处理的种子低于对照。

图4 生长调节物质对各长柄扁桃茎体积的的影响Fig.4 Effect of growth regulators on total stem volume
由图5可知,6-BA、Cys和Met处理的长柄扁桃1号种子,其茎平均直径都高于对照;H2O2处理的种子与对照相当;GA3处理的种子平均直径最小。6-BA、Cys和 Met处理的长柄扁桃2号种子,其茎平均直径都高于对照;H2O2和GA3处理的种子略低于对照。6-BA处理的长柄扁桃3号、4号和5号种子,其茎平均直径高于对照;Cys、Met和H2O2处理的种子与对照相当;GA3处理的种子平均直径最小。
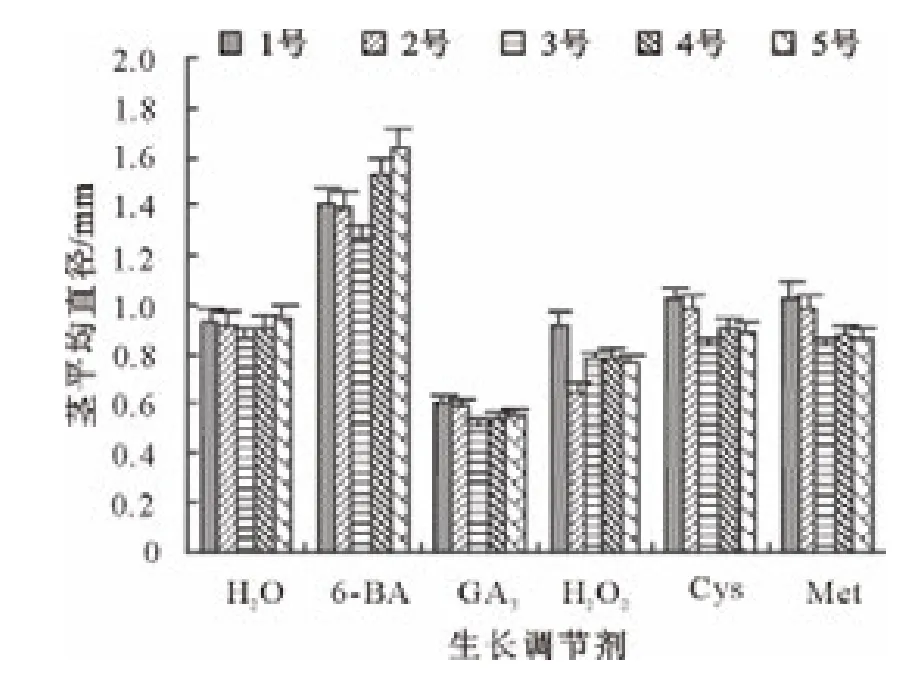
图5 生长调节物质对各长柄扁桃茎平均直径的影响Fig.5 Effect of growth regulators on average diameter of stem
由图6可知,GA3和H2O2处理的长柄扁桃1号种子,其总叶面积都高于对照,而且GA3和H2O2处理的种子总叶面积是对照的2倍以上;Met处理的种子总叶面积略低于对照;6-BA和Cys处理的种子总叶面积明显低于对照。GA3和H2O2处理的长柄扁桃2号种子总叶面积都明显高于对照;Met、6-BA和Cys处理的种子总叶面积均低于对照。GA3和H2O2处理的长柄扁桃3号种子总叶面积都明显高于对照;Met处理的种子总叶面积略高于对照;6-BA和Cys处理的种子总叶面积均低于对照。GA3和H2O2处理的长柄扁桃4号和5号种子,其总叶面积均高于对照;6-BA、Met和Cys处理的种子茎总长都低于对照。
H2O2处理的各长柄扁桃,其茎总长、茎投影总面积、茎总表面积、茎总体积、总叶面积大都高于对照,而且茎平均直径与对照相当;说明该处理促进了幼苗茎和叶的生长,易于获取健壮的幼苗。GA3处理的各长柄扁桃品种,其茎总长、茎投影总面积、茎总表面积、茎总体积、总叶面积大都高于对照,但是茎平均直径都低于对照;说明该处理有助于幼苗纵向生长,但是幼苗瘦弱,不易成活。Met处理的各长柄扁桃品种,其茎总长、茎投影总面积、茎总表面积、茎总体积、茎平均直径及总叶面积大都与对照相当,没有表现出明显的促进作用。Cys处理的各长柄扁桃品种,其茎总长、茎投影总面积、茎总表面积、茎总体积、总叶面积大都低于对照,说明该生长调节剂对长柄扁桃的幼苗生长有抑制作用。6-BA处理的各长柄扁桃品种,其茎总长、茎投影总面积、茎总表面积、总叶面积与对照相比,没有明显的规律,但茎平均直径和茎总体积大都明显高于对照和其他处理,说明该处理有助于茎横向生长。
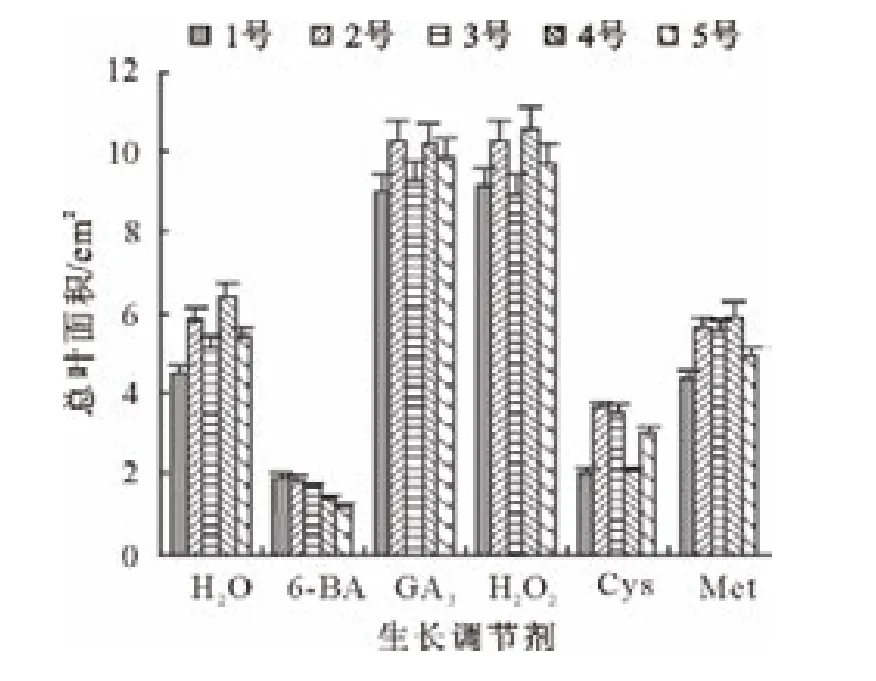
图6 生长调节剂对各长柄扁桃总叶面积的影响Fig.6 Effect of growth regulators on total leaf area
2.4 生长调节剂对长柄扁桃幼苗根系的影响
由图7可知,H2O2处理的长柄扁桃1号、2号和4号种子,其根系总长与同品种的其他处理相比最长,其次是GA3和Met处理的种子。H2O2处理的长柄扁桃3号种子根系总长高于对照;其他处理都低于对照。GA3处理的长柄扁桃5号种子根系最长;其次是H2O2和Met处理的种子。
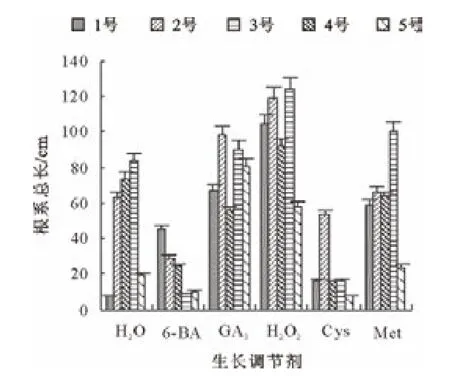
图7 生长调节物质对各长柄扁桃根系总长的影响Fig.7 Effect of growth regulators on total root length
由图8可知,所有处理的长柄扁桃1号种子,其根系投影总面积均高于对照;H2O2处理的种子总投影面积最大,其次是GA3、6-BA、Met、Cys处理的种子。H2O2、GA3和Met处理的长柄扁桃2号种子投影总面积高于对照,而H2O2处理的种子投影总面积最大。H2O2处理的长柄扁桃3号种子根系投影总面积大于对照,其余处理都小于对照。H2O2和Met处理的长柄扁桃4号种子,其根系投影总面积大于对照,其余处理都小于对照。H2O2和GA3处理的长柄扁桃5号种子,其根系投影总面积明显大于对照;Met处理的种子投影总面积与对照相当;6-BA和Cys处理的种子投影总面积小于对照。
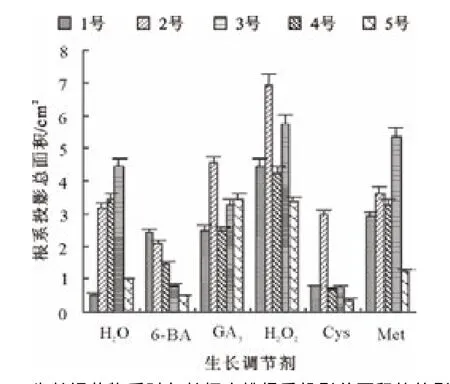
图8 生长调节物质对各长柄扁桃根系投影总面积的的影响Fig.8 Effect of growth regulators on total root projected area
由图9可知,所有处理的长柄扁桃1号种子根系总表面积都大于对照;H2O2处理的种子根系总表面积最大,其次依次是 Met、GA3、6-BA、Cys处理的种子。H2O2处理的长柄扁桃2号种子,其根系总表面积最大;GA3和Met处理的种子根系总表面积略高于对照;6-BA和Cys处理的种子根系总表面积低于对照。H2O2处理的长柄扁桃3号种子根系总表面积最大;其他生长调节剂处理的种子根系总表面积都低于对照。H2O2和Met处理的长柄扁桃4号种子,其根系总表面积高于对照;其他生长调节剂处理的种子根系总表面积都低于对照;6-BA和Cys处理的种子根系总表面积明显低于对照。GA3和H2O2处理的长柄扁桃5号种子根系总表面积明显高于对照;Met处理的种子总表面积与对照相当;6-BA和Cys处理的种子根系总表面积低于对照。
由图10可知,所有处理的长柄扁桃1号种子根系总体积都大于对照;H2O2处理的种子根系总体积最大。H2O2处理的长柄扁桃2号种子根系总表面积最大且显著高于对照;GA3、Cys和Met处理的种子根系总体积略高于对照;6-BA处理的种子根系总体积低于对照。H2O2和Met处理的长柄扁桃3号和4号种子根系总体积高于同一品种的对照;其他生长调节剂处理的种子根系总表面积都低于同一品种的对照。H2O2和GA3处理的长柄扁桃5号种子根系总体积明显高于对照;Met处理的种子根系总体积略高于对照;6-BA和Cys处理的种子根系总体积低于对照。
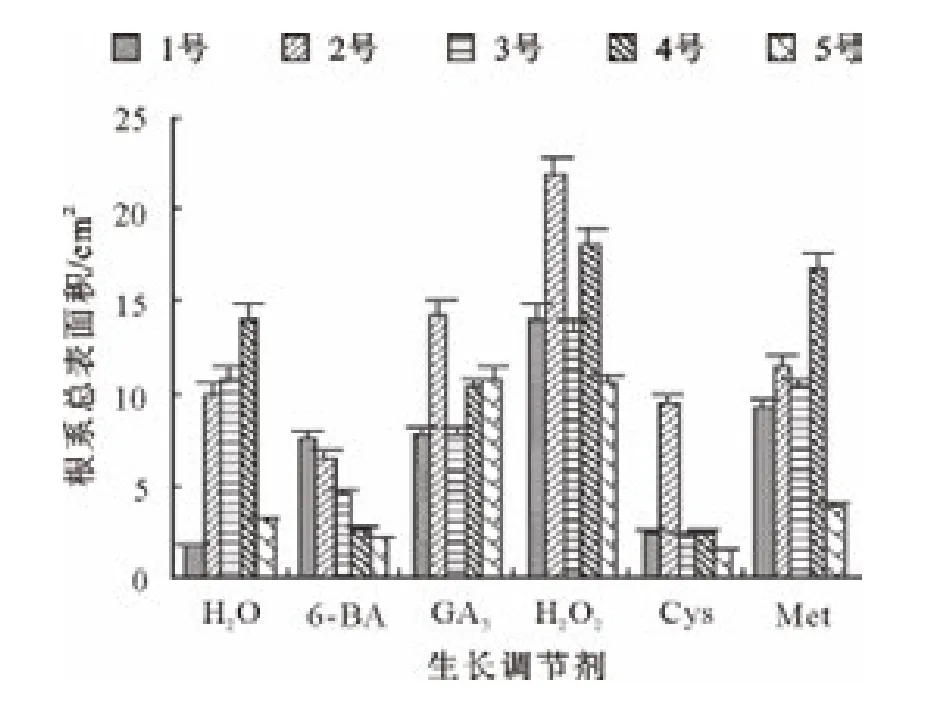
图9 生长调节物质对各长柄扁桃根系总表面积的影响Fig.9 Effect of growth regulators on total surface of root
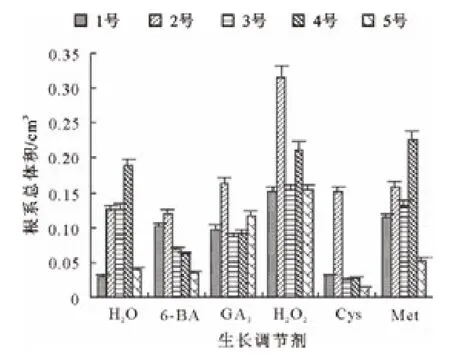
图10 生长调节物质对各长柄扁桃根系总体积的的影响Fig.10 Effect of growth regulators on total root volume
由图11可知,所有处理的长柄扁桃1号种子根系平均直径与对照相当。6-BA、H2O2、Cys和 Met处理的长柄扁桃2号种子根系平均直径高于对照;6-BA处理的种子平均直径明显高于其他处理和对照;GA3处理的种子根系平均直径低于对照。6-BA和Met处理的长柄扁桃3号种子根系平均直径高于对照;其他处理的种子根系平均直径都低于对照。6-BA处理的长柄扁桃4号种子根系平均直径高于对照;其他处理的种子根系平均直径与对照相当。所有处理的长柄扁桃5号种子根系平均直径均与对照相当。
H2O2处理的各长柄扁桃根系总长、根系投影总面积、根系总表面积、根系总体积大都高于对照,而且根系平均直径高于对照或与对照相当;说明该处理对幼苗根系生长有促进作用。GA3处理的各长柄扁桃品种根系总长、根系投影总面积、根系总表面积、根系总体积大都高于对照,但是根系平均直径低于对照或与对照;说明该处理促使幼苗的根系生长量增加,但主根系较其他处理较细。Met处理的各长柄扁桃品种根系总长、根系投影总面积、根系总表面积、根系茎总体积及根系平均直径大都略高于对照或与对照相当,没有表现出明显的促进作用。Cys处理的各长柄扁桃品种根系总长、根系投影总面积、根系总表面积、根系总体积大都低于对照,说明该生长调节剂对长柄扁桃的幼苗根系生长有抑制作用。6-BA处理的各长柄扁桃品种根系总长、根系投影总面积、根系总表面积、根系总体积与对照相比,没有明显的规律,但根系平均直径大都明显高于对照和其他处理,说明该处理有助于根系横向生长,但是侧根和毛细根等很少。
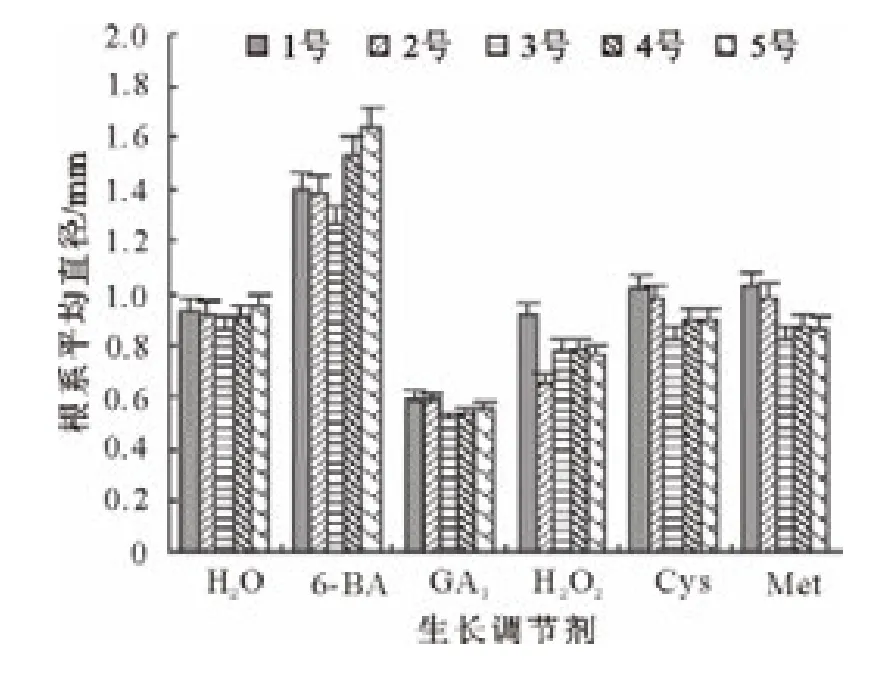
图11 生长调节物质对各长柄扁桃根系平均直径的影响Fig.11 Effect of growth regulators on average diameter of root
3 结论与讨论
3.1 长柄扁桃种子形态结构对种子萌发的影响
长柄扁桃种仁体积越大,则种子的胚具有的2个子叶越大,储藏的养分越多,为种子的萌发提供充分的物质基础[20]。种子活力指数是由种子的发芽指数与幼苗根系生长量间接测定,所以种子活力指数能预测种子在田间的成苗率以及长期的增产与优质潜力[21]。用蒸馏水浸泡后的各长柄扁桃种子的萌芽率与千仁重、种仁体积(长×宽×厚)呈正相关;除6-BA处理外,在其他处理中,长柄扁桃2号和长柄扁桃4号的萌芽率均高于其他3种扁桃。除6-BA和Met处理外,在其他处理中,长柄扁桃2号和长柄扁桃4号的发芽指数均高于其他3种扁桃。
3.2 植物生长调节剂对长柄扁桃种子萌发的影响
GA3对种子的萌芽起着重要的作用,特别是对打破种子休眠,促进种子萌发有积极的作用[22-23]。H2O2预处理可以加速萌发、降低温度和盐对种子萌发的影响、减除 ABA对萌芽的阻碍作用[17]。GA3和H2O2处理的各长柄扁桃种子萌芽率、发芽指数都明显高于同一品种对照;Cys和Met处理的种子,各指标与同一品种对照没有明显的差异;6-BA和SA对种子的萌发有明显的抑制。而有研究者的萌芽试验中[18],GA3、6-BA、SA 和 Met可以促进种子萌芽。二者结果不同,可能是种子浸泡的时间和浓度不同引起的,也有可能是种源不同。
3.3 植物生长调节剂对长柄扁桃幼苗的影响
用激素对各长柄扁桃进行处理,目的是清除种子吸胀与萌发的障碍,以促进胚的生长,缓和逆境的不良影响,提高种子的发芽率和幼苗的生活力[11]。不同激素处理的各长柄扁桃种子幼苗生长状况不同。其中,在所有处理中,H2O2处理的长柄扁桃种子幼苗生长最好;GA3处理的长柄扁桃种子幼苗的根系和茎生长都偏是细长型,所以幼苗生长的健壮程度欠佳;6-BA处理的长柄扁桃种子幼苗的根系和茎都偏钝粗型,所以幼苗生长量(体积)虽然很高,但并不是健康的幼苗;Met和Cys处理的长柄扁桃种子幼苗的生长状况与对照相比,没有明显的促进作用,甚至还有抑制作用。
综合以上分析和讨论可知,经H2O2处理的长柄扁桃2号和4号萌芽率和发芽指数较其他处理和品种都高,且幼苗生长状况最佳。
[1] 李国平,申烨华,李聪,等.沙生植物长柄扁桃种子油制备生物柴油研究[C/OL].http://www.doc88com/p-197579357865.html,2008.
[2] 邹林林,红雨,任国学.濒危植物蒙古扁桃和柄扁桃种子萌发率和幼苗生长比较研究[J].内蒙古师范大学学报:自然科学汉文版,2008,37(6):791-794.ZOU L L,HONG Y,REN G X.The comparative research on the germination rate and seedling growth of the endangered plants Prunus mongolica and Prunus pedunculata[J].Journal of Inner Mongolia Normal University:Nat.Sci.Edi.,2008,37(6):791-794.(in Chinese)
[3] LARSEN S U,ERIKSEN E N.Delayed release of primary dormancy and induction of secondary dormancy in seeds of woody taxa caused by temperature alternations[J].Acta Horticulturae,2004,630:91-100.
[4] BEWLEY J D,BLACK M.Seeds physiology of development and germination[M]//The language of science.New York:Plenum Press,1994.
[5] KEBREAB E,MURDOCH A.A quantitative model for loss of primary dormancy and induction of secondary dormancy in imbibed seeds of Orobanche spp.[J].Journal of Experimental Botany,1997,50:211-219.
[6] KATHRYN J S.Dormancy release during hydrated storage in Lolium rigidum seeds is dependent on temperature,light quality,and hydration status[J].Journal of Experimental Botany,2004,398:929-937.
[7] RAINA R,JOHRI A K,SRIVASTAVA L J.Seed germination studies in Swetia chirata[J].Seed Research,1996(1):62-63.
[8] MACCHIA M,ANGELINI L G,CECCARINI L.Methods to overcome seed dormancy in Echinacea angustifolia DC.[J].Scientia Horticulturae,2001,89:317-324.
[9] 斯琴巴特尔,满良.蒙古扁桃种子萌发生理研究[J].广西植物,2002,22(6):564-566.SECHENBATER,MAN L.Study on seed germination's physiology of Prunus mongolica Maxim[J].Guihaia,2002,22(6):564-566.(in Chinese)
[10] 斯琴巴特尔,满良,阿木兰,等.植物激素对蒙古扁桃种子萌发的影响[J].内蒙古师范大学学报:自然科学汉文版,2002,31(4):384-387.SECHENBATER,MAN L,A M L,et al.Effect of plant hormones on seed germination of Prunus mongolia Maxim[J].Journal of Inner Mongolia Normal University:Nat.Sci.Edi.,2002,31(4):384-387.(in Chinese)
[11] 侯江涛,克热木·伊力,高启明.不同处理对扁桃种子发芽率及幼苗生长的影响[J].种子,2005,24(12):4-9.(in Chinese)HOU J T,KENG RM,GAO Q M.Effect of different treat ments on seed germination and seedling growth of amlond seed[J].Seed,2005,24(12):4-9.
[12] ELIAS P,ELIAS M,OLGA M,et al.Effect of pretreatments on seed germination of Prunus mahaleb L.[J].Not.Bot.Horti Agrobo,2012,40(2):183-189.
[13] ZAHRA K F,MAJID A,SAMRIA N.Seed germination and dormancy breaking techniques for Echinacea purpurea L.[J].Biol.Environ.Sci.,2011,5(13):7-10.
[14] 马小卫,郭春会,罗梦.核壳、盐和水分胁迫对长柄扁桃种子萌发的影响[J].西北林学院学报,2006,21(4):69-72.MA X W,GUO C H,LUO M.Influence of endocarp,salt and water stress on the seed germination of Amygdalus pedunculata[J].Journal of Northwest Forestry University,2006,21(4):69-72.(in Chinese)
[15] RABHI M,CASTAGNA A,REMORINID,et al.Photosynthetic responses to salinity in two obligate halophytes:Sesu-vium portulacastrumand Tecticornia indica[J].South African Journal of Botany,2012,(79):39-47.
[16] RODRIGOQ M,MARCELAT P O,RAFAELAM C,et al.Germination of prosopis juliora(Sw)DC seeds after scarification treatments[J].Plant Species Biology,2011 (26):186-192.
[17] KURSAT C,KUDRET K.Effects of hydrogen peroxide on the germination and early seedling growth of barley under NaCl and high temperature stresses[J].Eurasian Journal of Bio.Sciences,2010(4):70-79.
[18] PATIL M S,GAIKWAD D K.Effect of plant growth regulation on seed germination of oil yilding plant Simarouba glauca DC.[J].Plant Sciences Feed,2011,1 (5):65-68.
[19] 张檀,郑瑞杰,梅立新,等.长柄扁桃种子萌发特性的研究[J].西北林学院学报,2006,21(4):73-76.ZHANG T,ZHENG R J,MEI L X,et al.Germination characters of the seeds of the Amygdalus pedunculata Pall.[J].Journal of Northwest Forestry University,2006,21(4):73-76.(in Chinese)
[20] 王忠.植物生理学[M].北京:中国农业出版社,2008:496-500.
[21] 桑红梅,彭祚登,李吉跃.我国林木种子活力研究进展[J].种子,2006,25(6):55-59.
[22] VANDELOOK F,BOLLE N,VAN J A.Seed dormancy and germination of the European Chaerophydlum temulum (Apiaceae)a member of a trans-atlantic genus[J].Ann.Bot.,2007,100:233-239.
[23] PEREZ G F.Effect of cryopreservation,gibberellic acid and mechanical scarification on the seed germination of eight endemic species from the Canary Islands[J].Seed Sci.,Technol.,2008,36:237-242.
——以起源权属为例

