有机凝胶构筑液态油脂晶体网络的研究进展
傅 红 张 虹 郑丽婷 罗淑玲 胡 鹏 叶秀云
(福州大学生物科学与工程学院1,福州 350108)
(丰益(上海)生物技术研发中心有限公司2,上海200137)
有机凝胶构筑液态油脂晶体网络的研究进展
傅 红1张 虹2郑丽婷1罗淑玲1胡 鹏2叶秀云1
(福州大学生物科学与工程学院1,福州 350108)
(丰益(上海)生物技术研发中心有限公司2,上海200137)
消费者在十年来对膳食中减少饱和脂肪酸和消除反式脂肪酸的需要,促使脂类质构剂的研究日趋活跃。在液态油脂中添加小分子质量和低浓度的有机凝胶,可以自组装成晶体网络结构,代替饱和脂肪和反式脂肪以固化油脂。植物甾醇、神经酰胺、烷烃和蜡、单酰基甘油酯、乙基纤维素等都属于能够构建疏水性液态油脂的有机凝胶类型。全面叙述了作为新型脂类质构剂的有机凝胶的研究进展和应用前景,并总结了有机凝胶晶体网络微观结构的分析方法,及其分子间非共价键组成晶格的形式和方法。
有机凝胶 脂类质构剂 自组装脂肪晶体网络 氢键
有机凝胶具有固定原油或植物油等疏水性液体成分,并呈现类似于固体流变学特性的基本属性,在构建超分子物质结构方面发挥越来越重要的作用,是近年来在食品、化妆品和药品上迅速发展的新型分子功能材料[1]。十年来,由于消费者对减少食物中饱和脂肪并消除反式脂肪的迫切需求,有力促进了有机凝胶作为传统食用油脂中固态三酰甘油替代剂的研究,为食品工业降低脂类心血管疾病的高风险因素提供了依据和可行性。
根据傅红等[2-3]对2005—2009年中国反式脂肪酸食品的调查结果,国内反式脂肪和饱和脂肪含量最多的是某些特种油脂,如人造奶油、含有夹心层和涂层的各类烘焙食品用油。自2013年中国卫生部《预包装食品营养标签通则》实施以来,国内食品企业积极控制饱和脂肪和部分氢化产品反式脂肪的添加[4]。但是对于面团起酥食品,如牛角面包和丹麦点心等烘焙食品,几乎不可能完全消除这一类脂肪的添加。因为传统商用起酥油中的饱和及反式脂肪具有高熔点、高固体脂肪指数(SFI)的晶体特性,可以覆盖面筋粒子阻止面筋蛋白的交联,形成短而脆的面团质构,其栅栏作用阻碍了液态三酰甘油的“渗出”。目前,液态油脂的有机凝胶化可加强脂肪原料“固化”结构,维持面团可塑性和弹性功能,并最终达到降低或消除饱和及反式脂肪的目的[5]。
1 有机凝胶的形成机理和特性
有机凝胶网络通常由非共价键的分子间弱作用力形成。以12-羟基硬脂酸(12-Hydroxystearic,简称12-HAS)为例,12-HSA分子间羟基构成了氢键,其晶体堆积是沿着纤维轴状的单轴而结晶的,锯齿形的氢键序列沿着纤维轴平行排列,晶体相互作用,形成自组装的纤维状网络结构(self-assembled fibrillar network,简称 SAFiN),如图1所示[6]。
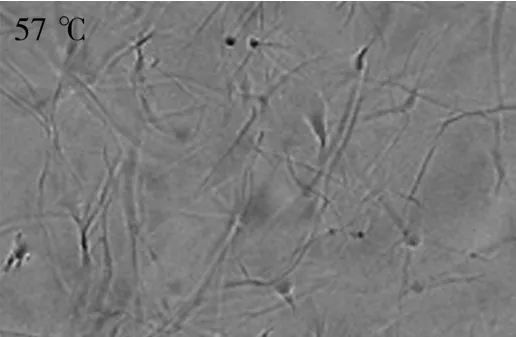
图1 SAFiN凝胶网络通过毛细作用力截留溶剂,赋予材料类似固体的性质[6]
大部分有机凝胶剂可以在疏水性溶剂中形成不对称的中等尺度结构[7]。如果生长受到一个维度的限制,则形成纤维状或针状的中等尺度结构;如果生长受到二维限制,则得到薄片状结构;在三维结构中,大小不同的有机凝胶超分子形成网络,并最终导致凝胶化。有机凝胶剂在溶剂中的成胶能力,被认为是溶剂和凝胶剂之间可溶与不可溶的一种平衡——一个凝胶剂分子必须相对不溶,以至于形成结晶或自组装成中等尺度结构;但又必须相对可溶,能够与溶剂分子相互作用,否则就形成了沉淀物,而不是凝胶。
大部分有机凝胶属于非聚合体化合物,具有“低分子质量、低凝胶浓度”的“两低”特性,这和传统的凝胶体系有本质区别。常见的食品凝胶体系,包括许多蛋白质凝胶和多糖凝胶,如乳清蛋白凝胶、酪蛋白凝胶、藻酸盐凝胶、卡拉胶、淀粉凝胶等,主要是多分子或高分子聚合体,都不属于有机凝胶。通常情况下,由于构建疏水性液体的 “低分子质量有机凝胶”分子间无共价键形成,所以属于热可逆凝胶,又因为分子作用力为较弱的RT等级,所以对温度高度敏感[8]。另外,产生凝胶的分子数量相对较低,通常小于10%就足以形成凝胶质构,如12-HAS的凝胶浓度低至0.5%[9],这和花生酱、沙拉酱和蛋黄酱等产品是依靠高体积分数构成“堵塞的”压缩体系来维系硬度和质构特性是不同的。
在脂质代谢方面,临床试验表明摄入卡诺拉菜籽油的有机凝胶后,受试者餐后三酰甘油、游离脂肪酸等心血管疾病标志物的水平,显著低于摄入黄油或人造黄油产品;体外模拟十二指肠的试验显示有机凝胶化减少了三酰甘油的脂解作用。有机凝胶作为载体物质,还可以控制性释放生物活性化合物和功能性成分。在油脂工业上,有机凝胶的增稠能力可以抑制油脂迁移,减缓巧克力糖果的霜化或花生酱的多相分离等质量缺陷[10-11]。
2 构筑液态油脂晶体网络的有机凝胶种类
理想的油脂食品有机凝胶除了具有和固体脂肪类似的物理性质(特定温度下的硬度、可塑性、熔点和融化曲线),以保证其在储存温度(5~25℃)和生理温度(37℃)下使用时可以加强液态油脂的坚固性以阻止渗出,还应符合食品安全的管理要求,属于食品等级的可添加物质或食品添加剂。另外,在经济成本上必须相对便宜;而且在较低的添加浓度下应呈现出较好的构建油脂能力,避免由于摄入过量而产生不期望的后果。
2.1 植物甾醇型有机凝胶
由于植物甾醇的降低LDL血清水平的功能具有明显的商业价值,甾醇型有机凝胶成为近十年来文献最常报道的热门研究课题[12-13]。植物甾醇酯γ-谷维素和二氢胆甾醇、胆固醇、β-谷甾醇、胆甾醇烷及豆甾醇的植物甾醇混合,可以形成有机凝胶。多年以来,Bot工作组研究β-谷甾醇和γ-谷维素混合物在植物油中的凝胶性能[14],2005年,此领域研究获得美国专利授权[15],并且Bunge公司已将其作为营养添加剂在油脂中使用[16]。
甾醇分子凝胶特性和化学结构相关。形成晶体网络结构的甾核中的环戊烷氢化菲必须存在—OH基团,并且环内双键的数量不能大于一个,不符合上述特征的麦角固醇和5α-胆甾烷就不能形成凝胶[17]。显微结构研究表明,甾醇和甾醇酯在植物油中可以自组装成纳米级管状晶体,管状晶体直径为6.7~8.0 nm,壁厚 0.8~1.2 nm[18]。管状晶体的聚集和交互作用构成了空间网络结构,以固化植物油。
池建伟等[19]利用傅里叶红外光谱法,通过分析分子官能团吸收峰的特征变化,表明等摩尔量的β-谷甾醇和γ-谷维素有机凝胶的吸收峰强度和位移都发生了最明显的变化。其中β-谷甾醇的羟基伸缩振动吸收峰从3 440.18 cm-1红移到3 145.68 cm-1,并且谱带变宽;γ-谷维素羰基特征伸缩振动的吸收峰从1 710.49 cm-1红移到1 683.09 cm-1;此结果证实了β-谷甾醇的羟基(R—O—H)可以与γ-谷维素电负性强的羰基(—═C O)氧原子,形成分子间氢键R—O—H…O—R'的理论推测。研究结果揭示了植物甾醇型有机凝胶网络结构形成的本质规律。植物甾醇型有机凝胶对棕榈油的构建见图2。此外,还确定了植物甾醇型特种油脂的制备条件。

图2 偏振光显微镜下的植物甾醇型有机凝胶对棕榈油的构建
2.2 神经酰胺有机凝胶
Rogers等[20]发现神经酰胺脂肪酸部分的链长影响凝胶化能力。和大多数有机凝胶的分子链长增加导致更高的凝胶化效率不同,神经酰胺中较短的脂肪酸链长更有利于有机凝胶化。比如C-2脂肪酸的合成神经酰胺形成凝胶的最低质量分数为2%,而类似的C-24神经酰胺在5%以上才能形成凝胶。X-射线衍射发现,神经酰胺分子结晶呈双层斜方晶亚晶包堆积[21];均匀脂肪酸链长度的神经酰胺的微观晶体结构为纤维状或针状[20]。
2.3 山梨醇酯和卵磷脂混合物的有机凝胶
Pernetti等[22]研究发现,山梨糖醇三硬脂酸脂(STS)和卵磷脂的混合物在最低质量分数为4%、卵磷脂:STS为2∶3~3∶2时,可以使植物油凝胶化。X射线散射观察混合物的晶体结构,表明只有卵磷脂时无衍射光谱;但是当STS与卵磷脂混合时有衍射峰产生,其小角度区域显示存在几个C18分子堆积成的双层排布衍射峰(高阶反射),在广角区域有一个单一的间距为0.42μm的衍射峰,显示晶体呈现六方堆积亚晶胞。显微照片表明,该凝胶由分散的平均长度约为10μm的针状晶体构成。
山梨醇酯和卵磷脂混合物凝胶具有明显的低熔点,在冷藏温度下(5~15℃)硬度保持相对稳定,但当温度高于30℃时,几乎失去了所有的固性。另外,凝胶对水具有敏感性,这2个特征限制了山梨醇酯和卵磷脂混合物凝胶在食品中的应用。
2.4 n-烷烃和蜡的有机凝胶
n-烷烃和蜡的有机凝胶主要包括n-烷烃分子、小烛树蜡、米糠蜡和棕榈蜡,它们能够在液态的三酰甘油中形成晶体状凝胶。
n-烷烃分子被认为是最简单的疏水性有机凝胶,长链n-烷烃凝胶所需的最低摩尔浓度伴随链长增加而降低,而凝胶稳定性随链长的增加而增加[23]。小烛树蜡是FDA批准使用的食品添加剂,可以作为某些食品中的上光剂。小烛树蜡产自墨西哥北部和美国西南部地区常绿灌木(大戟蜡果)原生叶,是以高熔点烷烃为主的复杂混合物,其成分主要是C29、C31和C33的奇数烃类混合物,其中至少一种成分C31烷烃,显示有机凝胶化的能力。已经证明低至2%的小烛树蜡可以加强植物油的固化结构[24];烷烃链的奇偶性和三萜类化合物等杂质影响了微观片晶大小。米糠蜡可从去蜡得米糠油副产物得到,在亚洲稻米种植区来源丰富[25]。米糠蜡的主要化学成分是具有48~60个碳原子的偶数脂肪族蜡酯。1%米糠蜡的色拉油有机凝胶晶体形态为针状,针状的长度在20~50μm之间。棕榈蜡是一种从巴西棕榈树的叶和叶芽中得到的植物蜡[26]。棕榈蜡成本高,因此仅用于高价值附加值应用。棕榈蜡的组成类似于米糠蜡,含有约1%的烃,约40%的脂族酯和高比例的其他化学成分[27]。
研究表明,同样的室温(25℃)条件下,0.5%的米糠蜡就足以形成有机凝胶结构,小烛树蜡形成凝胶的最低质量分数为1%,巴西棕榈蜡为4%。三者中米糠蜡的凝胶硬度最大,这可能要归因于米糠蜡较高的熔化焓而导致较强的分子堆积效应[28]。
2.5 脂肪酸和脂肪醇
在食用油脂中,脂肪酸随着链长的增加,会减少植物油凝胶化所需的最低浓度,如月桂酸为15%,而硬脂酸为2%。硬脂酸凝胶的显微镜照片揭示了直径约300 nm的多层囊泡的出现,这些多层囊泡形成网络,并可能进一步导致油脂凝胶化[5]。
除了链长,各种官能团(除羧酸基团外)在构建中的作用也不相同[29]。二羧酸,如己二酸,辛二酸和癸二酸在凝胶植物油中的效率,比具有相同长度的一元羧酸更好。另外,12-HSA中12位羟基基团的取代,导致它在特定的油脂中凝胶化效率成倍增加。二羟基脂肪酸也能形成凝胶,但效率不如单羟基脂肪酸,添加甲基基团将降低凝胶化效率。同时,相应的脂肪酸甲酯和脂肪酸相比,凝胶能力也大大降低;脂肪醇的凝胶能力也比脂肪酸弱。Gandolfo等[30]研究了具有相同链长的脂肪族化合物的混合物来构建植物油,结果发现脂肪醇和相同链长的脂肪酸混合物将产生协同效应,形成比单体物质更加坚硬和更具弹性的凝胶。
2.6 单酰基甘油酯有机凝胶
单酰基甘油酯形成的有机凝胶,可能是目前唯一在商业化油脂中已得到广泛应用的成熟体系。分子蒸馏单甘脂在油水两相之间构成双分子层,进一步形成液晶网络结构的能力,早已被食品学界熟知[31]。像三酰甘油一样,这些晶体可以堆积成α(六方晶系),β′(斜方晶系)和β(三斜晶系)三种典型的亚晶包,稳定性依次增加。
2.7 其他类型有机凝胶
以上描述的是低分子质量有机凝胶,但高聚物的植物油凝胶化却是一个新课题。迄今为止,只报道了一种高聚物乙基纤维素,适合于植物油的凝胶化。Dey等[32]研究表明,乙基纤维素也能够在其他疏水性溶剂中形成凝胶。另外,干的稳定化蛋白乳化剂也可以形成有机凝胶,小变形流变学试验表明β-乳球蛋白可以在石蜡油和橄榄油中形成凝胶,或者在油水混合体系中通过喷雾干燥或热交联的方法将其干燥至水分含量约0.25%时,形成多面体的泡沫状结构[33]。
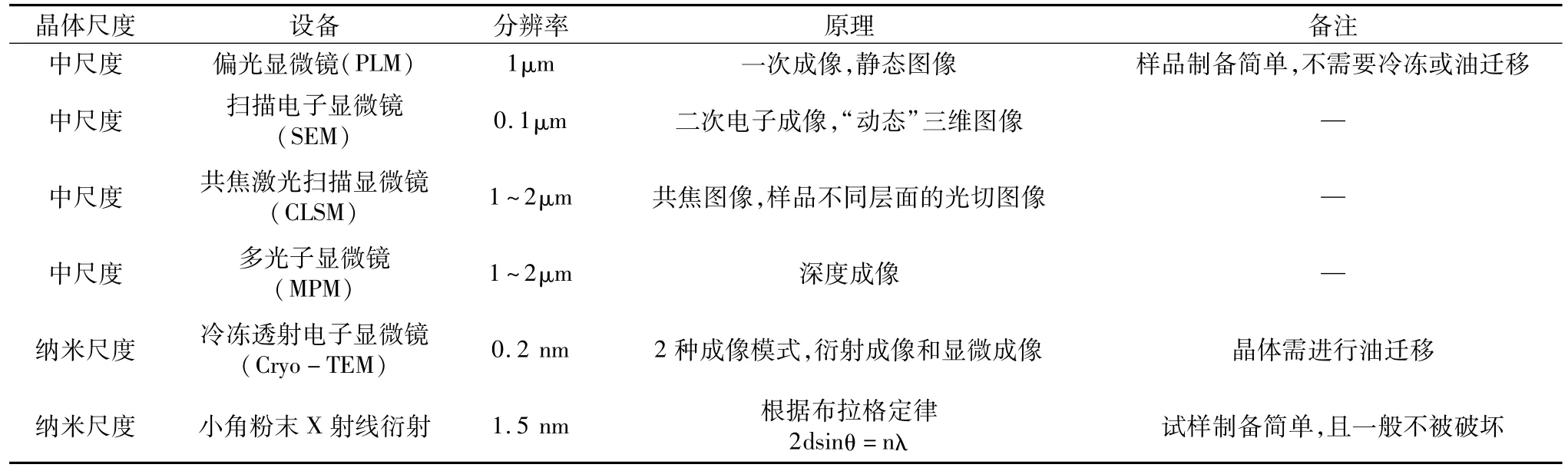
表1 油脂晶体中尺度和纳米尺度显微网络结构的研究方法
3 有机凝胶晶体网络结构的分析方法
3.1 有机凝胶晶体网络结构的观察和表征方法
1~100μm的粒子微观结构通常被称作“中尺度”,许多显微技术可用于此范围的脂肪晶体网络的微观结构领域研究[34-36]。例如,偏光显微镜可以直接观察油中的晶体,而不需要冷冻样品或是油迁移。相比之下,扫描电子显微镜具有更高的分辨率,并由于电子束不能穿过样品,所以可对晶体的表面形态进行更深入的研究,如用于冷冻断裂脂肪研究。共焦激光扫描显微镜和多光子显微镜则由于光束可以进入到更深的样品中,弥补了传统光学显微镜和电子显微镜的不足,但其分辨率较低。
对于更小的单个三酰甘油薄层(3~6nm)或单个三酰甘油多晶体(1~3μm)尺度范围,即纳米尺度的关注,是最近的研究热点[37]。但由于油脂晶体中液体油的存在阻碍了对纳米结构的合理分析,所以需要特殊的制备技术将液体油从固体脂肪中移除,才可能观察到对接近单个晶体片晶的纳米结构[37]。Acevedo等[38-39]发明了一种基于冷溶剂萃取截留油相的方法,通过破坏油脂晶体网络并取出形成的纳米片晶体,用冷冻透射电子显微镜让纳米晶体成像,这可以更加清晰地认识片晶结构和油脂晶体网络的结构层次。油脂晶体微米级和纳米级结构研究方法如表1所示。
粉末X-射线衍射已被广泛用于油脂晶体网络的研究。X-射线衍射所测数据通常定义为多晶型的长距和短距;小角区域内最大特定衍射峰的一半宽度可以通过谢乐公式进行分析,得到纳米晶体的结晶域尺寸D,相当于纳米片的厚度[38]。不同X-射线衍射仪器的特点和它们在有机凝胶体系中的应用实例如表2所示。

表2 不同X射线衍射的适用范围和在有机凝胶中应用举例
3.2 有机凝胶晶体网络相互作用力
有机凝胶在油脂中的自组装结构,主要是通过氢键、范德华力等非共价键结合方式获得的。为了阐明油脂晶体网络的纳米结构,不仅需要将主要晶体的排列可视化,而且了解这些基本单元之间的相互作用力也显得尤为重要。近30年来,分子间范德华力的值可以通过使用表面力仪测量固体表面的各项测量值,并结合Lifshitz理论的不同方法计算Hamaker系数A得到[37,42-44]。作为重要的有机凝胶晶体网络相互作用力的氢键,常用的仪器测试手段主要有红外光谱、核磁共振,X-射线衍射和中子衍射等。其中,拉曼光谱常和红外光谱的联合使用相得益彰,X-射线衍射和中子衍射可以得到有关氢键的更加准确的数值[45]。
4 结论和展望
迄今为止,有机凝胶剂的发现通常是在试验中意外发现的,它在食用油脂方面的研究和应用还处于起步阶段。因此,有机凝胶对诸如油脂结晶、表面化学、物理和材料科学等多个领域的影响和作用,都存在有待深入认识和解决的重要问题。未来最值得关注的领域,是在关于有机凝胶的超分子性质研究中,如何理解和阐明其不对称中尺度结晶的原理,寻找自组装法则的本质规律,重新合成有机凝胶剂体系。现代工业中,疏水性液体的有机凝胶化在生物组织工程、无机纳米结构的模板化合成、生物传感器、纳米线、煎炸油的处置、溢出油的回收和艺术品保护的清洁剂等方面,具有广泛的应用前景。相信在不久的将来,有机凝胶作为食品级可替代饱和脂肪和反式脂肪的质构剂,也会占据重要的一席之地。
志谢:本研究得到丰益(上海)生物技术研发中心有限公司资助,特此致谢!
[1]Weiss RG,Térech P.Molecular gels:materials with selfassembled fibrillar networks[M].Springer, Dordrecht,2006:1-16
[2]Fu H,Yang L,Yuan H J,et al.Assessment of Trans Fatty Acids Content in Popular Western-Style Products in China[J].Journal of the American Oil Chemists Society,2008,73(8):383-391
[3]傅红,赵霖,杨琳,等.中国市售食品中反式脂肪酸含量的现状研究[J].中国食品学报,2010,10(4):48-52
[4]姜元荣,夏树华,张余权,等.中国市场食品中反式脂肪酸含量现状调研[J].中国粮油学报,2013,28(5):112-115
[5]Edmund Daniel CooAlejandroG.Marangoni.Organogels:An Alternative Edible Oil-Structuring Method[J].Journal of the American Oil Chemists Society,2012,89:749-780
[6]Rogers M A,Marangoni A G.Non-isothermal nucleation and crystallization of 12-hydroxystearic acid in vegetable oils[J].Crystal Growth&Design,2008,8:4596-4601
[7]Estroff L A,Hamilton A D.Water gelation by small organic molecules[J].Chemical Reviews,2004,104:1201-1218
[8]Smith D K.Molecular gels-nanostructured soft materials[C]//Atwood JL,Steed JW (eds)Organic nanostructures.Wiley-VCH,Weinheim,2008:111-153
[9]Burkhardt M,Kinzel S,Gradzielski M.Macroscopic properties and microstructure of HSA based organogels:sensitivity to polar additives[J].Journal of Colloid and Interface Science,2009,331:514-521
[10]Elliger C A,Guadagni D G,Dunlap CE.Thickening action of hydroxystearates in peanut butter[J].Journal of the A-merican Oil Chemists Society,1972,49:536-537
[11]Hughes N E,Marangoni A G,Wright AJ,et al.Potential food applications of edible oil organogels[J].Trends in Food Science&Technology,2009,20:470-480
[12]Zinic M,Vogtle F,Fages F.Cholesterol-based gelators.In:Fages F(ed)Topics in current chemistry#256:low molecular mass gelators:design,self-assembly,function[M].Springer,Berlin,2005:39-76
[13]Katan M B,Grundy SM,Jones P,et al.Efficacy and safety of plant stanols and sterols in the management of blood cholesterol concentrations[J].Mayo Clinic Proceedings,2003,78:965-978
[14]Gill V.Feature:kitchen chemistry-one of the world's largest food companies has reinvented its approach to R&D[J].Chemistry World,2008,5:60-63
[15]Heike Ritter,Robert Leovan de Sande,Volkmar Muller.Liquid fatty component containing composition[P].US 6846507 B1.2005-01-25
[16]Pszczola D E.Fats:the good,the bad,and the in-between[J].Food Technology,2012,6:81-100
[17]Bot A,Agterof WGM.Structuring of edible oils by mixtures ofγ-oryzanol withβ-sitosterol or related phytosterols[J].Journal of the American Oil Chemists Society,2006,83:513-521
[18]Bot A,den Adel R,Roijers EC.Fibrils ofγ-oryzanol+β-sitosterol in edible oil organogels[J].Journal of the A-merican Oil Chemists Society,2008,85:1127-1134
[19]池建伟,张虹,傅红,等.β-谷甾醇与γ-谷维素键和特征的红外光谱分析[J].中国粮油学报,2013,28:97-101
[20]Rogers M A,Wright A J,Marangoni A G.Oil organogels:the fat of the future[J].Soft Matter,2009,5:1594-1596
[21]Raudenkolb S,Wartewig S,Neubert RH.Polymorphism of ceramide 3.Part 2:a vibrational spectroscopic and X-ray powder diffraction investigation of N-octadecanoylphytosphingosine and the analogous specifically deuterated d35 derivative[J].Chemistry and Physics of Lipids,2003,124:89-103
[22]Pernetti M,van Malssen K F,Kalnin D,et al.Structuring edible oil with lecithin and sorbitantristearate[J].Food Hydrocolloids,2007,21:855-861
[23]Marie E,Chevalier Y,Brunel S,et al.Settling of paraffin crystals in cooled middle distillate fuels[J].Journal of Colloid and Interface Science,2004,69:117-125
[24]Toro-Vazquez J F,Morales-Rueda J A,Dibildox-Alvarado E,et al.Thermal and textural properties of organogels developed by candelilla wax in safflower oil[J].Journal of the American Oil Chemists Society,2007,84:989-1000
[25]Wolfmeier U,Schmidt H,Heinrichs FL,et al.Waxes.In:Hans-Jurgen A(ed)Ullmann's encyclopedia of industrial chemistry,5th edn[M].Wiley-VCH,Weinheim,2005,63
[26]Koonce SD,Brown JB.An historical review of the chemistry of carnauba wax[J].Journal of the American Oil Chemists Society,1944,21:167-170
[27]Vandenburg L E,Wilder E A.The structural constituents of carnauba wax[J].Journal of the American Oil Chemists Society,1970,47:514-518
[28]Dassanayake LSK,Kodali DR,Ueno S,et al.Physical properties of rice bran wax in bulk and organogels[J].Journal of the American Oil Chemists Society,2009,86:1163-1173
[29]Daniel J,Rajasekharan R.Organogelation of plant oils and hydrocarbons by long-chain saturated FA,fatty alcohols,wax esters and dicarboxylic acids[J].Journal of the American Oil Chemists Society,2003,80:417-421
[30]Gandolfo FG,Bot A,Floter E.Structuring of edible oils by long-chain FA,fatty alcohols and their mixtures[J].Journal of the American Oil Chemists Society,2004,81:1-6
[31]王璋,许时婴,汤坚.食品化学[M].北京:中国轻工业出版社,2010:91-105
[32]Dey T,Kim DA,Marangoni AG.Ethylcelluloseoleogels.In:Marangoni AG,Garti N(eds)Edible oleogels:structure and health implications[M].AOCS Press,Urbana,2011,295-311
[33]Romoscanu AI,Mezzenga R.Emulsion-templated fully reversible protein-in-oil gels[J].Langmuir,2006,22:7812-7818
[34]Campos R,Narine S,Marangoni AG.Effect of cooling rate on the structure and mechanical properties of milk fat and lard[J].Food Research International,2002,35:971-981
[35]Awad TS,Rogers MA,Marangoni AG.Scaling behavior of the elastic modulus in colloidal networks of fat crystals[J].Journal of Physical Chemistry,2004,108:171-179
[36]Shi Y,Liang B,Hartel R W.Crysta l morphology,microstructure,and textural properties of model lipid systems[J].Journal of the American Oil Chemists Society,2005,82:399-408
[37]Nuria C Acevedo,Fernanda Peyronel,Alejandro G.Marangoni.Nanoscale structure intercrystalline interactions in fat crystal networks[J].Current Opinion in Colloid&Interface Science,2011,16:374-383
[38]Acevedo N C,Marangoni A G.Characterization of the nanoscale in triacylglycerol crystal networks[J].Crystal Growth&Design,2010,10:3327-3333
[39]Acevedo N C,Marangoni A G.Towards nanoscale engineering of triacylglycerol crystal networks[J].Crystal Growth&Design,2010,10:3334-3339
[40]Leena I.Christiansen,Jukka T.Rantanen,Anna K.von Bonesdorff,et al.A novel method of producing a microcrystalline in oil[J].Pharmaceutical Sciences,2002,15:261-269
[41]Arjen Bot,Ruud den Adel,Christos Regkos,et al.Structuring inβ-sitosterol+γ-oryzanol-based emulsion gels during various stages of a temperature cycle[J].Food Hydrocolloids,2011,25:639-646
[42]Israelachvili J.In:Israelachvili J,editor.Intermolecular and surface forces.2nd edn[M].London:Academic Press,1992
[43]Richetti P,Kékicheff P.Direct measurement of depletion and structural forces in a micellar system[J].Physical Review Letters,1992,68:1951-1954
[44]Hamaker H C.The London-van der Waals attraction between spherical particles[J].Physica,1937,4:1058-1072
[45]苏成勇,潘梅.配位超分子结构化学基础与进展[M].北京:科学出版社,2010:50-53.
Research Advance of Fat Crystal Network of Liquid Oil Structured by Organogels
Fu Hong1Zhang Hong2Zheng Liting1Luo Shuling1Hu Peng2Ye Xiuyun1
(College of Biological Science and Technology,Fuzhou University1,Fuzhou 350108)
(Wilmar Shanghai Biotechnology Research&Development Centre Co.,Ltd2,Shanghai 200137)
Lipid texture agent is an active area on the basis of consumer demands of saturated fatty acids reduction and trans-fatty acids elimination from the diets in the past decades.By the addition of low molecular weight and low quantities of organogels into edible liquid oil,a self-assembly fat crystal network has been formed to replace saturated fat and trans-fat which traps and solidifies the lipid oil.The organogels structured hydrophobic liquids are phytosterols,ceramide,alkanes and wax,monoacylglycerides,polymer ethyl cellulose,etc.In the paper,the research advance as well as the applied perspective of lipid organogels have been comprehensively discussed.Meanwhile,the analyses of micro-structure of organogel crystal network and the bonding of non-covalent interaction among crystal have been also summarized.
organogels,lipid texture agent,self-assembly fat crystal network,hydrogen bonding
TS22
A
1003-0174(2015)02-0136-06
国家自然科学基金(31271882/C200201),福建省自然科学基金(2013J01131)
2013-11-12
傅红,女,1970年出生,教授,食品脂质开发与应用

