傅里叶变换红外光谱法鉴别纯核桃油并定量检测掺伪含量
梁鹏娟 赵声兰 陈朝银 葛 锋 刘迪秋 樊启猛
(昆明理工大学生命科学与技术学院1,昆明 650500)
(云南中医学院2,昆明 650500)
傅里叶变换红外光谱法鉴别纯核桃油并定量检测掺伪含量
梁鹏娟1赵声兰2陈朝银1葛 锋1刘迪秋1樊启猛2
(昆明理工大学生命科学与技术学院1,昆明 650500)
(云南中医学院2,昆明 650500)
应用傅里叶变换红外光谱(FT—IR)法测定纯核桃油和分别混合大豆油、普洱茶籽油和葵花籽油的掺伪核桃油的红外光谱,结合主成分分析法(PCA)以及马氏距离判别法对核桃油的纯度进行判别,3个判别模型的准确率均达到100%;同时对验证集样品的类归属进行判别,判别准确率达均为100%。结合偏最小二乘法(PLS)定量检测核桃油纯度,建立的PLS校正集模型中核桃油的真实含量与FT—IR预测含量的相关系数R2分别为0.990 8、0.994 4和0.995 5,校正集均方根误差分别为0.032 7、0.023 5和0.019 6。试验结果证明,该方法可以作为核桃油质量监控的快速检测方法。
傅里叶变换红外光谱 核桃油 掺伪 主成分分析—马氏距离 偏最小二乘法
核桃别名胡桃、羌桃,属胡桃科胡桃属植物,是我国重要经济树种之一。核桃油是一种营养价值较高的植物油,近年来,其生物活性成分日益引起关注,不饱和脂肪酸总量高达90%左右,其中,亚油酸和ɑ-亚麻酸质量分数分别为47.4%和15.8%,这些不饱和脂肪酸均为人体必需脂肪酸[1]。医学研究表明:核桃油的多不饱和脂肪酸不仅能使胆固醇酯化,降低血清和肝脏中胆固醇和三酰甘油水平[2-3],同时含有大脑神经纤维和神经细胞的核心天然成分,促进神经网络的形成[4]。核桃油不仅具有药理功效,也可以作为“老人婴儿营养油”和航空工作人员的保健油,还可以用作化妆品以及护理剂[5]。总之,核桃油的使用价值将会越来越多地受到各界关注。
在国际市场上,核桃油同橄榄油一样倍受消费者青睐,市场前景广阔且售价高,然而一些不法经营者将低价位的植物油掺入核桃油中从而牟取暴利。植物油种类不同,脂肪酸组成和营养成分的含量也存在差异,掺假将严重影响核桃油的营养功效;更有甚者在植物油中掺入桐油、大麻籽油、蓖麻油、矿物油、潲水油等非食用油,且这些油脂加工处理后与核桃油掺兑,很难通过感官分析和一些理化指标进行区分;不仅损害了消费者的身体健康,而且严重地损害了消费者以及合法经营者的利益。因此,迫切需要寻找一种快速可靠的核桃油掺伪检测方法,有效地遏制这种行为。食用油掺伪作为一个严重的问题在商业中存在已久,国内外学者对食用植物油的掺假检测方法进行了广泛研究,包括理化方法、色谱法、核磁共振波谱法、红外光谱法[6-7]。理化方法操作简便,经济、易推广,不需昂贵的仪器,但耗时长,不宜于快速检验油脂掺伪工作的开展,且一般都是针对某一种油的特征反应来进行,专一性较强,而且一般只能用来定性不能定量[8]。色谱法和核磁共振法样品用量少,分析快速,适合大批样品的检测,然而该方法所用的仪器较昂贵,操作也复杂,且工作量大、耗时,还需要专门的实验人员[9-10]。
近年来,傅里叶变换红外(FT-IR)光谱逐渐应用到食品研究领域,特别是对于食用油脂的研究已经成为一个强大的分析工具[11]。由于其“指纹技术”,这意味着任何两个即使只有细微差别的样品也绝不会具有相同的FT—IR光谱,无论是在峰的数量,或在最大峰值的强度上都会有所体现[12],此方法的优点在于灵敏度高,速度快、波数准确,重复性好,无需样品前处理,能够在线检测及多组分同时测定等优点。缺点在于特征峰的选取比较困难,各种植物油的光谱图近似,很难直接区分,需要结合各种化学计量学方法进行数据处理分析。本研究将FT—IR与主成分分析法(PCA)、聚类分析法以及偏最小二乘法(PLS)相结合,鉴别纯核桃油以及掺伪核桃油定量检测,均取得良好的效果。
1 材料与方法
1.1 试验材料
纯核桃油和选择的掺伪植物油包括大豆油、普洱茶籽油和葵花籽油均由原料直接制成。分别将大豆油、普洱茶籽油和葵花籽油以一定的比例掺入纯核桃油中,共配制掺伪样品63个,见表1。
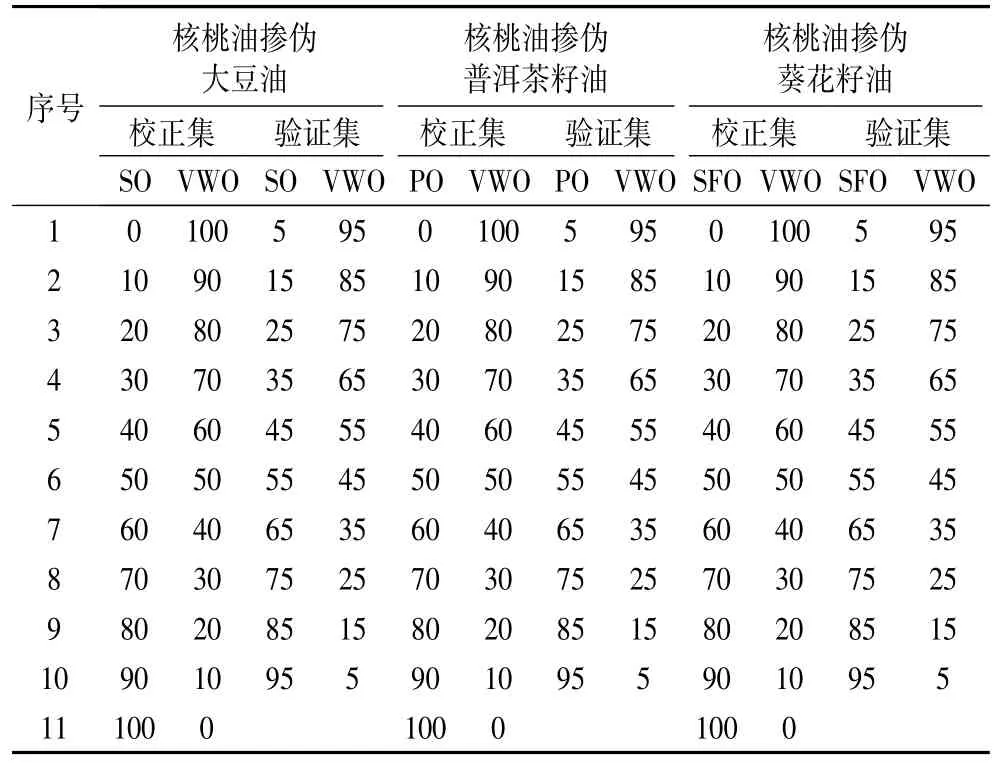
表1 校正集和验证集中核桃油掺伪大豆油、普洱茶籽油和葵花籽油的掺伪比例/%
1.2 光谱采集
采用岛津Irprestige-21傅里叶红外光谱仪,配置DLATGS检测器以及Irsolution控制软件。样品测量时直接将油样滴在2个KBr芯片中间,形成一层均匀的液膜,放在样品室(20℃)测定,光谱区域为4 000~400 cm-1,扫描 40次,分辨率 4 cm-1,要求每次扫描前进行背景扫描以去除空气和湿度的影响。测定每组样品时均要清洗干净压片,先用丙酮清洗2次,再用正己烷清洗2次,最后用脱脂棉擦干,然后进行样品滴加。光谱采集样品详见表1,且另采集20个纯核桃油样品光谱。
1.3 化学计量学分析
化学计量学分析采用SIMCA-P分析软件,选择1 500~1 000 cm-1光谱指纹区域的17个波峰波谷值构建模型。采用主成分分析法(PCA)结合马氏距离判别法鉴别纯核桃油以及掺伪核桃油;采用偏最小二乘法(PLS)定量检测核桃油中掺伪油含量(每种掺伪试验样品都包括11个校正集和10个验证集)。
2 结果与讨论
2.1 光谱分析
油脂的主要成分是直链高级脂肪酸和甘油生成的酯,具有非常相似的化合物组成,因此,它们混合在一起往往是难以察觉的[13]。红外光谱能够用于结构鉴定或通过指纹图谱对有机基团定性分析,主要由于每个有机化合物都有其特定的红外吸收光谱;红外光谱同样可用于定量分析,以(Lambert-Beer)定律为理论基础,红外光谱有许多可供选择的特征波长,因此,气体、液体及固体均可利用红外光谱定量[14]。由于基频振动是红外活性振动中吸收最强的振动,绝大多数有机化合物的化学键振动基频均在中红外区域出现,所以中红外区最适宜进行各种有机物定性和定量分析。
图1表示纯核桃油、大豆油、普洱茶籽油和葵花籽油在4 000~650 cm-1区域的平均光谱信息。观察纯核桃油、大豆油、普洱茶籽油和葵花籽油的红外光谱,可以发现大豆油、普洱茶籽油和葵花籽油与纯核桃油相比,红外光谱极其相似,只存在一些细微差别,主要表现在3 007 cm-1处为芳环的C—H伸缩振动,2 854 cm-1处的—CH3对称和不对称伸缩振动,1 463 cm-1处的—CH3非对称弯曲振动,1 377 cm-1的—CH3对称弯曲振动,1 238 cm-1处的—C—O伸缩振动,1 163 cm-1处是氟原子与芳环直接相接时C—F伸缩振动,1 120 cm-1的—C—O伸缩振动,1 099 cm-1的—C—伸缩振动以及 722 cm-1处的—CH═ CH— 弯曲振动[15-16]。1 500~1 000 cm-1是油脂的红外指纹区[17],因此对纯核桃油鉴别以及定量检测大豆油、普洱茶籽油和葵花籽油在核桃油中的掺伪可以选择这一光谱区域。
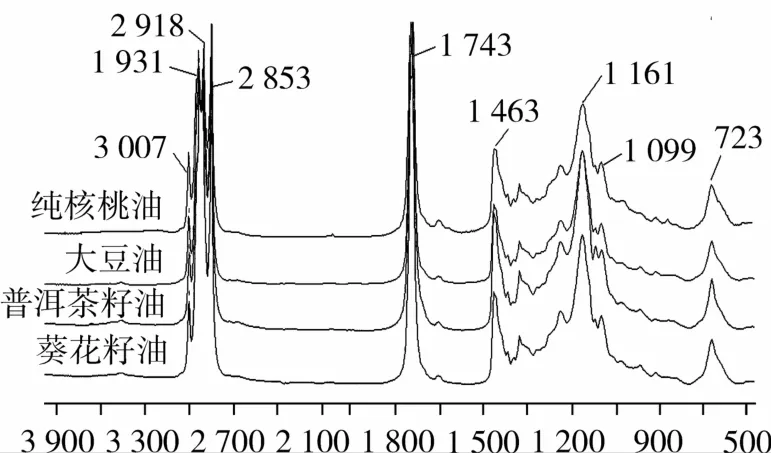
图1 不同油在4 000~650 cm-1区域的光谱图
2.2 主成分分析
主成分分析(principal component analysis,PCA)是一种常用的提取光谱特征信息的方法,也是一种有效的数据降维分析法。利用方差最大原则,通过数学转换,将原始变量线性组合成一组新的变量,即一组主成分,仅用部分主成分就可表达原有变量的主要信息[18]。利用这一特性,可在减少分析指标的同时,尽量减少原指标包含信息的损失,对所收集的资料作全面的分析。对20个独立的纯核桃油样品进行红外光谱扫描,从中选取15张纯核桃油的中红外光谱,并同时对混有大豆油、普洱茶籽油和葵花籽油的掺伪核桃油进行红外扫描,每种掺伪油选取11个掺伪比例,在表1中随机选取。从获得的光谱中选取波段1 500~1 000 cm-1作为指纹特征光谱分析区域,建立主成分分析模型。
图2是纯核桃油与混有大豆油、普洱茶籽油和葵花籽油的掺伪核桃油的红外光谱经过主成分分析后,主成分PC1、PC2、PC3得分的二维散点图。由图2可以看出,主成分PC1、PC2、PC3累计贡献率达到99.9%,几乎能反映样本的全部原始光谱信息,纯核桃油和3种掺伪核桃油在主成分空间中处于相对独立的位置,样本基本得到有效区分,说明纯核桃油和不同种类的掺伪核桃油之间存在显著差异。此外,从图2可知,混有普洱茶籽油的核桃油与纯核桃油相距最远,混有葵花籽油的核桃油与纯核桃油相距最近,混有大豆油的核桃油距离居中。这种分布差异有可能体现了样本的亲缘关系不同,混有葵花籽油的核桃油与纯核桃油分布距离最近,化学成分种类最相近。因此,主成分分析模型不仅能区分纯核桃油和掺伪油,而且还在一定程度上反映样本的亲缘关系。
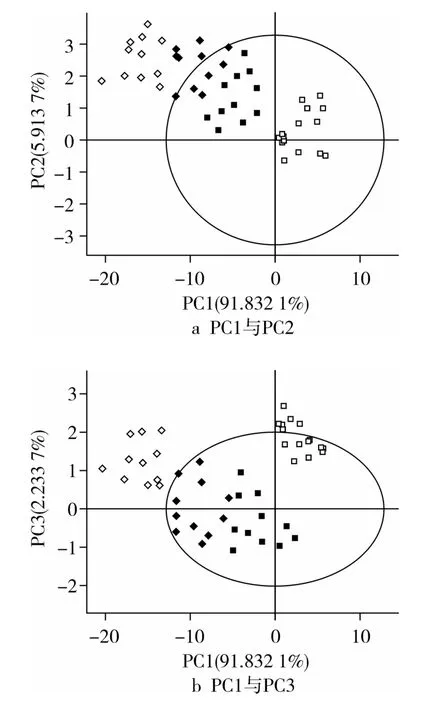
图2 纯核桃油与3种掺伪核桃油样品的主成分得分散点图
2.3 马氏距离判别分析
在红外光谱定性判别分析中,利用测得的光谱来对样品进行归属指定,即判别该样本是否归属某一个总体,这就是差距分析的范围。马氏距离判别分析法,从根本上说,就是利用样本的光谱所提供的最大信息差异或相似性来进行识别[19]。进一步采用主成分分析结合马氏距离法建立判别模型,可以避免选择过多波长造成过度拟合,同时保留了光谱的主要信息[20]。
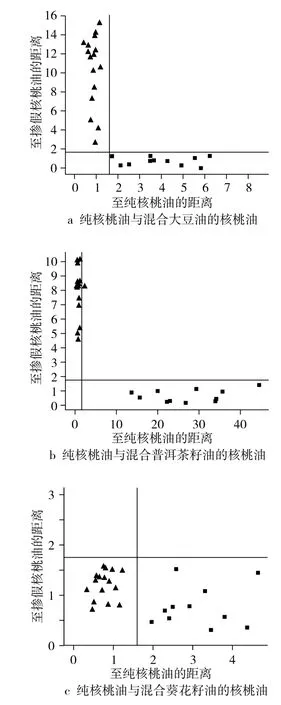
图3 纯核桃油与掺伪核桃油的马氏距离判别分析模型结果
由主成分分析的结果可知,每一种掺伪油的前2个主成分PC1、PC2的累计贡献率均已达到98%,本研究选择前2个主成分来建立模型,以最大限度消除重叠的冗余信息。选取纯核桃油15个,其他3种掺伪油中每1种选取11个掺伪浓度建立校正集模型,选取的掺伪样品与前一步主成分分析时的样品相同,且表1的其余样品作为验证集并进行编号。掺伪大豆油、普洱茶籽油和葵花籽油的核桃油的判别验证集的样品编号分别为 a1~a10、b1~b10和c1~c10,其中a1、b1和c1为表1校正集的1号样,掺伪油含量为零,即为纯核桃油,并另取20个纯核桃油中剩余的5个样品编号为1~5加入验证集。通过SIMCA—P软件计算,建立校正集模型,样品明显聚为2类,纯核桃油和3种掺伪油的判别结果见图3。
为了进一步确证试验建立的3个判别分析模型的可靠性,分别用验证集样品进行验证后,均获得正确分类,分析结果见表2,由表2可知模型的鉴别效果很好,判别率为100%。

表2 模型对验证集样品的预测结果
2.4 偏最小二乘法分析
偏最小二乘法(partial least square,PLS)是一种应用非常广泛的化学计量学方法,它综合了多元线性回归法(MLR)和主成分回归法(PCR)的优势,在一个算法下可以同时实现回归建模、数据结构简化以及两组变量之间的相关分析[21]。预测大豆油、普洱茶籽油和葵花籽油在核桃油中的掺伪量,首先建立校正集模型,依然选取指纹区1 500~1 000 cm-1的光谱区域,并利用相关系数R2,均方根误差(RMSEC)和交互验证均方根误差(RESECV)值来确定最佳主因子数,R2值越高,RMSEC和RESECV值越小得到的最佳主因子数,说明模型的预测能力越好[22]。
2.4.1 校正集模型的建立与优化
通过SIMCA—P软件对核桃油中混合大豆油、普洱茶籽油和葵花籽油3种掺伪油品建立校正集,模型的相关系数分别为:0.990 8、0.994 4、0.995 5,校正集均方根误差(RMSEC)分别为0.032 7、0.023 5和0.019 6。优化PLS模型采用交叉验证的“除一法”技术,在这项技术中,校正集中的一组样品被剔除,接着用剩余样本建立的模型来预测,并重复该步骤,直到每组样品从模型中被排除1次[23]。则计算3种掺伪油品的交叉验证均方根误差(RMSECV)分别为0.035 2、0.026 9和0.022 5,在此结果的基础上,再结合较高的R2和较低的RMSEC值,确定了3种掺伪油校正集模型的最佳主因子数分别为6、5和5,且进一步证明模型预测性良好。
2.4.2 预测集样品对模型的检验
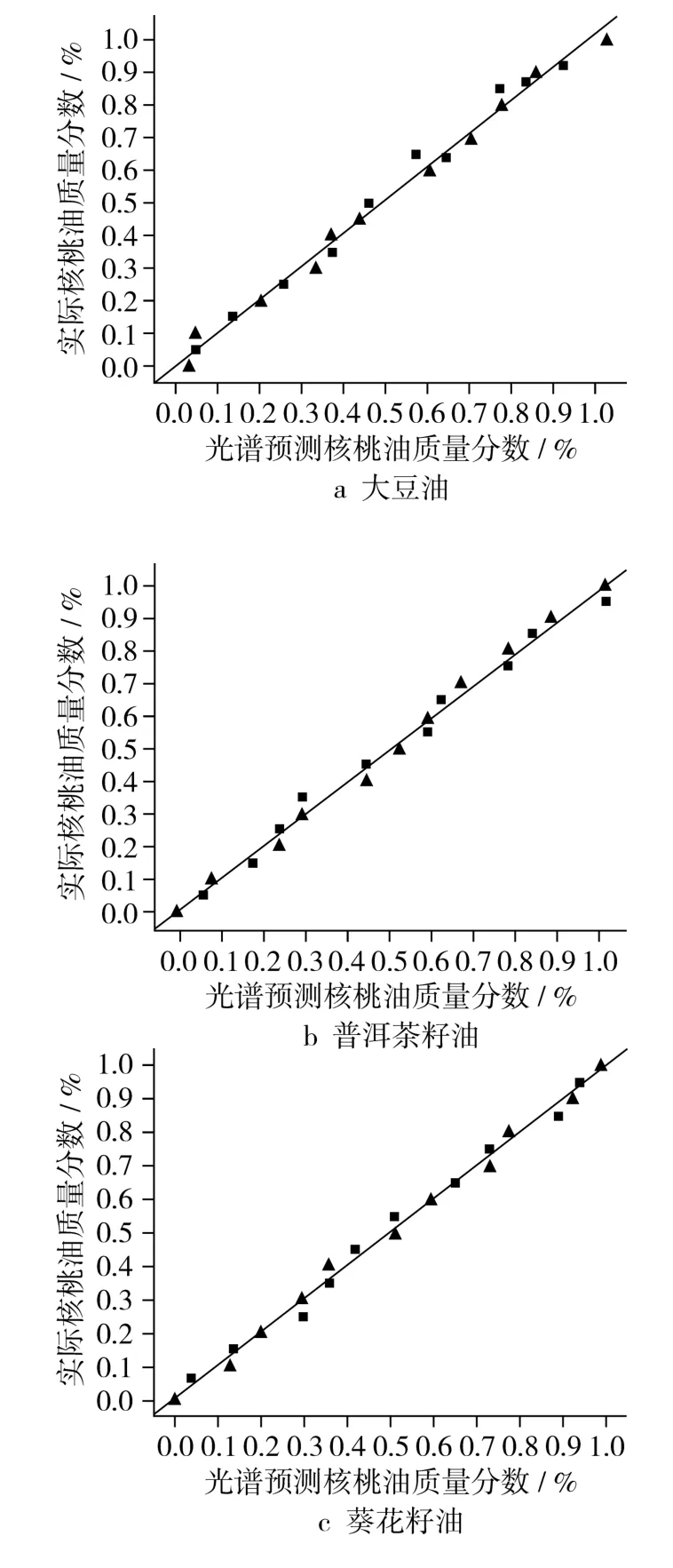
图4 校正集模型对混合不同油脂的掺伪油验证集中核桃油含量的预测
图4表示核桃油的真实百分比与FT—IR估计百分比的PLS校正集模型对验证集的预测。即用建立的校正集对混合大豆油、普洱茶籽油和葵花籽油的掺伪油进行核桃油含量的预测,验证相关系数分别 为0.9861、0.9912和0.9930,R2值均较高;验证集均方根误差(RMSEP)分别为0.047 3、0.034 9和0.028 1,均较低;有以上2点可知试验所建立的PLS校正集模型非常成功,证明FT—IR结合PLS能够准确地对核桃油掺伪含量进行检测。表3包含了所有PLS模型的 R2、RMSECV、RMSEC、RMSEP值,以及建立模型的主因子数。
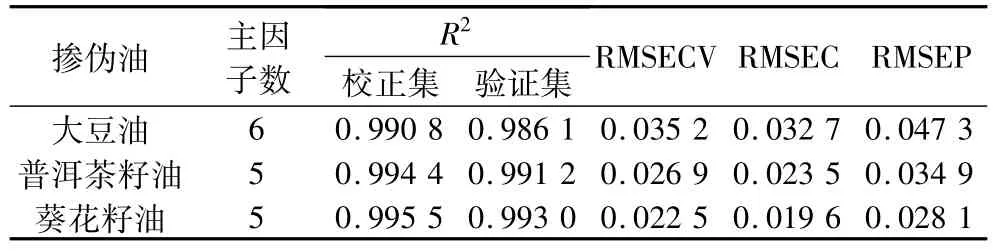
表3 核桃油掺伪大豆油、普洱茶籽油和葵花籽油的PLS模型的相关结果
3 结论
选择大豆油、普洱茶籽油和葵花籽油作为掺伪植物油混入核桃油中,采用FT—IR光谱技术结合PCA和马氏距离判别法能快速鉴别纯核桃油和掺伪核桃油,结合PLS能够准确检测出核桃油的掺伪水平,为核桃油质量的控制和检测提供了一种新的简便方法。
[1]万本屹,董海洲,李宏,等.核桃油的特性及营养价值的研究[J].西部粮油科技,2001,26(5):18-21
[2]翁新楚,董新伟,任国普,等.核桃油研究进展[J].生物工程进展,1994,14(6):56-60
[3]Phillipson B E,Douglas M D,Rothrock M D,et al.Reduction of plasma lipids,lipoproteins,and apoproteins by dietary fish oils in patients with hypertriglyceridemia[J].New England Journal of Medicine,1985,312:1210-1216
[4]赵声兰,陈朝银,葛锋,等.核桃油功效成分研究进展[J].云南中医学院学报,2010,33(6):71-75
[5]赵声兰,唐嘉,葛锋,等.核桃油的几种新产品的开发研究[J].云南中医学院学报,2008,31(1):6l-63
[6]Rossell J B,King B,Downes M J,et al.Detection of adulteration[J].Journal American Oil Chemists’Society,1983,60:333-339
[7]唐佳妮,刘东红.食用植物油掺假鉴别方法研究进展[J].中国粮油学报,2009,24(11):158-162
[8]王江蓉,周建平,张令夫,等.植物油掺伪检测方法的应用与研究进展[J].中国油脂,2007,32(6):78-82
[9]Aparicio R,Aparicio-Ruíz R.Authentication of vegetable oils by chromatographic techniques[J].Journal of Chromatography A,2000,881:93-104
[10]Kamm W,Dionisi F,Hischenhuber C,et al.Authenticity assessment of fats and oils[J].Food Reviews International,2001,17:249-290
[11]Guillen M D,Cabo N.Some of the most significant changes in the Fourier transform infrared spectra of edible oils under oxidative conditions[J].Journal of the Science of Food and Agriculture,2000,80:2028-2036
[12]Pavia D L,Lampman G M,Kriz G.S,et al.Introduction to spectroscopy(3rded.)[M].Thomson Learning Australia,2001
[13]Christy A A,Kasemsumran S,Du Y,et al.The detection and quantification of adulteration in olive oil by near-infrared spectroscopy and chemometrics[J].Analytical Science,2004,20:935-940
[14]代秀迎,郑建明,陈斌,等.傅里叶变换红外光谱在食用油分析上的应用[J].现代科学仪器,2011,2:113-116
[15]Guillen M D,Cabo N.Characterization of edible oils and lard by Fourier transform infrared spectroscopy.Relationships between composition and frequency of concrete bands in the fingerprint region[J].Journal American Oil Chemists’Society,1997,74:1281-1286
[16]Lerma-Garcia M J,Ramis-Ramos G,Herrero-Martinez JM,et al.Authentication of extra virgin olive oils by Fourier transform infrared spectroscopy[J].Food Chemistry,2010,118:78-83
[17]Rohman A,Che Man Y B.Fourier transform infrared(FTIR)spectroscopy for analysis of extra virgin olive oil adulterated with palm oil[J].Food Research International,2010,43:886-892
[18]袁玉峰,陶站华,刘军贤,等.红外光谱结合主成分分析鉴别不同产地黄柏[J].光谱学与光谱分析,2011,31(5):1258-1261
[19]田海清,应义斌,陆辉山,等.基于可见/近红外光谱的乙烯利催熟西瓜与正常成熟西瓜分类试验研究[J].光谱学与光谱分析,2009,29(4):940-944
[20]张灵帅,王卫东,谷运红,等.近红外光谱的主成分分析-马氏距离聚类判别用于卷烟的真伪鉴别[J].光谱学与光谱分析,2011,31(5):1254-1257
[21]Geladi P,Kowalski B R.Partial least-squares regression:A tutorial[J].Analytica Chimica Acta,1986,185(1):1-17
[22]Paradkar M M,Irudayaraj J.A rapid FTIR spectroscopic method for estimation of caffeine in soft drinks and total methylxanthines in tea and coffee[J].Journal Food Science,2002,657:2507-2511
[23]Gurdeniz G,Tokatli F,Ozen B,et al.Differentiation of mixtures of monovarietal olive oils by mid-infrared spectroscopy and chemometrics[J].European Journal of Lipid Science and Technology,2007,109:1194-1202.
The Application of Fourier Transform Infrared(FT-IR)Spectroscopy for Detection and Quantification of Adulteration in Pure Walnut Oil
Liang Pengjuan1Zhao Shenglan2Chen Chaoyin1Ge Feng1Liu Diqiu1Fan Qimeng2
(School of Life Science and Technology,Kunming University of Science and Technology1,Kunming 650500)
(Yunnan University of Chinese Traditional Medicine2,Kunming 650500)
Fourier transform infrared(FT-IR)spectrometer was used to collect infrared spectra of pure virgin walnut oil(VWO)and VWOs adulterated with soybean oil(SO),pure tea seed oil(PO)and sunflower oil(SFO).FT-IR spectroscopy combined with principal component analysis(PCA)and mahalanobis distance were developed for determining the authenticity of VWO,and all the accuracy rates of three models are 100%;Meanwhile,validation samples were used to predict the results by the models,and all the prediction accuracy rates are 100%.The partial least square(PLS)model was further used to predict the levels of these vegetable oils in independent samples for validation purpose.PLS models correlate the actual and FT-IR estimated values of oil adulterants(SO,PO and SFO)with coefficient of determination(R2)of 0.990 8,0.994 4,0.995 5 respectively.The RMSECvalues of SO,PO and SFOin VWOobtained are 0.032 7,0.023 5 and 0.019 6,respectively.The method,therefore,has been as a rapid method for detection and quantification of VWO adulteration.
FT-IR spectroscopy,pure walnut oil,adulteration,principal component analysis-mahalanobis distance,partial least squares
TS227
A
1003-0174(2015)02-0122-06
国家科技支撑计划 (2011BAD46B03),云南省科技计划 (2009EB081,2011AB006)
2013-09-29
梁鹏娟,女,1988年出生,硕士,生物化工
陈朝银,男,1957年出生,教授,生物资源高效利用

