杏仁种皮黑色素抑制晚期糖基化末端产物的研究
李红姣 赵 忠 李巨秀
杏仁种皮黑色素抑制晚期糖基化末端产物的研究
李红姣1赵 忠1李巨秀2
建立牛血清蛋白-葡萄糖(BSA-Glucose)、牛血清蛋白-果糖(BSA-Fructose)和牛血清蛋白-丙酮醛(BSA-Methylglyoxal)的美拉德模拟反应体系,在体系中添加不同浓度的杏仁种皮黑色素,氨基胍(AG)作为阳性对照,37℃下反应,以荧光强度(Ex=370 nm,Em=440 nm)表示晚期糖基化末端产物(AGEs)含量,分析BSA-Glucose体系中蛋白质巯基、羰基含量变化,通过反相高效液相色谱/二极管阵列法(RP-HPLC-DAD)分析杏仁种皮黑色素对丙酮醛(Methylglyoxal,MGO)的清除效果。结果表明,杏仁种皮黑色素对BSAGlucose、BSA-Fructose、BSA-Methylglyoxal体系中AGEs的形成均有显著的抑制作用(P<0.05),抑制率最高分别达到73.81%、42.22%、38.57%。杏仁种皮黑色素能显著升高BSA-Glucose中蛋白质巯基含量(P<0.05),对MGO也具有清除作用,清除率随着时间的延长而升高,当反应24 h时,清除率达到最高,为63.54%。
美拉德反应 晚期糖基化末端产物 杏仁种皮 黑色素
晚期糖基化末端产物(Advanced glycation end products,AGEs)是指在非酶条件下,蛋白质、氨基酸、脂类或核酸等大分子物质的游离氨基与还原糖的醛基经过缩合、重排、裂解、氧化修饰后产生的一组稳定的终末产物[1-2],该反应又称为Maillard反应。
蛋白非酶糖基化所产生的 AGEs通过改变蛋白质结构和功能影响脂质代谢、修饰核酸及胞内蛋白以及诱导氧化应激等,可以造成糖尿病慢性并发症的发生和发展,如动脉粥样硬化形成肾小球基底膜通透性升高致糖尿病性肾病等[3-5]。因此,非酶糖基化抑制剂的研究具有重要意义。目前,关于AGEs的研究大多集中于医学邻域[6-7]。
随着对AGEs的深入研究,已经证实AGEs与一些流行性慢性病、衰老均有一定的相关性[8]。减少食物中AGEs的含量,可以预防高血糖症的病发[9]。目前医学临床使用的如氨基胍、ALT711(4,5-二甲基-3-苯乙酰基噻唑嗡氯化物,DPTC)等抑制AGEs的药物,由于有一定的毒副作用,使其使用范围有了一定的限制,更突显了研究天然提取物对AGEs的抑制作用的重要性。有相关研究表明,绿豆中的多酚类物质对AGEs有明显的抑制作用[10],绿茶提取物也可以有效抑制AGEs的形成,降低小鼠患糖尿病的风险[11]。
天然黑色素是一种异源多聚芳香族化合物类色素,不同来源的黑色素都有一定的特异性。目前一些天然黑色素逐渐应用在各个领域中,如在食品工业中黑芝麻、黑米、黑豆中的黑色素应用于饮料、糖果、糕点、巧克力、果酱等[12-14]。研究还表明,黑色素具有抗紫外线辐射、螯合金属离子、促进免疫和抗氧化活性等功能作用[15-18],天然黑色素在保健食品加工中有较好的应用前景。杏(Prunus sibirica L.)为蔷薇科杏属植物,杏仁种皮黑色素从杏仁种皮中提取,为真黑色素,在200 nm附近有最大吸收峰,结构中具有酚型骨架部分,并具有烷基、芳香基团、酚类基团、羧酸基团等,不溶于酸性溶液,微溶于水,不溶于常见有机溶剂,可溶于碱性溶液。这与其他来源的真黑色素是相似的。杏仁种皮黑色素也具有抗辐射、螯合金属离子等作用,但经研究表明,其清除自由基功能与其他黑色素相比较弱[19-21]。
本研究分别建立了牛血清蛋白-葡萄糖(BSAGlucose)、牛血清蛋白 -果糖(BSA-Fructose)和牛血清蛋白-丙酮醛(BSA-Methylglyoxal)的美拉德模拟反应体系,向各个反应模型中加入不同浓度梯度的杏仁种皮黑色素,通过测定荧光强度探究杏仁种皮黑色素对AGEs形成的抑制作用;同时测定BSAGlucose体系孵化过程中羰基、巯基的含量变化,高效液相色谱法测定杏仁种皮黑色素清除丙酮醛的能力,以此来研究杏仁种皮黑色素抑制糖基化反应的机制。
1 材料与方法
1.1 材料与试剂
杏仁种皮黑色素:实验室自制。牛血清蛋白、葡萄糖、氨基胍(AG)、叠氮化钠、丙酮醛(MGO):Sigma公司。
1.2 仪器与设备
F-4500 FL型荧光光谱仪、424 UV1101型分光光度计:日本岛津公司;5417R型低俗冷冻超速离心机:德国艾本德公司。
1.3 方法
1.3.1 杏仁种皮黑色素的提取
黑色素的提取流程见图1[22]。

图1 杏仁种皮黑色素的提取工艺流程
1.3.2 建立BSA-Glucose美拉德模拟反应体系
用PB缓冲液(0.2 mol/L,pH 7.4)溶解牛血清蛋白和葡萄糖,使其浓度分别为 10 mg/mL,300 mmol/L,再加入0.02%的叠氮化钠以防止微生物的生长。设试验组、阳性对照组、空白对照组和BSA组。试验组加入不同浓度梯度的杏仁种皮黑色素。结合预试验结果,杏仁种皮黑色素质量浓度确定为20、40、60、80、100、120 mg/L。阳性对照组添加同样浓度梯度的氨基胍,空白对照组中只含BSA和Glucose。BSA组为只含10 mg/mL的BSA。反应液置于37℃恒温培养箱中培养。利用AGEs的荧光性质,在激发波长370 nm、发射波长440 nm下测定试验各组荧光强度,以荧光强度表示AGEs含量。分别在反应时间为7、14、21、28 d时测定AGEs,并根据下面公式计算杏仁种皮黑色素和AG对AGEs的抑制率。

式中:A为AGEs抑制率/%;B为试验组或阳性对照组荧光值;C为空白对照组荧光值。
1.3.3 建立BSA-Fructose美拉德模拟反应体系
将采用 PB缓冲液(50 mmol/L,pH 7.4,含有0.02%的叠氮化钠)溶解的1 mL 1.5 mol/L果糖和1 mL不同浓度的杏仁种皮黑色素混合后,37℃下孵育2 h后加入1 mL BSA(30 mg/mL),在37℃下孵育6 d。以不加抑制剂的1 mL缓冲液作为空白对照,10 mmol/L AG作为阳性对照组。AGEs的检测方法同1.3.2。
1.3.4 建立BSA-Methylglyoxal模拟反应体系
将用 PB缓冲液(50 mmol/L,pH 7.4,含有0.02%的叠氮化钠)溶解的1 mL 60 mmol/L丙酮醛和1 mL不同浓度的杏仁种皮黑色素混合后,37℃下孵育2 h后加入1 mL BSA(30 mg/mL),在37℃下孵育6 d。以不加抑制剂的1 mL缓冲液作为空白对照,10 mmol/L AG作为阳性对照组。AGEs的检测方法同1.3.2。
1.3.5 杏仁种皮黑色素清除丙酮醛的测定
将 MGO采用磷酸缓冲液(50 mmol/L,pH 7.4)配制成10 mmol/L,杏仁种皮黑色素配制成0.25 mg/mL的溶液,分别取0.25 mL混合后在37℃孵育。分别在 0.5、1、2、4、8、24 h取样加入 0.25 mL 50 mmol/L的邻苯二胺(OPD)在37℃衍生30 min。然后采用RP-HPLC-DAD测定MGO含量。RPHPLC-DAD条件:采用二极管阵列检测器(DAD),波长范围190~600 nm,C18色谱柱(250 mm×4.6 mm,5μm,进样体积为20μL;等度洗脱,流动相为0.5%冰乙酸水—甲醇(40∶60,V/V),在 315 nm处分析样品中MGO的含量。以磷酸缓冲液作为空白对照,10 mmol/L AG作为阳性对照。并根据式(2)计算杏仁种皮黑色素和AG对MGO的清除率。

式中:A为MGO清除率/%;B为试验组和阳性对照组MGO含量;C为空白对照组MGO含量。
1.3.6 糖基化过程中蛋白质羰基含量测定
取孵化不同时间的样品100μL,加入1 mL以2 mol/L的盐酸为溶剂配制 10 mmol/L浓度的 2,4-二硝基苯肼(DNPH)溶液,混匀后在常温下黑暗处静置反应1 h,每隔10 min用混匀1次。然后用1 mL冰三氯乙酸(TCA)(20%,m/V)混合,10 000 r/min离心10 min,倒掉上清液保留底部蛋白质。取沉淀加入乙醇与乙酸乙酯以1∶1的混合液1 mL,涡旋振荡后清洗再以12 000×g离心10 min,倒掉上层溶液保留底部蛋白质(重复3次)。用2 mL的盐酸胍(6 mol/L,pH 2.3)溶解蛋白质,涡旋振荡后37℃水浴15 min,用紫外分光光度计在370 nm条件下进行测定吸光值(用盐酸胍调零)。蛋白质羰基的含量按照公式(3)计算。

式中:A为蛋白质羰基含量/μmol/mg pro;B为吸光值;C为摩尔消光系数22.0 mmol/(L· cm)。
1.3.7 糖基化过程中蛋白质巯基含量的测定
取孵化不同时间的样品溶液250μL加入含有2.5 mL缓冲液和50μL Ellman试剂(4 mg/mL的DTNB)的试管中,室温黑暗处反应15 min,测定412 nm处的吸光值,由标准曲线查得相对应的样品中巯基含量浓度(以L-半胱氨酸浓度计)。
1.4 统计分析方法
所有试验进行3次重复。数据表示方式为平均值±标准偏差。采用单因素Duncan法进行多重比较,以DPSv7.55软件进行显著性分析。显著水平为P<0.05。
2 结果与分析
2.1 杏仁种皮黑色素对BSA-Glucose反应体系中AGEs形成的抑制作用
BSA-Glucose反应体系反应时间为4周,可全面揭示美拉德反应的各个阶段。杏仁种皮黑色素和氨基胍对BSA-Glucose模拟反应体系中AGEs形成的抑制作用结果见表1、表2、图2。
由表1、表2所示,空白对照组的荧光值明显高于BSA组(P<0.05),说明在牛血清蛋白中加入葡萄糖后发生了明显的糖基化反应,生成了荧光性物质;空白对照组的荧光值在3周内随着时间的进行,不断增加,说明具有荧光性的晚期糖基化产物不断积累;从第4周开始荧光性的物质又有所降低,这是因为荧光性的物质为晚期糖基化过程中的一些中间产物,随着反应的进行,这些具有荧光性的中间产物转化为没有荧光性的末端产物,如类黑素;杏仁种皮黑色素和氨基胍对具有荧光性的AGEs具有明显的抑制作用(P<0.05),且随着杏仁种皮黑色素和氨基胍浓度的增加抑制作用加强。相同反应时间下,添加不同浓度的杏仁种皮黑色素时,各试验组的荧光值均有显著性差异(P<0.05),添加AG的趋势和杏仁种皮黑色素相同。
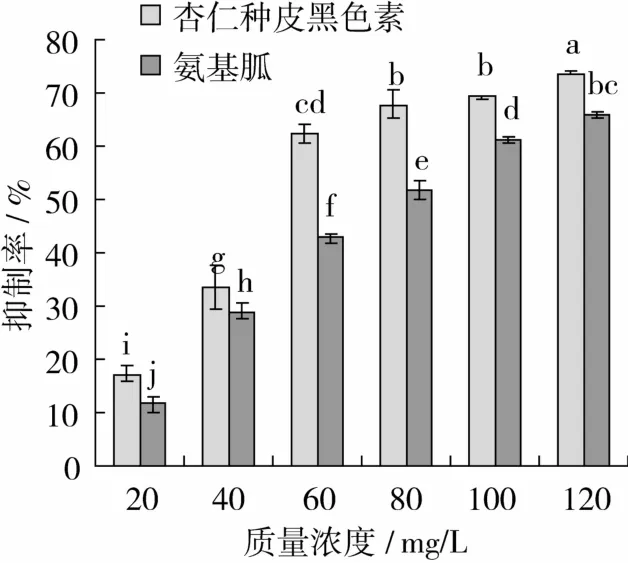
图2 反应4周时杏仁种皮黑色素和氨基胍对BSA-Glucose体系中AGEs抑制作用
表1 杏仁种皮黑色素对BSA-Glucose反应体系中AGEs形成的抑制作用()

表1 杏仁种皮黑色素对BSA-Glucose反应体系中AGEs形成的抑制作用()
注:显著性分析以逗号区分,逗号前为相同列内显著性比较,逗号后为相同行内显著性比较,显著水平为P<0.05;不同字母表示有显著差异,相同字母表示无显著差异。下同。
20 40 60 80 100 120第 1周 218.10±4.31b,d 403.37±3.01d,a 337.68±8.59c,b 260.93±2.47c,c 228.04±4.05c,d 189.02±9.73b,e 166.26±3.29b,f 132.36±10.72c,BSA 空白对照组 杏仁种皮黑色素/mg/L g第 2周 227.82±9.97b,e 670.86±24.39b,a 495.70±3.24b,b 395.67±15.47b,c 302.33±2.52b,d 223.23±2.77a,e 186.91±12.27a,f 149.70±6.67b,g第 3周 225.68±8.96b,e 714.34±9.31a,a 541.74±16.19a,b 431.01±5.83a,c 330.70±3.92a,d 220.85±3.99a,e 199.54±7.28a,f 166.39±1.56a,g第 4周 268.65±11.22a,d 620.94±27.21c,a 514.21±9.67b,b 411.96±24.98ab,c 232.53±10.85c,e 199.34±15.75b,f 190.10±1.83a,f 162.59±1.67a,g
表2 氨基胍对BSA-Glucose反应体系中AGEs形成的抑制作用

表2 氨基胍对BSA-Glucose反应体系中AGEs形成的抑制作用
AG/mg/L 20 40 60 80 100 120第 1周 218.10±4.31b,d 403.37±3.01d,a 317.29±1.47c,b 282.47±1.85c,c 259.74±1.80b,d 255.65±1.16b,d 238.10±5.41a,e 241.04±6.24a,BSA 空白对照组e第 2周 227.82±9.97b,e 670.86±24.39b,a 301.47±9.58d,d 402.81±5.06b,b 343.24±12.02a,c 284.65±8.64a,d 247.05±8.20a,e 239.76±14.32a,e第 3周 225.68±8.96b,e 714.34±9.31a,a 574.60±3.79a,b 448.79±13.81a,c 333.82±26.14a,d 298.07±4.53a,e 240.36±9.38a,f 214.89±0.45b,g第 4周 268.65±11.22a,d 620.94±27.21c,a 549.16±0.68b,b 440.26±7.75a,c 354.54±5.47a,d 298.6±11.22a,e 241.47±3.23a,g 211.44±3.18b,h
由图2可得出,随着浓度的增加,杏仁种皮黑色素和氨基胍对具有荧光性的AGEs的抑制率增加,在20 mg/L时,杏仁种皮黑色素的抑制率达17.19%,AG的抑制率为11.56%,差异显著(P<0.05),达60 mg/L时,杏仁种皮黑色素的抑制率达62.55%,而AG的抑制率仅为42.90%,在80~120 mg/L时,杏仁种皮黑色素的抑制效果均明显强于AG(P<0.05)。
2.2 杏仁种皮黑色素对BSA-Fructose反应体系中AGEs形成的抑制作用
杏仁种皮黑色素对BSA-Fructose反应体系中AGEs形成的抑制作用见图3。

图3 杏仁种皮黑色素和氨基胍对BSA-Fructose反应体系中AGEs形成的抑制作用
由图3所示,随着杏仁种皮黑色素和氨基胍浓度的增大,对BSA-Fructose美拉德模拟反应体系中生成的AGEs抑制率增大,抑制作用增强,且各相邻浓度抑制率均有显著差异(P<0.05),相同浓度时,氨基胍抑制率显著高于杏仁种皮黑色素(P<0.05)。
2.3 杏仁种皮黑色素对BSA-Methylglyoxal反应体系中AGEs形成的抑制作用
MGO是美拉德反应的中期产物[1-2],能与蛋白质的氨基反应形成AGEs,因此在 BSA-Methylglyoxal反应体系中添加杏仁种皮黑色素和氨基胍,能充分反应杏仁种皮黑色素和氨基胍对美拉德反应中后期AGEs的抑制作用。杏仁种皮黑色素对BSA-Methylglyoxal反应体系中AGEs形成的抑制作用见图4。
由图4所示,随着杏仁种皮黑色素和氨基胍浓度的增大,对BSA-Methylglyoxal反应体系中生成的AGEs抑制率增大,抑制作用增强,对于氨基胍,各相邻浓度抑制率均有显著差异(P<0.05);对于黑色素来说,当质量浓度大于10 mg/L时,各相邻浓度抑制率有显著差异(P<0.05)。相同浓度时,氨基胍抑制率显著高于杏仁种皮黑色素(P<0.05)。
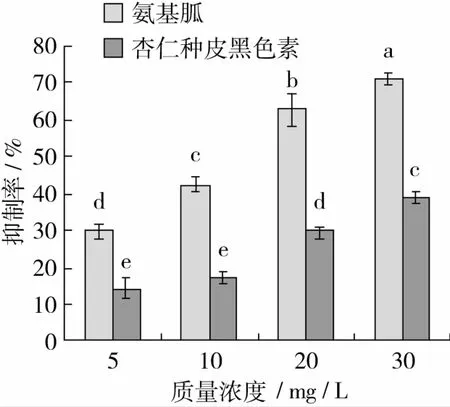
图4 杏仁种皮黑色素和氨基胍对BSA-Methylglyoxal反应体系中AGEs形成的抑制作用
2.4 杏仁种皮黑色素对丙酮醛的清除作用
作为美拉德反应的中期产物,MGO的含量直接影响AGEs的形成。清除MGO能阻断AGEs的形成路径,减少AGEs的合成底物。杏仁种皮黑色素对丙酮醛的清除作用见图5。
从图5可以看出,随着时间的延长,杏仁种皮黑色素对丙酮醛的清除率显著增大,且各相邻浓度之间有显著差异(P<0.05),反应时间相同时,杏仁种皮黑色素对丙酮醛的清除作用弱于氨基胍,差异显著(P<0.05)。对于氨基胍来说,当反应时间少于2 h时,对丙酮醛的清除作用随着时间的延长而增大且相邻时间梯度之间差异显著(P<0.05),24 h时抑制率最高(P<0.05)。对于杏仁种皮黑色素来说,随着时间的延长,清除率逐渐增大,且各时间梯度之间有显著性差异(P<0.05),在反应时间多于1 h后,各时间梯度之间有显著性差异(P<0.05)。

图5 杏仁种皮黑色素和氨基胍对MGO的清除作用
2.5 杏仁种皮黑色素对糖基化过程中蛋白质羰基含量变化的影响
美拉德反应中乙二醛、丙二醛等活性羰基化中间产物能与蛋白质反应形成褐色的不可逆的AGEs产物[2],捕获羰基、降低羰基产物的形成,就能阻断AGEs的形成。杏仁种皮黑色素对糖基化过程中蛋白质羰基含量变化的影响见图6。
从图6可以看出,空白对照组的羰基含量明显高于BSA组(P<0.05),说明糖基化过程中蛋白质被氧化,羰基含量增加;随着时间的延长,糖基化程度加强,羰基含量随时间延长而增加;加入AG后羰基含量降低,说明AG能抑制蛋白被氧化生成的羰基,羰基含量与蛋白糖基化程度成正比。这与荧光值的分析结果是一致的。而加入杏仁种皮黑色素后,糖基化过程中羰基生成未被抑制,这与荧光值的分析结果相反,可能的原因是杏仁种皮黑色素结构中本身含有羰基基团[23]。
2.6 杏仁种皮黑色素对糖基化过程中蛋白质巯基含量变化的影响
蛋白质氧化是引起衰老以及各种生理疾病的重要原因[24],蛋白质巯基含量的减少是蛋白质氧化的另一重要标志。杏仁种皮黑色素对糖基化过程中蛋白质巯基含量变化的影响见图7。
由图7可知,空白对照组巯基含量显著低于BSA组(P<0.05),说明糖基化过程中蛋白质被氧化,巯基含量降低,巯基的下降率为(32.9±0.7)%;随着时间的延长,巯基含量下降,说明蛋白质氧化程度加强;添加杏仁种皮黑色素和AG可以保护巯基,抑制其发生氧化变化,从图7中可以看出相同浓度时氨基胍的保护效果比杏仁种皮黑色素差,这与荧光值的分析结果是一致的。

图6 BSA/Glucose体系中的羰基含量变化
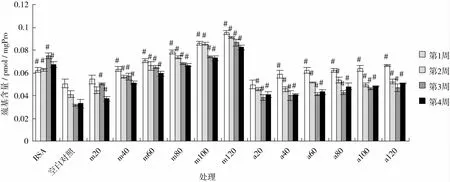
图7 BSA/Glucose体系中的巯基含量变化
3 讨论
杏仁种皮黑色素对BSA-Glucose体系中AGEs形成的抑制作用强于氨基胍,但对BSA-Fructose和BSA-Methylglyoxal体系中AGEs形成的抑制作用弱于氨基胍,而且杏仁种皮黑色素对丙酮醛的清除作用也弱于氨基胍,可能的原因可能是:BSA-Glucose体系反应时间长,而BSA-Fructose和BSA-Methylglyoxal体系反应只有6 d,丙酮醛清除作用只有24 h,杏仁种皮黑色素的抑制和清除作用是长期效应,而氨基胍的作用是短期效应。
黑色素结构中含有大量羰基结构,而杏仁种皮黑色素不能降低牛血清蛋白-葡萄糖(BSA-Glucose)体系中蛋白质羰基含量,原因可能是黑色素本身结构中的羰基在测定过程中起到了干扰作用[23]。
4 结论
4.1 杏仁种皮黑色素对BSA-Glucose、BSA-Fructose和BSA-Methylglyoxal的美拉德模拟反应体系中AGEs的形成都具有抑制作用,在BSA-Glucose体系中杏仁种皮黑色素对AGEs的抑制作用强于氨基胍,但在其他2个体系中,杏仁种皮黑色素对AGEs的抑制作用弱于氨基胍。
4.2 杏仁种皮黑色素对丙酮醛有清除作用,但效果弱于氨基胍。
4.3 杏仁种皮黑色素不能降低BSA-Glucose体系中蛋白质羰基含量,但能降低体系中蛋白质巯基的含量。
[1]Bierhaus A,Hofmann M A,Ziegler R,et al.AGEs and their interaction with AGE-receptors in vascular disease and diabetes mellitus[J].Cardiovascular Research,1998,37(3):586-600
[2]Chompoo,J,Upadhyay A,Kishimoto W,et al.Advanced glycation end products inhibitors from Alpinia zerumbet rhizomes[J].Food Chemistry,2011,129(3):709-715
[3]Niwa T.Dialysis-related amyloidosis:pathogenesis focusing on AGE modification[J].Seminars in Dialysis,2001,14(2):123-126
[4]郭晓敏.晚期非酶糖基化终末产物(AGEs)及其临床意义[J].国外医学泌尿系统分册,1998,18(3):121-124
[5]Turk Z,Sesto M,Skodlar J,et al.Soluble LDL-immune complexes in type 2 diabetes and vascular disease[J].Hormone and Metabolic Research,2002,34(4):196-201
[6]李巨秀,房红娟,胡徽祥,等.食品中晚期糖基化末端产物的研究进展[J].食品科学,2011,32(21):293-297
[7]胡徽祥,房红娟,张双凤,等.食品天然抗氧化剂抑制晚期糖基化末端产物的研究[J]。中国食品学报,2013,13(3):15-20
[8]孙红艳,刘洪臣.晚期糖基化终末产物(AGEs)与衰老[J].中华老年口腔医学杂志,2010,8(5):314-317
[9]Osawa T,Kato Y.Protective role of antioxidative food factors in oxidative stress caused by hyperglycemia[J].Annals of the New York Academy of Sciences,2005,1043(6):440-451
[10]Peng X F,Zheng Z P,Cheng K W,et al.Inhibitory effect of mung bean extract and its constituents vitexin and isovitexin on the formation of advanced glycation endproducts[J].Food Chemistry,2008,106:475-481
[11]Babu PV,Sabitha K E,Shyamaladevi CS.Effect of green tea extract on advanced glycation and cross-linking of tail tendon collagen in induced diabetic rats[J].Food and Chemical Toxicology,2008,46:280-285
[12]李昌,聂少华,谢建华.黑芝麻黑色素的研究进展[J].食品工业科技,2010,31(6):414-416
[13]江友兴,刘希贞,龙小黎,等.黑米成分分析与功能利用[J].农牧产品开发,1999,(8):7-9
[14]应超.黑色食品中黑色素的研究现状[J].科学教育,2010,16(1):95-96
[15]Tadokoro T,Kobayashi N,Zmudzka B Z,et al.UV-induced DNA damage and melanin content in human skin differing in racial ethnic origin[J].Faseb Journal,2003,17(9):1177-1179
[16]Cadet J,Sage E,Douki T.Ultraviolet radiation-mediated damage to cellular DNA[J].Mutation research-genetic toxicology and environmental mutagenesis,2005,571(1/2):3-17
[17]Sies H,Schulz W A,Steenken S.Adjacent guanines as preferred sites for strand breaks in plasmid DNA irradiated with 193 nm and 248 nm UV laser light[J].Journal of Photochemistry and Photobiology B,Biology,1996,32(1/2):97-102
[18]李红姣,张双凤,李巨秀,等.杏仁种皮黑色素对果蝇的紫外辐射保护作用[J].食品科学,2012,33(21):285-289
[19]Sava V M,Yang S M,Hong M Y,Yang,et al.Isolation and characterization of melanic pigments derived from tea and tea polyphenols[J].Food Chemistry,2001,73(2):177-184
[20]Meredith P,Sarna T.The physical and chemical properties of eumelanin[J].Pigment Cell Research,2006,19(6):572-594
[21]Chen SR,Jiang B,Zheng J X.Isolation and characterization of natural melanin derived from silky fowl(Gallus gallus domesticus Brisson)[J].Food Chemistry,2008,111:745-749
[22]李巨秀,李红姣,赵忠,等.杏仁种皮黑色素提取工艺优化[J].食品科学,2012,33(8):11-14
[23]徐磊.短梗霉黑色素的分离提取及其结构分析[D].大连:大连理工大学,2006
[24]Stadtman E R,Levin R L.Protein oxidation[J].Annals of the New York Academy of Sciences,2000,899(1):191-208.
Inhibitory Effects of Melanin Derived from Apricot Testa on the Formation of Advanced Glycation End Products
Li Hongjiao1Zhao Zhong1Li Juxiu2
(College of Forestry,NorthWest A&F University,Key Laboratory of Environment and Ecology in Western China,Ministry of Education1,Yangling 712100)
(College of Food Science and Engineering,NorthWest A&F University2,Yangling 712100)
The model system of bovine serum albumin-glucose(BSA-Glucose),bovine serum albuminfructose(BSA-Fructose)and bovine serum albumin-methylglyoxal(BSA-Methylglyoxal)have been used to evaluate the effect of melanin derived from apricot kernel skin of AGEs formation with aminoguanidine(AG)as positive control.All samples were incubated at 37℃.The fluorescence intensities(Ex=370 nm,Em=440 nm)were measured as the total AGEs content.Protein sulfhydryl and carbonyl contents were also determined.The MGO scavenging abilities of melanin derived from apricot kernel skin and AG were detected by reversed phase high-performance liquid chromatography/diode array detector(RP-HPLC-DAD).The results showed that melanin derived from apricot kernel skin had expressed an extra-strong inhibitory activity against the formation of AGEs(P<0.05)in the three model systems,with the highest inhibition ratios as 73.81%,42.22%and 38.57%respectively.Melanin derived from apricot kernel skin could significantly increase protein sulfhydryl content in BSA-Glucose(P<0.05)and scaveng the MGO.The MGO scavenging ability of melanin derived from apricot kernel skin increased along with the reaction time.The highest scavenging ratio reached 63.54%after 24 h’s reaction.
maillard reaction,advanced glycation end products,apricot kernel skin,melanin
(西北农林科技大学林学院西部环境与生态教育部重点实验室1,杨凌 712100)
(西北农林科技大学食品科学与工程学院2,杨凌 712100)
S662.2
A
1003-0174(2015)02-0050-07
国家自然科学基金 (31101217),国家林业局林业公益性科研专项(200904020)
2013-10-28
李红姣,女,1987年出生,博士,森林培育理论与技术
赵忠,男,1958年出生,教授,森林培育理论与技术李巨秀,女,1972年出生,副教授,食品化学和功能食品

