厌氧胁迫对发芽糙米中γ-氨基丁酸含量变化的影响
丁俊胄 杨特武 周 强 董梦钇 熊善柏 赵思明
(华中农业大学食品科技学院1,武汉 430070)
(华中农业大学植物科技学院2,武汉 430070)
(黄冈市农业科学院3,黄冈 438000)
厌氧胁迫对发芽糙米中γ-氨基丁酸含量变化的影响
丁俊胄1杨特武2周 强3董梦钇1熊善柏1赵思明1
(华中农业大学食品科技学院1,武汉 430070)
(华中农业大学植物科技学院2,武汉 430070)
(黄冈市农业科学院3,黄冈 438000)
以籼稻“扬两优6号”为材料,利用CO2和N2在糙米萌发不同阶段制造厌氧环境,研究不同气体种类的厌氧胁迫及处理时间对发芽糙米中GABA积累的影响,探讨促进发芽糙米中GABA积累的适宜工艺。结果表明,CO2和N2厌氧处理时段以及持续时间均对发芽糙米中的GABA含量有显著影响(P<0.05)。在发芽前期进行厌氧处理一般会抑制GABA的积累,在发芽中后期,尤其是在发芽60~72 h时段则起显著促进作用(P<0.05),且CO2的促进效果明显优于N2(P<0.05)。发芽0~12 h期间进行厌氧处理会抑制GAD活力(P<0.05),在发芽24~72 h期间则可以显著提高GAD活力(P<0.05)。糙米在发芽66~72 h期间进行CO2厌氧环境处理,在72 h时发芽糙米中GABA含量为(965.44±29.35)mg/100 g(干基),显著高于其他时段处理后的含量,且比未经过厌氧处理的发芽糙米高出460.13 mg/100 g(干基)。
糙米 发芽 γ-氨基丁酸 厌氧胁迫 CO2N2
γ-氨基丁酸(γ-aminobutyric acid,GABA)可显著改善神经感知功能进而延缓大脑衰老[1-3],临床研究证实,GABA有助于治疗精神分裂症[4],摄入50~100 mg GABA便可以有效舒缓神经紧张,提升精神抗压能力[5],还能有效预防和缓解高血压[6-7]。然而,人体自身积累GABA的能力随着年龄增长逐渐下降[8],通过提高谷物类主食中的GABA含量来增加GABA的日常摄入对人们尤其是老年人及高压人群的健康大有裨益。糙米在适宜条件下发芽后GABA等小分子营养物质含量显著增加,GABA的开发利用与营养富集技术是近年来研究热点之一[9-10],但目前市场上发芽糙米及其制品中GABA的含量尚有待进一步提高。
高等植物在逆境胁迫下,GABA能起到应激信号的作用,其积累可显著提高植物的抗逆性[11]。Akihiro等[12]和 Allan等[13]学者报道了水稻、番茄、烟草等高等植物中GABA代谢路径及作用机制,在厌氧胁迫下,GABA含量在一定时间内均会显著升高[14],且不同形式和程度的厌氧胁迫引起GABA含量增加的幅度与其达到最高响应值时的时间均不同[15]。Bai等[16]通过浸渍隔氧营造厌氧环境有效提高了粟谷发芽后的GABA含量,然而研究不同气体在不同发芽时段制造厌氧胁迫对发芽糙米中GABA含量的影响鲜见报道。本研究通过充入CO2和N2对糙米发芽过程(0~72 h)中特定时段进行厌氧胁迫,促进发芽过程中GABA的合成积累,为进一步提高发芽糙米制品中的GABA含量奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 糙米原料
糙米原料由2012年收获的杂交籼稻品种“扬两优6号”经垄谷制备。
1.1.2 试验试剂
GABA标品:美国 Sigma公司;L-谷氨酸(LGlu):上海伯奥生物科技有限公司;磷酸吡多醛(PLP):北京拜尔迪生物公司;其余化学试剂均为国产分析纯。
1.2 试验设备
FE20型台式 pH计:美国 Orion Research Inc.;HP250GS型智能人工气候箱:武汉瑞华仪器设备有限公司;DZ400/ZD型充气/真空包装机(排氧量20 m3/h,极限真空度1.333 kPa):上海余特包装机械制造有限公司。
1.3 试验方法
1.3.1 发芽糙米制备
使用砻谷机制备糙米并精选,称取一定质量的糙米于30℃纯净水中浸泡12 h,然后取出置于自行设计改装的超声波水雾供湿通气培养装置(ZL201010221392.6)中,按照文献[17]中的方法进行发芽。
1.3.2 气调厌氧胁迫试验设计
糙米储藏包装材料采用加厚型聚丙烯透明袋。
试验一:发芽试验开始后 0、12、24、36、48、60 h取出小型发芽器装入袋中,分别充入CO2和N2后密封制造持续12 h的厌氧环境,并在各胁迫终点取样测定GABA含量、GAD活力、浸提液pH值,以未经厌氧处理的发芽糙米(连续发芽时间分别为12、24、36、48、60、72 h)作对照。
试验二:发芽试验开始后 0、12、24、36、48、60 h取出样品,应用CO2、N2处理12 h,结束胁迫后继续避光、保温、供湿、通气培养至72 h,取样测定糙米芽长和GABA含量,以未进行厌氧处理的发芽糙米为对照。
试验三:发芽试验开始后 60、62、64、66、68、70 h再进行厌氧处理,至发芽72 h时解除厌氧胁迫,取样检测。
1.3.3 发芽糙米中GABA含量的测定
[17]的方法测定发芽糙米样品中GABA的含量。
1.3.4 发芽糙米中谷氨酸脱羧酶的提取及活力测定
参考Bartyzel等[18]的方法配制谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)提取液及反应液,按照文献[17]中使用的方法测定GAD活性。
1.3.5 发芽糙米的组织酸度测定
采用发芽糙米浸提液的pH值表示组织酸度。取2.5 g发芽糙米,用纯净水研磨成浆,定容至50 mL,振荡浸提2 h后静置澄清,使用pH计测定浸提上清液pH值。
1.4 数据处理与分析
各组试验3次重复,各个指标测定3次平行。应用Excel 2007绘图,使用SAS8.1统计软件进行数据统计分析。
2 结果与分析
2.1 不同发芽时段厌氧胁迫处理对发芽糙米GABA含量和组织酸化的影响
GAD是GABA的关键限速酶,最适pH为5.9。厌氧环境引起植物组织酸化,促进GABA的合成代谢,GABA的合成可在一定程度上缓解过度酸化。本试验测定了不同时段的厌氧胁迫下发芽糙米中GABA含量、GAD酶活、组织酸度。
2.1.1 GABA含量
随着发芽时间的延长,糙米中GABA含量整体呈现上升趋势,36 h后含量增加显著(P<0.05)。由图1可知,气体胁迫处理对GABA含量均有显著影响(P<0.05),CO2与N2的胁迫效果差异明显(P<0.05);0~12 h采用CO2处理会使糙米中GABA含量减少,而在发芽24、36、48、60 h后采用 CO2厌氧处理12 h则使糙米中的GABA含量显著升高(P<0.05);在发芽0~12、12~24、24~36、36~48 h期间采用 N2进行厌氧处理会降低发芽糙米中GABA含量,在发芽48、60 h后进行N2处理12 h则可显著提高GABA含量(P<0.05)。总体而言,在发芽各时段中进行CO2处理对GABA积累的促进效果优于N2处理,发芽后期(48~72 h)进行CO2或N2厌氧处理均可显著提高GABA的积累量。
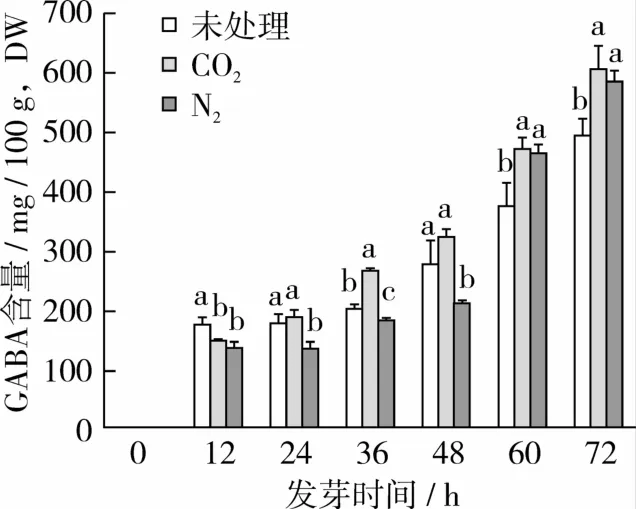
图1 不同发芽时段厌氧胁迫12 h的糙米GABA含量
2.1.2 GAD活力
随着发芽时间的延长,糙米中GAD活力随之显著上升(P<0.05)。由图2可知,气体胁迫处理对GAD活力影响明显,在发芽早期(0~12 h)CO2或N2厌氧处理会导致GAD活力降低,发芽24、36、48、60 h后进行厌氧处理12 h则会使GAD活力明显高于未处理的对照样品(P<0.05),CO2和N2之间差异不显著(P>0.05)。

图2 不同发芽时段厌氧胁迫12 h后的GAD活力
2.1.3 组织酸度
随着发芽时间的延长,发芽糙米组织的浸提液pH值显著下降(P<0.05)。由图3可知,与未厌氧处理的样品比较,发芽12~24 h间采用CO2进行厌氧胁迫处理会使组织酸化加剧,pH降低约0.3,而在发芽中后期(24~72 h)进行CO2处理,则pH高于对照。在发芽24~36 h以及60~72 h时段进行N2处理,对组织过度酸化有显著缓解作用(P<0.05)。

图3 各发芽时段进行气体胁迫12 h后的pH值
2.2 不同发芽时段厌氧胁迫处理对糙米出芽生长及GABA含量的影响
如表1所示,在各时段进行N2和CO2处理均会显著抑制糙米的胚芽生长(P<0.05),种子萌发初期的厌氧处理可以抑制乙烯合成,谷物种子在低于空气中O2含量时萌发速率都会延迟,且当萌发过程中O2含量低至0.2%~0.8%时将诱导次生休眠[19]。由表1可知,CO2对糙米胚芽生长的抑制作用强于N2,处理时间越早则芽长抑制效果越明显。
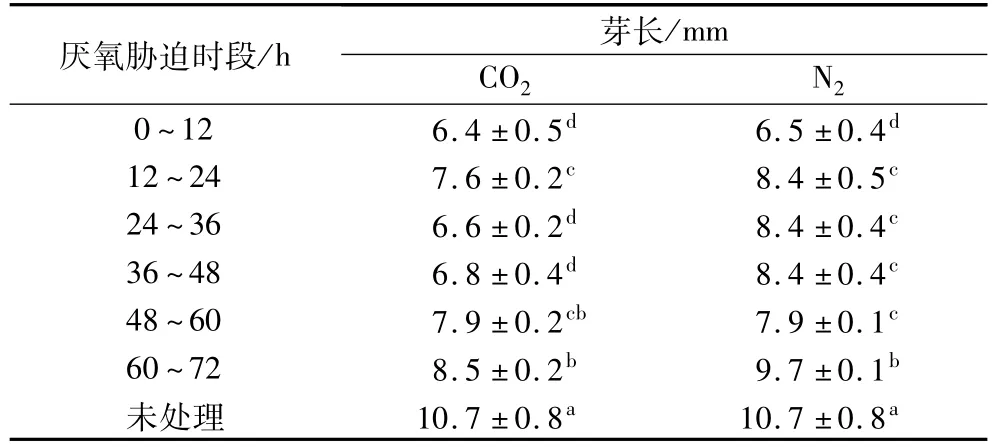
表1 不同发芽阶段厌氧胁迫处理下糙米萌发72 h的芽长
图4可见,发芽60~72 h时段厌氧胁迫可显著提高发芽72 h后的GABA含量(P<0.05),且CO2效果优于N2。发芽60~72 h时段采用CO2和N2处理,终点时发芽糙米中的GABA干基含量分别为(617.97±21.50)mg/100 g和(533.74±27.60)mg/100 g,比未处理分别高出140.04 mg/100 g和55.81 mg/100 g,提高幅度分别为29.30%和11.68%。
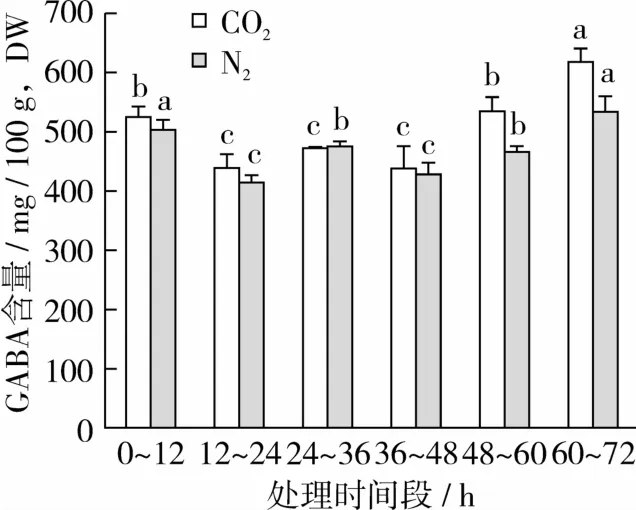
图4 不同厌氧胁迫时段对糙米发芽72 h时GABA含量的影响
2.3 糙米发芽后期厌氧胁迫承受时间的优化
Kinnersley等[15]报道了低氧胁迫引起高等植物中GABA含量的增加通常需要4~24 h。本研究显示,当胁迫时长为12 h时,在糙米发芽后60~72 h胁迫处理的GABA含量最高。为寻求提高GABA含量更适合的胁迫时段,在发芽60~72 h期间将厌氧胁迫处理时间分别设置为12、10、8、6、4、2 h进行试验,发芽72 h后糙米GABA含量测定结果见图5。
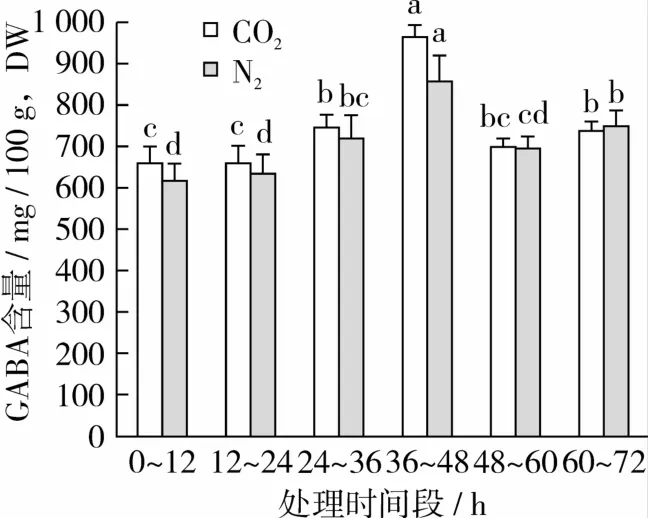
图5 发芽60 h后不同气体胁迫时长对发芽72 h时GABA含量的影响
由图5可知,在发芽66 h后厌氧处理6 h,至发芽终点72 h时GABA明显高于未处理对照及其他处理时段的样品,且 CO2处理优于 N2处理。在66~72 h时段采用CO2处理的样品在72 h时的GABA干基含量为(965.44±29.35)mg/100 g,GABA干基含量高出未处理样品460.13 mg/100 g。
3 讨论
3.1 厌氧胁迫对发芽糙米中GAD活力及GABA积累的影响
GAD是一种钙调素(Calmodulin,CaM)结合蛋白,其表面有Ca2+/CaM结合域,GAD最适pH值为5.9,钙离子浓度[20-22]、组织细胞 pH[23]、L-Glu浓度[24]均会影响GAD活性。糙米在发芽过程中LGlu被GAD脱去羧基生成GABA,同时,GABA又在γ-氨基丁酸转氨酶(aminobutyric acid transaminase,GABA-T)的作用下降解为琥珀酸半醛(succinate semialdehyde,SSA)。在本研究中,CO2和N2制造的厌氧环境可显著促进GABA在发芽糙米中积累,一方面是由于非生物胁迫下植物细胞内[Ca2+]和[H+]浓度增加,激活GAD活性,提高GABA含量,而GABA含量的升高又可缓解细胞过度酸化,抵御逆境胁迫[25-26];另一方面,厌氧胁迫导致无氧呼吸,引起琥珀酸半醛脱氢酶(succinate semialdehyde dehydrogenase,SSADH)活性的降低,导致琥珀酸半醛积累,反馈抑制 GABA-T活力,从而减慢GABA消耗[12]。进一步深入研究不同胁迫条件对GABA-T、SSADH活性、细胞中Ca2+及钙调蛋白表达量的影响程度,可以系统阐释不同胁迫条件对糙米发芽过程GABA积累的影响机制。
3.2 不同气体种类及厌氧胁迫时段对发芽糙米中GABA积累的影响
文献[27]报道了糙米在有氧环境下发芽0~72 h过程蛋白酶及GAD活力呈升上趋势。本研究显示,在发芽前期(0~24 h)进行厌氧处理不利于GABA积累,可能是因为萌发初期种子内贮藏物质尚未充分动员,GAD活力及蛋白酶分解贮藏蛋白产生的L-Glu浓度含量不足。在有氧环境下随着发芽时间的延长,糙米组织pH呈下降趋势,在发芽中后期(36~72 h)进行CO2处理显著减缓pH的下降,这是因为发芽中后期 GABA积累能力较强,GABA能消耗[H+],缓解组织酸化。本研究还显示,CO2厌氧胁迫对于提高发芽糙米GABA含量的效果优于N2。一方面可能是发芽早期(0~24 h)采用CO2处理后由于CO2溶于水导致pH值降低,加剧组织酸化,一定程度上有助于中后期(36~72 h)GAD活力上升和GABA合成;另一方面可能是因为CO2参与发芽过程的碳代谢[11],促进GABA合成。由此可见,发芽糙米GABA的积累在发芽前期需要氧的参与,在发芽48 h之后才能形成有效的厌氧胁迫应激机制,促进GABA的积累。
4 结论
厌氧胁迫对发芽糙米的胚芽长、GABA含量及GAD活力均存在显著影响。在发芽后期(48~72 h)更适合进行厌氧胁迫促进GABA积累,CO2和N2处理均可提高GABA含量及GAD活力,且CO2处理效果优于N2。本试验最佳厌氧处理方式是在糙米发芽66 h后开始进行持续6 h的CO2处理,胁迫终点时发芽糙米中GABA干基含量为(965.44±29.35)mg/100 g,显著高于其他处理时段,比未处理的样品高出460.13 mg/100 g。
参考文献
[1]Hensch T K,Stryker M P.Columnar architecture sculpted by GABA circuits in developing cat visual[J].Science,2004,303:1678-1681
[2]Mamiya T,Kise M,Morikawa K,et al.Effects of polished and pregerminated brown rice on the brain function in mice[J].Journal of Pharmacological Sciences,2007,103(1):34-35
[3]Palmer M L,Schulz M J,Murphy C S,et al.The cellular basis of GABAB-mediated interhemispheric inhibition[J].Science,2012,335:989-993
[4]Marenco S,Savostyanova A A,van der Veen W J,et al.Genetic modulation of GABA levels in the anterior cingulate cortex by GAD1 and COMT[J].Neuropsychopharmacology,2010,35(8):1708-1717
[5]Abdou A M,Higashiguchi S,Horie K,et al.Relaxation and immunity enhancement effects of gamma-aminobutyric acid(GABA)administration in humans[J].Biofactors,2006,26(3):201-208
[6]Hayakawa K,Kimura M,Kasaha K,et al.Effect of aγaminobutyric acid-enriched dairy product on the blood pressure of spontaneously hypertensive and normotensive Wistar-Kyoto rats[J].British Journal of Nutrition,2004,92(3):411-417
[7]Yoshimura M,Toyoshi T,Sano A,et al.Antihypertensive effect of a gamma-aminobutyric acid rich tomato cultivar“DG03-9”in spontaneously hypertensive rats[J].Journal of Agricultural and Food Chemistry,2010,58(1):615-619
[8]Leventhal A G,Wang Y,Pu M,et al.GABA and its agonists improved visual cortical function in senescent monkeys[J].Science,2003,300:812-815
[9]Heinemann R J B,Fagundes P L,Pinto E A.Comparative study of nutrient composition of commercial brown parboiled and milled rice from Brazil[J].Journal of Food Composition and Analysis,2005,18(4):287-296
[10]Iwaki K,Kitada Y.Availability of partially milled rice as a daily source ofγ-aminobutyric acid[J].Food Science and Technology Research,2007,13(1):41-44
[11]Fait A,Yellin A,Fromm H.GABA shunt deficiencies and accumulation of reactive oxygen intermediates,insight from Arabidopsis mutants[J].FEBS Lettres,2005,579:415-420
[12]Akihiro T,Koike S,Tani R,et al.Biochemical mechanism on GABA accumulation during fruit development in tomato[J].Plant and Cell Physiology,2008,49:1378-1389
[13]Allan W L,Simpson J P,Clark SM,et al.γ-Hydroxybutyrate accumulation in Arabidopsis and tobacco plants is a general response to abiotic stress,putative regulation by redox balance and glyoxylate reductase isoforms[J].Journal of Experimental Botany,2008,59:2555-2564
[14]Allan WL,Peiris C,Bown A W,et al.Gamma-hydroxybutyrate accumulates in green tea and soybean sprouts in response to oxygen deficiency[J].Canadian Journal of Plant Science,2003,83:951-953
[15]Kinnersley A M,Lin F.Receptor modifiers indicatebthatγ-aminobutyric(GABA)is potential modulator of ion transport in plants[J].Plant Growth Regulation,2000,32:65-76
[16]Bai Q Y,Chai M Q,Gu Z X,et al.Effects components in culture medium on glutamate decarboxylase activity andγaminobutyric acid accumulation in foxtail millet(Setaria italica L.)during germination[J].Food Chemistry,2009,116:152-157
[17]丁俊胄,刘贞,张璐,等.储藏期对发芽糙米富集γ-氨基丁酸的影响[J].中国粮油学报,2011,26(9):83-86
[18]Bartyzel I,Pelczar K,Paszkowski A.Functioning of theγ-aminobutyrate pathway in wheat seedlings affected by osmotic stress[J].Biologia Plantarum,2003,47:221-225
[19]宋松泉,程红焱,姜孝成,等.种子生物学[M].北京:科学出版社,2008:145
[20]Yap K L,Yuan T,Mal T K,et al.Structural basis for simultaneous binding of two carboxy-terminal peptides of plant glutamate decarboxylase to calmodulin[J].Journal of Molecular Biology,2003,328:193-204
[21]Oh SH.Stimulation of gamma-amino butyric acid synthesis activity in brown rice by a chitosan/glutamic acid germination solution and calcium/calmodulin[J].Journal of Biochemistry and Molecular Biology,2003,36(3):319-325
[22]Zik M,Fridmann-Sirkis Y,Fromm H.C-terminal residues of plant glutamate decarboxylase are required for oligomerization of a high-molecular weight complex and for activation by calcium/calmodulin[J].Biochimica et Biophysica Acta,2006,1764(5):872-876
[23]Crawford L A,Bown A W,Breitkreuz K E,et al.The synthesis ofγ-aminobutyric acid in response to treatments reducing cytosolic pH [J].Plant Physiology,1994,104:865-871
[24]Scott-Taggart C P,Van Cauwenberghe O R,McLean M D,et al.Regulation ofγ-aminobutyric acid synthesis in situ by glutamate availability[J].Physiologia Plantarum,1999,106(4):363-369
[25]Kinnersley A M,Turano F J.γ-Aminobutyric acid(GABA)and plant responses to stress[J].Critical Reviews in Plant Sciences,2000,19:479-509
[26]Yevtushenko D P,McLean M D,Peiris S,et al.Calcium/calmodulin activation of two divergent glutamate decarboxylases from tobacco[J].Journal of Experimental Botany,2003,54:2001-2002
[27]丁俊胄,刘贞,赵思明,等.糙米发芽过程中内源酶活力及主要成分的变化[J].食品科学,2011,32(11):29-32.
γ-Aminobutyric Acid Concent of Brown Rice Induced by Hypoxia Stress During Germination
Ding Junzhou1Yang Tewu2Zhou Qiang3Dong Mengyi1Xiong Shanbai1Zhao Siming1
(College of Food Science and Technology,Huazhong Agricultural University1,Wuhan 430070)
(College of Plant Science and Technology,Huazhong Agricultural University2,Wuhan 430070)
(Huang Gang Academy of Agricultural Sciences3,Huanggang 438000)
Yang Liang You No.6,an indica rice cultivar,have been utilized as the material to research the influence of hypoxia stress on GABA accumulation.The hypoxia stresses induced by gas(CO2and N2)at different stages of germinating have been studied.The effects of hypoxia stress on the shoot length,GABA content,GAD activity and acidity(pH)were also determined.The treatment stage,duration and species of hypoxia stress had significantly impact on GABA accumulation(P<0.05).Hypoxia stress inhibited GABA accumulation at the early stage,but promoted it at the later stage of germination(P<0.05)especially within 60~72 h.Further,CO2stress showed a higher promotion effect than N2stress(P<0.05).The GAD activity was inhibited under hypoxia stress during the 0~12 h of germination,but it was promoted under hypoxia treatment during the 24~72 h of germination.The brown rice treated with CO2stress during the66~72 h of germination had higher GABA content[(965.44±29.35)mg/100 g](DW)at 72 h of germination,which was 460.13 mg/100 g more than the control and significantly higher than that of the other treatments.
brown rice,germination,GABA,hypoxia stress,CO2,N2
S337
A
1003-0174(2015)02-0006-06
2013-11-03
丁俊胄,男,1988年出生,博士,食品科学
熊善柏,男,1963年出生,教授,水产品及淀粉质食品加工保鲜理论与技术

