三叶木通SRAP体系的优化及其遗传多样性
张燕祥,张 铮,董 声
(药用资源与天然药物化学教育部重点实验室,西北濒危药材资源繁育国家工程实验室,陕西师范大学 生命科学学院,陕西 西安 710119)
三 叶 木 通 (Akebiatrifoliata(Thunb.)Koidz.)为木通科(Lardizabalaceae)木通属(Akebia Decne.)落叶木质藤本植物,其根、茎、果实都可入药,是我国传统的中药材,已被收录于《中华人民共和国药典》2010年版,其具有清热利尿、活血通脉等功效,现代药理研究表明其还具有抗肿瘤、抗衰老、降血压等作用[1-3].
目前对三叶木通的研究,主要集中在生物学特征、化学成分、药用价值、育苗技术及病虫害鉴定[4-6]的研究,而运用分子标记对三叶木通的研究中,随机扩增多态性DNA标记(RAPD)稳定性和重复性较差,扩增片段长度多态性(AFLP)实验过程复杂,费用昂贵,与这两种标记技术相比,SRAP标记具有信息量大,重复性好,操作简单,费用低等特点[7],已被广泛应用于药用植物、经济作物、农作物等的遗传多样性分析、遗传图谱构建、基因定位与克隆[8-9]等的研究.我们期望建立和优化适合于三叶木通的SRAP反应体系,为三叶木通种质资源评价、遗传连锁图谱构建、种质资源保存及遗传育种等研究提供一种新的分子标记方法.
1 材料与方法
1.1 材料
2012年4月在秦岭地区选择3个具有代表性的三叶木通居群,随机选取健康植株共62株(表1),株间距大于50m,在每个植株上采集其幼嫩叶片20片,硅胶干燥,-20℃保存,用于室内分析.
1.2 仪器与试剂
Taq酶(大连宝生物工程有限公司),DL2000 Marker(西安润德生物技术有限公司),实验所用引物参照Li和Quiros[10],由上海生工合成.
Microfuge 22R 离心机,PTC-200PCR仪(BIORAD公司),Tanon-1600数码凝胶图像处理系统(上海天能科技有限公司).

表1 三叶木通样本的基本信息Tab.1 The basic information of Akebia trifoliate samples
1.3 方法
1.3.1 基因组DNA的提取 三叶木通DNA提取采用本实验室确立的改良CTAB法[11].1.5%琼脂糖凝胶电泳及微量核酸蛋白分析仪检测DNA质量与浓度,-20℃保存.
1.3.2 SRAP-PCR反应体系的建立及优化 扩增程序参照Li和Quiros的程序[10],设定为:94℃预变性5min;94℃变性1min,37℃复性1min,72℃延伸2min,5个循环;94℃变性1min,54℃复性1 min,72℃延伸2min,35个循环;72℃延伸10min,4℃保存.三叶木通的SRAP的初始体系设定如下:(25μL)2.0mmol/L Mg2+、1UTaq 酶、0.25 mmol/L dNTPs、30ng/25μL DNA、0.3μmol/L引物、1×Reaction Buffer.
以原初反应体系作为标准,以M6E7为引物,对SRAP-PCR反应体系中的影响因素 Mg2+、dNTPs、Taq酶、引物、DNA 模板 的浓度 进 行L16(45)的正交试验,各因素水平见表2.每个组合做两个重复,2%琼脂糖凝胶电泳检测扩增结果.

表2 SRAP反应体系的因素水平设定Tab.2 The designation of factors and their levels in SRAP reaction
参照李仁伟[12]的直观分析法,以扩增条带多、清晰、重复性好为原则来确定最适反应体系.参照谢运海等[13]的方法,根据同一引物,不同反应组合中的SRAP-PCR产物电泳结果,对条带数、亮度、清晰度进行打分统计,扩增效果的总分为这3个指标的和(即总分 = 条带分 + 亮度分 + 清晰分);设置以上3个指标的总分值为16分,在遗传多样性分析中,条带的丰富度较重要,而亮度和清晰度次之,因此3个指标各自的分值依次为10分、4分、2分.对条代数进行打分时,条代数最多的打10分,以最多条带为基准,每减少一个条带降低0.5分;对亮度打分时,选择两条主带作为代表进行打分.两条都亮的为4分,一条亮而另一条亮度不足的为3分,两条亮度都不足的为2分,一条亮度不足且缺一条主带的为1分,无带的记为0分;清晰度打分:分为2个等级,清晰度高的为2分,清晰度差的打1分.对16个组合中每个组合的两个重复依次进行评分,参照王骞春等[14]的极差分析方法,对实验中得到的分值进行极差分析,各因素极差R为各因素最大平均值减去最小平均值,R越大说明该因素对指标影响越大.
1.3.3 SRAP分析 利用SRAP-PCR的最佳反应体系,对由10个正向引物和10个反向引物随机组合的100对引物进行筛选,采用M-E的组合表示方式.用筛选出的引物分别对62个样本进行SRAPPCR扩增,2%琼脂糖电泳,Tanon-1600数码凝胶图像处理系统拍照.
将带型编成二进制数据:1代表有带,0代表无带,利用软件PopGene32计算基因多样性指数、Shannon信息指数、基因流、遗传距离等.采用NTSYS-pc2.1软件进行聚类分析,构建聚类图.
2 结果与分析
2.1 DNA提取结果
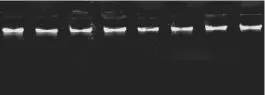
图1 部分三叶木通材料提取DNA电泳图Fig.1 The result of DNA electrophoresis from typical Akebia trifoliate
三叶木通部分样本基因组DNA电泳结果见图1.提取的样本基因组DNA电泳条带整齐、清晰、无拖尾,微量核酸蛋白质分析仪检测其OD260/OD280值在1.8~2.0之间,能够满足SRAP反应对DNA质量的要求.
2.2SRAP-PCR体系的优化结果
SRAP-PCR的正交试验结果如图2,直观分析表明,10号组合扩增效果最好,条代数最多,条带清晰且条带亮度最高.对1到16个组合扩增结果所得分数进行极差分析,结果见表3.各因素水平的变化对试验的影响程度由大到小依次为:Mg2+、Taq酶、DNA、引物、dNTPs.
结合以上两种评价方法,得出三叶木通SRAPPCR最佳体系为(25μL):1×Reaction Buffer、Mg2+2.5mmol/L,dNTPs 0.2mmol/L、Taq 酶2U、引物0.4μmol/L、DNA 20ng/25μL.
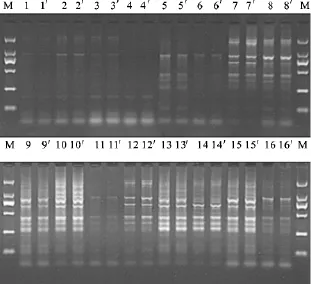
图2 正交试验PCR反应体系的扩增结果*Fig.2 The amplification results of PCR reaction systems from orthogonal design
表3 正交试验结果Tab.3 The results of orthogonal design
2.3 SRAP扩增结果
利用SRAP-PCR最佳反应体系,从100对随机组合的SRAP引物中选出扩增条带丰富、清晰、重复性好的6对引物,分别对62个样品进行SRAP-PCR扩增,并对扩增条带进行统计分析,大部分条带长度在100~2 000bp之间,形成了带型丰富、片段大小不同的电泳图谱.如表4所示,共检测到142个清晰且可重复的条带,其中多态性条带共为124个,平均多态性比率为87.32%,表明SRAP分子标记对三叶木通的基因组的SRAP-PCR扩增效果较好,能够提供丰富的信息位点,是进行三叶木通遗传多样性的有效分析工具.3个居群的遗传多样性参数、遗传距离及基因流计算结果,见表5、6.

表4 不同引物的扩增结果及遗传多样性参数Tab.4 The amplification results from different primers and the genetic diversity parameters

表5 三叶木通居群的遗传多样性参数Tab.6 Genetic variation index of population of Akebia trifoliate

表6 三叶木通居群间的遗传分化和基因流Tab.6 Analysis of differentiation between populations for Akebia trifoliate
2.4 聚类分析
聚类分析结果见图3.从聚类图中可以看出,在相似性系数为0.72(直线L2)处,可将62份三叶木通材料分为3大类群,第Ⅰ组群包含镇安县的所有样本;第Ⅱ和第Ⅲ组群分别包含太白和佛坪的所有样本.在相似性系数为0.666(L1)处,可将所有材料分为2大类群,第一类群包括第Ⅰ组群(镇安居群),第二类群包括第Ⅱ组群(太白居群)和第Ⅲ组群(佛坪居群).由遗传差异分析表明,镇安居群与太白居群的遗传距离较大,基因流较小;太白居群与佛坪居群间的遗传距离较小,基因流较大.不同居群间亲缘关系的远近与它们间的地理距离呈现出一定的相关性.这可能是因为地理距离较近的两个居群间存在的基因流降低了它们间的遗传差异.
3 讨论
SRAP是基于PCR的分子标记技术,受反应体系和扩增程序变化及物种不同的影响.因此首先应对其PCR反应体系进行优化,以确立稳定性好的反应体系.而优化体系的方法一般有单因素、均匀设计、正交设计3种,相对其他两种设计,正交设计不仅试验次数较少而且能够考虑到各因素间的交互作用,具有均衡分散、整齐可比及效率高等[15]特点,是相对较佳的一种方法.本研究采用正交试验设计法,得出三叶木通SRAP-PCR的最佳体系.各因素水平的变化对三叶木通SRAP-PCR反应的影响程度依次为:Mg2+>Taq酶 >DNA>引物>dNTPs.在体系优化的因素选择上,与有些学者[16-17]一样,选择上述5个作为影响PCR的主要因素.但各因素水平变化对PCR反应的影响程度不同,这与不同植物的基因组特性有关.
本试验利用SRAP标记对62份三叶木通进行遗传多样性初步分析,平均每对引物扩增出20.67条多态性谱带,多态性比率占87.32%,与本实验室前期利用AFLP标记对三叶木通遗传多样性分析(待发表)相比,多态性高于AFLP标记;从聚类结果看,分子聚类与样品采集地的居群相一致,与本实验室前期的AFLP分子聚类的结果相同,而居群间的聚类SRAP标记与AFLP的结果有略微差别.产生这种结果的原因首先是两种分子标记的原理不同,所揭示的基因序列不同;其次是所选的样本量有所差异.SRAP标记在62份三叶木通中表现出较高的多态性,而且重复性好,操作简单,费用低,在三叶木通遗传多样性的研究中是一种有效的分子标记.
本研究显示的三叶木通居群总的多态性比率为87.32%,而居群内多样性水平由高到低依次为佛坪居群、太白居群、镇安居群.一般认为,当Nm<1,遗传漂变是种群间遗传分化的主要原因,而Nm>1时,基因流就可以防止由遗传漂变引起的群体间的遗传分化.从实验的结果来看,三叶木通在居群内的遗传多样性水平不高,太白和佛坪居群间的基因交流频率较高,可能是由于这两个居群间的地理距离较近.居群间的遗传变异的产生推测不是由遗传漂变所致,可能主要是由于植物对生存环境的适应而导致的遗传分化.
对物种遗传多样性的研究是人类保护及合理利用资源的基础,为了更合理利用及保护中药资源,今后还需要更广泛地采集样本,把分子水平、形态学水平、有效成分分析以及生态环境等的研究结合起来,全面综合评价、利用药用植物资源.

图3 基于SM的UPGMA聚类分析图Fig.3 UPGMA dendrogram based on the genetic similarity
4 结论
本试验选取对试验结果影响较大的 Mg2+、dNTPs、Taq酶、引物及DNA共五个因素,并将每个因素设定四个水平.运用L16(45)的正交试验,对三叶木通SRAP反应体系进行优化,得到的最佳反应体系为(25μL):1×Reaction Buffer、Mg2+2.5 mmol/L、dNTPs 0.2mmol/L、Taq酶2U、引物0.4 μmol/L、DNA 20ng/25μL.本次试验建立了一个较为完整可靠的三叶木通SRAP反应体系,为今后研究三叶木通的遗传多样性以及优异种质选育等提供分子水平的参考,也为今后三叶木通属SRAP标记研究打下一定的基础.
应用优化后的最佳反应体系从随机组合的100对SRAP引物中筛选出扩增条带清晰且多态性丰富的6对引物组合.用6对引物组合对62份三叶木通基因组DNA扩增,共得到142条清晰可辨的条带,平均每对引物扩增出20.67条条带,多态性比率为87.32%.由居群的基因多样性指数、Shannon信息指数以及多态位点百分率都显示镇安居群(ZAY)内的遗传多样性水平相对较低,最高的为佛坪居群(FP).UPGMA聚类结果显示,镇安居群的供试材料间的遗传变异不丰富,而太白居群与佛坪居群有着密切的亲缘关系.
[1]应俊生,陈德昭.中国植物志(第29卷)[M].北京:科学出版社,2001:8.
[2]高慧敏,王智民.木通属药用植物研究进展[J].中国中药杂志,2006,31(1):10-14.
[3]国家药典委员会.中华人名共和国药典[M].北京:中国医药科技出版社,2010:55.
[4]吴永朋,原雅玲,肖娅萍.三叶木通的研究进展[J].陕西林业科技,2013(1):31-34.
[5]张铮,王喆之.三叶木通不同部位有效成分含量比较研究[J].中药材,2005,28(11):983-984.
[6]刘昱锋,张铮,马银峰.三叶木通叶斑病分离鉴定[J].植物保护,2013,39(2):57-62.
[7]郑海燕.利用RAPD,ISSR和SRAP标记技术构建红麻种质资源分子身份证[D].北京:中国农业科学院,2010.
[8]Liu Ying,Zhang Juming,Wang Xianguo,et al.Genetic diversity inViciaamoena(Fabaceae)germplasm resource in China using SRAP and ISSR markers[J].Biochemical Systematics and Ecology,2013,51:86-93.
[9]Yusa Turkeli,Salih Kafkas,First genetic linkage map in pistachio constructed using an interspecific cross betweenPistaciaveraL.and monoecious Pistacia atlantica Desf[J].Scientia Horticulturae,2013,151:30-37.
[10]Li G, Quiros C F. Sequence related amplified polymorphism (SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging inBrassica[J].Theoretical and Applied Genetics,2001,103:455-461.
[11]张铮,王强.三叶木通总DNA提取方法的比较[J].西北农业学报,2005,14(3):141-144.
[12]李仁伟.大菊品种遗传多样性及基于SRAP标记的分类研究[D].北京:北京林业大学,2011.
[13]谢运海,夏德安,姜静,等.利用正交设计优化水曲柳ISSR-PCR 反 应 体 系 [J].分 子 育 种,2005,3(3):445-450.
[14]王骞春,冯建,陆爱君,等.东部白松SRAP反应体系的建立和优化[J].生物技术,2010(21):168-171.
[15]刘瑞江,张业旺,闻崇炜,等.正交试验设计和分析方法研究[J].实验技术与管理,2010,27(9):52-55.
[16]郑志雷.厚朴遗传多样性的研究及指纹图谱的构建[D].福州:福建农林大学,2010.
[17]苏美和,赵兰勇.牡丹杂交品系SRAP-PCR反应体系优化及引物筛选[J].中国农学通报,2012,28(19):189-193.

