肺癌骨转移105 例预后分析
曲新栋,孙大强,石树远,张 雷(. 天津医科大学研究生院,天津300070;. 天津市胸科医院胸外科,天津300)
骨骼系统是肺癌发生远处转移的主要位点之一,据文献统计,肺癌患者骨转移发生率为30%~40%[1]。骨转移的临床症状为难治性疼痛、麻木、肌肉酸胀、骨关节功能障碍,严重时可出现病理性骨折、脊髓受压等,极大地降低了肺癌患者的生活质量。传统治疗方式主要是化疗和放疗,近年来,双膦酸盐类药物以及表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)越来越多地被用于治疗肺癌骨转移。然而,肺癌骨转移患者的预后仍然很差,据国外文献报道,肺癌骨转移患者中位生存时间为2.5~15.0 个月[2-3]。已有一些研究涉及肺癌骨转移患者预后因素的分析,但各自的独立研究结论不尽一致,尚未形成有效评估预后的统一意见[4]。本研究回顾性分析2006 年1 月至2010 年12 月天津市胸科医院胸外科诊治的105 例肺癌骨转移患者的临床资料,就其临床特征对患者生存质量的影响进行分析,旨在筛选独立的风险因素,为今后对肺癌骨转移患者的预后评价及合理治疗提供指导。
1 资料与方法
1.1 一般资料 选择天津市胸科医院2006 年1 月至2010 年12 月诊治的肺癌骨转移患者105 例,其中男66 例,女39 例;年龄32~77 岁,平均(60.50±5.41)岁。全组患者骨转移灶数目总计229 个,转移部位主要是肋骨(31.0%,71/229)、胸椎(21.4%,49/229)、腰椎(20.5%,47/229)、骨盆(13.5%,31/229),其他还有股骨、肩胛骨、颅骨等(13.5%,31/229)。肺癌伴单纯骨转移74 例;其余31 例同时并发有其他部位的转移,其中脑转移10 例,胸膜转移8 例,肺内转移6 例,肝脏转移5 例,肾上腺转移2 例。初诊时无骨相关事件(SREs,指由肿瘤骨转移导致的一组并发症的统称,包括病理性骨折、脊髓或神经根受压、为缓解症状接受骨放射治疗或骨科手术、恶性高钙血症等[5])的81 例患者中,有21 例在随访期内发生SREs,其中骨放射治疗14 例,病理性骨折3 例,脊髓压迫2例,高钙血症2 例。体力状态(PS)评分参照美国东部肿瘤协作组(ECOG)标准。0 分:活动能力完全正常,与起病前无明显差别;1 分:能行走和从事轻度体力活动,但不能从事较重的体力活动;2 分:能行走,生活自理,但不能工作,日间超过一半时间下床活动;3 分:生活仅能部分自理,日间一半以上时间卧床或坐轮椅;4分:卧床不起,生活不能自理。
1.2 诊断标准[6-7](1)有明确细胞学或组织学诊断的原发性肺癌病灶。(2)骨发射单光子计算机断层扫描(ECT)显示典型多个异常浓聚病灶而确诊为骨转移;仅有单个异常浓聚病灶而不能确定时,进一步作X 射线、CT 或磁共振成像(MRI)检查确诊。(3)正电子发射型计算机断层显像/计算机断层扫描(PET/CT)有典型骨高代谢病灶确诊骨转移者;PET/CT 显示不典型可疑病灶时进一步行X 射线、CT 或MRI 检查确诊。(4)骨ECT 或PET/CT 表现不典型但伴有临床症状,出现病理性骨折或脊髓压迫者。入组患者应具备(1)并同时符合(2)~(4)中至少1 条。
1.3 治疗情况 肺部原发灶行手术切除者36 例。接受胸部放疗44 例,其中癌灶放疗38 例,术后辅助放疗6 例。确诊肺癌后100例患者接受了以铂类为基础的2 种药物联合化疗,其中29 例患者为术后辅助化疗。68 例患者在确诊骨转移后接受了以铂类为基础的2 种药物联合化疗,43 例患者接受了骨转移灶局部放疗,57例患者接受了双膦酸盐类药物治疗。有7 例女性腺癌患者接受了二线EGFR-TKI 治疗,口服吉非替尼250 mg/d。
1.4 治疗随访 采取门诊复查、电话访问方式对入组患者进行随访,随访截止日期为2012 年12 月31 日。105 例患者完整随访97例,失访4 例,因急性心肌梗死死亡2 例,在随访结束时有2 例男性患者带瘤生存;97 例均死亡,总计8 例删失数据。根据随访结果,按临床病理特征进行分层分析,比较组间生存有无差异。
1.5 统计学处理 应用SPSS 17.0 统计软件计算全组患者自确诊肺癌起的中位生存期,采用生存典线法估计患者1、2 年生存率,计算全组患者自确诊骨转移起的中位生存期,估计骨转移后患者1 年和2 年生存率。采用对数秩检验Log-rank 法对患者各临床特征进行单因素方差分析,采用COX 比例风险模型进行多因素方差分析。P<0.05 为差异有统计学意义。
2 结 果
2.1 生存情况 自确诊肺癌算起,本组肺癌患者的中位生存期为19 个月,1、2 年生存率分别为82.9%(87/105)、29.5%(31/105)。自确诊骨转移算起,患者的中位生存期为10.3 个月,1 年生存率为38.1%(40/105),2 年生存率为12.4%(13/105)。生存曲线显示105例肺癌患者确诊骨转移后的总体生存情况见图1。
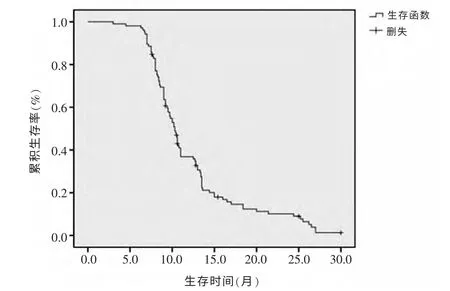
图1 105 例肺癌骨转移患者的总体生存曲线
2.2 单因素方差分析 结果显示,与本组肺癌骨转移患者预后相关的因素包括确诊肺癌时的临床分期、肺原发灶手术、确诊骨转移时的PS 评分、骨转移后的化疗、EGFR-TKI 治疗、双膦酸盐治疗等。根据以上因素分组分析时,两组生存率比较,差异有统计学意义(P<0.05),见表1。
2.3 多因素方差分析 结果显示,确诊肺癌时的临床分期、确诊骨转移时的PS 评分、确诊骨转移后的化疗是影响本组肺癌骨转移患者预后的独立因素,初诊肺癌时的临床分期与预后显著相关,由Ⅰ期到Ⅳ期,死亡风险逐渐增加[风险比(RR)=2.387,P<0.001]。确诊骨转移时PS 评分2~4 分的患者其死亡风险是PS 评分0~1分患者的1.951 倍(RR=1.951,P=0.009)。确诊骨转移后接受化疗的患者,其死亡风险是未接受化疗患者 的61.5%(RR=0.615,P=0.022),见表2。
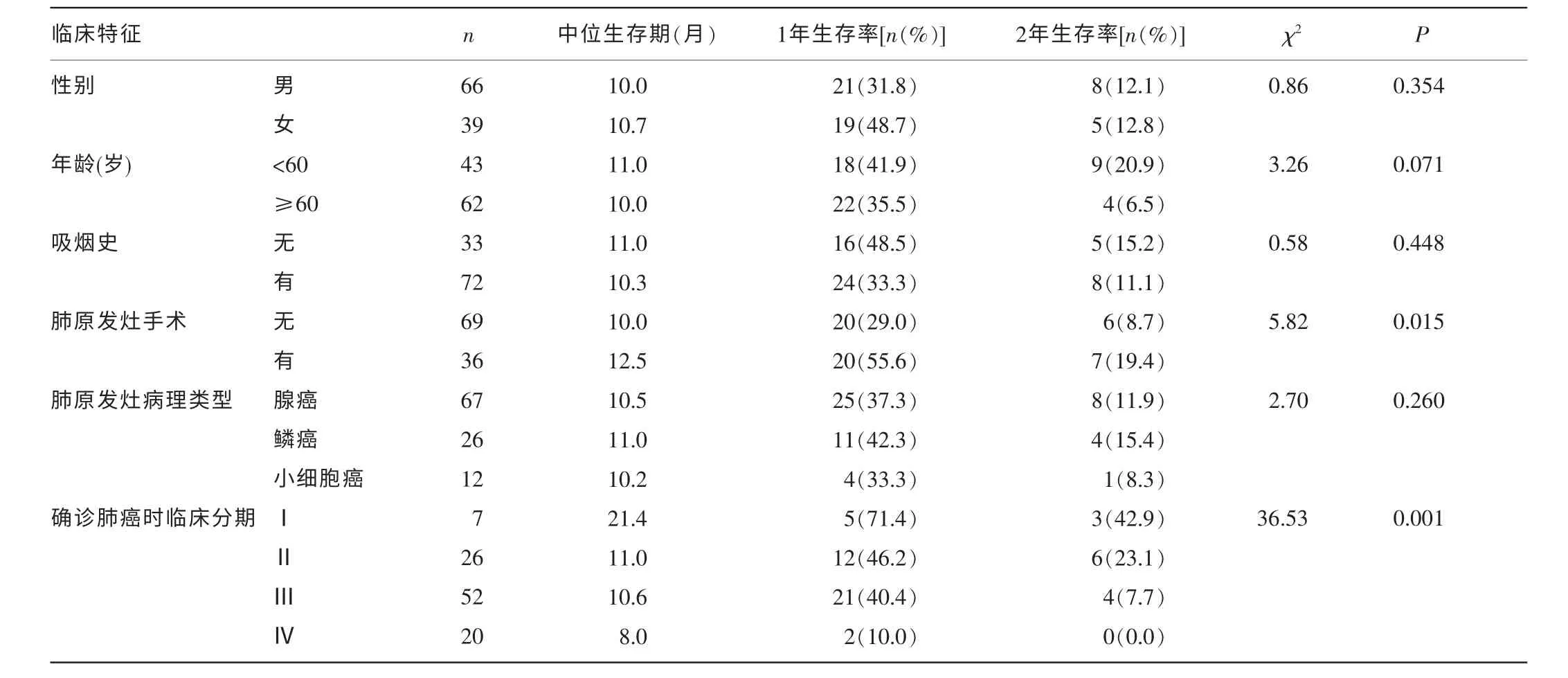
表1 105 例肺癌骨转移患者临床特征与预后关系的单因素分析
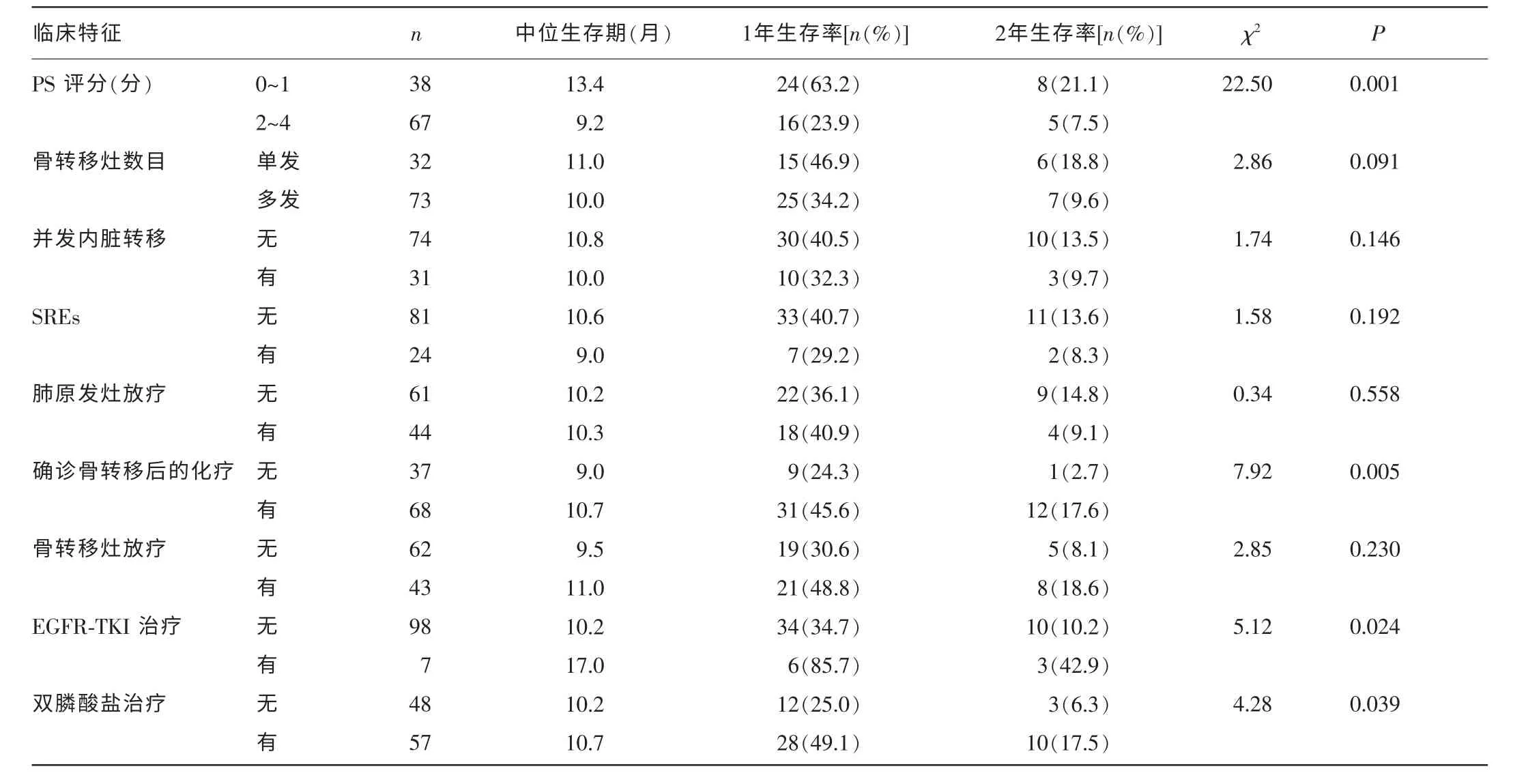
续表1 105 例肺癌骨转移患者临床特征与预后关系的单因素分析
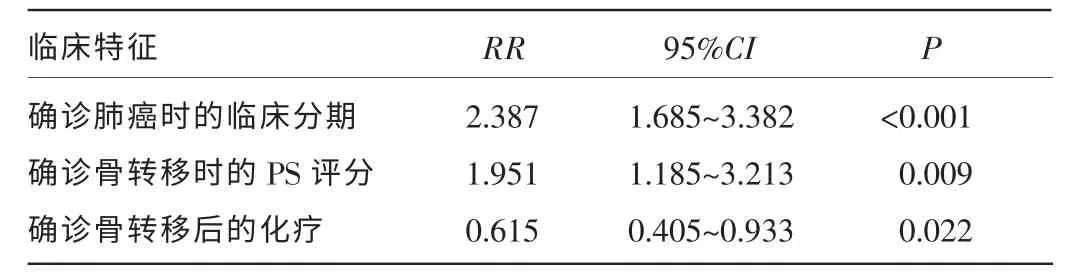
表2 COX 多因素分析
3 讨 论
筛选出有效预测肺癌骨转移患者预后的临床因素,是建立预后评估标准的基础,可以指导临床医生制订更合适的治疗策略,也能为今后临床对照试验提供参考。目前国内外已有一些关于肺癌骨转移患者预后因素分析的研究,但研究结果不尽相同,尚未形成统一意见。Sugiura 等[8]的研究结果显示,肺癌病理类型、四肢长骨转移、EGFR-TKI 治疗是影响患者预后的独立因素。Bae 等[4]的研究则认为,PS 评分、骨转移灶数目也是影响肺癌骨转移患者预后的独立因素。本研究结果显示,确诊肺癌时的临床分期、确诊骨转移时的PS 评分、骨转移后的化疗是影响本组肺癌骨转移患者预后的独立因素,其中骨转移后的化疗作为独立预后因素的研究报道较少。
据统计,有30%~60%的肺癌骨转移患者会在其病程中至少经历1 次SREs,大约30%的患者会发生多次SREs,并且首次SREs的发生将大大增加后期再次出现SREs 的风险[5]。SREs 对患者的一般状态、自主功能和生活质量均有不良影响,但目前认为其与肺癌骨转移患者总体生存时间的缩短相关性不大。Saad 等[9]对纳入多种恶性肿瘤骨转移患者的大样本回顾性分析显示,乳腺癌或前列腺癌骨转移患者合并病理性骨折时,其死亡风险明显增加;而对肺癌骨转移患者根据有无病理性骨折的分组分析显示,两组患者的生存率比较,差异无统计学意义(P>0.05)。尽管如此,众多学者仍认为,预防或延迟首次SREs 的发生对保护患者的自主功能和生活质量至关重要[3,4,10]。以唑来膦酸为代表的双膦酸盐类药物可以抑制破骨细胞介导的溶骨作用,可用于治疗肿瘤骨转移患者的骨痛症状和高钙血症。近年来研究认为,应用唑来膦酸有助于减少SREs 的发生,尤其是延缓形成病理性骨折的进程[10]。据文献统计,乳腺癌骨转移患者中双膦酸盐的应用率已达80%,骨磷治疗已成为常规治疗方案[11]。相比之下,肺癌骨转移人群中双膦酸盐的应用率则在50%以下,许多患者由于各种原因未能接受双膦酸盐治疗。而本研究结果显示,接受双膦酸盐治疗患者的中位生存期长于未应用该药患者(10.7 个月和10.2 个月,P=0.039),患者可从中获益。因此,作者建议,对于存在影像学可疑骨转移灶或可疑骨转移症状的肺癌患者,宜尽早启用双膦酸盐治疗。
本研究发现,确诊骨转移后的化疗是影响肺癌骨转移患者预后的独立因素。既往研究认为,骨骼系统的恶性肿瘤对细胞毒性药物相对不敏感,初诊肺癌后的化疗以及确诊骨转移后的化疗对患者的生存影响不大[6,8]。这是本研究与既往研究的不同之处。在确诊骨转移后,有68 例患者接受了以铂类为基础的2 种药物联合化疗,其余37 例患者未进行化疗,两组患者的中位生存期为10.7个月和9.0 个月,2 年生存率为17.6%和2.7%,两组生存率比较,差异有统计学意义(P=0.005);多因素分析显示,骨转移后的化疗是本组患者预后的独立影响因素,接受化疗患者的死亡风险是未接受化疗患者 的61.5%(RR=0.615,P=0.022)。说明在临床上化疗仍然是治疗肺癌骨转移的基本选择,对于能耐受药物不良反应的患者,接受化疗可能会更多地获益。
近年来,EGFR-TKI 越来越多地被用于治疗晚期非小细胞肺癌患者。目前已有一些研究表明,肺癌骨转移患者可从EGFR-TKI治疗中获益。Bae 等[4]的研究中有65 例肺癌骨转移患者接受过EGFR-TKI 二线或三线治疗,其生存期明显优于未接受该项治疗的患者(20 个月和13 个月,P=0.001),多因素分析亦显示,EGFRTKI 治疗是影响肺癌骨转移患者预后的独立因素。Yoshida 等[12]的研究显示,EGFR 突变阳性并接受EGFR-TKI 治疗的肺癌骨转移患者,相对于EGFR 突变阴性并接受以铂类为基础化疗的患者,其SREs 发生率显著较低(21%和36%,P<0.05),由确诊骨转移到发生首次SREs 的时间也明显较长(13 个月和6 个月,P<0.05)。本组中有7 例女性腺癌患者接受了EGFR-TKI 二线治疗,接受EGFRTKI 治疗患者的中位生存期优于未进行该治疗的患者(17.0 个月和10.2 个月,P=0.024),但EGFR-TKI 治疗并非影响本组患者预后的独立因素,可能与样本量小有关。目前认为,靶向药物只能使特定人群获益,对于非优势人群中肺癌骨转移患者的治疗意义有待进一步研究。
综上所述,本研究结果表明,临床分期为早期、PS 评分0~1 分的患者,其预后可能相对更好,应采取更为积极的治疗措施;而应用以铂类为基础的2 种药物化疗将在一定程度上改善患者预后。本研究的不足之处是为回顾性分析,缺乏对照设置,且样本量相对较小,因此上述结论有待通过前瞻性随机对照试验加以验证。
[1] Price N.Bisphosphonates to prevent skeletal morbidity in patients with lung cancer with bone metastases[J].Clin Lung Cancer,2004,5(5):267-269.
[2] Delea TE,McKiernan J,Brandman J,et al. Impact of skeletal complications on total medical care costs among patients with bone metastases of lung cancer[J]. J Thorac Oncol,2006,1(6):571-576.
[3] Sekine I,Nokihara H,Yamamoto N,et al.Risk factors for skeletalrelated events in patients with non-small cell lung cancer treated by chemotherapy[J].Lung Cancer,2009,65(2):219-222.
[4] Bae HM,Lee SH,Kim TM,et al.Prognostic factors for non-small cell lung cancer with bone metastasis at the time of diagnosis[J].Lung cancer,2012,77(3):572-577.
[5] Kuchuk M,Addison CL,Clemons M,et al.Incidence and consequences of bone metastases in lung cancer patients[J]. J Bone Oncol,2013,2(1):22-29.
[6] 沈玉萍,韩宝惠,许青,等. 非小细胞肺癌骨转移的临床与预后分析[J]. 第二军医大学学报,2009,30(9):1043-1047.
[7] Liu N,Ma L,Zhou W,et al.Bone metastasis in patients with nonsmall cell lung cancer:the diagnostic role of F-18 FDG PET/CT[J].Eur J Radiol,2010,74(1):231-235.
[8] Sugiura H,Yamada K,Sugiura T,et al.Predictors of survival in patients with bone metastasis of lung cancer[J].Clin Orthop Relat Res,2008,466(3):729-736.
[9] Saad F,Lipton A,Cook R,et al. Pathologic fractures correlate with reduced survival in patients with malignant bone disease[J].Cancer,2007,110(8):1860-1867.
[10] Langer C,Hirsh V. Skeletal morbidity in lung cancer patients with bone metastases:demonstrating the need for early diagnosis and treatment with bisphosphonates[J]. Lung Cancer,2010,67(1):4-11.
[11] Mathew A,Mathew IE,Rosenzweig MQ,et al.Association between bisphosphonate use in metastatic breast cancer(MBC)and overall survival[J].Cancer Res,2011,71(24):4-11.
[12] Yoshida T,Yoh K,Goto K,et al.Impact of EGFR tyrosine kinase inhibitors on skeletal-related events in EGFR mutation-positive non-small cell lung cancer patients with bone metastases[J]. J Clin Oncol,2012,30(2):15-21.

