油茶脂氢过氧化物裂解酶基因的克隆与序列分析
王建勇 ,谭晓风 ,龙洪旭 ,陈鸿鹏 ,刘 凯 ,朱凤云
(1. 中南林业科技大学经济林培育与保护教育部重点实验室,湖南 长沙 410004;2. 中南林业科技大学经济林育种与栽培国家林业局重点实验室,湖南 长沙 410004)
油茶脂氢过氧化物裂解酶基因的克隆与序列分析
王建勇1,2,谭晓风1,2,龙洪旭1,2,陈鸿鹏1,2,刘 凯1,2,朱凤云1,2
(1. 中南林业科技大学经济林培育与保护教育部重点实验室,湖南 长沙 410004;2. 中南林业科技大学经济林育种与栽培国家林业局重点实验室,湖南 长沙 410004)
以油茶近成熟种子为材料,根据油茶EST文库中已知的脂氢过氧化物裂解酶EST序列,利用3’RACE与5’RACE技术, 克隆到脂氢过氧化物裂解酶的全长cDNA序列。该基因全长1648bp,,包含一个1476bp开放阅读框长,编码491个氨基酸,5’与3’非编码分别为52bp、121bp。预测该蛋白相对分子量为54.7779KDa,等电点为6.77,是个叶绿体转运肽,N端包含有22个疏水氨基酸残基组成的序列,不仅具有转运肽富含的丝氨酸,还含有大量转运肽中很少存在的脯氨酸。多序列比对发现油茶脂氢过氧化物裂解酶核苷酸序列与茶的相似性达到96%,因此将该基因命名coHPL。
油茶;脂氢过氧化物裂解酶;基因克隆;序列分析
植物HPL是脂氧化途径中脂氧合酶(lipoxygenase,LOX)下游的酶,催化LOX的反应产物—脂氢过氧化物裂解生成短链醛和含氧酸[1],根据底物过氧基位置的差异,植物HPL分为两类同工酶[1-2],其中特异催化13位过氧基断裂的属于第1类同工酶(也命名为13-HPL),第2类HPL(也命名为9-HPL)主要裂解9位过氧基,生成九碳化合物。自1996年Matsui等[3]首先从辣椒中得到了HPL的cDNA全长序列以来,人们相继从辣椒果实、拟南芥、黄瓜、甜瓜、紫花苜蓿和马铃薯等多种植物中得到了HPL的cDNA。通过比较不同物种间HPL基因的结构与编码产物功能等研究表明,已经证实植物HPL裂解产物与植物生长发育中植物的抗病虫、抗伤害、抗逆反应和贮藏、老化、器官发育、化感、休眠、信号分子调控应激反应、改善植物风味等重要的生理功能与进程有关[1-2,4-13]。鉴于HPL具有多种生物活性以及参与生物体多项生理活动,可以想见,对油茶抗病虫和贮藏特性等的遗传改良来说,油茶HPL的基因克隆和相关分子生物学研究无疑是一个值得考虑的新思路,我们在已构建的油茶cDNA文库和EST文库基础上[14-15],首次在油茶中发现了该基因,并运用基因克隆技术获得了油茶HPL基因的全长cDNA序列,在此基础上对该基因进行了序列特征和生物信息学分析,为今后进一步深入开展揭示油茶中油脂合成与抗逆等生理过程的相关研究奠定了基础。
1 材料方法
1.1 实验材料
以株洲马家河油茶基地国审油茶品种‘华硕’[16]的8月份近成熟种子为实验材料,-80℃超低温冰箱保存;试剂:大肠杆菌DH5α为本实验室保藏、pMD18-T质粒载体、2x Easy Taq Mix、Total RNA Purif i cationSystem、3'RACE试剂盒、5'RACE试 剂 盒、Puprep Gel ExtractionKit、单链cDNA合成试剂盒等分别购自TaKaRa、Invitrogen、Clontech、Ambiogen、Fermentas公司;氨苄青霉素购自Promega;引物与测序分别由华大博尚公司完成,其它试剂为分析纯。
1.2 方法
1.2.1 HPL基因同源性分析
将文库中初步认定为HPL基因的EST序列在NCBI上进行BLAST,并用软件Primer Premier 5.0设计特异引物克隆油茶HPL基因,进一步检测EST文库序列的正确性。
EST-F(5′GATACATTCTGAGTCTCTCCATTCT AAGGT3′)
EST-R(5′GTGATTGCCCCAGACGAGTTA CA3′)
EST反应体系(20 μL):2x Easy Taq Mix 10 μL,EST-F (10 μM )0.5 μL,EST-R (10 μM)0.5 μL,模板 DNA 0.5 μL (约 10 ng),ddH2O 8.5 μL。PCR扩增条件:94℃预变性5 min;94℃变性30 S,(60℃/58℃)依次退火30S,72℃延伸1.5 min,各5个循环;94℃变性30 S,56℃退火30 S,72℃延伸1.5 min,25个循环;72℃继续延伸7 min,4℃保存。
1.2.2 油茶种子总RNA的提取及RT-PCR
以油茶优良“华硕”的8月份近成熟种子为材料,采用Invitrogen公司试剂盒 (见总RNA提取试剂盒操作手册)提取种子总RNA,电泳检测总RNA的纯度与浓度,并以此为模板反转录合成单链 cDNA(方法详见 3′ RACE,5′RACE 与Fermentas试剂盒说明书)。
1.2.3 RACE扩增
根据文库中HPL基因的序列信息,使用软件Primer Premier 5.0在基因3′端和5′端各设计3条引物(如下所示)
3GSP1:5′CCGACTCAACCCGCCCGT3′;3GSP2:5′GTTACTGAATTACTTGTACTGGT3′;
3GSP3:5′CTAAGTGAGATGATGAGGAT3′;5GSP1:5′GGAGAGCGAGCCAGAGGTC3′;
5GSP2:5′GGACTTGGCGAGGCTGGACTC TATG3′;
5GSP3:5′TCAGATGTATCAAGATAAGCACA AACT3′;以各自单链cDNA为模板,用特异引物巢式PCR,扩增出目的条带。(除特别注明,引物终浓度均为10μM)
3′ RACE 反 应 体 系(20 μL):2x Easy Taq Mix 10 μL,3GSP2 0.5 μL,AUAP 0.5 μL,3′RACE 单链 cDNA0.5 μL (约 10 ng),ddH2O8.5 μL。PCR扩增条件:94℃预变性5 min;94℃变性30 S,(57℃/55℃/53℃/51℃)依次退火30 S,72℃延伸1.5 min,各4个循环; 94℃变性30 S,49℃退火30 S,72℃延伸1.5 min,20个循环;72℃继续延伸7 min,4℃保存。
5′ RACE 反 应 体 系(20 μL):2x Easy Taq Mix 10 μL,5GSP2 0.5 μL,UPM 2 μL,5’ RACE单链 cDNA0.5 μL(约 10 ng),ddH2O 7 μL。PCR扩增条件:94℃预变性5 min;94℃变性30 S,(69℃/67℃/65℃/63℃)依次退火30 S,72℃延伸1.5 min,各4个循环;94℃变性30 S,61℃退火30 S,72℃延伸1.5 min,20个循环;72℃继续延伸7 min,4℃保存。
1.2.4 RACE产物检测及回收
取50 μL RACE产物于10 g/L琼脂糖凝胶上电泳,Bio-Rad2000DC自动凝胶成像系统检测结果。用Puprep Gel Extraction Kit回收RACE产物(回收操作步骤详见试剂盒说明书)。
1.2.5 coHPL基因cDNA全长克隆、测序及CDS克隆
回收的RACE产物克隆,巢式引物进行菌液PCR,鉴定重组子,将阳性克隆送至博尚公司测序。由测序结果设计特异性引物扩增油茶HPL基因的完整编码框( CDS)。
特异引物序列如下:(F-代表正向引物,R-代表反向引物,引物终浓度10 μM)
CDS F1:5′ GGACTATTAGAGAGAGAAACAC 3′;
CDS F2:5′ ACACAAAGACTCCAAAACCA 3′;
CDS R1:5′ TAAAATGAAAGTCGGATGTTGG 3′;
CDS R2:5′ CAATTATTCGGTACACATGATT TTA 3′
CDS反应体系(20 μL):2x Easy Taq Mix 10 μL,CDS F1 0.5 μL,CDS R2 0.5 μL, 单 链cDNA 0.5 μL(约 10 ng),ddH2O 8.5 μL。PCR 扩增条件:94℃预变性5 min;94℃变性30 S,(54℃/52℃)依次退火30S,72℃延伸1.5 min,各5个循环;94℃变性30 S,50℃退火30 S,72℃延伸1.5 min,25个循环;72℃继续延伸10 min,4℃保存。
1.2.6 生物信息学分析
利用在线NCBI的ORF软件寻找开放阅读框、BLAST功能搜索同源的核苷酸序列及氨基酸序列;运用VectorNTI10. 0进行核苷酸与氨基酸序列比对;运用MEGA 4.1软件对氨基酸聚类分析;利用在线ProtParam软件计算HPL的分子量、等电点、不稳定系数等; Pfam17.0预测蛋白质家族等;TMPRED Server预测跨膜结构等;TargetP 1.1Server预测蛋白质亚细胞定位及前导肽等;predictprotein Serve预测蛋白质二级结构。
2 结果与分析
2.1 油茶种子总RNA
将提取的油茶种子总RNA进行电泳(图1),电泳结果显示28S,18SrRNA条带清晰,浓度比约为2∶1,说明提取的RNA质量较高,符合RT-PCR扩增的要求。
2.2 HPL基因EST序列检测
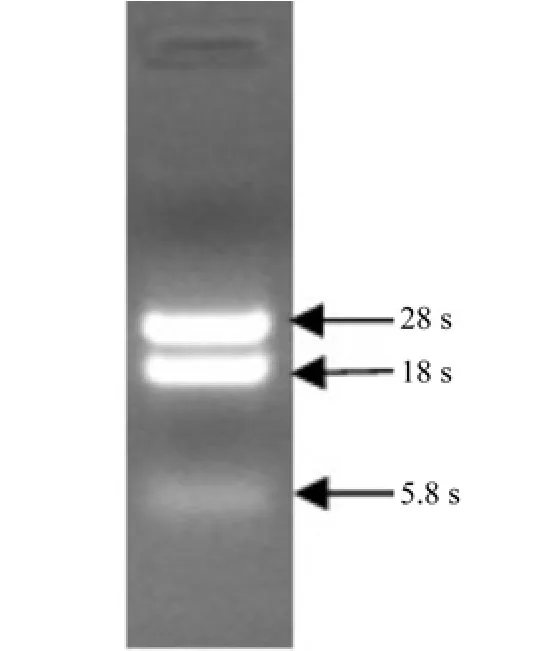
图1 油茶种子总RNAFig. 1 The total RNA of Camellia oleifera seed
克隆检测EST文库中的HPL基因序列。PCR特异扩增得1037bp的核苷酸序列,这与预测的特异DNA条带大小一致的(图2),将测序结果与EST文库序列进行在线NCBI的blast,结果表明相似性为99.99%,进一步证明了EST文库序列的正确性。

图2 EST序列电泳图Fig.2 Electrophoresis pattern of EST product
2.3 RACE的回收产物克隆与测序
将RACE扩增得到的目的DNA片段回收、克隆并测序,测序结果:3’RACE(403 bp),5’RACE(609 bp),这分别与(图3)中的1与2预测结果一致,将各序列进行Blast分析,结果表明RACE序列与已报道的其它物种HPL基因的cDNA序列具有较高的相似性,可确认我们所克隆的序列是油茶HPL基因的3’-端与5’-端序列。

图3 RACE产物电泳图Fig.3 Electrophoresis pattern of 3′ and 5′ RACE product 1∶ 3′ RACE ,2∶ 5′ RACE
2.4 油茶HPL基因全长cDNA及氨基酸的序列特征分析
用 软 件 VectorNTI10. 0对 3’RACE 序 列、5’RACE序列、文库中EST序列拼接,即获得油茶HPL基因的全长cDNA序列,该序列全长为1 648 bp,CDS为1 476 bp(52~1527),编码491个氨基酸,5’UTR和3’UTR分别为 51 bp和121 bp,终止密码子后有加尾信号AATAAA和PolyA尾巴(图4),是一个完整的cDNA序列。
根据coHPL的全长cDNA序列在起始密码子和终止密码子部位设计特异引物,扩增该基因的CDS区段, 测序结果与图4中下划线部分的序列相吻合,与其它物种该基因的CDS序列比对, 结果进一步证实该序列就是油茶coHPL基因的完整CDS。

图4 油茶HPL基因的全长cDNA序列及氨基酸序列Fig. 4 cDNA sequence and deduced amino acid sequen of co HPL full-length cDNA
2.5 油茶HPL基因的生物信息学分析
根据HPL基因的CDS序列推导出该基因编码的氨基酸序列与GenBank中已注册的其它植物HPL的对应序列进行了Blastp分析,与12种植物HPL进行了相似性(similarity)分析(表1),结果表明,coHPL与茶Camellia sinensis相似性最高(96%);而与西红柿Solanum lycopersicum和马铃薯Solanum tuberosum的相似性最低(67%)。
利用MEGA4.1软件,将油茶HPL与上述12种植物的HPL进行了氨基酸序列水平上的聚类分析(图5),结果表明,coHPL(coHPL)与茶(cs1HPL)的亲缘关系更近,并与番石榴(pgHPL)、毛果杨(ptHPL)、甜橙(cs2HPL)、油橄榄(oeHPL)、葡萄(vvHPL)为一大类;蓖麻(rcHPL)、烟草(ntHPL)、三七(pnHPL)、西红柿(slHPL)、川椒(caHPL)、马铃薯(stHPL)聚为一大类。这一聚类结果表明,coHPL与木本植物或不饱和脂肪酸含量较高的植物在进化上具有较高的保守性。
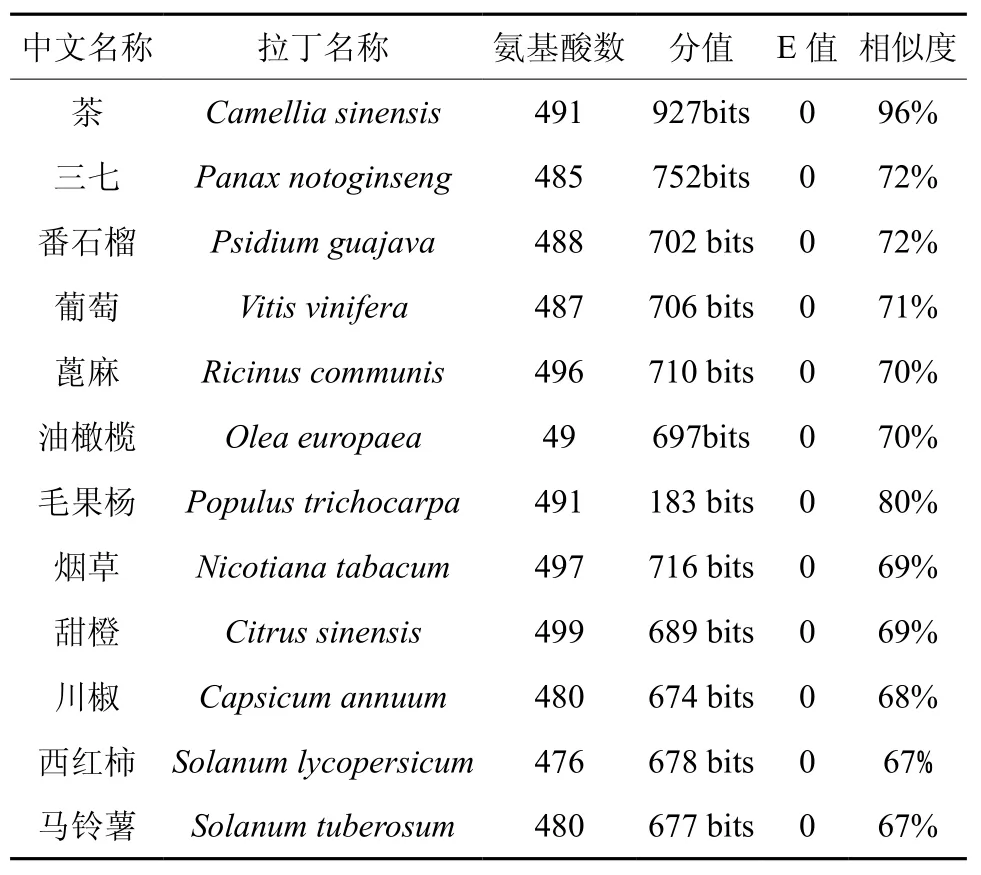
表1 HPL基因的氨基酸序列比较Table 1 Alignment of HPL amino acid sequence
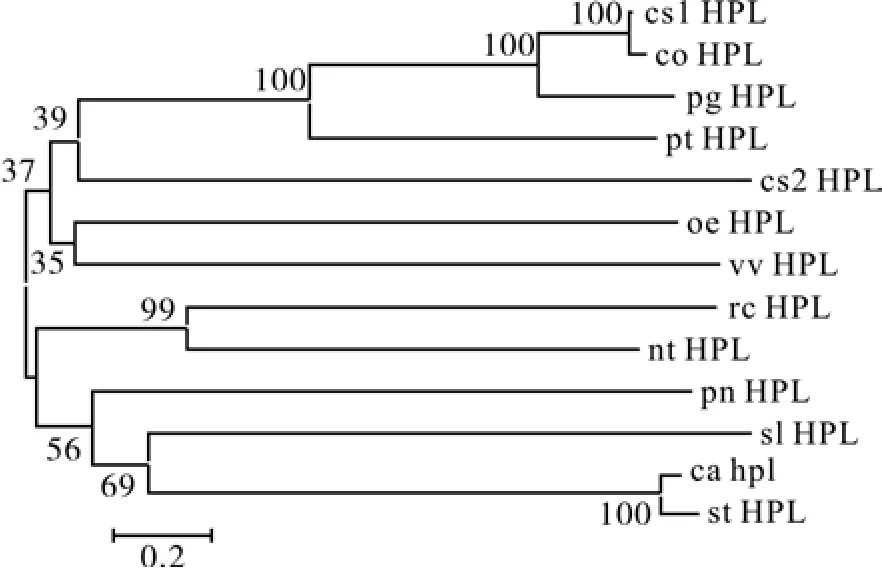
图5 油茶HPL与12种植物HPL的氨基酸聚类分析Fig. 5 Clustering of CoHPL and other HPL of 12 plants
在线ProtParam软件分析,coHPL分子式 为 C2501H3849N621O722S19,Molecular weight为54.7779kDa,富含丝氨酸(S)和亮氨酸(L),理论等电点(Theoretical pI)为6.77,不稳定系数(Instability index)为47.89,说明这种蛋白质结构不稳定,亲水性指数GRAVY (Grand average of hydropathicity)为-0.063,表明脂氢过氧化物裂解酶为亲水性蛋白。
用Pfam 17.0预测蛋白家族(图6),结果显示coHPL属于CytP450蛋白。由Predictprotein分析,coHPL包含了1个N-糖基化位点,1个cAMP和cGMP依赖性蛋白激酶磷酸化位点,5个蛋白激酶C磷酸化位点,8个酪蛋白激酶Ⅱ磷酸化位点,1个酪氨酸激酶磷酸化位点,5个N-肉豆蔻酰化位点,6个二硫键,16个蛋白结合位点;α-螺旋占45.42%,β-折叠占8.35%,无规则卷曲占46.23%。由TMPREDservice、ProScale等预测脂蛋白质结构,结果表明coHPL具有5个比较明显的跨膜蛋白的结构(评分大于500)(图7),整体上具亲水性。由TargetP1.1Server揭示coHPL是个叶绿体转运肽, 可能具有38个氨基酸残基的前导肽。由氨基酸序列分析知,coHPL的N端包含有22个疏水氨基酸残基组成的序列,不仅具有转运肽富含的丝氨酸,还含有大量转运肽中很少存在的脯氨酸,根据Noordermeer等[1]对紫花苜蓿HPL的研究可以推测,它也有可能是以前体形式存在,切去N 端38个氨基酸残基后酶被激活。
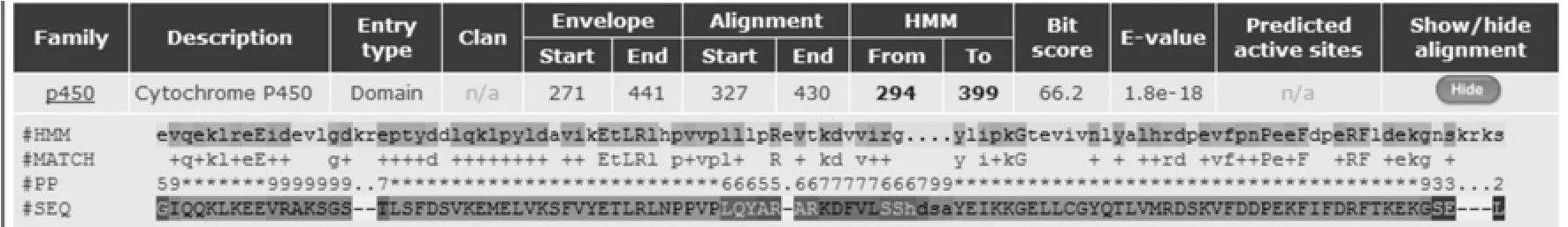
图6 油茶HPL的蛋白质家族预测Fig.6 Protein family prediction of HPL from Camellia oleifera

图7 油茶HPL的在线在线疏水性及跨膜结构分析Fig.7 Analysis of online hydrophobicity and transmembrane domain of of CoHPL
3 结论与讨论
CytP450是一类以分子氧、CytP450还原酶作为辅助因子,分子量为40~60 kD的血红素-铁硫蛋白,一般以可溶性、膜结合两种形态存在于植物细胞内,大多数分布于膜结构上。植物CytP450具有组织特异性,在光、昆虫等外界刺激下可诱导表达,这是CytP450的重要特征之一[1],在同一植物不同组织中、不同亚型细胞间或不同发育时期含量不同,另外,不同物种间CytP450具同源性,有以下一些共同的保守区域:(1)氮端15~20个疏水残基组成的跨膜信号序列;(2)血红素结合区,其中Phe、Cys残基高度保守;(3)螺旋K区,可能与P450电子供体相作用;(4)螺旋I区,可能和P450与底物分子的结合有关。脂氢过氧化物裂解酶(fatty acid hydroperoxide lyase,HPL)作为CytP450家族的成员之一,也是一类血红素-铁硫蛋白,具有CytP450家族的普遍特征[17],值得注明的是,它还具有一些特殊性质——根据Noordermeer等[1]首先提出的HPL可能的催化机制可知,它是一个循环体系的催化反应,不需要氧和CytP450还原酶等辅助因子来维持活性,可以以13-HPOD(hydroperoxy linoleic acid)作为催化底物等[1,4],由此将其划分为CytP450家族的CYP74亚家族。LOX和HPL作为植物不饱和脂肪酸氧化途径中的关键酶系统,目前LOX/HPL的研究主要集中在果蔬类植物,在禾本科植物中主要对LOX进行过大量研究,本实验室已在油茶上克隆到LOX基因[18],但对HPL却很少有报道。本研究在已建立的油茶cDNA文库和EST文库的基础上[14-15],通过RACE技术获得了油茶HPL基因的全长cDNA。该基因全长1 648 bp,含有一个1 473 bp的编码框,编码了含491个氨基酸的蛋白质,5'端非编码区长51 bp,3'端非编码区长121 bp,有一个长29 bp的polyA尾巴。通过比对分析,油茶HPL基因除与茶相似性达96%外,与其它物种的的相似性都比较低,这表明表明山茶属氢过氧化物裂解酶基因与其它物种在进化上存在一定的差异。通过生物信息学分析,co HPL蛋白质的分子量为54.7779kDa,等电点大概为6.77,并有5个比较明显的跨膜蛋白的结构(评分大于500),是个叶绿体转运肽,二级结构中主要以α-螺旋和无规卷曲为主,β-转角较少。
自1996年第一个HPL基因克隆以来,有关此酶的相关研究逐渐受到人们关注。油茶HPL基因全长cDNA序列的确定和运用生物信息学对其结构和功能的初步分析与预测,为揭示HPL基因结构与功能的关系提供了很好的研究材料和基础,这为今后对原核与真核表达的重组蛋白进行活性分析,和进一步的研究其转基因植株的抗病虫、抗伤害、抗逆反应、贮藏等重要的生理功能,从而阐明其作用机理,为指导油茶遗传改良奠定重要的分子生物学基础。
[1] Noordermeer M A, Dijken A J H V, Smeekens S C M,et al. Characterization of three cloned and expressed 13-hydroperoxidelyase isoenzymes from alfalfa with unusual N-terminal sequences and different enzyme kinetics[J]. FEBS Lett, 2000, 267: 2473-2482.
[2] NoordermeerM A, Veldink G A, Vliegnthart J F G. Alfalfa contains substantial 9-hydroperoxide lyase activity and a 3Z:2 Eenal isomerase[J]. FEBS Lett, 1999, 443: 201-204.
[3] Matsui K, Shibutani M, Hase T, et al. Bell pepper fruit fatty acid hydroperoxide lyase is a cytochrome P450(CYP74B)[J]. FEBS Lett, 1996, 394: 21-24.
[4] Bate N J, Sivasankar S, Moxon C, et al. Molecular characterization of an Arabidopsis gene encoding hydroperoxide lyase, a cytochrome P450 that is wound inducible[J]. Plant Physiol, 1998, 117: 1393-1400.
[5] Croft KPC J F, Slusarenko A J. Volatile product of the lipoxygenase pathway evolved from Phaseolus vulgaris(L.)leaves inoculated with Pseudomonas syringae pv phaseolicol[J].Plant Physiol, 1993, 101: 13-24.
[6] Howe G A, Lee G I, Itoh A, et al. Cytochrome P450-dependent metabolism of oxylipins in tomato. Cloning and expression of allene oxide synthase and fatty acid hydroperoxide lyase[J]. Plant Physiol, 2000, 123: 711-724.
[7] Vancanneyt G, Sanz C, Farmaki T, et al. Hydroperoxide lyase depletion in transgenic potato plants leads to an increase in aphid performance[J]. Proc Natl Acad Sci USA 982001,(14): 8139-8144.
[8] Koshio K, Takahashi H, Ota Y. Induction of browning of male flowers of Cryptomeria japonica by treatment with fatty acids:mechanism and the role of trans-2-hexenal[J]. Plant Cell Physiol,1995, 36: 1511-1517.
[9] Zeringue H J. Effect of C6-C10 alkenals and alkanals on eliciting a defence response in the developing cotton boll[J]. Phytochem,1992, 31: 2305-2308.
[10] Deng W L, Hamilton-Kemp T R, Nielsen M T, et al. Effects of six carbon aldehydes and alcohols on bacterial proliferation[J].Agr Food Chem,1993, 41: 506-510.
[11] French R C, Leather G R. Screening of nonanal and related volatile flavor compounds on the germination of 18 species of weed seed[J]. Agr Food Chem, 1979, 27: 828-832.
[12] Gardner H W, Dornbos D L, Desjardins A E. Hexanal, trans-2-hexenal, and trans-2-nonenal inhibits oybean, Glycinemax, seed germination[J]. Agr Food Chem, 1990, 38: 1316-1320.
[13] Porta H, Rocha-Sosa M. Plant lipoxygenase: Physiological and molecular features[J]. Plant Physiol, 2002, 130:15-21.
[14] 谭晓风,胡芳名,谢禄山,等. 油茶种子EST文库构建及主要表达基因的分析[J]. 林业科学, 2006, 42(1): 43-48.
[15] 胡芳名, 谭晓风, 石明旺. 油茶种子cDNA文库的构建[J]. 中南林学院学报, 2004, 24(5): 1-5.
[16] 谭晓风, 袁德义, 袁 军, 等. 大果油茶良种‘华硕’[J]. 林业科学, 2011, 47(12): 184.
[17] 刘 宛, 李培军, 周启星. 植物细胞色素P450酶系的研究进展及其与外来物质的关系[J]. 环境污染治理技术与设备,2001, 2(5): 1-9.
[18] 朱凤云, 陈鸿鹏, 谭晓风, 等. 油茶脂氧合酶基因全长cDNA的克隆与序列分析[J]. 中南林业科技大学学报, 2012, 32(10): 45-51.
Cloning and sequence analysis of a fatty acid hydroperoxide lyase gene from Camellia oleifera
WANG Jian-yong1,2, TAN Xiao-feng1,2, LONG Hong-xu1,2, CHEN Hong-peng1,2, LIU Kai1,2, ZHU Feng-yun1,2
(1.Key Laboratory of Cultivation and Protection for Non-wood Forest trees, Central South University of Forestry and Technology,Changsha 410004, Hunan, China;2.The Key Lab of Non-Wood Forest Product of State Forestry Administration, Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
∶ A cDNA library and a of Camellia oleifera were constructed.According to the fatty acid hydroperoxide lyase EST sequences of Camellia oleifera, a specific primer was designed,the fatty acid hydroperoxide lyase gene was cloned from Camellia oleifera with 3’RACE and 5’RACE, respectively. This gene is 16 48 bp in length,including 51 bp of 5’ untranslated region and 121 bp of 3’untranslated region. It has an open reading frame of 1 476 bp,encoding aprotein of 491 amino acid residues with protein molecular weight of 54 777.9 Da and isoelectric point of 6.77. A chloroplast transfer peptide was predicted, contains 22 hydrophobic amino acid residue in N-terminal, rich in serine and praline, however, the latter is rarely in transfer peptide.The alignment of amino acids sequence reveals that the comparability of Camellia oleifera and Camellia sinensis is 96%. This gene is named coHPL.
∶ Camellia oleifera; fatty acid hydroperoxide lyase; cloning; sequence analysis
S794.4
A
1673-923X(2014)06-0049-06
2013-10-05
国家自然科学基金(31170639);国家自然科学基金(31070603);湖南省自然科学基金(14JJ2104);中南林业科技大学青年基金重点项目(QJ2011008A)
王建勇(1990-),男,湖北阳新人,硕士研究生,主要从事植物分子生物学的研究
谭晓风(1956-),男, 湖南茶陵人,教授,博士,主要从事经济林栽培育种与林业生物技术研究;
E-mail:tanxiaofencn@126.com
[本文编校:吴 彬]

