当归愈伤组织培养研究
蔡子平 ,王国祥 ,王宏霞
(1.甘肃省农业科学院中药材研究所,甘肃 兰州 730070;2.甘肃农业大学农学院,甘肃 兰州730070;3.甘肃省中药材种质改良与质量控制工程实验室,甘肃 兰州 730070)
当归[Angelica sinensis(Oliv.)Diels]为伞形科多年生草本植物,以干燥根入药,具有补血活血、调经止痛、润肠通便等功效,素有“十方九归”之称[1]。其主产于甘肃、云南、四川、陕西、青海等省,尤以甘肃岷县当归为最佳[2]。近年来,随着中药产业的发展,当归已在美容保健、饮品、调味品等行业中广泛应用,市场需求量也越来越大,种植当归已成为甘肃当归主产区的支柱产业之一[3]。
当归是一种适宜高海拔育苗、低海拔引种移栽的特殊植物。长期以来,利用传统开垦生地育苗的方法,既破坏天然植被,造成严重的水土流失,导致环境恶化,又因当归种子的生产周期长,繁殖系数低,育苗成本高。加之近年来由于气温升高,原适宜区的适宜性下降,其育苗所需的高海拔荒地也越来越少,优质当归种苗已成为限制当归生产的瓶颈[4]。目前,生产中由于品种混杂严重,种苗质量良莠不齐,导致早期抽苔现象严重,影响到当归的产量和品质。随着生物技术的发展,组织培养技术在作物品种改良方面发挥了突出的作用,也为解决当归种子、种苗质量提供了一条新途径[5~8]。
1 材料与方法
1.1 材料
当归无菌苗培养材料为甘肃岷县茶埠乡当年采集的新鲜种子,分去翅和不去翅两种。
1.2 方法
1.2.1 种子预处理 先将作为培养材料的去翅和不去翅的当归种子用自来水冲洗1遍,再加入洗涤剂清洗,然后用自来水冲洗干净,在超净工作台上用75%乙醇浸泡10 s,用无菌水冲洗2~3遍,再用1 g/kg的升汞溶液浸泡6 min,最后用无菌水冲洗3~4次备用。
1.2.2 无菌苗培养 在无菌条件下,将经消毒处理的两种当归种子分别接种于MS、1/2MS和自制琼脂培养基(琼脂与水比例为1∶200)3种培养基中培养。每处理20瓶,每瓶4粒。每天进行观察,20 d后统计种子发芽率及污染率。
1.2.3 愈伤组织诱导及外植体筛选 种子培养20 d,待苗长到真叶抽出后,分别以子叶、真叶、叶柄及根为外植体,在无菌条件下,分别将子叶、真叶、叶柄及根切成0.5~1.0 cm的小块,接种于H+0.5 mg/L 2,4-D培养基中进行愈伤组织诱导,筛选最佳外植体。每处理24瓶,每瓶3块。每天观察生长情况,20 d后统计诱导率。
1.2.4 初代培养 将筛选出的最佳外植体转接到以H、MS和1/2MS为基本培养基,并添加0.5 mg/L 2,4-D的培养基上进行愈伤组织诱导。每处理16瓶,每瓶3块。每天观察生长情况,20 d后统计诱导率。
1.2.5 继代培养 15 d后将初代培养诱导出的愈伤组织再切成小块,转接到以H为基本培养基,分别添加0.5、1.0、2.0 mg/L 2,4-D和0、0.5、1.0 mg/L IAA的继代培养基中培养,以便获得更多的愈伤组织。每处理16瓶,每瓶3块。每天观察统计生长情况。
1.3 培养条件
培养室温度为(25±2)℃,光照强度为1 500~1 800 Lx,光照 12 h/d。
1.4 统计分析方法
有关的试验数据均采用DPS和Excel软件进行统计分析。
2 结果与分析
2.1 不同培养基对无菌苗培养的影响
从表1可以看出,去翅种子和不去翅种子的发芽率均以自制琼脂培养基中最高,分别为79.0%和87.5%,但其污染率也分别达到最高值76.3%和85.0%;其次是在1/2 MS培养基中,发芽率分别为55.4%和68.6%,且污染率均最低,分别为6.5%和11.6%;在MS培养基中的发芽率相对较低,分别为29.1%和40.5%,但污染率均较高,分别为13.2%和14.3%。可见,在同一培养基中,不去翅种子的发芽率明显高于去翅种子,但其污染率也相应较高。综合来看,当归无菌苗培养时,以去翅种子在1/2 MS培养基中的培养效果最好。
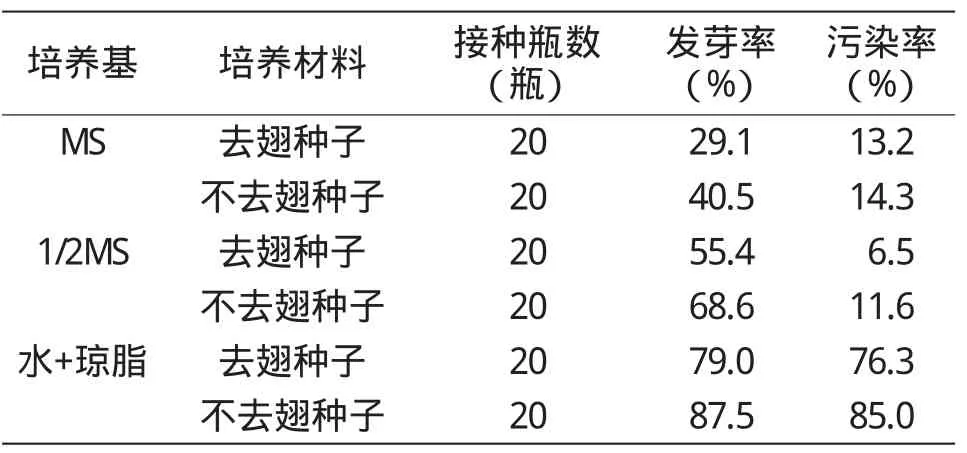
表1 不同培养基中当归种子的发芽率及污染率
2.2 不同外植体对愈伤组织诱导的影响
观察结果表明,接种5 d后,子叶、叶柄的边缘均开始膨胀。随着培养时间的延长,叶柄的周围开始出现大量颗粒状、白色愈伤组织,且生长旺盛;子叶膨大明显,在其周围伤口处出现少量颗粒状愈伤组织,但容易褐化;叶片膨大不明显,伤口处慢慢褐化,直至最后叶片全部黄化;根基本没有变化。从表2可以看出,叶柄的诱导率最高,达91.32%,且愈伤组织生长旺盛,色泽亮;子叶诱导率虽在80%以上,但容易老化、褐变;叶片的诱导率仅为18.06%。因此,当归愈伤组织诱导时,以叶柄作为外植体最适宜。
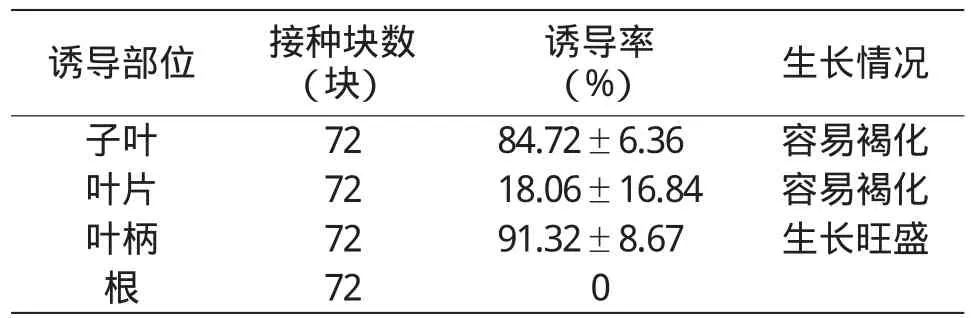
表2 不同外植体的愈伤组织诱导率
2.3 不同培养基对叶柄愈伤组织诱导的影响
从表3可以看出,各处理均能较好的对叶柄诱导出愈伤组织,其中以H+0.5 mg/L 2,4-D培养基的诱导率最高,达89.58%±13.01%,且愈伤组织数量多,颜色淡黄,生长旺盛;MS+0.5 mg/L 2,4-D培养基虽能诱导出愈伤组织,但愈伤组织极褐化严重;1/2 MS+0.5 mg/L 2,4-D培养基的诱导率相对较低,诱导效果次于H+0.5 mg/L 2,4-D培养基。即H培养基为当归诱导愈伤组织的适宜基本培养基,H+0.5mg/L 2,4-D的诱导效果较好。
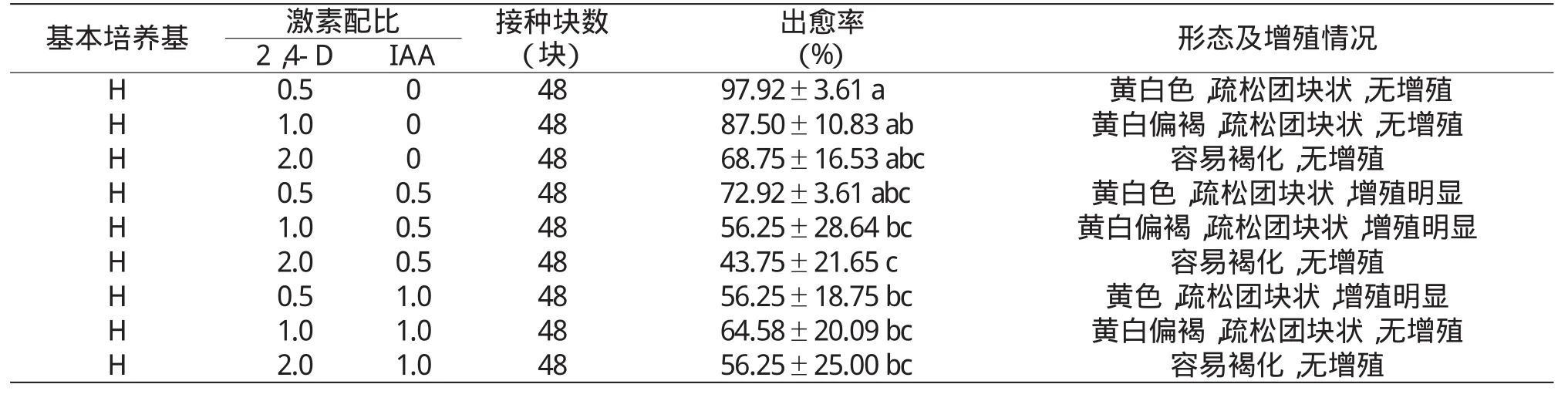
表4 继代培养诱导效果
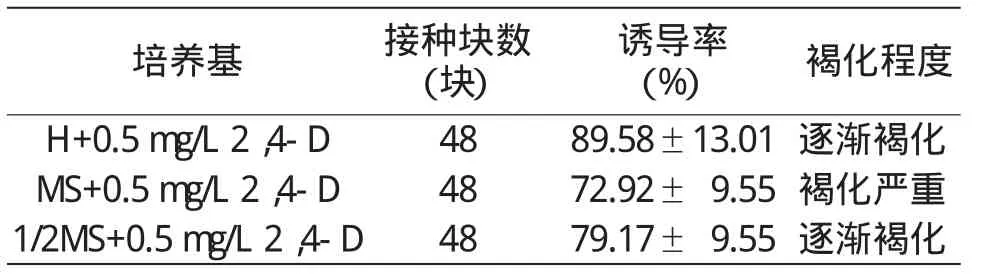
表3 不同培养基对叶柄愈伤组织的诱导效果
2.4 植物生长调节剂对继代培养的影响
由表4可以看出,在H培养基中仅添加2,4-D时,随着2,4-D浓度的增加,出愈率逐渐降低,愈伤组织均无增殖现象;2,4-D浓度为0.5 mg/L时出愈率最高,达97.92%;2,4-D浓度为2.0 mg/L时诱导出的愈伤组织极容易褐化。同时添加2,4-D和IAA时,在IAA浓度为0.5 mg/L条件下,随着2,4-D浓度的增加,出愈率逐渐降低,以2,4-D浓度为0.5、1.0 mg/L时的愈伤组织均增殖明显,生长旺盛;在IAA浓度为1.0 mg/L条件下,随着2,4-D浓度的增加,出愈率呈先增加再降低趋势,以2,4-D浓度为0.5 mg/L时的愈伤组织均增殖明显,生长旺盛。由此可见,只有低浓度的2,4-D配合较高浓度的IAA才可产生大量的颗粒状愈伤组织,而高浓度的2,4-D对愈伤组织的增殖有抑制作用。以H+0.5 mg/L 2,4-D诱导愈伤组织效果最好,出愈率达90%以上;以H+0.5 mg/L 2,4-D+1.0 mg/LIAA增殖效果最好。
3 小结与讨论
1)试验结果表明,种子去翅后在1/2 MS培养基上培养是获得当归无菌苗的最佳条件,此时发芽率达55.4%,污染率仅为6.5%。叶柄为当归愈伤组织诱导的最佳外植体,H培养基为当归诱导愈伤组织的适宜基本培养基。诱导愈伤组织培养基为H+0.5 mg/L 2,4-D时,出愈率达90%以上;继代增殖培养基为H+0.5 mg/L 2,4-D+1.0 mg/L IAA的增殖效果较好。
2)当归种子去翅后灭菌更彻底,可极大地降低污染率。选择无菌苗培养基时,在水+琼脂培养基上当归种子萌发率较高,但污染率也很高,其原因有待于进一步研究。组织培养中通常以茎尖或茎段作为外植体进行愈伤组织的诱导,但从当归愈伤组织诱导结果来看,叶柄是最好的诱导材料,这与张俊莲的结论相似,且材料易得,培养效率也较高[9]。实验中发现,当归愈伤组织在培养过程中极易出现褐化,可能与选用的激素及培养的时间有关,所以在后续的研究中应继续优化激素配比,在继代增殖的过程中要勤转接,尽量减少在同一瓶培养基中的培养时间。
[1] 国家药典编委会.中华人民共和国药典(2010版一部)[M].中国医药科技出版社,2010:124-125.
[2] 孔令武,孙海峰.现代实用中药栽培养殖技术[M].人民卫生出版社,2000:202-205.
[3] 鱼亚琼,邱黛玉,蔺海明,等.外源激素和种苗大小对当归成药期生理变化的影响[J].湖南农业科学,2011(9):41-44.
[4] 武延安,刘效瑞,曹占凤,等.日光温室冬季育苗抑制当归早期抽薹的效应研究[J].中国中药杂志,2005,35(3):283-284.
[5] 张世瑜,郑国昌.当归愈伤组织诱导和植株再生[J].植物学报,1982,24(6):512-518.
[6] 张顺培,贾敬芬,李浩日,等.当归原生质体的分离培养和愈伤组织的形成[J].科学通报,1985(18):1 423-1 425.
[7] 张世瑜,郑国昌.当归胚性愈伤组织的诱导及胚状体发生的组织细胞学研究田[J].植物学报,1986,28(3):241-244.
[8] 张俊莲,米受恩,栾文举.当归愈伤组织产生的影响因素分析[J].甘肃农业科技,1995(11):8-10.
[9] 张俊莲.当归愈伤组织的再分化及植株再生[J].甘肃农业大学学报,1995,12(3):293-297.

